Los Escherichia coli diarreagénicos (ECD) son importantes agentes de diarrea tanto endémica como epidémica en seres humanos en todo el mundo1. Los ECD se clasifican en varios patotipos, en función de sus distintos factores de virulencia, entre los cuales destacan 5grupos principales: E.coli verotoxigénicos (ECVT) o productores de toxinas Shiga (STEC), E.coli enteropatogénicos (ECEP), E.coli enterotoxigénicos (ECET), E.coli enteroinvasivos (ECEI) y E.coli enteroagregativos (ECEA)1. Los ECVT son capaces de provocar desde una diarrea no sanguinolenta hasta una colitis hemorrágica, con el síndrome urémico hemolítico (SUH) o la púrpura trombocitopénica trombótica como complicaciones más habituales, principalmente en niños, ancianos y pacientes inmunodeficientes2. En Europa la mayoría de las infecciones por ECVT se atribuyen al serotipo O157:H73, si bien cada vez se registran con mayor frecuencia casos de infección atribuidos a cepas de serogrupos distintos del O157, como O26, O103, O111 y O145, entre otros, conocidas como ECVT no-O157. Los restantes patotipos se consideran principalmente agentes de diarrea del viajero en adultos en países desarrollados y de diarrea infantil en países en vías de desarrollo1,4.
La identificación de los distintos patotipos de ECD requiere su diferenciación del resto de cepas de E.coli no patógenas que forman parte de la microbiota intestinal normal, diferenciación que no puede llevarse a cabo mediante métodos microbiológicos convencionales. Esta identificación se basa necesariamente en la detección de los genes de virulencia característicos de los distintos patotipos, ausentes en las cepas no patógenas de E.coli, principalmente mediante métodos moleculares como PCR o hibridación5. En el Laboratorio Nacional de Referencia del Centro Nacional de Microbiología (LNR-CNM) llevamos a cabo la detección de ECD mediante PCR convencional para detectar la presencia de los genes que codifican las verotoxinas de ECVT (genes vtx1 y vtx2)6, la intimina de ECEP y ECVT (gen eae)6, las enterotoxinas de ECET (genes estA y eltA)5, las proteínas de invasión de ECEI (gen ipaH)7 y el plásmido de virulencia de ECEA (gen aatA)8. Para ello es necesario partir de un coprocultivo primario de la muestra clínica en agar MacConkey, empleando para la detección el ADN extraído a partir de la zona de crecimiento confluente de la placa de cultivo. En caso positivo, repetimos la detección sobre colonias aisladas morfológicamente compatibles con E.coli hasta obtener el/los aislado/s de ECD presente/s en la muestra clínica. En caso de evidencia o sospecha de SUH por ECVT, recomendamos realizar una detección directa a partir de la muestra de heces, además de los coprocultivos preceptivos, ya que estos pueden resultar negativos en la fase post-diarreica. Una posibilidad diagnóstica adicional en las infecciones por ECVT, al alcance de un mayor número de laboratorios, son los métodos inmunológicos comerciales para la detección de verotoxinas, algunos de los cuales han sido aprobados por organismos como Food and Drug Administration (FDA) o Centers for Disease Control and Prevention (CDC)9.
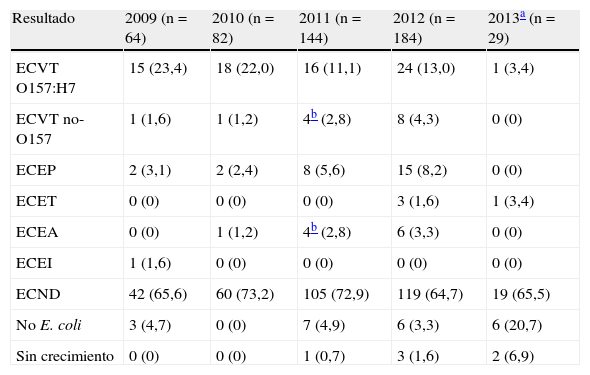
Esta complejidad en el diagnóstico determina que las infecciones por ECD con frecuencia no se diagnostiquen en los laboratorios de microbiología clínica, de ahí que su incidencia real esté subestimada. Por otro lado, estas infecciones no son de declaración obligatoria en España, por lo que solo una pequeña parte de los casos se acaba derivando a un laboratorio con capacidad diagnóstica. En este sentido, la tabla 1 recoge el número de muestras procedentes de casos de gastroenteritis con sospecha de ECD recibidas en el LNR-CNM en el periodo 2009-2013, así como la prevalencia observada de los distintos patotipos de ECD analizados.
Prevalencia observada de los distintos patotipos de ECD en muestras procedentes de casos de gastroenteritis con sospecha de ECD recibidas en el LNR-CNM en el periodo 2009-2013. Los valores expresan el número de casos positivos a cada patotipo y, entre paréntesis, el porcentaje
| Resultado | 2009 (n=64) | 2010 (n=82) | 2011 (n=144) | 2012 (n=184) | 2013a (n=29) |
| ECVT O157:H7 | 15 (23,4) | 18 (22,0) | 16 (11,1) | 24 (13,0) | 1 (3,4) |
| ECVT no-O157 | 1 (1,6) | 1 (1,2) | 4b (2,8) | 8 (4,3) | 0 (0) |
| ECEP | 2 (3,1) | 2 (2,4) | 8 (5,6) | 15 (8,2) | 0 (0) |
| ECET | 0 (0) | 0 (0) | 0 (0) | 3 (1,6) | 1 (3,4) |
| ECEA | 0 (0) | 1 (1,2) | 4b (2,8) | 6 (3,3) | 0 (0) |
| ECEI | 1 (1,6) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| ECND | 42 (65,6) | 60 (73,2) | 105 (72,9) | 119 (64,7) | 19 (65,5) |
| No E. coli | 3 (4,7) | 0 (0) | 7 (4,9) | 6 (3,3) | 6 (20,7) |
| Sin crecimiento | 0 (0) | 0 (0) | 1 (0,7) | 3 (1,6) | 2 (6,9) |
ECD: E.coli diarreagénicos; ECEA: E.coli enteroagregativos; ECEI: E.coli enteroinvasivos; ECEP: E.coli enteropatogénicos; ECET: E.coli enterotoxigénicos; ECND: E.coli no diarreagénicos; ECVT: E.coli verotoxigénicos.
En mayo de 2011 tuvo lugar en Alemania el brote de infección por ECVT de mayor mortalidad e incidencia de SUH ocurrido hasta el momento, producido por una cepa de E.coli verotoxigénica y enteroagregativa (ECVT/ECEA), multirresistente, del serotipo O104:H410. El brote se extendió a otros 12países de la Unión Europea (UE) y a 3países más de fuera de la UE10, y tuvo una extraordinaria repercusión mediática. En España se identificaron 2casos10: un primer caso sin confirmación microbiológica, solo epidemiológica, y un segundo caso confirmado microbiológicamente en el LNR-CNM. Para valorar el impacto que el brote pudiera haber tenido sobre la recepción de muestras con sospecha de ECD en el LNR-CNM y, en consecuencia, sobre la detección y aislamiento de ECD, llevamos a cabo un análisis estadístico de los datos de aislamientos de ECVT O157:H7, ECVT no-O157, ECD no-O157 (incluyendo en este grupo ECVT no-O157, ECEP, ECEA, ECEI y ECET) y E.coli no diarreagénicos (ECND) realizados antes y después de la aparición del brote. Para ello comparamos los siguientes periodos: de la semana 21 de 2009 a la semana 8 de 2010 (periodo 1); de la semana 21 de 2010 a la semana 8 de 2011 (periodo 2); de la semana 21 de 2011 a la semana 8 de 2012 (periodo 3); de la semana 21 de 2012 a la semana 8 de 2013 (periodo 4). Realizamos el análisis mediante el test T-student para datos apareados con el paquete estadístico SPSS v.18, considerando una diferencia estadísticamente significativa cuando el valor p obtenido fue inferior a 0,05.
Una vez realizado el análisis estadístico de los datos constatamos que el número de muestras procedentes de casos de gastroenteritis con sospecha de ECD recibido en el LNR-CNM había aumentado significativamente con respecto al periodo de 2011 anterior a la aparición del brote de Alemania y con respecto a los años anteriores 2009 y 2010 (p<0,05). Las diferencias entre los datos de aislamientos obtenidos antes y después de la aparición del brote fueron estadísticamente significativas concretamente para los grupos ECVT no-O157, ECD no-O157 y ECND (p<0,05), lo que en la práctica se tradujo en un aumento significativo en la detección de ECVT no-O157, ECEP y ECEA con posterioridad al brote, habiéndose mantenido sin embargo la tendencia de años anteriores en la detección de ECVT O157:H7. Estos resultados se explicarían por una mayor concienciación acerca de las infecciones por ECD como opción diagnóstica, motivada por la aparición del brote y su impacto mediático, dando lugar a un aumento en el envío de muestras al LNR-CNM y, sobre todo, a un envío de las mismas en las condiciones necesarias para realizar un diagnóstico rápido y correcto (envío de coprocultivo primario y/o muestra clínica). El mantenimiento de las cifras de detección de ECVT O157:H7 constatado se debería a que el diagnóstico de este serotipo, a diferencia del resto de ECVT y el resto de ECD, es mucho menos dependiente de los métodos moleculares, ya que puede realizarse en los laboratorios de microbiología clínica simplemente atendiendo a sus características fenotípicas (incapacidad para fermentar el sorbitol en el medio agar MacConkey sorbitol) y mediante el uso de un antisuero específico.
Nuestros resultados ponen de manifiesto la necesidad de mejorar el diagnóstico de las infecciones por ECD en los laboratorios de microbiología clínica, así como la importancia del LNR-CNM como laboratorio de apoyo en el diagnóstico y/o caracterización, especialmente de patotipos distintos de ECVT O157:H7.
Agradecemos a Víctor Flores (Centro Nacional de Epidemiología) su colaboración en el análisis estadístico de los datos y a todos los laboratorios colaboradores el envío voluntario y desinteresado de muestras y aislados.