En los últimos años un aumento en la frecuencia de aislamiento de Vagococcus spp. estaría indicando la urgencia de la infección por este patógeno en nuestra institución.
MétodosEstudio prospectivo y descriptivo que abarca el periodo de julio de 2014 a enero de 2019. La identificación fenotípica de 15 aislados de Vagococcus spp. se realizó por pruebas bioquímicas convencionales, por metodología automatizada y por espectrometría de masas (MALDI-TOF MS). La identificación molecular por secuenciación del gen ARNr 16S. La sensibilidad antibiótica fue realizada utilizando el sistema automatizado Vitek® 2C.
ResultadosSe identificaron 11 Vagococcus fluvialis, un Vagococcus lutrae y tres Vagococcus spp. por metodología molecular. MALDI-TOF MS permitió el rápido reconocimiento de este género. Los antibióticos más activos fueron ampicilina, trimetoprima/sulfametoxazol, vancomicina, teicoplanina y linezolid.
La mayoría de los aislamientos se asociaron con infecciones en la piel y partes blandas u osteoarticulares en pacientes diabéticos.
ConclusiónEsta comunicación representa la mayor revisión de casos de infecciones por Vagococcus spp. reportados en la literatura, en la que se destacan los aspectos microbiológicos y clínicos de este patógeno.
An increase in recent years in the isolation of Vagococcus spp. is suggestive of emerging infection by this pathogen in our hospital.
MethodsProspective, descriptive study. Period: July 2014-January 2019. Phenotypic identification of 15 isolates of Vagococcus spp. was performed by conventional biochemical tests, automated methodology and mass spectrometry (MALDI-TOF MS). Molecular identification was achieved by sequencing the 16S rRNA gene. The Vitek™ 2C automated system was used to test antibiotic susceptibility.
ResultsThe molecular method identified 11 Vagococcus fluvialis, one Vagococcus lutrae and three Vagococcus spp. MALDI-TOF MS facilitated the rapid recognition of the genus. The most active antibiotics were ampicillin, trimethoprim/sulfamethoxazole, vancomycin, teicoplanin and linezolid. Most of the cases of isolation were associated with skin and soft tissue or osteoarticular infections in patients with diabetes.
ConclusionThis article is the most extensive review of cases of Vagococcus spp. infection reported in the literature and highlights the microbiological and clinical aspects of this pathogen.
Vagococcus spp. es un género de cocos gram positivos catalasa negativa, anaerobios facultativos y comprende 14 especies1, de las cuales sólo Vagococcus salmoninarum y Vagococcus fluvialis han sido asociados a enfermedad infecciosa en animales. V. fluvialis ha sido aislado de lesiones en cerdos, en ganado vacuno, en gatos y en caballos, mientras que V. salmoninarum en peces salmónidos enfermos de peritonitis2. Sin embargo, su importancia como patógenos humanos, permanece incierta, ya que en la mayoría de los casos el aislamiento es en cultivo polimicrobiano, debido a lo cual establecer el verdadero rol infeccioso de esta especie resulta difícil3. En los últimos años un aumento en la frecuencia de aislamiento de Vagococcus spp. a partir de muestras clínicas, nos estaría indicando la urgencia de la infección por este patógeno en nuestra institución, un hospital público de la provincia de Buenos Aires, Argentina.
El objetivo de este trabajo fue evaluar los aspectos microbiológicos y clínicos de Vagococcus spp. aislados a partir de muestras clínicas humanas.
MétodosSe trata de un estudio prospectivo observacional. Se analizaron 15 aislamientos provenientes de muestras clínicas humanas (período julio 2014-enero 2019) en un centro de salud de la Provincia de Buenos Aires.
Medio sanitario: nuestra institución es un Hospital Interzonal de Agudos situado en el noreste de la provincia de Buenos Aires (Argentina) y es el hospital de mayor complejidad en la región sanitaria en la que se enclava, que abarca 14 localidades. Cuenta con 230 camas y 3 unidades de cuidados intensivos (adultos, pediátricos y neonatales). El 20% de las internaciones en el servicio de Clínica Médica son debidas a infecciones de pie diabético.
Número de muestras de partes blandas y óseas en pacientes con pie diabético: nuestro protocolo incluye la toma de tres a seis muestras, con un mínimo de tres. En la mayoría de los casos (11 de 13) se procesaron como mínimo tres muestras (partes blandas y/o óseas).
Toma de muestra: las muestras de tejido (partes blandas y óseas) fueron tomadas en el quirófano por biopsia, previo desbridamiento quirúrgico y de contaminación de la lesión o úlcera.
Identificación fenotípica: se realizó con pruebas bioquímicas convencionales, según el esquema propuesto por Christensen y Ruoff4, basado en las siguientes pruebas: catalasa, bilis esculina, motilidad, PYR, leucina aminopeptidasa, crecimiento en ClNa 6,5%, a 45°C y a 10°C, y sensibilidad a vancomicina, y por el propuesto por Texeira et al. para identificar las especies de Enterococcus spp.5 basado en la hidrólisis de arginina, la utilización del piruvato y la producción de ácido a partir de manitol, sorbitol, rafinosa, arabinosa, alfa metil glucósido glicerol y sacarosa.
La identificación se realizó también mediante el sistema automatizado Vitek® 2C (BioMérieux®) y por espectrometría de masas (MALDI-TOF MS, Bruker®, Becton Dickinson®) utilizando un instrumento Bruker Daltonics MicroFlex LT® con el software Biotyper 3.1® (Bruker Daltonics®, Bremen, Alemania). Basado en informes previos6-8 y en nuestros propios resultados9, se emplearon puntos de corte más bajos que los propuestos por el fabricante para la identificación a nivel de género y a nivel de especie: se consideró identificación correcta a nivel de género y especie cuando se obtuvo un score ≥ 1,5 y ≥ 1,7 respectivamente; un puntaje < 1,5 se consideró no confiable. Se utilizó el criterio de validez de interpretación entre la primera especie y la siguiente distinta de los diez primeros resultados con una divergencia del 10%8. Si no se cumplía esta condición, la identificación se consideró correcta sólo a nivel de género8. La identificación por MALDI-TOF MS se consideró correcta cuando el resultado obtenido estuvo de acuerdo con los resultados de identificación obtenidos mediante la secuenciación del gen ARNr 16S.
La identificación molecular fue considerada como el gold standard y se llevó a cabo por amplificación por PCR del ARNr 16S, empleando Taq ADN polimerasa (Promega®) usando los cebadores descriptos por Weisburg et al.10 para la obtención del producto. La secuenciación de los productos de ambas cadenas se realizó usando un BioAnalizador ABIPrism® 3100 en las instalaciones de Macrogen Inc®. (Corea del Sur). Las secuencias se analizaron mediante BLAST (Basic Local Alignment Search Tool) y fueron comparadas con las secuencias disponibles en la base de datos GenBank.
Sensibilidad antibiótica: se realizó mediante el sistema automatizado Vitek®2C (BioMérieux®) utilizando la tarjeta AST 577. Los antibióticos ensayados fueron ampicilina, trimetoprima/sulfametoxazol (TMS), eritromicina, ciprofloxacina, vancomicina, teicoplanina, minociclina, tetraciclina y linezolid. Para la interpretación de los resultados se usaron los puntos de corte establecidos por el Clinical and Laboratory Standards Institute [Instituto de Estándares Clínicos y de Laboratorio] (CLSI) para Enterococcus spp. excepto para el caso de eritromicina en el que se usaron aquellos fijados para Streptococcus grupo viridans11.
Correlato clínico: se recabó información sobre edad, sexo, comorbilidades, tipo de infección (mono o polimicrobiana), tratamiento antibiótico instaurado y evolución, a fin de evaluar el rol de Vagococcus spp. en la infección humana. La jerarquización del aislamiento de Vagococcus spp. en cada caso fue evaluada conjuntamente entre el microbiólogo y el infectólogo. En líneas generales, Vagococcus spp. fue jerarquizado desde el punto de vista clínico cuando fue observado en el examen directo y aislado como único microorganismo en la muestra. Cuando se aisló formando parte de una microbiota polimicrobiana fue considerado como un patógeno oportunista, con la misma jerarquía que un estafilococo coagulasa negativa, Streptococcus grupo viridans, Corynebacterium spp. y Enterococcus spp al ser aislados en microbiota polimicrobiana12.
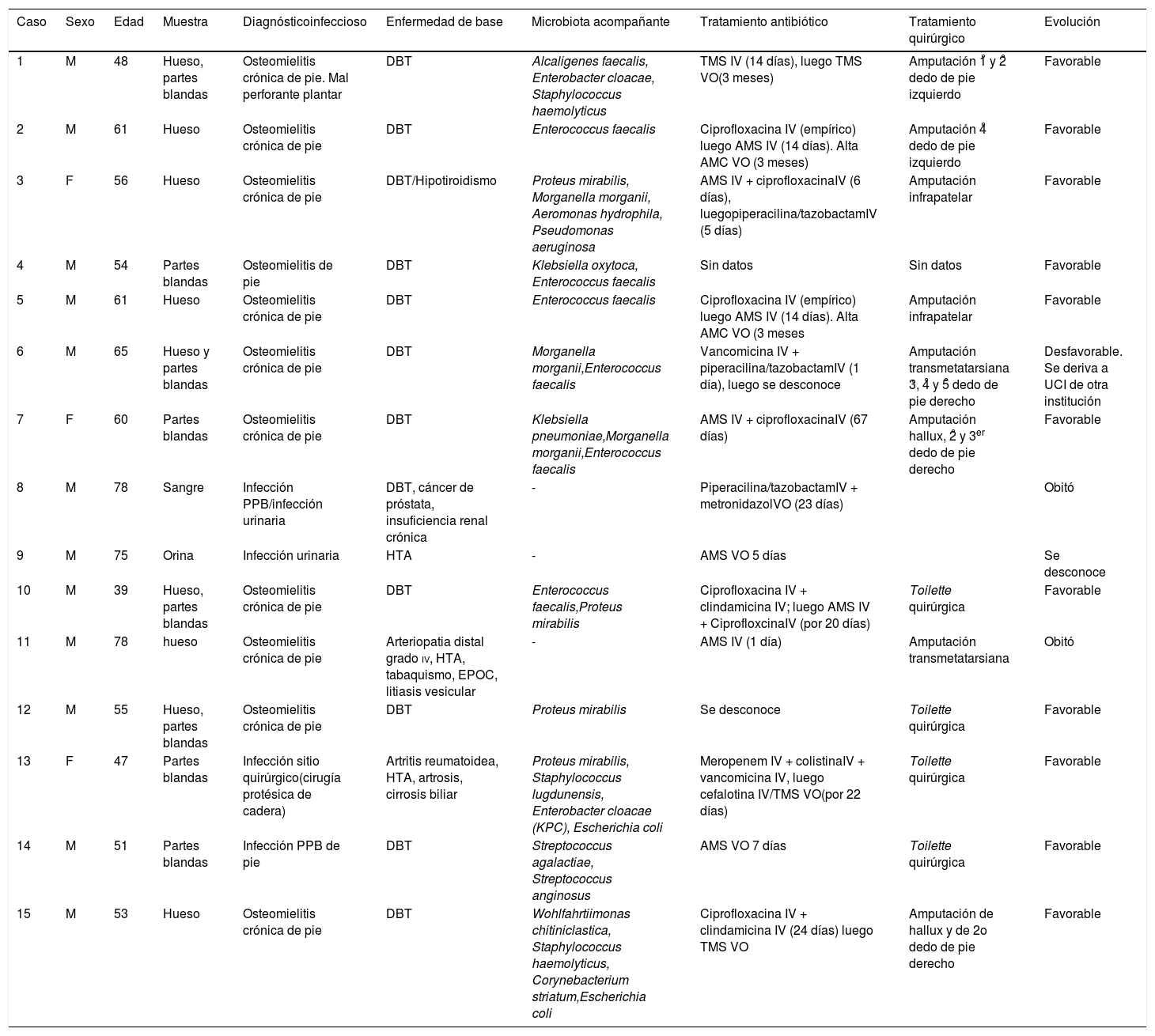
TratamientoLos antibióticos suministrados y la vía de administración, así como la duración de cada tratamiento, varió de acuerdo a la severidad de la infección, y se muestran en la tabla 1.
Características microbiológicas y clínicas de los casos con aislamiento de Vagococcus spp
| Caso | Sexo | Edad | Muestra | Diagnósticoinfeccioso | Enfermedad de base | Microbiota acompañante | Tratamiento antibiótico | Tratamiento quirúrgico | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 48 | Hueso, partes blandas | Osteomielitis crónica de pie. Mal perforante plantar | DBT | Alcaligenes faecalis, Enterobacter cloacae, Staphylococcus haemolyticus | TMS IV (14 días), luego TMS VO(3 meses) | Amputación 1̊ y 2̊ dedo de pie izquierdo | Favorable |
| 2 | M | 61 | Hueso | Osteomielitis crónica de pie | DBT | Enterococcus faecalis | Ciprofloxacina IV (empírico) luego AMS IV (14 días). Alta AMC VO (3 meses) | Amputación 4̊ dedo de pie izquierdo | Favorable |
| 3 | F | 56 | Hueso | Osteomielitis crónica de pie | DBT/Hipotiroidismo | Proteus mirabilis, Morganella morganii, Aeromonas hydrophila, Pseudomonas aeruginosa | AMS IV + ciprofloxacinaIV (6 días), luegopiperacilina/tazobactamIV (5 días) | Amputación infrapatelar | Favorable |
| 4 | M | 54 | Partes blandas | Osteomielitis de pie | DBT | Klebsiella oxytoca, Enterococcus faecalis | Sin datos | Sin datos | Favorable |
| 5 | M | 61 | Hueso | Osteomielitis crónica de pie | DBT | Enterococcus faecalis | Ciprofloxacina IV (empírico) luego AMS IV (14 días). Alta AMC VO (3 meses | Amputación infrapatelar | Favorable |
| 6 | M | 65 | Hueso y partes blandas | Osteomielitis crónica de pie | DBT | Morganella morganii,Enterococcus faecalis | Vancomicina IV + piperacilina/tazobactamIV (1 día), luego se desconoce | Amputación transmetatarsiana 3̊, 4̊ y 5̊ dedo de pie derecho | Desfavorable. Se deriva a UCI de otra institución |
| 7 | F | 60 | Partes blandas | Osteomielitis crónica de pie | DBT | Klebsiella pneumoniae,Morganella morganii,Enterococcus faecalis | AMS IV + ciprofloxacinaIV (67 días) | Amputación hallux, 2̊ y 3er dedo de pie derecho | Favorable |
| 8 | M | 78 | Sangre | Infección PPB/infección urinaria | DBT, cáncer de próstata, insuficiencia renal crónica | - | Piperacilina/tazobactamIV + metronidazolVO (23 días) | Obitó | |
| 9 | M | 75 | Orina | Infección urinaria | HTA | - | AMS VO 5 días | Se desconoce | |
| 10 | M | 39 | Hueso, partes blandas | Osteomielitis crónica de pie | DBT | Enterococcus faecalis,Proteus mirabilis | Ciprofloxacina IV + clindamicina IV; luego AMS IV + CiprofloxcinaIV (por 20 días) | Toilette quirúrgica | Favorable |
| 11 | M | 78 | hueso | Osteomielitis crónica de pie | Arteriopatia distal grado iv, HTA, tabaquismo, EPOC, litiasis vesicular | - | AMS IV (1 día) | Amputación transmetatarsiana | Obitó |
| 12 | M | 55 | Hueso, partes blandas | Osteomielitis crónica de pie | DBT | Proteus mirabilis | Se desconoce | Toilette quirúrgica | Favorable |
| 13 | F | 47 | Partes blandas | Infección sitio quirúrgico(cirugía protésica de cadera) | Artritis reumatoidea, HTA, artrosis, cirrosis biliar | Proteus mirabilis, Staphylococcus lugdunensis, Enterobacter cloacae (KPC), Escherichia coli | Meropenem IV + colistinaIV + vancomicina IV, luego cefalotina IV/TMS VO(por 22 días) | Toilette quirúrgica | Favorable |
| 14 | M | 51 | Partes blandas | Infección PPB de pie | DBT | Streptococcus agalactiae, Streptococcus anginosus | AMS VO 7 días | Toilette quirúrgica | Favorable |
| 15 | M | 53 | Hueso | Osteomielitis crónica de pie | DBT | Wohlfahrtiimonas chitiniclastica, Staphylococcus haemolyticus, Corynebacterium striatum,Escherichia coli | Ciprofloxacina IV + clindamicina IV (24 días) luego TMS VO | Amputación de hallux y de 2o dedo de pie derecho | Favorable |
AMC: amoxicilina-ácido clavulánico; AMS: ampicilina-sulbactam; DBT: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IV: administración endovenosa; PPB: piel y partes blandas; TMS: trimetoprima-sulfametoxazol; UCI: Unidad de Cuidados Intensivos; VO: administración vía oral.
La amplificación y posterior secuenciación del gen ARNr 16S identificó 11 aislamientos como V. fluvialis, uno como V. lutrae y en tres casos sólo se obtuvo la identificación molecular a nivel de género dado que esta metodología no discriminó entre V. fluvialis y V. carnophilus.
Debido a la similitud fenotípica entre las distintas especies, la identificación por pruebas bioquímicas convencionales sólo permitió la identificación a nivel de género.
Aunque la identificación por espectrometría de masas correlacionó con la identificación molecular en 11 aislados de V. fluvialis, los tres aislamientos identificados sólo a nivel de género por el método de referencia también fueron identificados como V. fluvialis con scores > 2,0 por la espectrometría de masas. A pesar de obtener un score confiable a nivel de especie, la identificación por esta metodología fue considerada correcta sólo a nivel de género, dado que V. carnophilus no se encuentra en la base de datos del equipo. El único aislado identificado como V. lutrae por metodología molecular fue identificado a nivel de especie por MALDI-TOF MS.
En relación al sistema automatizado VITEK® C2 y, a diferencia de la identificación molecular, todos los aislados fueron identificados como V. fluvialis, por lo tanto, la identificación por esta metodología se consideró correcta sólo a nivel de género.
La mayoría de los hallazgos de Vagococcus spp. (13/15) correspondieron a infecciones localizadas en piel y partes blandas/partes óseas; los dos aislados restantes procedían de urocultivo y hemocultivo.
El único aislamiento de Vagococcus lutrae a partir de sangre correspondió a un paciente diabético de 77 años, con antecedentes de cáncer de próstata en tratamiento con quimioterápicos, que ingresó por mala evolución clínica. El paciente presentaba dos probables focos infecciosos como fuente de la bacteriemia, el foco urinario y el de piel y partes blandas. A partir de la orina se aisló K. pneumoniae productora de beta lactamasa de espectro extendido (BLEE) sólo sensible a amicacina y carbapenemes, pero la muestra de partes blandas (celulitis de dorso de pie) lamentablemente no fue enviada para cultivo. El paciente tuvo una mala evolución y falleció.
Con relación al correlato clínico, el grupo etario estuvo comprendido entre 39 y 78 años, de los cuales 12 fueron de sexo masculino y 3 de sexo femenino.
En doce de los casos Vagococcus spp. fue aislado con microbiota acompañante (tabla 1).
Doce de quince de los pacientes presentaban diabetes mellitus como enfermedad de base (tabla 1). Dos pacientes fallecieron.
Los antibióticos más activos fueron ampicilina, TMS, vancomicina, teicoplanina y linezolid, con una CIM50 (μg/mL) de < 2,0, < 2,0, 2, 0,5 y 1,0 respectivamente. La resistencia a las fluoroquinolonas fue observada en seis aislamientos, con una CIM50 de 1,0 μg/mL y CIM90 de 8,0 μg/mL. Doce de los quince aislamientos resultaron resistentes a las tetraciclinas con una CIM50 de 16 μg/mL. Los macrólidos presentaron una escasa actividad (sólo cuatro de 15 aislamientos fueron sensibles) (CIM50 y CIM90 de 1,0 μg/mL).
DiscusiónLa primera evidencia de una conexión de V. fluvialis con posibles infecciones humanas fue comunicada por Teixeira et al., en 199713, ellos reportaron el aislamiento de esta especie del líquido peritoneal de un paciente con nefropatía, a partir de una herida infectada de un paciente mordido por un cordero; y de hemocultivos de dos pacientes de los que no se disponía información adicional sobre el estado clínico o la enfermedad asociada13. Recién, veinte años después, en el año 2008, Al-Ahmad et al. informaron el aislamiento de V. fluvialis como parte de una infección endodóntica mixta en un paciente con un conducto radicular dentario infectado14. Más recientemente, Jadhav et al. describieron un caso de endocarditis por esta especie en un paciente de 70 años con insuficiencia aortica grave que requirió reemplazo valvular15.
Con relación a otras especies, García et al. comunicaron en 2016 el primer aislamiento clínico de Vagococcus lutrae (una especie que fue aislada en nutrias), proveniente de lesiones maceradas en piel en paciente con obesidad mórbida en Francia16. El segundo aislamiento de esta especie a partir de una infección humana y el primero a partir de sangre de una paciente añosa con lesiones en piel como probable foco de infección fue recientemente reportado por Altintas et al.17.
En agosto de 2019, Shewmaker et al. describen el aislamiento de una nueva especie: Vagococcus vulneris en una herida de pie18.
El aislamiento de Vagococcus lutrae a partir de sangre en el presente trabajo representaría el segundo reporte de aislamiento de esta especie a partir de sangre y el tercero a partir de una infección humana en la literatura. Lamentablemente no pudo establecerse si el foco de la bacteriemia fue la infección de piel y partes blandas, o si en cambio se trató de un contaminante, dado que el microorganismo fue aislado en uno de dos frascos de hemocultivos.
Se destaca la presencia de diabetes como enfermedad de base en 12 de los 15 pacientes en los que se aisló Vagococcus spp. Esta asociación no ha sido mencionada previamente en la literatura y abre una nueva puerta para la investigación.
Consideramos que el reporte de Vagococcus puede estar subestimado debido a que el microorganismo suele ser incorrectamente identificado como Enterococcus spp. por pruebas bioquímicas convencionales, dada la similitud en su perfil bioquímico5,13. El advenimiento de la espectrometría de masas MALDI-TOF MS y su uso cada vez más extendido a nivel mundial permitirá reconocer este género en forma rápida y establecer su verdadero rol en la infección humana.
Nuestro trabajo incluye el estudio de 15 aislados de Vagococcus spp., lo que constituye el trabajo con el mayor número de casos descriptos en la literatura. Su aislamiento mayoritario a partir de infecciones de piel, partes blandas y óseas de pacientes diabéticos abre una puerta a la investigación de la posible asociación entre las infecciones por Vagococcus spp. y los pacientes con esta enfermedad metabólica.
FinanciaciónEl presente trabajo ha sido financiado con fondos del Proyecto UBACYT 2018 Modalidad i: Código 20020170100109BA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.