La mayoría de las micosis diagnosticadas en España están producidas por hongos existentes en este país; el resto tienen como agente causal hongos endémicos de otras regiones del mundo1,2. La histoplasmosis se debe a la infección por 2 variedades de Histoplasma capsulatum: H. capsulatum var. capsulatum y H. capsulatum var. duboisii. La primera variedad causa infecciones pulmonares y diseminadas en la mitad oriental de Estados Unidos y la mayor parte de Latinoamérica, mientras que la segunda produce principalmente lesiones cutáneas y óseas, y se localiza en las zonas tropicales de África3. La incidencia de histoplasmosis en zonas no endémicas está aumentando debido al incremento de los viajes internacionales y de la inmigración2. La presentación clínica de la histoplasmosis producida por H. capsulatum var. capsulatum depende de la intensidad de la exposición y del estado inmunológico del organismo anfitrión4,5, aunque prácticamente todas las formas de presentación de esta enfermedad pueden recordar a la tuberculosis6,7. Las formas diseminadas agudas se presentan con un síndrome febril, astenia, manifestaciones cutaneomucosas e infiltrados pulmonares. Pueden observarse hepatomegalia, esplenomegalia y adenomegalia. Una pequeña proporción de pacientes presentan un estado de shock séptico con elevada mortalidad1,3,4. Las formas diseminadas agudas de la enfermedad resultan o bien por una infección aguda o bien por la reactivación de la infección latente y son mucho más graves en los pacientes con sida.
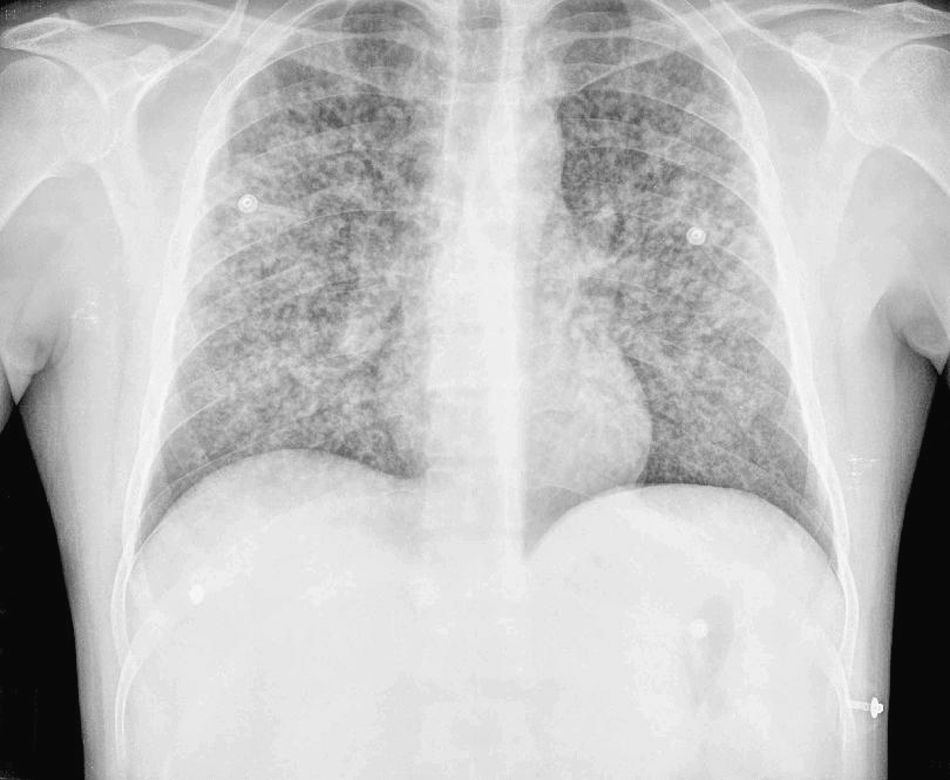
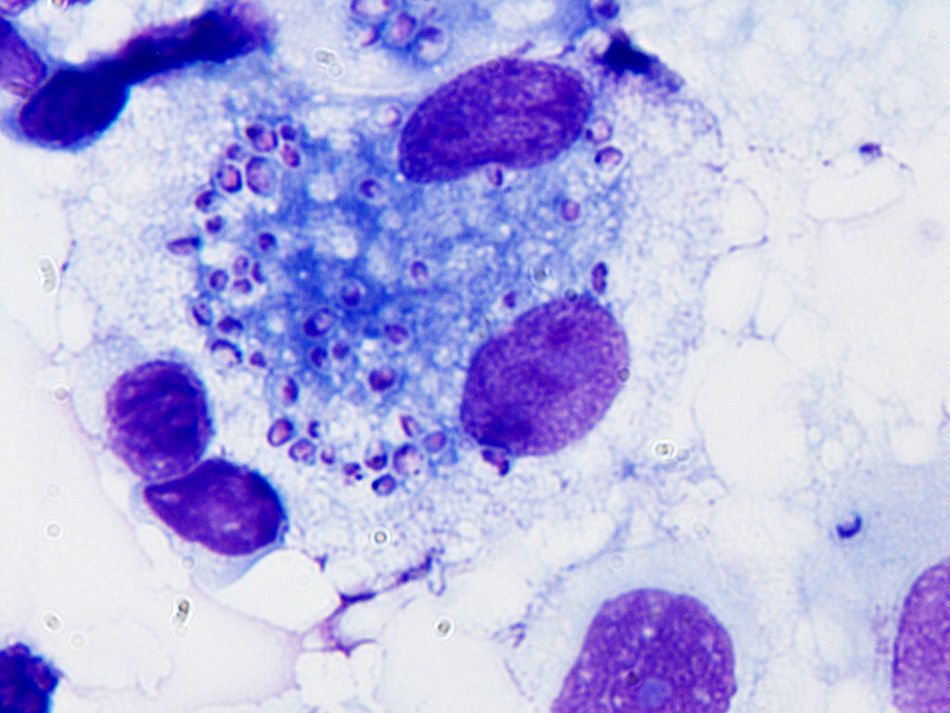
Describimos a continuación el caso de un paciente varón de 31 años, natural de Panamá, diagnosticado de VIH en 2002, sin tratamiento antirretroviral activo. Desde febrero de 2010 consultó en varias ocasiones en su centro de atención primaria por un cuadro de fiebre intermitente de hasta 39°C, sudoración vespertina y pérdida de peso, ocultando su condición de infectado por el VIH. Se orientó como fiebre de origen desconocido y se derivó al hospital de día de la unidad de enfermedades infecciosas, al que nunca acudió. En abril de 2010 realizó un viaje a Panamá, donde consultó por cuadro de fiebre y disnea. Se le diagnosticó posible tuberculosis pulmonar por la imagen radiográfica sin que se realizaran pruebas o se instaurara tratamiento (fig. 1). A las 48 h de esta consulta regresó a Barcelona (9/4/2010) acudiendo a nuestro centro directamente desde el aeropuerto. Se solicitaron muestras de sangre para estudio citológico y microbiológico. Analíticamente destacaba pancitopenia (Hb de 7g/dl, plaquetas de 120 x 109/l, leucocitos de 1,3 x 109/l) y unos valores de procalcitonina de 44,5mg/dl y PCR de 38mg/dl. Se instauró cobertura antibiótica empírica con rifampicina i.v. 300mg/24h, isoniacida i.v. 1.000mg/24h, etambutol i.v. 1.200mg/48h, piracinamida 1.000mg/24h, ceftriaxona 1g/24h, levofloxacino i.v. 250mg/48h y cotrimoxazol i.v. 800mg/8h, añadiéndose fluconazol i.v. 200mg/24h por candidiasis orofaríngea. El paciente desarrolló dentro de las primeras 72 h de ingreso fracaso multiorgánico por lo que requirió intubación orotraquial, ventilación mecánica, hemodiálisis y soporte con fármacos vasoactivos por inestabilidad hemodinámica. El 10 de abril se realizó fibrobroncoscopia, enviándose muestras de lavado broncoalveolar al laboratorio de Microbiología. En el examen de frotis de sangre periférica teñida con Giemsa se apreciaron formas levaduriformes intracelulares compatibles con H. capsulatum, por lo que se instauró tratamiento con anfotericina B liposomal en dosis de 4mg/kg/día. Se envió muestra respiratoria al Centro Nacional de Microbiología donde confirmaron el diagnóstico de H. captulatum mediante PCR. Tras 10 días de incubación de los hemocultivos en el sistema automatizado Bact/ALERT 3D® (Biomérieux)©, se detectó crecimiento y se realizó una resiembra en agar Sabouraud donde se observó crecimiento de un hongo filamentoso a los 7 días de incubación a 30°C. No se observó ningún crecimiento micobacteriano en ninguna de las muestras enviadas. El paciente presentó una evolución tórpida, con persistencia de la fiebre, empeoramiento analítico e insuficiencia hepática y renal. Se decidió mantener cobertura para probable tuberculosis miliar ajustando a función hepática y renal dejando estreptomicina i.m. 1.000mg/96h, etambutol i.v. 1.200mg/48h y levofloxacino i.v. 250mg/48h. El 14 de abril se realizó estudio inmunológico de VIH detectándose 94 CD4/μl y una carga viral de 303.168 copias/ml. Se consideró no tributario de tratamiento antirretroviral por la insuficiencia hepática y renal. El 27 de abril se realizó un aspirado de médula ósea que teñida con Giemsa mostró abundantes levaduras intracelulares (fig. 2). El paciente presentó un empeoramiento progresivo clínico y analítico, con fallo multiorgánico, y murió el día 29 de abril.
El diagnóstico de laboratorio de la histoplasmosis se basa en diferentes procedimientos microbiológicos. El cultivo de muestras respiratorias, médula ósea o sangre debe incubarse a 25-30°C durante 4-6 semanas. Las colonias que se originan son de aspecto algodonoso y la conversión a levadura puede ser difícil. La serología es muy útil en los casos subagudos y crónicos pero tiene limitaciones (requiere de 2 a 6 semanas para producir anticuerpos, es menos sensible en pacientes inmunodeprimidos, no siempre indica una infección actual y se pueden dar reacciones cruzadas con otras micosis endémicas). La tinción histopatológica teñida con Giemsa demostrando levaduras intracelulares es también útil para la confirmación. La detección de antígeno por enzimoinmunoanálisis en sangre, orina, LCR o lavado broncoalveolar en los pacientes con inmunodepresión grave proporciona un método rápido de diagnóstico de histoplasmosis diseminada o aguda. Existe la prueba cutánea con histoplasmina, aunque no es útil para el diagnóstico de la histoplasmosis, ya que puede detectar exposición previa al hongo, se vuelve positiva a las 2-4 semanas de la exposición y puede ser negativa en la mitad de las infecciones diseminadas. Las técnicas para la detección de ácidos nucleicos fúngicos están muy desarrolladas, pero falta el paso de estandarización que permita su comercialización y, por tanto, validación en los laboratorios. El gran interés de estas técnicas radica en su gran sensibilidad8,9.
Aunque en nuestro medio es una enfermedad poco frecuente, la histoplasmosis debería incluirse en el diagnóstico diferencial de enfermedades que afecten a viajeros e inmigrantes procedentes de zonas endémicas. Además, los clínicos deben estar alerta para diferenciarla de la tuberculosis, ya que es una enfermedad prevalente también en inmigrantes y pacientes con VIH y produce unas manifestaciones clínicas similares. En países endémicos, el 2-5% de los pacientes con sida presentan histoplasmosis. A pesar de que la mayoría de las infecciones que produce son asintomáticas, también pueden darse formas diseminadas letales especialmente en pacientes inmunodeprimidos, por lo que los clínicos de zonas no endémicas deberían poner especial atención a la hora de recoger la historia clínica, preguntando por áreas visitadas, contacto con pájaros o murciélagos u otras actividades de riesgo. Aunque la profilaxis primaria usando 200mg/día de itraconazol no ha demostrado beneficio en la supervivencia, previene la histoplasmosis en pacientes con infección por el VIH y recuento de linfocitos T CD4+ < 150 cél./mm3, y está recomendada en pacientes con infección por VIH que viven en regiones con altas tasas de histoplasmosis. En España podría plantearse en inmigrantes infectados por el VIH originarios de países endémicos. Ante un caso similar, y siempre teniendo en cuenta las posibles interacciones con otros fármacos, se podría plantear recomendar el tratamiento empírico con itraconazol o anfotericina B.