Con la introducción de telaprevir, un nuevo antiviral de acción directa frente al virus de la hepatitis C (VHC), sustrato e inhibidor de la isoenzima CYP3A del citocromo P450, la valoración de las interacciones medicamentosas se ha convertido en un elemento de importancia capital en la evaluación de los pacientes que realizan tratamiento para la hepatitis C. Hay que tener presente que durante el tratamiento de esta infección, muchos pacientes necesitan tomar otros medicamentos para mitigar los efectos adversos de los fármacos anti-VHC y para el control de otras comorbilidades. Además, los pacientes coinfectados por el VHC y el virus de la inmunodeficiencia humana necesitan, en su inmensa mayoría, tomar antirretrovirales durante el tratamiento de la hepatitis C. Es muy importante, por lo tanto, conocer las propiedades farmacocinéticas de los antivirales de acción directa frente al VHC, así como sus potenciales interacciones medicamentosas. En este capítulo se revisa la información disponible hasta la fecha sobre las interacciones de telaprevir con otros fármacos y se dan unas recomendaciones para la práctica clínica diaria
Telaprevir is a new direct-acting antiviral drug for the treatment of hepatitis C virus (HCV) infection and is both a substrate and an inhibitor of cytochrome P450 (CYP450) isoenzymes. With the introduction of this new drug, assessment of drug-drug interactions has become a key factor in the evaluation of patients under treatment for HCV infection. During the treatment of this infection, many patients require other drugs to mitigate the adverse effects of anti-HCV drugs and to control other comorbidities. Moreover, most patients coinfected with HIV and HCV require antiretroviral therapy during treatment for HCV. Physicians should therefore be familiar with the pharmacokinetic properties of direct-acting antivirals for HCV treatment and their potential drug-drug interactions. The present article reviews the available information to date on the interactions of telaprevir with other drugs and provides recommendations for daily clinical practice.
Las interacciones de medicamentos no eran del todo nuevas en el campo del tratamiento de infección por el virus de la hepatitis C (VHC), especialmente con los pacientes infectados por el virus de inmunodeficiencia humana (VIH), en los que podían resultar problemáticas las interacciones entre ribavirina y algunos análogos de nucleósido1.
Con la introducción de los antivirales de acción directa como telaprevir, el manejo de las interacciones fármaco-fármaco en el tratamiento de pacientes infectados por el VHC ha cobrado un gran interés y resulta comparable con lo que ocurrió tras la introducción de los inhibidores de la proteasa (IP) del VIH a mediados de los años noventa.
Los profesionales de la salud involucrados en el tratamiento del VHC deben tener un conocimiento sólido de las potenciales interacciones farmacocinéticas de los nuevos antivirales de acción directa frente al VHC; interacciones que pueden ser bidireccionales, y con potenciales efectos sobre la eficacia y/o seguridad de los distintos grupos de fármacos. Es importante tener presente que este es un campo en rápida evolución y que todavía se desconocen las interacciones con muchos fármacos.
Es difícil interpretar los resultados de los estudios de interacción farmacocinética sin conocer bien la correlación entre concentración y respuesta terapéutica, dado que no hay pruebas sólidas que nos indiquen cuáles son los cambios en las concentraciones del fármaco que se asocian con reducción de la eficacia. También es importante conocer la concentración a partir de la cual aumenta de forma significativa la toxicidad del fármaco; cuál es el parámetro farmacocinético más estrechamente relacionado con la respuesta terapéutica (el área bajo la curva [AUC] o la concentración mínima [Cmin]), y cuál es la variabilidad interindividual en la farmacocinética del fármaco. No es de extrañar que en la práctica clínica resulte prácticamente imposible la evaluación equilibrada y completa de los datos de interacción de fármacos.
Telaprevir es un inhibidor de la serin proteasa del VHC, una enzima no estructural denominada NS3/4A, esencial en el ciclo de replicación del virus. Telaprevir se administra oralmente y presenta una absorción dependiente de la ingesta de alimentos y con una vida media relativamente corta, que exige la administración 3 veces al día, aunque su administración 2 veces al día ha sido estudiada en el seno de ensayos clínicos y, actualmente, está en trámites de ser incluida en la ficha técnica del fármaco2.
En plasma, telaprevir se une moderadamente a proteínas (59–76%), fundamentalmente a la glucoproteína alfa-1 ácida y a la albúmina. Esta unión es inversamente proporcional a la concentración total del fármaco. La competencia con otras sustancias por la unión a proteínas puede ser fuente de interacciones.
Telaprevir se metaboliza en el hígado, donde alcanza concentraciones 35 veces superiores a las plasmáticas. En el hígado, telaprevir es sustrato del CYP3A, que constituye su principal vía metabólica y también es inhibidor potente de dicha isoenzima3. La disminución en la actividad del CYP3A se mantiene incluso durante 7 días tras la interrupción del fármaco, hasta que se generan nuevas enzimas CYP3A.
Telaprevir se puede metabolizar también por otras vías de hidrólisis, reducción u oxidación de sustancias no relacionadas con los citocromos, que adquieren mayor importancia tras la exposición a dosis múltiple de telaprevir y que podría ser la base de resultados inesperados de ciertas interacciones.
Además, telaprevir es sustrato del transportador de membrana glucoproteína-P (P-gp)3, presente en muchos lugares del organismo, como tracto gastrointestinal, barrera hematoencefálica y placenta. La P-gp es una bomba que impide la captación de sustratos y, como tal, puede ser vista como una protección del organismo contra sustancias nocivas. Telaprevir es también inhibidor de P-gp, aunque este efecto es más difícil de evaluar en casos concretos, dado que hay un gran solapamiento entre los sustratos de CYP3A y P-gp3.
Por todo lo anterior, la mayor parte de la atención debe dirigirse al estudio y conocimiento de las interacciones entre telaprevir y los fármacos que son sustratos, inhibidores o inductores, tanto de CYP3A como de P-gp, y a las interacciones por desplazamiento de las uniones a proteínas.
Sin embargo, en el caso de telaprevir, las interacciones farmacocinéticas con otras sustancias observadas en estudios in vivo no siempre coinciden con lo esperado de los conocimientos de su metabolismo o de los resultados de los estudios in vitro. Incluso algunas interacciones farmacocinéticas pudieran no tener la relevancia farmacodinámica (impacto en la eficacia o en la seguridad) que presumen. Por eso es importante disponer de estudios clínicos de interacción específicos donde se pueda evaluar la interacción farmacocinética y farmacodinámica.
Por último hay que tener en cuenta que telaprevir se utiliza en pacientes con hepatopatía. Los estudios farmacocinéticos en pacientes con insuficiencia hepática leve o moderada indican una disminución de la exposición a telaprevir que puede ser clínicamente relevante en caso de insuficiencia hepática moderada (disminución del 50% en el AUC).
El propósito de este capítulo es la revisión de los datos disponibles sobre interacciones de telaprevir con otros fármacos con un sentido práctico, mostrando las limitaciones y precauciones que debemos tener con dichas asociaciones, y señalando los conocimientos que deberían generarse para una mejor toma de decisiones.
Inmunosupresores y esteroidesSin duda, algunas de las interacciones farmacológicas más importantes de los nuevos agentes anti-VHC son las que ocurren con inmunosupresores como tacrolimus y ciclosporina4. Estos inmunosupresores son sustratos de CYP3A y P-gp, y dados los efectos inhibidores de telaprevir sobre estos sistemas enzimáticos es de esperar que las concentraciones plasmáticas de los inmunosupresores se incrementen de manera significativa cuando se combinan con telaprevir.
La interacción entre tacrolimus y ciclosporina con telaprevir se ha estudiado en voluntarios sanos5 y se ha demostrado que la interacción de telaprevir con tracrolimus es de gran magnitud, con un incremento en el AUC de tacrolimus de 70 veces y un incremento en el AUC de ciclosporina de aproximadamente 4,6 veces, por lo que se considera que los efectos de la combinación de telaprevir con estos fármacos, especialmente con tacrolimus, pueden ser graves si no se ajustan las dosis de inmunosupresores.
En estudios llevados a cabo en pacientes, la dosis de ciclosporina necesitó un ajuste promedio de 1,3 veces, lo que resulta inferior a las 2,6 veces descrita en voluntarios sanos. Se están realizando ensayos clínicos de fase II para conocer si pautas con dosis bajas de tacrolimus administradas 1 vez a la semana pueden permitir una monitorización menos intensiva del inmunosupresor cuando se combina con telaprevir6.
En el documento de la Agencia Española del Medicamento sobre recomendaciones para el tratamiento con telaprevir de la hepatitis crónica C en pacientes trasplantados de hígado7, se recomienda que en el mismo día en que se comienza el tratamiento con telaprevir, la dosis de ciclosporina debe reducirse a la mitad y administrarse cada 48h en vez de cada 12h. Por ejemplo, un paciente que recibe una dosis de ciclosporina de 100mg/12h debe reducir la dosis a 50mg/48h.
En cuanto a tacrolimus, la recomendación es reducir la dosis a 1/10 el día del inicio del tratamiento con telaprevir y espaciar posteriormente la administración de tacrolimus cada 48–72h en vez de cada 12h. Por ejemplo, un paciente con una dosis de 2mg/12h debe reducir la dosis a 0,2mg/48–72h.
Tras la primera administración de telaprevir se procederá a la determinación de C2 (concentración de ciclosporina o tacrolimus a las 2h) para disponer de una determinación pico. Es preferible que, hasta que no haya una mayor experiencia en el manejo de las interacciones entre telaprevir y ciclosporina, los pacientes permanezcan en hospital de día o consultas externas unas 6 h tras la primera administración.
Adicionalmente se recomienda monitorizar los valores de ciclosporina o tacrolimus a días alternos durante la primera semana del inicio del tratamiento con telaprevir y en la semana siguiente a la suspensión de telaprevir. Estos cambios en las dosis e intervalos de ciclosporina o tacrolimus recomendados son aproximaciones y, por tanto, deberán ajustarse individualmente en función de los valores valle determinados a días alternos durante la primera semana de seguimiento.
Además, una vez interrumpido el tratamiento con telaprevir se reiniciará el tratamiento inmunosupresor a las dosis previas al inicio de los IP (y se procederá a monitorizar los valores a días alternos durante la primera semana).
Telaprevir presenta adicionalmente la ventaja de necesitar ser administrado solamente durante 12 semanas, con lo cual el ajuste de la dosis de inmunosupresores es necesario solamente durante esas 12 semanas de tratamiento triple.
Se ha prestado menos atención a los efectos de los inmunosupresores sobre telaprevir, aunque no se espera que haya muchos cambios.
La combinación de inmunosupresores, como ciclosporina o tacrolimus, y boceprevir produce una interacción menos marcada, pero que requiere también ajuste de dosis de los inmunosupresores y el inconveniente de necesitar ser administrado durante 44 semanas8–10. Apenas hay datos sobre el uso de otros inmunosupresores como sirolimus y everolimus, pero se espera que los efectos sean similares a aquellos con tacrolimus.
La mayoría de los estudios de triple terapia en pacientes trasplantados hepáticos infectados por el VHC genotipo 1 se han realizado con telaprevir y, aunque el número de pacientes evaluados es aún pequeño, muestran resultados preliminares de negativización del ARN del VHC en la semana 12 de tratamiento de entre el 68 y el 100%11–18. Estos datos sugieren que podría darse un gran avance, ya que la respuesta virológica sostenida de pacientes con genotipo 1 a la biterapia oscilaba entre un 12 y un 40%19.
Los corticoides sistémicos, como prednisona y metilprednisolona, son sustratos de CYP3A, por lo que sus valores pueden aumentar cuando se combinan con antivirales de acción directa6. Esto también puede ocurrir con algunos corticoides que se administran por inhalación o por vía intranasal, como budesonida y fluticasona. Por dicho motivo puede verse síndrome de Cushing iatrogénico cuando se combinan estos corticoides con IP del VHC. La dexametasona puede actuar como inductor enzimático y reducir las concentraciones de los antivirales de acción directa6.
No se espera que haya muchas interacciones entre telaprevir y los preparados dermatológicos de corticoides; sin embargo, las cosas podrían ser diferentes para los corticoides tópicos que se utilizan para trastornos anorrectales.
AntimicrobianosEl ketoconazol es un prototipo de inhibidor de la CYP3A que se utiliza a menudo para investigar las interacciones farmacológicas durante el desarrollo clínico de fármacos que son sustratos del CYP3A, como por ejemplo telaprevir. Los estudios de interacción entre telaprevir y ketoconazol han mostrado que las concentraciones de telaprevir aumentan en un 62% y las de ketoconazol en un 46–125%, lo que demuestra el potencial inhibitorio de telaprevir sobre CYP3A/Pgp3. Cuando se administren juntos se recomienda no modificar la dosis de telaprevir y no superar la dosis diaria de 200 mg de ketoconazol para evitar el desarrollo de toxicidad3. Esta recomendación se ha hecho extensiva al itraconazol, aunque la combinación de este antifúngico con telaprevir no se ha estudiado formalmente6.
La claritromicina es un conocido inhibidor del CYP3A. Cuando se combinan claritromicina y boceprevir, las concentraciones plasmáticas de este último aumentan marginalmente (+21%), por lo que se considera que estos fármacos pueden combinarse de manera segura sin ajuste de dosis6. No se han estudiado las interacciones entre claritromicina y telaprevir, pero se considera que la recomendación es la misma que con boceprevir6. El posible aumento de los valores de claritromicina hace aconsejable la monitorización electrocardiográfica de los pacientes que toman este fármaco en combinación con telaprevir, dado que puede haber prolongación del intervalo QT. Siempre que sea posible, el macrólido para combinar con telaprevir debe ser azitromicina, ya que este fármaco no es ni inhibidor ni sustrato del CYP3A.
La rifampicina es el prototipo de inductor enzimático potente y, por tanto, resulta difícil de combinar con sustratos del CYP como telaprevir. El AUC de telaprevir en combinación con rifampicina se redujo en un 92%, por lo que esta combinación está contraindicada3.
Metadona/buprenorfinaDebido a que el uso de drogas intravenosas es una de las principales vías de adquisición del VHC, un número considerable de pacientes que están recibiendo terapia de sustitución de opiáceos será considerado para el tratamiento con telaprevir.
La metadona se utiliza comúnmente en los programas de sustitución de opiáceos y se ha estudiado ampliamente. El telaprevir reduce la concentración total de metadona en un 29% debido a que compite con el opiáceo por los sitios de unión de las proteínas plasmáticas, sin que se produzcan cambios en la concentración de la fracción libre de metadona3. Por lo tanto, según la ficha técnica del fármaco, no se requiere ajustar la dosis de metadona cuando se inicia la administración conjunta de telaprevir.
La buprenorfina es una alternativa a la metadona para pacientes con adicción a opiáceos. Tiene múltiples vías metabólicas incluyendo CYP3A, por lo que es posible que aumenten sus concentraciones plasmáticas cuando se combina con inhibidores de la CYP3A como telaprevir. Sin embargo se ha comprobado que la combinación de telaprevir no aumenta las concentraciones de buprenorfina ni se asocia con signos de toxicidad del opiáceo20.
AntidepresivosEl uso concomitante de antidepresivos durante el tratamiento del VHC es frecuente dado que la depresión es una comorbilidad relativamente común de los pacientes o aparece como efecto adverso del tratamiento con interferón pegilado (Peg-IFN) alfa. Por este motivo es importante disponer de información acerca de interacciones farmacocinéticas entre antidepresivos y nuevos antivirales frente al VHC, como telaprevir, ya que ambos grupos de fármacos son a menudo sustratos del CYP.
El escitalopram es un fármaco muy bien estudiado para la prevención de la depresión inducida por Peg-IFN y, por lo tanto, un candidato lógico para estar incluido en la lista de estudios de interacción de fármacos con IP del VHC. Cuando se combina escitalopram con telaprevir, no se modifican las concentraciones de telaprevir, pero las concentraciones de escitalopram se reducen aproximadamente en un 35%3,6. Por dicho motivo, cuando se inicia el tratamiento con escitalopram en un paciente con telaprevir, se debe alcanzar una dosis lo suficientemente alta antes de concluir que el antidepresivo no es eficaz. Otros antidepresivos, como sertralina y mirtazapina, son sustratos de CYP3A y sus concentraciones plasmáticas pueden aumentar cuando se combinan con telaprevir3,6.
Otros antidepresivos (p. ej., paroxetina, duloxetina y fluoxetina) se metabolizan de manera selectiva por el CYP2D6 y no se espera que su farmacocinética se altere cuando se combinan con telaprevir, dado que este agente carece de actividad inhibidora de CYP2D6, aunque se necesitan más estudios en esta área3,6.
TranquilizantesVarias de las benzodiacepinas se metabolizan por el CYP3A, por lo que resulta esperable que haya interacciones con el telaprevir cuando se coadministren.
El midazolam es un prototipo de sustrato de CYP3A, que se utiliza con frecuencia como premedicación antes de procedimientos endoscópicos. Cuando se coadministran telaprevir y midazolam oral, el AUC de midazolam se incrementa unas 9 veces21, por lo que el midazolam oral está contraindicado con telaprevir. La interacción de telaprevir con midazolam parenteral es menor que la observada con midazolam oral. De hecho, el AUC de midazolam aumenta 3,4 veces sin que se modifique la concentración máxima (Cmax) de la benzodiacepina cuando se coadministran midazolam intravenoso (i.v.) y telaprevir21. Por este motivo se considera segura la administración del 50% de la dosis normal de midazolam i.v. en pacientes tratados con telaprevir. Está contraindicada la administración de otras benzodiacepinas orales como triazolam y alprazolam en pacientes tratados con telaprevir3,6.
Cuando se coadministran zolpidem y telaprevir se reducen las concentraciones de zolpidem en un 50%, por lo que puede resultar necesario aumentar la dosis de zolpidem3,6.
El propofol se elimina principalmente por vía renal, por lo que no resulta esperable que tenga interacciones con telaprevir6.
EstatinasLa mayoría de las estatinas son sustratos de CYP3A, por lo que resulta esperable que los inhibidores de CYP3A, como telaprevir, aumenten los valores de estatinas con el consiguiente riesgo asociado de toxicidad grave, como rabdomiólisis. De hecho, las concentraciones de atorvastatina aumentan casi 8 veces cuando se combina con telaprevir22,23. Por lo tanto, está contraindicada la combinación de telaprevir con atorvastatina y también con simvastatina, aunque no hay datos de interacción entre telaprevir y este último fármaco.
Pravastatina no es un sustrato de CYP, por lo que, al menos teóricamente, podría combinarse con telaprevir. No hay datos de interacción de telaprevir con rosuvastatina y los IP del VHC.
Dado que la duración del tratamiento con telaprevir es corta (12 semanas), una opción razonable es interrumpir temporalmente la estatina para evitar la potencial toxicidad asociada a la interacción medicamentosa.
Fármacos cardiovascularesLos antagonistas del calcio son sustratos de CYP3A (y en parte también de P-gp), por lo que sus concentraciones plasmáticas pueden aumentar cuando se combinan con inhibidores de la CYP3A como telaprevir. La combinación de telaprevir con amlodipino aumenta en 1,8 veces las concentraciones de este último fármaco23, por lo que, en caso de que deban coadministrarse, se aconseja comenzar con una dosis de amlodipino de 5 mg y aumentar según necesidad.
El efecto del telaprevir sobre otros antagonistas del calcio puede que sea más intenso, ya que la mayoría de estos agentes tiene un metabolismo de primer paso mediado por CYP3A más acusado que amlodipino; por dicho motivo, las consecuencias de la interacción puede que sean más relevantes desde el punto de vista clínico6.
Algunos antagonistas del calcio tienen una biodisponibilidad sistémica muy baja (4–8%: barnidipino, lacidipino, lercanidipino) debido al extenso metabolismo de primer paso y sus concentraciones pueden aumentar mucho cuando se combinan con inhibidores de CYP3A; por lo tanto, estos agentes no se deben utilizar como primera elección en pacientes que reciben tratamiento con telaprevir6.
Otros grupos farmacológicos como diuréticos, inhibidores de la enzima de conversión de la angiotensina y antagonistas del receptor de la angiotensina II, no se metabolizan de manera significativa por el CYP extensa, por lo que no se espera que su combinación con telaprevir resulte problemática6.
Tampoco presentan problemas a este respecto los bloqueadores beta dado que muchos se eliminan por vía renal (p. ej., atenolol y sotalol) o se metabolizan a través de CYP2D6 (p. ej., metoprolol y carvedilol)6.
Los antiarrítmicos tienen un estrecho margen terapéutico y algunos son sustratos de CYP3A, como por ejemplo amiodarona y bepridil. Estos últimos están contraindicados en pacientes que toman telaprevir, que es un potente inhibidor del CYP3A6.
La digoxina, prototipo de sustrato de la P-gp, se ha estudiado con telaprevir (inhibidor moderado de este sistema enzimático) y se ha observado que los valores de digoxina aumentaron en un 85% con telaprevir21, por dicho motivo se debe comenzar con dosis bajas de digoxina en pacientes en tratamiento con telaprevir.
AntidiabéticosLa repaglinida es uno de los pocos antidiabéticos orales que se metaboliza parcialmente por CYP3A, por lo que teóricamente podría interactuar con telaprevir. Sin embargo, la ruta principal del metabolismo de repaglinida es CYP2C8 y esta sería la vía de escape en presencia de un inhibidor del CYP3A. Por lo tanto, no se espera que haya interacciones con telaprevir por este mecanismo6. La repaglinida es también sustrato de la familia de proteínas transportadoras de aniones orgánicos (OATP), por lo que posible que presente interacciones con telaprevir no mediadas por CYP6.
Otros antidiabéticos orales también se metabolizan por el hígado, pero no la CYP3A; por ejemplo, la glimepirida es un sustrato de la CYP2C9, enzima que no se afecta por telaprevir6. Tampoco se esperan interacciones entre metformina y telaprevir6.
Otros fármacosLos siguientes fármacos están contraindicados con telaprevir dado que su metabolismo depende en gran medida de CYP3A y tienen un rango terapéutico estrecho: alfusozina, cisaprida, ergotamina y sus derivados, y pimozida6.
Las concentraciones en plasma de los anovulatorios o de su componente estrogénico se reducen aproximadamente en un 25–30% cuando se combinan con telaprevir24, por lo que se recomienda tomar precauciones adicionales para prevenir el embarazo.
La colchicina es otro sustrato de CYP3A con estrecho margen terapéutico. Los pacientes con insuficiencia renal o hepática no deben tomar colchicina con telaprevir, debido al riesgo de toxicidad de colchicina. En los pacientes con función renal y hepática normales se recomienda la interrupción del tratamiento con colchicina, o bien seguir un curso limitado de tratamiento con colchicina a dosis reducidas.
Además de rifampicina, otros inductores enzimáticos potentes son carbamazepina, fenitoína, fenobarbital y la hierba de San Juan; fármacos que no se deben combinar con telaprevir por el riesgo de que produzcan concentraciones subterapéuticas del antiviral. Como antiepilépticos alternativos se encuentran ácido valproico, lamotrigina y levetiracetam, que no son inductores o sustratos de CYP3A6.
Los inhibidores de la fosfodiesterasa tipo 5 (PDE5), como sildenafilo y tadalafilo, son sustratos del CYP3A y sus concentraciones pueden elevarse hasta valores tóxicos cuando se combinan con telaprevir. Estos fármacos están contraindicados con telaprevir cuando se administran a dosis altas para el tratamiento de la hipertensión pulmonar. Sin embargo, el tadalafilo puede utilizarse en la disfunción eréctil, a dosis más bajas y/o con dosificación menos frecuente6.
El inhibidor de la bomba de protones esomeprazol no influye en la exposición a telaprevir6.
En la tabla 1 se muestra un resumen de las interacciones de telaprevir con fármacos diferentes a los antirretrovirales basadas en la información disponible en la ficha técnica del producto25.
Resumen de las interacciones del telaprevir con fármacos diferentes a los antirretrovirales, basada en la información disponible.
| Efecto en la concentración de telaprevir o de la medicación concomitante | Posible mecanismo | Comentario | |
| Anticoagulantes | |||
| Warfarina | ↑ o ↓ warfarina | Modulación de enzimas metabólicas | Monitorizar el INR |
| Dabigatrán | ↑ dabigatrán | Efecto en el transporte mediado por P-gp en el intestino | Se recomienda precaución y un seguimiento analítico y clínico |
| ↔ telaprevir | |||
| Antimicrobianos | |||
| Claritromicina | ↑ telaprevir | Inhibición del CYP3A | Precaución cuando se administre un macrólido con telaprevir. Se ha observado prolongación del intervalo QT y torsade de pointes con claritromicina y eritromicina. Se ha observado prolongación del intervalo QT con telitromicina |
| Eritromicina | ↑ antibacterianos | ||
| Telitromicina | |||
| Troleandomicina | |||
| Rifabutina | ↓ telaprevir | Inducción del CYP3A por acción de rifabutina, inhibición del CYP3A por acción de telaprevir | Telaprevir puede ser menos eficaz debido a concentraciones disminuidas. No se recomienda el uso concomitante de rifabutina y telaprevir |
| ↑ rifabutina | |||
| Rifampicina | 4- telaprevir | Inducción del CYP3A por acción de rifampicina, inhibición del CYP3A por acción de telaprevir | La administración conjunta de rifampicina con telaprevir está contraindicada |
| AUC 0,08 (0,07–0,11) | |||
| Cmax 0,14 (0,11–0,18) | |||
| ↑ rifampicina | |||
| Ketoconazol | ↑ ketoconazol (200 mg) | Inhibición del CYP3A. Debido a las distintas enzimas que participan en el metabolismo del voriconazol, es difícil predecir la interacción con telaprevir | Cuando sea necesaria su administración conjunta, no se recomienda la administración de dosis altas de itraconazol (> 200mg/día) ni de ketoconazol (> 200mg/día). Se recomienda precaución y un seguimiento clínico del paciente con itraconazol, posaconazol y voriconazol. Se ha descrito prolongación del intervalo QT y torsade de pointes con voriconazol y posaconazol. Se ha descrito prolongación del intervalo QT con ketoconazol. No se debe administrar voriconazol a pacientes que estén recibiendo telaprevir, salvo que la relación beneficio-riesgo justifique su empleo |
| Itraconazol | AUC 2,25 (1,93–2,61) | ||
| Posaconazol | Cmax 1,75 (1,51–2,03) | ||
| Voriconazol | ↑ ketoconazol (400mg) | ||
| AUC 1,46 (1,35–1,58) | |||
| Cmax 1,23 (1,14–1,33) | |||
| ↑ telaprevir (con ketoconazol 400mg) | |||
| AUC 1,62 (1,45–1,81) | |||
| Cmax 1,24 (1,10–1,41) | |||
| ↑ itraconazol | |||
| ↑ posaconazol | |||
| ↑ o ↓ voriconazol | |||
| Aparato cardiovascular | |||
| Amlodipino | ↑ amlodipino | Inhibición del CYP3A | Se debe usar con precaución y considerar una reducción de la dosis de amlodipino. Se recomienda supervisión clínica |
| AUC 2,79 (2,58–3,01) | |||
| Cmax 1,27 (1,21–1,33) | |||
| Diltiazem | ↑ antagonistas de los canales de calcio | Inhibición del CYP3A y/o efecto en el transporte mediado por P-gp en el intestino | Se recomienda precaución y supervisión clínica del paciente |
| Felodipino | |||
| Nicardipino | |||
| Nifedipino | |||
| Nisoldipino | |||
| Verapamilo | |||
| Digoxina | ↑ digoxina | Efecto en el transporte mediado por P-gp en el intestino | Inicialmente se debe prescribir la dosis más baja de digoxina. Ajustar la dosis en función de las concentraciones plasmáticas de digoxina |
| AUC 1,85 (1,70–2,00) | |||
| Cmax 1,50 (1,36–1,65) | |||
| Lidocaína (i.v.) | ↑ lidocaína | Inhibición del CYP3A | Precaución cuando se administre lidocaína i.v. para el tratamiento de la arritmia ventricular aguda |
| Bosentán | ↑ bosentán | Inducción de CYP3A por acción del bosentán, inhibición del CYP3A por acción de telaprevir | Se recomienda precaución y supervisión clínica |
| ↓ telaprevir | |||
| Aparato digestivo | |||
| Esomeprazol | ↔ telaprevir | Se pueden usar inhibidores de la bomba de protones sin necesidad de modificar la dosis | |
| AUC 0,98 (0,91–1,05) | |||
| Cmax 0,95 (0,86–1,06) | |||
| Domperidona | ↑ domperidona | Inhibición del CYP3A | Se debe evitar la administración conjunta de domperidona con telaprevir |
| Aparato respiratorio y alergia | |||
| Salmeterol | ↑ salmeterol | Inhibición del CYP3A | No se recomienda la administración conjunta de salmeterol y telaprevir. La combinación puede aumentar el riesgo de acontecimientos adversos cardiovasculares asociados con salmeterol, incluyendo prolongación del intervalo QT, palpitaciones y taquicardia sinusal |
| Fluticasona | ↑ fluticasona | Inhibición del CYP3A | No se recomienda la administración concomitante de fluticasona o budesonida con telaprevir, a menos que el posible efecto beneficioso para el paciente sea mayor que el riesgo de efectos adversos de los corticoides sistémicos |
| Budesonida inhalador/nasal | ↑ budesonida | ||
| Inmunosupresores incluyendo corticoides sistémicos | |||
| Prednisona | ↑ prednisona | Sustratos del CYP3A | Puede verse síndrome de Cushing iatrogénico cuando se combinan estos corticoides con telaprevir |
| Metilprednisolona | |||
| ↑ metilprednisolona | |||
| Dexametasona | ↑ dexametasona | Sustratos del CYP3A | Puede verse síndrome de Cushing iatrogénico cuando se combina dexametasona con telaprevir. El uso concomitante puede dar lugar a una pérdida del efecto terapéutico de telaprevir. Por lo tanto se recomienda usar con precaución esta combinación o considerar otras alternativas |
| ↓ telaprevir | Inducción del CYP3A | ||
| Ciclosporina | ↑ ciclosporina | Inhibición del CYP3A, inhibición del transporte de proteínas | Se necesitarán reducciones considerables de las dosis de inmunodepresores y prolongación de sus intervalos posológicos. Se recomienda una supervisión estrecha de los valores plasmáticos de los inmunodepresores, de la función renal y de los efectos adversos relativos a los inmunosupresores cuando se administren conjuntamente con telaprevir |
| AUC 4,64 (3,90–5,51) | |||
| Cmax 1,32 (1,08–1,60) | |||
| ↑ telaprevir | |||
| Tacrolimus | ↑ tacrolimus | Inhibición del CYP3A, inhibición del transporte de proteínas | Se necesitarán reducciones considerables de las dosis de inmunodepresores y prolongación de sus intervalos posológicos. Se recomienda una supervisión estrecha de los valores plasmáticos de los inmunodepresores, de la función renal y de los efectos adversos relativos a los inmunosupresores cuando se administren conjuntamente con telaprevir. Tacrolimus puede prolongar el intervalo QT |
| AUC 70,3 (52,9–93,4)* | |||
| Cmax 9,35 (6,73–13,0)* | |||
| ↑ telaprevir | |||
| Sirolimus | ↑ sirolimus | Inhibición del CYP3A, inhibición del transporte de proteínas | Se necesitarán reducciones considerables de las dosis de inmunodepresores y prolongación de sus intervalos posológicos. Se recomienda una supervisión estrecha de los valores plasmáticos de los inmunodepresores, de la función renal y de los efectos adversos relativos a los inmunosupresores cuando se administren conjuntamente con telaprevir |
| ↑ telaprevir | |||
| Endocrinología/hormonas/ metabolismo | |||
| Atorvastatina | ↑ atorvastatina | Inhibición del CYP3A | La administración conjunta de atorvastatina y telaprevir está contraindicada |
| AUC 7,88 (6,82–9,07) | |||
| Cmax 10,6 (8,74–12,85) | |||
| Colchicina | ↑ colchicina | Inhibición del CYP3A | Los pacientes con insuficiencia renal o hepática no deben de tomar colchicina con telaprevir debido al riesgo de toxicidad de colchicina. En los pacientes con función renal y hepática normales, se recomienda la interrupción del tratamiento con colchicina, o bien seguir un curso limitado de tratamiento con colchicina a dosis reducidas |
| Etinilestradiol | ↓ etinilestradiol | Mecanismo desconocido | Cuando se administren anticonceptivos hormonales concomitantemente con telaprevir se deben utilizar otros métodos anticonceptivos adicionales no hormonales. Se debe supervisar clínicamente a las pacientes que usen estrógenos como tratamiento hormonal sustitutivo para detectar signos de deficiencia estrogénica |
| Noretindrona | AUC 0,72 (0,69–0,75) | ||
| Cmax 0,74 (0,68–0,80) | |||
| Cmin 0,67 (0,63–0,71) | |||
| ↔ noretindrona | |||
| AUC 0,89 (0,86–0,93) | |||
| Cmax 0,85 (0,81–0,89) | |||
| Cmin 0,94 (0,87–1,00) | |||
| Inhibidores de la fosfodiesterasa 5 (PDE-5) | |||
| Sildenafilo | ↑ inhibidores de PDE-5 | Inhibición del CYP3A | No se recomienda la administración conjunta de sildenafilo o vardenafilo y telaprevir. Puede usarse tadalafilo para el tratamiento de la disfunción eréctil con precaución en una dosis única no excediendo la dosis de 10 mg cada 72 h y con una mayor vigilancia de los acontecimientos adversos asociados al tadalafilo. La administración conjunta de sildenafilo o tadalafilo y telaprevir en el tratamiento de la hipertensión arterial pulmonar está contraindicada |
| Tadalafilo | |||
| Vardenafilo | |||
| Sistema nervioso central y analgésicos narcóticos | |||
| Alprazolam | ↑ alprazolam | Relevancia clínica desconocida | |
| AUC 1,35 (1,23–1,49) | |||
| Cmax 0,97 (0,92–1,03) | |||
| Midazolam i.v. | ↑ midazolam | Inhibición del CYP3A | La administración conjunta se debe hacer en un contexto que asegure la supervisión clínica y un manejo médico adecuado en caso de depresión respiratoria y/o sedación prolongada. Se debe considerar la reducción de la dosis de midazolam administrada por vía parenteral, sobre todo si se administra más de una única dosis de midazolam |
| AUC 3,40 (3,04–3,79) | |||
| Cmax 1,02 (0,80–1,31) | |||
| Midazolam oral | ↑ midazolam | Inhibición del CYP3A | La administración conjunta de midazolam por vía oral y telaprevir está contraindicada |
| AUC 8,96 (7,75–10,35) | |||
| Cmax 2,86 (2,52–3,25) | |||
| Triazolam oral | ↑ triazolam | Inhibición del CYP3A | La administración conjunta de triazolam por vía oral y telaprevir está contraindicada |
| Zolpidem | ↓ zolpidem | Mecanismo desconocido | Relevancia clínica desconocida. Es posible que haya que aumentar la dosis de zolpidem para mantener la eficacia |
| AUC 0,53 (0,45–0,64) | |||
| Cmax 0,58 (0,52–0,66) | |||
| Escitalopram | ↔ telaprevir | Mecanismo desconocido | Relevancia clínica desconocida. Es posible que haya que aumentar la dosis cuando se combina con telaprevir |
| ↓ escitalopram | |||
| AUC 0,65 (0,60–0,70) | |||
| Cmax 0,70 (0,65–0,76) | |||
| Cmin 0,58 (0,52–0,64) | |||
| Trazodona | ↑ trazodona | Inhibición del CYP3A | La administración concomitante puede dar lugar a la aparición de náuseas, mareos, hipotensión y síncope. Se recomienda precaución cuando se administre trazodona conjuntamente con telaprevir, y debe considerarse una dosis menor de trazodona |
| Carbamazepina | ↓ telaprevir | Inducción del CYP3A por acción de los antiepilépticos, e inhibición del CYP3A por acción de telaprevir | La administración conjunta con estos agentes está contraindicada |
| Fenobarbital | ↑ carbamazepina | ||
| Fenitoína | ↑ o ↓ fenitoína | ||
| ↑ o ↓ fenobarbital | |||
| Metadona | ↓ R-metadona | Desplazamiento de la metadona de las proteínas plasmáticas | No se requiere ajustar la dosis de metadona cuando se inicia la administración conjunta de telaprevir. No obstante se recomienda supervisión clínica porque en algunos pacientes puede que haya que ajustar la dosis de metadona durante el tratamiento de mantenimiento. Se han notificado prolongación del intervalo QT y torsade de pointes con metadona. Los ECG deben ser evaluados en la visita basal y regularmente durante el tratamiento |
| AUC 0,71 (0,66–0,76) | |||
| Cmax 0,71 (0,66–0,76) | |||
| Cmin 0,69 (0,64–0,75) | |||
| Ningún efecto en las concentraciones de R-metadona libre | |||
| Buprenorfina | ↔ buprenorfina | No es necesario ajustar la dosis de buprenorfina cuando se administre conjuntamente con telaprevir | |
| AUC 0,96 (0,84–1,10) | |||
| Cmax 0,80 (0,69–0,93) | |||
| Cmin 1,06 (0,87–1,30) | |||
AUC: área bajo la curva; Cmax: concentración máxima; Cmin: concentración mínima; ECG: electrocardiograma; INR: cociente internacional normalizado; i.v.: intravenoso; P-gp: glucoproteína P.
Ritonavir es un potente inhibidor de CYP3A4 y se utiliza como potenciador de los IP del VIH.
En modelos in vitro y en animales, ritonavir inhibe el metabolismo de telaprevir28. En humanos, ritonavir incrementa la exposición a telaprevir administrados en dosis únicas, pero este efecto no se mantiene en el tiempo.
La administración de dosis única de telaprevir 750mg con 100mg de ritonavir en voluntarios sanos da lugar a un incremento medio del 100% en su AUC, Cmax y Cmin respecto a la administración sin ritonavir. Por el contrario, la administración de telaprevir 750mg/12h con ritonavir 100mg/12h disminuyó la exposición a telaprevir (AUC) entre un 15 y un 32% respecto a la obtenida con telaprevir 750mg/8h29.
En consecuencia, el uso concomitante de telaprevir con ritonavir no tiene el efecto potenciador esperado, y no permite reducir los intervalos de administración o las dosis de telaprevir en el tratamiento de la infección por VHC. La explicación de este efecto, diferente al observado con ritonavir y los IP del VIH, no es clara y tampoco predice lo que pueda ocurrir con otros fármacos utilizados específicamente por su capacidad inhibitoria de CYP3A4. Se precisan nuevos estudios en este sentido.
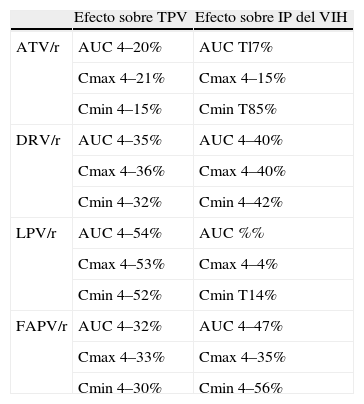
En 2011 investigadores de Tibotec y Vertex comunicaron conjuntamente los resultados de varios estudios en voluntarios sanos, con un diseño cruzado que permitía evaluar el efecto de atazanavir, darunavir, fosamprenavir o lopinavir, todos potenciados con ritonavir, sobre el metabolismo de telaprevir y de este sobre el metabolismo de los IP del VIH, una vez alcanzado el estado de equilibrio30 (tabla 2).
Interacciones farmacocinéticas entre telaprevir (TPV) e inhibidores de la proteasa (IP) del virus de la inmunodeficiencia humana (VIH).
| Efecto sobre TPV | Efecto sobre IP del VIH | |
| ATV/r | AUC 4–20% | AUC Tl7% |
| Cmax 4–21% | Cmax 4–15% | |
| Cmin 4–15% | Cmin T85% | |
| DRV/r | AUC 4–35% | AUC 4–40% |
| Cmax 4–36% | Cmax 4–40% | |
| Cmin 4–32% | Cmin 4–42% | |
| LPV/r | AUC 4–54% | AUC %% |
| Cmax 4–53% | Cmax 4–4% | |
| Cmin 4–52% | Cmin T14% | |
| FAPV/r | AUC 4–32% | AUC 4–47% |
| Cmax 4–33% | Cmax 4–35% | |
| Cmin 4–30% | Cmin 4–56% |
ATV: atazanavir; AUC: área bajo la curva; Cmax: concentración máxima; Cmin: concentración mínima; DRV: darunavir; FAPV: fosamprenavir; LOP: lopinavir; /r: potenciado con ritonavir.
La administración conjunta de atazanavir/r (300/100mg/día) con telaprevir (750mg/8h) disminuye el AUC, la Cmax y la Cmin de telaprevir discretamente30 (tabla 2). La disminución de la exposición a telaprevir en un 20% se cree que no compromete la eficacia sobre la inhibición de la replicación del VHC. Por otro lado, dicha asociación aumenta muy ligeramente el AUC de atazanavir, sin aumentar la Cmax, por lo que se considera que no hay riesgo de mayor toxicidad. Por este motivo, en el diseño estudio 110 (fase II para evaluar la eficacia de Peg-IFN, ribavirina y telaprevir en pacientes coinfectados por VIH y VHC) se incluyó un brazo de pacientes tratados con tenofovir, emtricitabina y atazanavir/r. En el subestudio farmacocinético, 14 pacientes recibieron atazanavir/r con IFN, ribavirina y telaprevir, mientras que 7 pacientes lo hicieron con IFN y ribavirina. Las concentraciones y el AUC de atazanavir no fueron significativamente diferentes entre los grupos. Cuando se comparó la farmacocinética de telaprevir entre 13 pacientes con atazanavir/r y los 7 pacientes sin tratamiento antirretroviral, esta fue similar31.
DarunavirLa administración conjunta de darunavir/r (600/100mg/12h) y telaprevir (750mg/8h) en voluntarios sanos disminuye significativamente el AUC, la Cmax y la Cmin, tanto de telaprevir como de darunavir, indicando dicha interacción que es posible una menor actividad anti-VIH y anti-VHC de la combinación30 (tabla 2). Sin embargo hay que señalar que estos estudios son en voluntarios sanos, y se ha medido exclusivamente la concentración total de telaprevir y de darunavir. Ambos fármacos compiten por la unión a proteínas, especialmente la alfa-1 glucoproteína. Es posible que la interacción en las concentraciones de la fracción libre de los fármacos sea menor que la observada en los estudios en voluntarios sanos. Por ello se está realizando un subestudio específico sobre interacción de darunavir/r y telaprevir en 20 pacientes coinfectados por VIH y VHC (subestudio PK del estudio 3008), que aclare el significado farmacocinético y la relevancia clínica de dicha interacción. Por otro lado, al menos en pacientes que inician tratamiento anti-VHC estando controlada la replicación viral del VIH, la actividad anti-VIH de Peg-IFN podría ser suficiente para compensar la disminución de actividad de los IP debido a la disminución de su exposición inducida por telaprevir.
LopinavirLa administración de lopinavir/r (400/100mg/12h) y telaprevir (750mg/8h) en voluntarios sanos reduce significativamente (más del 50%) las concentraciones de telaprevir, mientras que no altera los parámetros farmacocinéticos de lopinavir, lo que sugiere un riesgo de pérdida de eficacia en la erradicación de la infección por VHC30 (tabla 2). Al igual que con darunavir, son necesarios otros estudios para aclarar el mecanismo de esta interacción y su impacto clínico.
FosamprenavirPor último, la administración conjunta de fosamprenavir/r (700/100mg/12h) y telaprevir (750mg/8h) en voluntarios sanos reduce significativamente las concentraciones totales de fosamprenavir y de telaprevir30 (tabla 2). Con los datos actuales, no se puede recomendar el uso conjunto de telaprevir y fosamprenavir.
Inhibidores análogos de nucleós(t)idos de la transcriptasa inversa del virus de la inmunodeficiencia humana
Los inhibidores análogos de nucleós(t)idos de la transcriptasa inversa (ITIAN) forman parte de la mayoría de las combinaciones de tratamiento antirretroviral. A priori, la interacción ente los ITIAN y telaprevir, por su diferente metabolismo, no debería ser clínicamente significativa. Por todo ello, la AEMPS, en su documento sobre criterios y recomendaciones para el tratamiento con boceprevir o telaprevir en pacientes infectados por el VIH7, y el panel de expertos de Gesida, en sus recomendaciones sobre tratamiento antirretroviral32, aceptan la combinación de telaprevir con los ITIAN de uso más habitual (lamivudina, emtricitabina, abacavir y tenofovir), aun cuando no hay en todos los casos estudios específicos sobre interacciones farmacocinéticas.
Respecto a telaprevir, se ha estudiado la interacción con tenofovir, ya que tenofovir es sustrato de P-gp y su metabolismo puede ser alterado por la vía de la alteración de su transporte celular y excreción tubular real.
Cuando se administró a 18 voluntarios sanos tenofovir 300mg/ día, con y sin telaprevir 750mg/12h, en 3 ciclos separados de 7 días de tratamiento, durante el tratamiento combinado no se observó ninguna variación significativa en los parámetros farmacocinéticos de telaprevir respecto a la exposición aislada a este fármaco. Sin embargo, sí se observó un incremento del 30% en la Cmax y el AUC y del 40% en la Cmin de tenofovir durante la administración combinada33. En otro estudio se valoró el impacto de telaprevir 1.125mg/8h (16 voluntarios sanos) o 1.500mg/12h (15 voluntarios sanos) sobre las concentraciones de tenofovir (en este caso administrado con efavirenz) comparando con curvas farmacocinéticas de referencia en 18 voluntarios sanos. La exposición a tenofovir no varió significativamente, un +10% en el AUC y un 22–24% en la Cmax30. En todos los casos, el tratamiento fue bien tolerado. Por tanto, la asociación de tenofovir y telaprevir se considera que no tiene interacciones significativas, y se puede utilizar de una forma segura a las dosis habituales y a las dosis de telaprevir recomendadas cuando se utiliza con efavirenz.
Inhibidores de la transcriptasa inversa no análogos de nucleósidos
EfavirenzEs metabolizado por CYP3A4 y tiene un importante efecto inductor de esta vía metabólica; por tanto, era predecible la interacción con telaprevir en ambos sentidos. En un primer estudio en voluntarios sanos, expuestos a efavirenz 600mg/día, telaprevir 750mg/8h o ambos, se observó una disminución significativa del AUC y especialmente de la Cmin (47%) de telaprevir tras la administración conjunta, lo que podía dar lugar a una disminución de la actividad del inhibidor del VHC. Por el contrario, no hubo una modificación significativa en los parámetros de efavirenz27.
Para intentar solventar la disminución de exposición a telaprevir por inducción de su metabolismo por efavirenz y como prueba para el diseño de estudios en fase II con telaprevir en coinfectados por VIH y VHC, se realizó el ensayo clínico anteriormente comentado, en voluntarios sanos, administrando tenofovir y efavirenz a dosis habituales con telaprevir 1.125mg/8h o 1.500mg/12h. Se confirmó el escaso impacto de telaprevir sobre los parámetros farmacocinéticos de efavirenz (tabla 3). De nuevo, los parámetros farmacocinéticos de telaprevir fueron inferiores a los obtenidos con telaprevir administrado de forma aislada a dosis de 750 mg/8 h, pero la disminución con la dosis de 1.125mg/8h se consideró no relevante (tabla 3). Por el contrario se consideró relevante una disminución del 48% en la Cmin de telaprevir con la dosis de 1.500mg/12h administrada con tenofovir y efavirenz. En razón de estos resultados, los estudios y la indicación de telaprevir en coinfectados tratados con efavirenz requiere aumentar en un 50% las dosis de telaprevir, utilizando 1.125mg de telaprevir cada 8h30.
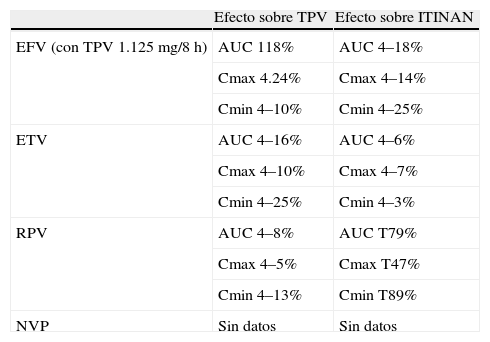
Interacciones farmacocinéticas entre telaprevir (TPV) e inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN) del virus de la inmunodeficiencia humana (VIH).
| Efecto sobre TPV | Efecto sobre ITINAN | |
| EFV (con TPV 1.125mg/8h) | AUC 118% | AUC 4–18% |
| Cmax 4.24% | Cmax 4–14% | |
| Cmin 4–10% | Cmin 4–25% | |
| ETV | AUC 4–16% | AUC 4–6% |
| Cmax 4–10% | Cmax 4–7% | |
| Cmin 4–25% | Cmin 4–3% | |
| RPV | AUC 4–8% | AUC T79% |
| Cmax 4–5% | Cmax T47% | |
| Cmin 4–13% | Cmin T89% | |
| NVP | Sin datos | Sin datos |
AUC: área bajo la curva; Cmax: concentración máxima; Cmin: concentración mínima; EFV: efavirenz; ETV: etravirina; NVP: nevirapina; RPV: rilpivirina.
Igual que con atazanavir, con efavirenz hay experiencia clínica preliminar de la interacción farmacocinética y farmacodinámica con telaprevir en pacientes coinfectados por VIH y VHC. En el estudio 110 (fase II para evaluar la eficacia de Peg-IFN, ribavirina y telaprevir en pacientes coinfectados por VIH y VHC) se incluyó un brazo de pacientes tratados con tenofovir, emtricitabina y efavirenz. En el subestudio farmacocinético, 15 pacientes recibieron efavirenz 1.125mg/8h con IFN, ribavirina y telaprevir, mientras que 7 pacientes recibieron efavirenz 750mg/8h con IFN y ribavirina sin telaprevir. La farmacocinética de efavirenz fue similar en ambos grupos. Cuando se comparó las concentraciones y el AUC de telaprevir entre pacientes con efavirenz y los 7 pacientes sin tratamiento antirretroviral, estas no fueron significativamente diferentes31.
RilpivirinaSe metaboliza preferentemente por CYP3A4, pero no se considera inductor o inhibidor de esta vía metabólica. Por ello se realizó un estudio en 16 voluntarios sanos en 2 períodos, en uno se administró solo rilpivirina 25mg/día durante 11 días y, con un período intermedio de lavado de 14 días, en otro período se administró telaprevir 750mg/8h durante 7 días (para asegurar el efecto inhibidor sobre CYPA34) y a partir del 8.o día se añadió rilpivirina 25mg/día durante otros 11 días. Se comparó la farmacocinética de rilpivirina con y sin telaprevir y la farmacocinética de telaprevir y rilpivirina con los datos de referencia de telaprevir en voluntarios sanos. El AUC, la Cmax y la Cmin de telaprevir combinado con rilpivirina fueron muy similares a las de referencia; sin embargo, las de rilpivirina se incrementaron moderadamente, en valores menores a 2 veces la concentración cuando se administra rilpivirina únicamente34 (tabla 3).
Se ha observado prolongación de QTc con cualquier dosis de rilpivirina, aunque una prolongación significativa, con riesgo de torsade de pointes, solo se produce con dosis ≥ 75mg al día, muy superiores a las utilizadas en la práctica clínica35. Kakuda et al consideran que el incremento de exposición a rilpivirina al asociarse a telaprevir no es clínicamente significativo y sin relevancia desde el punto de vista de riesgo de prolongación del QTc, dado el margen de seguridad entre las concentraciones de rilpivirina alcanzadas y las concentraciones tóxicas34. En consecuencia, al igual que los paneles de expertos20,21, no recomiendan ajustar las dosis cuando se administra rilpivirina y telaprevir. Sin embargo hay que tener en cuenta que muchos de los estudios farmacocinéticos están realizados con un número pequeño de casos, voluntarios sanos o pacientes muy seleccionados, donde el significado clínico de la prolongación del QTc es difícil de establecer. Por tanto, el uso de rilpivirina en situaciones que aumentan su exposición, como en el caso de la administración con telaprevir, debe realizarse con precaución, tanto más cuando se administren conjuntamente otros fármacos que también incrementan QTc. En este sentido, por no ser un escenario infrecuente, habrá que tener una precaución especial en los pacientes coinfectados por VIH y VHC que reciban tratamiento con metadona o claritromicina.
EtravirinaSe metaboliza por CYP3A4, pero también por otros citocromos y a su vez puede afectar el metabolismo de otros fármacos vía citocromos (p. ej., induciendo la actividad de CYP3A4) o vía P-gp (inhibiendo su actividad).
Se ha estudiado la interacción entre telaprevir y etravirina en un estudio en 2 etapas similar al descrito para rilpivirina. Las dosis de etravirina empleadas con o sin telaprevir fueron 200mg/12h. Los parámetros farmacocinéticos de etravirina con telaprevir fueron absolutamente superponibles a los de etravirina sin telaprevir. El AUC, la Cmax y la Cmin de telaprevir administrado con etravirina fueron inferiores a los de referencia de telaprevir en voluntarios sanos en una proporción que los expertos consideran no relevante desde el punto de vista clínico y, por tanto, recomiendan la administración conjunta sin modificar las dosis habituales34 (tabla 3).
NevirapinaNo se dispone de datos de su interacción con telaprevir. De acuerdo con su ficha técnica, el metabolismo oxidativo de la nevirapina es mediado esencialmente por isoenzimas del citocromo P450 de la familia CYP3A, si bien es posible que otras isoenzimas jueguen un papel secundario. La nevirapina es un inductor del CYP3A y potencialmente del CYP2B6, produciendo una inducción máxima al cabo de 2–4 semanas de iniciar la terapia a dosis múltiples. Por tanto, su interacción con telaprevir, al igual que con efavirenz, es muy posible y en ambos sentidos. En consecuencia, su administración conjunta debe evitarse mientras no se disponga de estudios que orienten sobre su interacción.
Inhibidores de la integrasaRaltegravirSu metabolismo principal es por la vía de la glucuronoconjugación, pero también es sustrato de la P-gp. No es inductor ni inhibidor de vías metabólicas y es un fármaco con poco potencial de inducir interacción en el metabolismo de otros fármacos. La interacción entre raltegravir y telaprevir se estudió en 20 voluntarios sanos. Los voluntarios fueron expuestos en 2 períodos separados por un período de lavado de 14 días, a una pauta de telaprevir 750 mg/8h durante 6 días, con estudio farmacocinético tras la dosis de la mañana del 7.o día, y en otro período a una pauta de raltegravir 400mg/12h durante 11 días combinada con telaprevir 750mg/8h entre los días 5 y 11. El día 4 se obtenía una farmacocinética de 12h de raltegravir y el día 11 una farmacocinética de 12h de raltegravir y de 8h de telaprevir36.
Como era previsible, los parámetros farmacocinéticos de telaprevir con raltegravir no se modificaron significativamente (AUC +7%, Cmax +7% y Cmin +14%). Sí se observó un incremento en los parámetros de raltegravir y de su metabolito (raltegravir glucuronidado). Las modificaciones en el metabolismo de raltegravir inducidas por telaprevir fueron poco significativas en el caso del AUC y la Cmax (+31 y +26% para raltegravir, y +37 y +25% para su metabolito) indicando bajo riesgo de toxicidad, especialmente siendo raltegravir un fármaco con amplio margen de seguridad. En el caso de la Cmin de raltegravir con telaprevir los incrementos fueron del 78% (para raltegravir) y del 96% (para su metabolito) indicando, por un lado, que no hay riesgo de pérdida de actividad antirretroviral y, por otro, que la interacción se produce probablemente por la inhibición de telaprevir del metabolismo de raltegravir vía P-gp.
Por tanto, los autores y expertos7,32,36 consideran que el efecto de telaprevir sobre raltegravir no es clínicamente relevante y se pueden administrar conjuntamente a las dosis habituales.
DolutegravirEs metabolizado preferentemente por glucuronoconjugación (enzima UGT1A1) con menor participación de CYP3A4 (10–15%). In vitro, no es inductor ni inhibidor de sistemas metabólicos (citocromos, UGT) ni de los principales de fármacos. En plasma presenta una amplia unión a proteínas (97%). Su interacción con telaprevir, aunque poco probable, no se ha publicado aún. En el momento actual se está desarrollando el estudio ING115697 (Clinical- Trials.gov Identifier: NCT01563328), promovido por ViiV Healthcare, que incluye 2 grupos de 12 voluntarios sanos para valorar la interacción entre dolutegravir 50mg/día y telaprevir 750mg/8h o boceprevir 800mg/8h.
Elvitegravir/cobicistatNo se dispone de datos de su posible interacción.
Otros antirretroviralesMaravirocEs sustrato de CYP3A4 y, al igual que ocurre con los IP del VIH, es presumible su interacción con telaprevir. Son necesarios estudios farmacocinéticos y farmacodinámicos para orientar su administración conjunta. En estos momentos se ha completado un estudio promovido por ViiV Healthcare sobre la interacción, en 14 voluntarios sanos, de maraviroc con telaprevir o boceprevir, estando pendiente la comunicación de sus resultados (ClinicalTrials.gov Identifier: NCT01597895). De momento, el uso concomitante con telaprevir está permitido7.
EnfuvirtideEs un inhibidor de la entrada del VIH de naturaleza proteica que no se metaboliza en el hígado y que no tiene ningún efecto sobre las vías metabólicas habituales de los fármacos, y en concreto de telaprevir. Sin embargo, por ser su uso muy restringido, no hay estudios sobre interacciones y el panel de expertos de la Agencia Española del Medicamento y Productos Sanitarios no recomienda su uso concomitante7.
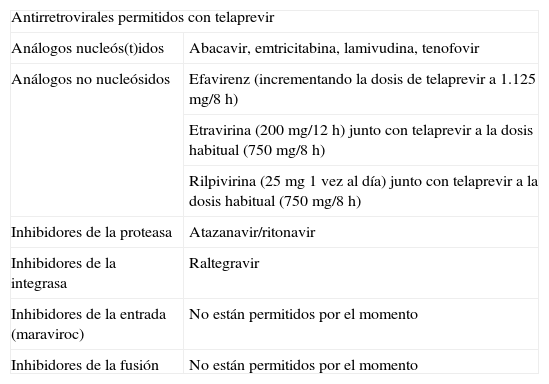
En conclusión, las interacciones farmacocinéticas de telaprevir con los antirretrovirales han sido ampliamente estudiadas en estudios en fase I en voluntarios sanos. Ello nos ha permitido disponer de datos que orientan la administración conjunta, de forma que prácticamente cualquier paciente puede recibir una pauta de antirretroviral segura durante las 12 semanas de tratamiento con telaprevir y sin riesgo de perder el control de la replicación del VIH7 (tabla 4).
Antirretrovirales permitidos con telaprevir.
| Antirretrovirales permitidos con telaprevir | |
| Análogos nucleós(t)idos | Abacavir, emtricitabina, lamivudina, tenofovir |
| Análogos no nucleósidos | Efavirenz (incrementando la dosis de telaprevir a 1.125mg/8h) |
| Etravirina (200mg/12h) junto con telaprevir a la dosis habitual (750mg/8h) | |
| Rilpivirina (25mg 1 vez al día) junto con telaprevir a la dosis habitual (750mg/8h) | |
| Inhibidores de la proteasa | Atazanavir/ritonavir |
| Inhibidores de la integrasa | Raltegravir |
| Inhibidores de la entrada (maraviroc) | No están permitidos por el momento |
| Inhibidores de la fusión | No están permitidos por el momento |
Aun así, se necesitan más estudios que, por un lado, incluyan nuevos fármacos, como los nuevos inhibidores de la integrasa y maraviroc y, por otro, investiguen las interacciones en el escenario del paciente coinfectado para valorar no solo el impacto farmacocinético, sino también el farmacodinámico.
En concreto, los estudios farmacocinéticos en voluntarios sanos de telaprevir e IP del VIH solo avalan su utilización conjunta con atazanavir/r. Teniendo en cuenta que la mayoría de los pacientes coinfectados por el VIH y el VHC adquirieron ambas infecciones hace muchos años, que muchos de ellos han tenido amplia exposición a antirretrovirales precisando en estos momentos pautas basadas en IP potenciados y que una gran parte presenta una hepatopatía moderadamente evolucionada o avanzada, es prioritario disponer de datos que aclaren cómo utilizar de la manera más eficaz y segura la combinación de telaprevir e IP del VIH.
Conflicto de interesesEl Dr. Juan Berenguer ha recibido fondos para investigación de BMS, MSD y ViiV Healthcare. También ha recibido honorarios por charlas y asesorías de Abbvie, Boehringer Ingelheim, BMS, GILEAD, Janssen Cilag, MSD y ViiV Healthcare.
El Dr. Juan González ha recibido honorarios por charlas y asesorías de Abbvie, BMS, GILEAD, Janssen Cilag, MSD y ViiV Healthcare.