En lo relativo al uso de telaprevir en pacientes infectados por el virus de la inmunodeficiencia humana (VIH) y el genotipo 1 del virus de la hepatitis C (VHC), se dispone de datos provenientes de un ensayo clínico en fase IIb en sujetos previamente no tratados frente al VHC, el estudio 110, y datos preliminares de un estudio de práctica clínica real en pacientes con fracaso a tratamientos previos frente al VHC, el estudio ARNSHC26 (TelapreVIH). Adicionalmente, están también en marcha ensayos clínicos en fase III en pacientes coinfectados, el C3008 y el 115, ambos tanto en pacientes naïve como previamente tratados. En el estudio 110, las tasas de respuesta viral sostenida (RVS) de los pacientes tratados con interferón pegilado (Peg-IFN) más ribavirina (RBV) y telaprevir fueron del 74%. Esta tasa de RVS es superponible a las comunicadas para pacientes monoinfectados por genotipo 1 del VHC, no pretratados, que recibieron Peg-IFN más RBV y telaprevir. Igualmente, los efectos adversos observados en este ensayo no difirieron de los conocidos en monoinfectados por genotipo 1 del VHC. Telaprevir ha sido autorizado por la Comisión Europea mediante un procedimiento centralizado para su uso en pacientes monoinfectados por genotipo 1 del VHC. La ficha técnica de telaprevir incluye datos de pacientes coinfectados, tanto de eficacia y seguridad como de manejo conjunto del fármaco con diferentes antirretrovirales. La Agencia Española del Medicamento y Productos Sanitarios (AEMPS) ha elaborado unas recomendaciones que regulan y permiten el uso de telaprevir en pacientes coinfectados por VIH/genotipo 1 del VHC. Las restricciones de uso de telaprevir más relevantes, siguiendo la regulación de la AEMPS, son: a) se pueden tratar sujetos con fibrosis hepática F3–F4 por biopsia hepática o rigidez hepática ≥ 9,5kPa; b) en ausencia de fibrosis avanzada se puede usar para tratar manifestaciones extrahepáticas graves de la infección por VHC; c) en caso de cirrosis deben estar en estadio Child-Pugh A.
Related to the use of telaprevir in patients with HIV and genotype 1 hepatitis C virus, there is available data from a phase IIb clinical trial in patients not previously treated for HCV, study 110; and preliminary data from a real practice study in patients with previous failure to a HCV treatment, study ARNSHC26 (TelapreVIH). Additionally, there are two ongoing phase III studies in coinfected patients, C3008 and 115, both in naive and previously treated patients. In the 110 study, rates of sustained viral response (SVR) in patients receiving the triple combination of pegylated interferon + ribavirin + telaprevir was 74%. This SVR rate is similar to those reported in treatment-naïve patients with genotype 1 HCV monoinfection who received pegylated interferon + ribavirin + telaprevir. Similarly, the adverse effects in this trial did not differ from those found in patients with genotype 1 HCV monoinfection. Telaprevir has been approved for use in patients with HCV genotype 1 monoinfection by the European Commission through a centralized procedure. Telaprevir label includes data on coinfected patients, covering efficacy, security, and practical management with different antirretroviral drugs. The Spanish Agency for Medications and Health Care Products has established recommendations that regulate and allow the use of telaprevir in patients with HIV/HCV genotype 1 coinfection. The most important restrictions on the use of telaprevir established by the Agency are as follows: a) patients with stage F3-F4 liver fibrosis on liver biopsy or liver stiffness ≥ 9.5kPa can be treated; b) in the absence of advanced fibrosis, telaprevir can be used to treat severe extrahepatic manifestations of HCV infection; c) patients with cirrhosis must have Child-Pugh stage A.
El tratamiento de la hepatitis crónica por genotipo 1 del virus de la hepatitis C (VHC) ha experimentado un notable avance recientemente. La disponibilidad para uso clínico de los primeros fármacos de acción directa (FAD) frente al genotipo 1 del VHC, telaprevir y boceprevir, ha permitido construir nuevos regímenes de tratamiento que han superado ampliamente en eficacia a la combinación de interferón pegilado alfa (Peg-IFN) y ribavirina (RBV)1,2. Sin embargo, el uso de FAD supone algunos inconvenientes que pueden llegar a limitar su uso, especialmente entre pacientes coinfectados por el virus de la inmunodeficiencia humana (VIH)/genotipo 1 del VHC. En primer lugar, la información disponible acerca de la eficacia y seguridad de los FAD en pacientes infectados por el VIH es muy limitada3,4; en segundo lugar, las formulaciones disponibles en la actualidad incrementan el número de comprimidos que un paciente infectado por el VIH/genotipo 1 del VHC necesita tomar para tratar simultáneamente ambas infecciones, lo que puede dificultar la adherencia a ambos tratamientos3,4; en tercer lugar, los FAD disponibles en la actualidad tienen un alto potencial de interacciones con los fármacos antirretrovirales (ARV) que limitan las posibilidades de tratamiento simultáneo de ambas infecciones5; en cuarto lugar, el uso simultáneo de FAD y ARV podría suponer un incremento potencial de la incidencia de efectos adversos, y, por último, el alto coste de los FAD supone una importante limitación para su uso en momentos como el actual, de graves dificultades económicas.
Eficacia del tratamiento frente al genotipo 1 del virus de la hepatitis C en pacientes coinfectados por el virus de la inmunodeficiencia humana: escenario previoDiversos ensayos clínicos realizados en pacientes monoinfectados por VHC demostraron la superioridad del tratamiento con Peg-IFN 2a y 2b sobre IFN-alfa 2a y 2b, y que era posible obtener mayores tasas de respuesta al utilizar Peg-IFN en combinación con RBV (Peg-IFN/ RBV). En pacientes coinfectados, la combinación de Peg-IFN/RBV también ha obtenido mejores resultados que IFN-alfa 2a y 2b6–8. Al igual que en pacientes monoinfectados por VHC, en pacientes coinfectados no se han demostrado diferencias significativas en la eficacia entre ambas formas de Peg-IFN9. En pacientes monoinfectados por VHC, ajustar la RBV al peso del paciente (1.000 o 1.200mg/día, respectivamente, para pacientes con < 75 o ≥ 75kg) ha obtenido mayores tasas de respuesta viral sostenida (RVS) en comparación a dosis fijas de 800 mg/día. En los ensayos clínicos de pacientes coinfectados, la dosis de RBV utilizada no ha sido uniforme. En algunos ensayos clínicos ha sido de 800mg/día. En otros, en cambio, se han utilizado dosis mayores, como dosis fija de 1.000mg/día o dosis ajustada al peso (< 60kg: 800mg/día; 60–75kg: 1.000mg/día, y > 75kg: 1.200mg/día). En los ensayos clínicos en los que se ha usado RBV ajustada al peso se han obtenido tasas de RVS más altas9, por lo que es la estrategia que se recomendaba.
Eficacia del tratamiento del virus de la hepatitis C genotipo 1 en pacientes coinfectados por el virus de la inmunodeficiencia humana: evidencias actualesLa experiencia con telaprevir en pacientes coinfectados por VIH/ genotipo 1 del VHC proveniente de ensayos clínicos es limitada. Se han comunicado resultados, al menos parciales, de 2 ensayos clínicos de fase II. Diversos ensayos clínicos en fase III, diseñados para evaluar la eficacia y seguridad del tratamiento con telaprevir en pacientes coinfectados por VIH/genotipo 1 del VHC, se encuentran en situación de reclutamiento. El ensayo 110 fue un estudio aleatorizado, doble ciego y controlado con placebo, realizado en 2 partes3. En la parte A del estudio se aleatorizó a recibir Peg-IFN/RBV más telaprevir o placebo, en una proporción 1:1, a pacientes que no estaban con ARV. En la parte B del estudio se incluyeron pacientes que recibían tenofovir y emtricitabina o lamivudina junto con efavirenz (EFV) o atazanavir/ ritonavir (ATV/r). Estos sujetos fueron aleatorizados a iniciar Peg- IFN/RBV más telaprevir o placebo en una proporción 2:1. En cada grupo de tratamiento en la parte B, la mitad de los sujetos recibió tratamiento basado en EFV y la otra mitad en ATV/r.
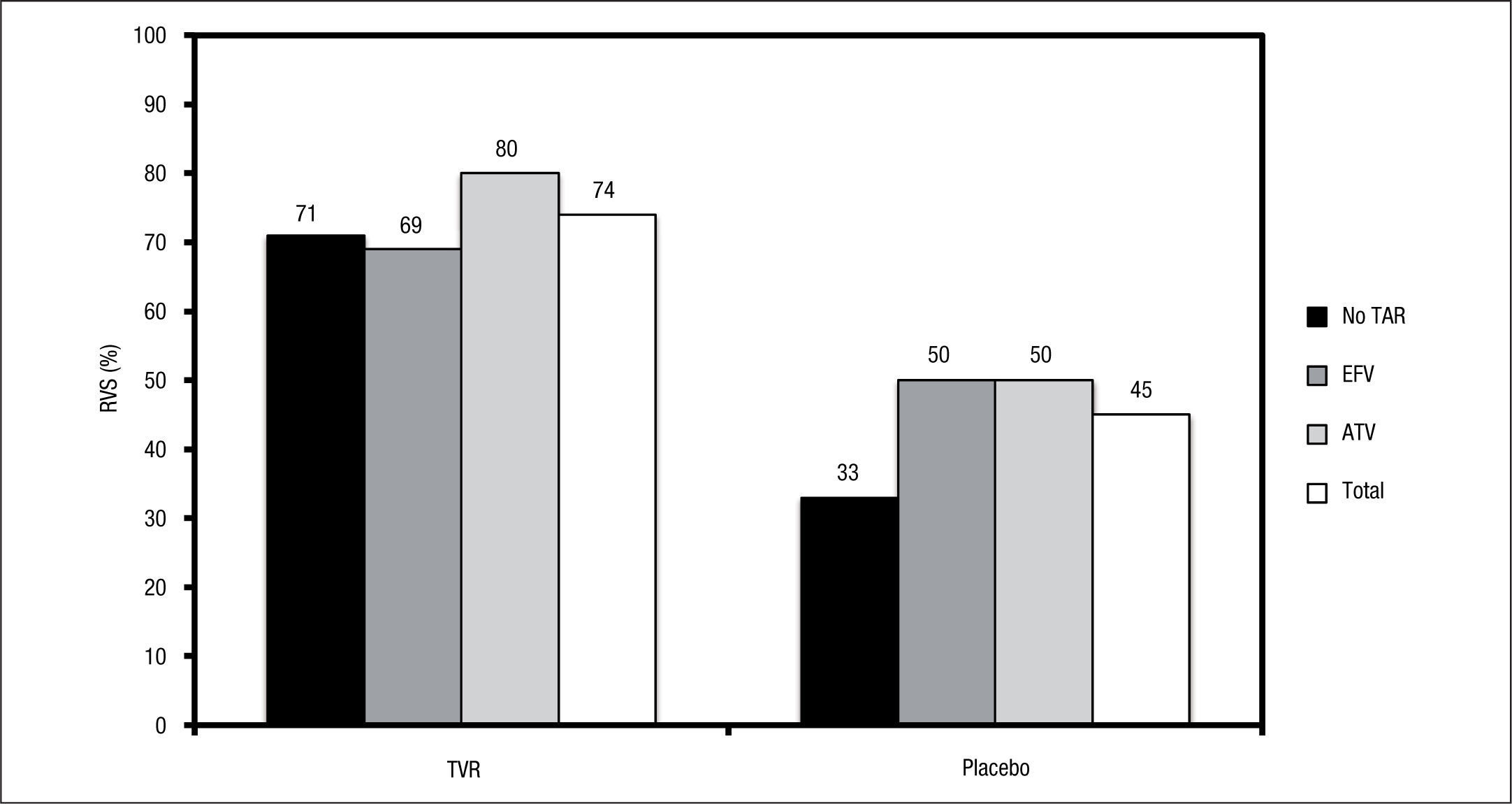
En el estudio se reclutaron 60 pacientes no previamente tratados frente al genotipo 1 del VHC, de los que 22 recibieron Peg-IFN/RBV más placebo y 38 Peg-IFN/RBV más telaprevir. Los pacientes que recibieron Peg-IFN/RBV más telaprevir presentaron unas tasas de RVS en la semana 24 postratamiento superiores a los que recibieron Peg- IFN/RBV más placebo (el 74 frente al 45%). La tasa de recidiva del grupo Peg-IFN/RBV más placebo fue de un 15%, frente a un 3% en el grupo Peg-IFN/RBV más telaprevir. En 3 pacientes que recibieron Peg-IFN/RBV más telaprevir se produjo un rebrote del ARN-VHC durante el tratamiento. Todos estaban con ARV, 2 con tratamiento combinando EFV y 1 ATV/r. En la figura 1 se muestran las tasas de RVS según el grupo de aleatorización y los ARV. Ningún paciente experimentó pérdida de control de la viremia VIH durante el seguimiento.
Se han presentado recientemente los resultados parciales del estudio ARNSHC26 (ensayo TelapreVIH), tras completar las primeras 16 semanas de tratamiento (incluyendo el total de las 12 semanas de tratamiento triple con telaprevir más Peg-IFN/RBV) en pacientes con fracaso a un tratamiento previo frente al VHC. La tasa de indetectabilidad del VHC en la semana 16 de tratamiento fue del 88% de forma global, no pareciendo afectarse por las distintas combinaciones de antirretrovirales permitidas en el estudio, superando siempre el 80% de indetectabilidad. Tampoco se observaron efectos adversos inusuales o previamente no descritos (Cotte L. Presentación oral en el CROI 2013).
Dosis y duración del tratamiento con telaprevir en pacientes coinfectados por el virus de la inmunodeficiencia humana/virus de la hepatitis CLa dosis de telaprevir utilizada en los ensayos clínicos de desarrollo del fármaco fue de 750mg (2 comprimidos) cada 8h, administrados con comida. Se recomienda que se incremente la dosis a 1.125mg (3 comprimidos) cada 8h cuando telaprevir se utiliza junto con EFV. No es necesario el ajuste de dosis de telaprevir cuando se usa con tenofovir, ATV/r, etravirina o raltegravir. Las interacciones farmacológicas de telaprevir con los ARV se revisan en el siguiente capítulo de la presente monografía.
La duración total del tratamiento es de 48 semanas. En pacientes coinfectados por el VIH/genotipo 1 del VHC se recomienda que telaprevir se administre en combinación con Peg-IFN 2a o 2b y RBV durante 12 semanas, seguidas de 36 semanas de tratamiento con Peg- IFN/RBV, hasta completar las 48 semanas totales de tratamiento. En pacientes monoinfectados por el genotipo 1 del VHC, naïve y sin cirrosis hepática que consiguen ARN-VHC indetectable en las semanas 4 y 12 del tratamiento, se ha comprobado que el tratamiento puede ser suspendido a las 24 semanas sin merma de su eficacia10. Algún dato anecdótico sugiere que en pacientes coinfectados por el VIH/ VHC, en situaciones similares a los monoinfectados, una duración inferior a los 12 meses podría ser eficaz11. El estudio C3008, actualmente en desarrollo, está estudiando pautas de tratamiento guiadas por respuesta de menor duración total en pacientes coinfectados.
Datos provenientes de ensayos clínicos apoyan la administración de telaprevir 1.125mg 2 veces al día en pacientes monoinfectados por genotipo 1 del VHC12,13. No disponemos de información acerca del uso de telaprevir administrado 2 veces al día en pacientes coinfectados por VIH/genotipo 1 del VHC. Se desconoce el impacto que las interacciones de los ARV puedan tener sobre la seguridad y eficacia de telaprevir utilizado 2 veces al día. Por todo ello, no es posible recomendar la pauta de telaprevir 2 veces al día en sujetos coinfectados en el momento actual. El estudio 115, actualmente en desarrollo, está estudiando la pauta de administración cada 12 h de telaprevir en pacientes coinfectados (Clinical Trial NCT 01513941).
Condiciones actuales de uso de telaprevir en pacientes coinfectados por el virus de la inmunodeficiencia humana/virus de la hepatitis CTelaprevir ha sido autorizado por la Comisión Europea mediante un procedimiento centralizado para su uso en pacientes monoinfectados por genotipo 1 del VHC. Aunque la indicación en pacientes coinfectados no está directamente desarrollada en la ficha técnica, esta incluye datos de pacientes coinfectados, tanto de eficacia y seguridad como de manejo conjunto del fármaco con diferentes antirretrovirales. En España, el acceso a los medicamentos en condiciones diferentes a las autorizadas está regulado por el Real Decreto 1015/2009 de 19 de junio. Esta regulación establece que la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) “podrá elaborar recomendaciones de uso de medicamentos en condiciones no contempladas en la ficha técnica cuando el uso del medicamento en estas condiciones suponga un impacto asistencial relevante”. De este modo, la AEMPS ha elaborado unas recomendaciones que regulan y permiten el uso de telaprevir en pacientes coinfectados por VIH/genotipo 1 del VHC14.
La AEMPS ha recomendado los siguientes criterios para la utilización de telaprevir en pacientes coinfectados por VIH/VHC:
- 1.
Criterios dependientes del VHC.
- –
Infección por genotipo 1 del VHC, independientemente de que el paciente haya recibido o no tratamiento previo para el VHC.
- –
Grado de fibrosis hepática F3 y F4 confirmada por biopsia hepática o rigidez hepática medida por elastografía hepática transitoria ≥ 9,5kPa.
- –
Independientemente del grado de fibrosis, se podrá considerar iniciar tratamiento con telaprevir o boceprevir en pacientes con manifestaciones extrahepáticas graves de la infección por VHC, como por ejemplo las derivadas de la crioglobulinemia mixta policlonal.
- –
Hepatopatía crónica compensada (Child-Pugh grado A).
- –
Concentración de hemoglobina > 11g/dl en mujeres y > 12g/dl en varones.
- –
- 2.
Criterios dependientes del VIH.
- –
Linfocitos CD4+ totales en sangre periférica > 100/ml o porcentaje de linfocitos CD4+ > 12%.
- –
Carga viral plasmática de VIH < 1.000copias/ml (pacientes en tratamiento antirretroviral).
- –
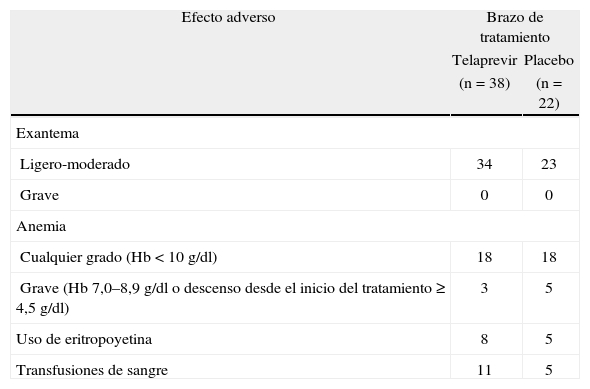
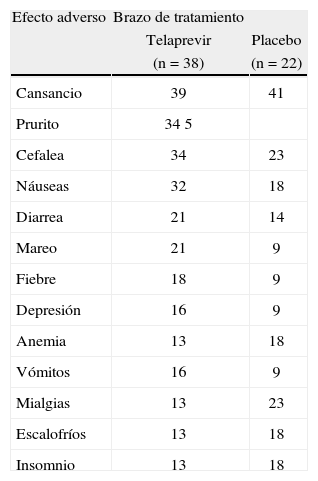
Los datos de seguridad y tolerabilidad de telaprevir en pacientes coinfectados por VIH y VHC son muy similares a los que se conocían previamente en sujetos monoinfectados tratados con este fármaco. De este modo, en el ensayo clínico 110, no se observaron eventos adversos relacionados con el tratamiento con telaprevir3. Se produjeron interrupciones definitivas de tratamiento por efectos adversos en un 8% de los sujetos que se aleatorizaron a recibir telaprevir. Esta proporción de interrupciones definitivas es parecida al aproximadamente 10% de interrupciones definitivas de tratamiento con telaprevir comunicadas para pacientes monoinfectados por genotipo 1 del VHC2. Sin embargo, en el ensayo 110, ningún paciente tratado con telaprevir sufrió un exantema grave (tabla 1). Se observaron erupciones ligeras a moderadas en un 34% de los pacientes que recibieron Peg-IFN/RBV más telaprevir, frente a un 23% de los que fueron tratados con Peg-IFN/RBV más placebo (tabla 1). A lo largo de las 12 semanas iniciales del ensayo, durante el tratamiento triple, el prurito fue más frecuente en los pacientes aleatorizados a la rama que contenía telaprevir, un 34%, en comparación con los que recibieron placebo, un 5%. Otros efectos adversos más frecuentes en los pacientes tratados con telaprevir fueron cefalea, náuseas y sensación de mareo (tabla 2). La tasa de anemia fue igual en ambos grupos de tratamiento, si bien la anemia grave se observó en menos ocasiones en el grupo telaprevir que en el grupo placebo (tabla 1). Sin embargo, en los sujetos tratados con telaprevir se indicaron con más frecuencia transfusiones sanguíneas y eritropoyetina (tabla 1).
Exantema y anemia durante todo el período de estudio en el ensayo 110.
| Efecto adverso | Brazo de tratamiento | |
| Telaprevir | Placebo | |
| (n=38) | (n=22) | |
| Exantema | ||
| Ligero-moderado | 34 | 23 |
| Grave | 0 | 0 |
| Anemia | ||
| Cualquier grado (Hb<10g/dl) | 18 | 18 |
| Grave (Hb 7,0–8,9g/dl o descenso desde el inicio del tratamiento ≥ 4,5g/dl) | 3 | 5 |
| Uso de eritropoyetina | 8 | 5 |
| Transfusiones de sangre | 11 | 5 |
Hb: hemoglobina
Efectos adversos que se produjeron en más del 15% de los pacientes durante el período de tratamiento triple (12 semanas iniciales del ensayo).
| Efecto adverso | Brazo de tratamiento | |
| Telaprevir | Placebo | |
| (n=38) | (n=22) | |
| Cansancio | 39 | 41 |
| Prurito | 34 5 | |
| Cefalea | 34 | 23 |
| Náuseas | 32 | 18 |
| Diarrea | 21 | 14 |
| Mareo | 21 | 9 |
| Fiebre | 18 | 9 |
| Depresión | 16 | 9 |
| Anemia | 13 | 18 |
| Vómitos | 16 | 9 |
| Mialgias | 13 | 23 |
| Escalofríos | 13 | 18 |
| Insomnio | 13 | 18 |
Las recomendaciones sobre el manejo de los efectos adversos asociados con telaprevir no difieren entre los pacientes con coinfección por VIH y aquellos sin coinfección por VIH14. Dichas recomendaciones se revisan en otro capítulo de esta monografía.
ConclusionesA falta de disponer de los resultados provenientes de los ensayos clínicos en fase III en la coinfección por VIH/genotipo 1 del VHC, las pautas de tratamiento basadas en telaprevir más Peg-IFN y RBV en pacientes coinfectados, y no previamente tratados frente al VHC, muestran tasas de RVS superponibles a las comunicadas en ensayos clínicos en individuos infectados únicamente por el genotipo 1 del VHC y no pretratados. Igualmente, no se han observado efectos adversos distintos, ni particularmente más frecuentes, asociados con telaprevir en la coinfección por VIH/genotipo 1 del VHC.
Conflicto de interesesAntonio Rivero declara que a través de su institución ha recibido ayudas para la investigación y/o formación de Roche Pharma, Abbott Laboratories, BMS, Boehringer Ingelheim, MSD, Gilead y ViiH.
Juan Macías declara que ha recibido compensaciones económicas por consultorías: GlaxoSmithKline, Bristol-Myers Squibb, Abbot, Gilead, MSD y Boehringer Ingelheim; presentaciones: GlaxoSmithKline, Roche, Abbot, Bristol-Myers Squibb, Boehringer Ingelheim, Schering- Plough Pharmaceuticals, Janssen, ViiV, Gilead y MSD; preparación de manuscritos: Bristol-Myers Squibb, Boehringer Ingelheim y Roche, y preparación de presentaciones educativas: Gilead y GSK. Su institución ha recibido fondos de GlaxoSmithKline, Roche, Bristol-Myers Squibb, Schering-Plough, Abbot, Boehringer Ingelheim Pharmaceuticals, Janssen, MSD, y Pfizer por proyectos en los que ha participado.






![Tasas de respuesta viral sostenida (RVS) según grupo de aleatorización (telaprevir [TVR] o placebo) y régimen de tratamiento antirretroviral (TAR) recibido. ATV: atazanavir; EFV: efavirenz. Tasas de respuesta viral sostenida (RVS) según grupo de aleatorización (telaprevir [TVR] o placebo) y régimen de tratamiento antirretroviral (TAR) recibido. ATV: atazanavir; EFV: efavirenz.](https://static.elsevier.es/multimedia/0213005X/00000031000000S3/v1_201309220012/S0213005X13701228/v1_201309220012/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

