La otitis media aguda (OMA) es una de las enfermedades infecciosas más frecuentes en pediatría. A los 5 años de vida, el 90% de los niños han presentado al menos un episodio, el 60% dos o más y el 30% más de seis1. Entre el 10 y el 20% de los niños presentan otitis recurrente, por lo que requieren múltiples ciclos de antibióticos y en muchas ocasiones colocación de tubos de timpanostomía. Estos pacientes pueden presentar secuelas auditivas con dificultades para el lenguaje y el aprendizaje2.
Debido a su elevada prevalencia, la OMA es una de las enfermedades que generan más gasto antibiótico en los países desarrollados3. Sin embargo, el índice de curación espontánea es superior al 80%2, por lo que hay que tratar entre 8 y 16 enfermos para que uno se beneficie4. Esto ha conducido en los últimos años al desarrollo de guías de actuación que propugnan un tratamiento de la infección sin antibióticos en casos seleccionados5.
Otro de los grandes problemas en el tratamiento de la OMA es la resistencia antibiótica de las bacterias implicadas. A pesar de que la resistencia a penicilina en neumococo está descendiendo en nuestro país, los aislados procedentes del oído medio tienen porcentajes de resistencia cercanos al 50%, y son más elevados en niños que han recibido tratamiento antibiótico previo6. Por esto, el interés se ha dirigido a la utilización de vacunas que prevengan la aparición de la OMA, especialmente a la vacuna neumocócica conjugada. En este artículo se revisa el diagnóstico y el tratamiento de la OMA en la edad pediátrica y se analiza el impacto de la vacunación antineumocócica en esta patología.
Diagnóstico de la OMAEl diagnóstico correcto de la OMA debe basarse en la clínica y el examen otoscópico. El síntoma cardinal de la OMA, la otalgia, posee una elevada especificidad como criterio diagnóstico, pero su sensibilidad es sólo intermedia debido a que hay niños con OMA sin dolor7. La presencia de otorrea es otro síntoma específico de la OMA, aunque debe diferenciarse mediante otoscopia del exudado inflamatorio de la otitis externa, especialmente en niños mayores y adolescentes. Otros síntomas que aparecen en la OMA, como rinitis, tos, fiebre y rechazo de la alimentación, no deben considerarse para el diagnóstico por su baja especificidad8, ya que pueden estar causados por una infección viral acompañante.
En la exploración otoscópica de la OMA el líquido del oído medio levanta todo el tímpano, se borran los relieves y desaparecen el pliegue y el maléolo. La otoscopia permite confirmar la presencia de diversas alteraciones timpánicas indicativas de OMA: alteraciones en la coloración (enrojecimiento o color amarillo-purulento), opacificación, abombamiento y disminución o ausencia de su movilidad (con el otoscopio neumático).
Recientemente, se ha publicado un importante consenso de la Academia Americana de Pediatría y Medicina de Familia (AAP-AAFP) sobre el diagnóstico y tratamiento de la OMA5. Según este consenso, el diagnóstico debe basarse en tres criterios: 1) comienzo agudo, inferior a 48 h; 2) presencia de líquido en el oído medio por otoscopia: abombamiento y pérdida de los relieves, nivel hidroaéreo u otorrea, y 3) presencia de signos (fuerte enrojecimiento) o síntomas (otalgia, irritabilidad o alteración inexplicable del sueño) de inflamación timpánica.
Un reciente consenso nacional sobre OMA de la Asociación Española de Pediatría y la Sociedad Española de Otorrinolaringología9 siguiendo los criterios de la AAP-AAFP, pero desarrollando algunos aspectos imprecisos en dicha guía, considera según la clínica dos tipos de OMA: OMA confirmada cuando se cumplen los tres criterios y OMA probable si falta alguno, pero existe una elevada posibilidad de que el niño presente esta patología (tabla 1). En esta última circunstancia, se aconseja que el médico valore la presencia de factores de riesgo favorecedores de OMA de evolución tórpida y, si se confirman, que la OMA probable se considere una OMA confirmada (tabla 2).
TABLA 1. Criterios diagnósticos de OMA (consenso nacional)
TABLA 2. Factores de riesgo de evolución tórpida de la OMA*
Etiología y resistencia antibióticaLas bacterias que causan OMA en nuestro medio son Streptococcus pneumoniae (35%), Haemophilus influenzae (25%), Streptococcus pyogenes (3-5%), Staphylococcus aureus (1-3%) y, ya excepcionalmente, bacilos gramnegativos, como Escherichia coli y Pseudomonas aeruginosa y anaerobios10. Moraxella catarrhalis es un patógeno raro en nuestro país, si bien en otras series su frecuencia está próxima a los patógenos principales. Existe un 20-30% de cultivos negativos. Se discute el papel de los virus en esta patología, ya que no se sabe si son agentes causales o simplemente aislados sin significación clínica. En la OMA es muy frecuente encontrar una infección respiratoria viral acompañante que es la responsable de la inflamación y la obstrucción de las trompas, lo que conduce a la acumulación posterior de exudado en el oído medio.
Según datos procedentes del último estudio de Sensibilidad a los Antimicrobianos Utilizados en la Comunidad en España (SAUCE), la resistencia global a penicilina en neumococo es del 44%, y el 20% de las cepas presentan una elevada resistencia (concentración inhibitoria mínima [CIM] 2 g/ml). El porcentaje de resistencia para otros antibióticos es del 0,4% para cefotaxima, del 4,4% para amoxicilina y amoxicilina-ácido clavulánico, el 25,6% para cefuroxima-axetil, el 34,5% para macrólidos y el 36,0% para cefaclor11. En lo referente a H. influenzae, el 20% de los aislados son productores de betalactamasas, cifra que se ha mantenido relativamente estable en los últimos años11.
Vacunación y OMALa única vacuna viral efectiva en la prevención de la OMA es la vacuna antigripal12. En tres estudios similares utilizando la vacuna inactivada intramuscular13,14 o la atenuada intranasal15 se ha demostrado una reducción de entre el 30 y el 36% en los episodios de OMA durante la temporada gripal. Sin embargo, fuera del período epidémico e incluso en años de baja incidencia de gripe16 la vacuna carece de actividad. En un reciente metaanálisis sobre los efectos de la vacunación antigripal para prevenir la OMA en niños sanos no se pudo demostrar beneficio global de la vacunación con respecto al placebo, si bien no se consiguió obtener poder estadístico suficiente17.
En cuanto a las vacunas bacterianas, la introducción de la vacunación sistemática frente a H. influenzae tipo b ha tenido muy poco impacto en la OMA, ya que la mayor parte de las cepas de Haemophilus aisladas en niños son no tipificables. La vacuna antineumocócica polisacarídica 23-valente no es inmunogénica en niños menores de 2 años, por lo que el interés se ha focalizado en la nueva vacuna neumocócica conjugada heptavalente18, que incluye siete serotipos de neumococo (4, 6B, 9V, 14, 18C, 19F y 23F) y se comercializa en nuestro país desde junio de 2001. Sin embargo, los dos principales ensayos clínicos en niños demostraron un beneficio muy modesto (6-7%) en la prevención de OMA19,20. En el estudio finlandés, aunque la vacuna mostró el 57% de eficacia en la prevención de otitis por los serotipos incluidos en la vacuna, hay un incremento del 33% en las otitis por serotipos no vacunales19. Curiosamente, también se encuentra un incremento del 11% en las otitis por H. influenzae no tipificable. Este incremento también se ha demostrado en dos estudios recientes21,22, en el que H. influenzae ha pasado a ser la principal bacteria causante de OMA en niños vacunados, por delante de neumococo (el 56-57 frente al 31%). En cuanto a la resistencia antibiótica, se ha evidenciado una disminución global de la resistencia a penicilina en neumococo en niños vacunados, al incluir la vacuna los serotipos más resistentes21-23. Sin embargo, muy recientemente se ha observado un incremento de la resistencia antibiótica de los serotipos no vacunales colonizadores de la vía respiratoria en niños vacunados24,25 y que en algunos casos podría estar mediada por un mecanismo de transformación capsular26. Esta situación podría reducir todavía más el impacto de la vacunación antineumocócica en la OMA27, conduciendo a medio plazo a una situación muy similar a la de la era prevacunal.
El seguimiento a largo plazo de los pacientes vacunados en la infancia ha evidenciado una eficacia vacunal del 10-18% en la prevención de OMA recurrente y del 24-39% en la utilización de tubos de timpanostomía, lo que sugiere una disminución en la gravedad de la infección28,29. Sin embargo, la vacunación en niños con antecedentes de OMA recurrente no previene frente a nuevos episodios de OMA ni disminuye la necesidad de implantación de tubos de timpanostomía30,31. Estos datos sugieren que la administración de la vacuna en niños sin otitis previas puede prevenir en parte la predisposición a la OMA, ya que estudios epidemiológicos han demostrado que el factor más importante para el desarrollo de OMA de repetición es presentar el primer episodio antes de los 6 meses de vida32. Con todo, la vacunación es ineficaz una vez que la OMA recurrente ya está establecida, seguramente por el daño crónico en las trompas y en la mucosa del oído medio. Todo ello ha quedado refrendado en un reciente metaanálisis que concluye que la vacunación no es eficaz como mecanismo preventivo en niños con OMA de repetición33.
Actualmente, están en desarrollo otras vacunas antineumocócicas conjugadas que amplían el espectro de la heptavalente a nueve serotipos (incluyendo los serotipos 1 y 5) y 11 serotipos (incluyendo también el 3 y el 7F). La primera ha demostrado una eficacia en la prevención de otitis media del 17% en niños de 1 a 3 tres años de vida34. Más prometedora es la vacuna antineumocócica 11-valente conjugada con la proteína D, una lipoproteína de superficie de H. influenzae, y que ha demostrado ser eficaz en la prevención de OMA por H. influenzae en modelos experimentales35. Recientemente, esta vacuna ha demostrado una efectividad del 57% frente a la OMA neumocócica causada por serotipos vacunales y del 35% frente a la causada por H. influenzae no tipificable36, aunque no se ha encontrado correlación entre la eficacia y los anticuerpos antiproteína D.
Tratamiento de la OMALa analgesia es prioritaria, especialmente con ibuprofeno por su doble efecto analgésico y antiinflamatorio. El tratamiento antibiótico acorta los síntomas, aumenta los porcentajes de curación y evita las complicaciones. El beneficio es mayor en niños con otorrea y en menores de 2 años con otitis media bilateral, lo que señala estos casos como más indicados para ser tratados37.
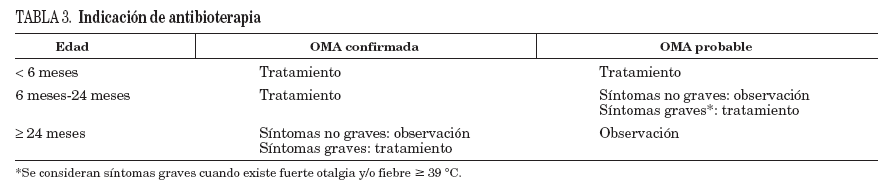
En el mencionado consenso de la AAP-AAFP5, los autores diferencian a los niños por grupos de edad y dividen el diagnóstico en confirmado o probable para considerar la antibioterapia (tabla 3). En los niños menores de 6 meses se recomienda la administración de antibióticos incluso cuando sólo hay diagnóstico de sospecha con el fin de prevenir recurrencias y evitar complicaciones. Entre los 6 y 24 meses está indicado el tratamiento antibacteriano si el diagnóstico es seguro o en los casos de diagnóstico probable y síntomas graves, como dolor intenso, irritabilidad o fiebre > 39 °C. Por encima de los 2 años no se recomienda antibioterapia, ni siquiera ante un diagnóstico cierto, excepto si hay síntomas graves o el niño presenta síntomas tras al menos 48 h de tratamiento sintomático. En un estudio realizado en el ámbito extrahospitalario, esta estrategia redujo la necesidad de tratamiento antibiótico en dos de cada tres niños38. En otro estudio más reciente realizado en un servicio de urgencias, sólo el 13% de los pacientes en el grupo de observación inicial sin antibióticos requirieron finalmente antibioterapia, frente al 62% en el grupo control39.
TABLA 3. Indicación de antibioterapia
El principal objetivo del tratamiento antibiótico debe ser la erradicación de la bacteria del oído medio. Diversos estudios han demostrado una buena correlación entre erradicación bacteriológica y eficacia clínica en OMA40. Alrededor del 40% de los niños con persistencia de cultivo positivo a partir del tercer día de tratamiento antibiótico fracasan clínicamente. La capacidad de erradicación de un antibiótico puede predecirse a partir de la relación existente entre las concentraciones que alcanza en el lugar de la infección y su actividad antimicrobiana. El índice más importante para antibióticos betalactámicos es el tiempo que su concentración en el oído medio supera la CIM del microorganismo (t > CIM)41. Para lograr la erradicación bacteriana del oído medio, este tiempo debe superar el 40% del intervalo entre dosis. En la OMA, sólo amoxicilina en dosis altas (80-100 mg/kg/día) consigue tiempos por encima de la CIM superiores al 40% frente al neumococo resistente por alcanzar concentraciones elevadas en el oído medio42. La asociación con ácido clavulánico ampliaría el espectro frente a H. influenzae productor de betalactamasas. Sin embargo, la erradicación espontánea de H. influenzae es más alta que la del neumococo (el 50 frente al 20%), y la otitis neumocócica suele ser más agresiva y con mayor frecuencia de complicaciones. Además, sólo el 20% de los H. influenzae aislados en nuestro país son productores de betalactamasas11, por lo que la amoxicilina continúa siendo el tratamiento de elección43. Amoxicilinaácido clavulánico (100/12,5 mg) se reservaría para pacientes con importante sintomatología o con riesgo de enfermedad grave, como los lactantes menores de 6 meses o los niños inmunodeprimidos o con historia de OMA recurrente (tabla 4).
TABLA 4. Tratamiento de la OMA
La generalización de la vacunación antineumocócica en nuestro país podría modificar las actuales guías terapéuticas. Como ya se ha mencionado, en países en los que la vacuna antineumocócica tiene una cobertura elevada, H. influenzae se ha convertido en el principal agente etiológico de la OMA, desplazando a S. pneumoniae. Además, la producción de betalactamasas es mayor en los aislados de niños vacunados21,22. H. influenzae es frecuente en la OMA recurrente del niño mayor y puede producir complicaciones, especialmente otorrea y mastoiditis en entre el 4 y el 18% de los casos44. Si consideramos las tasas de aislado y de resistencia de la era prevacunal, alrededor del 6% de las OMA en nuestro país estarían causadas por
H.influenzae productor de betalactamasas. Sin embargo, si el aumento de la frecuencia de H. influenzae observada en niños vacunados frente a neumococo se confirma, este porcentaje podría aumentar de forma considerable, influyendo en la antibioterapia empírica aconsejada en los diferentes protocolos. Por tanto, son necesarios estudios prospectivos para analizar la influencia de la vacunación en la etiología y resistencia antibiótica de la OMA en nuestro país.
En caso de alergia a penicilina, se recomienda cefuroxima axetilo, cefpodoxima o cefdinir (este último no se comercializa en España) si la alergia no es de tipo I (reacción anafiláctica mediada por IgE) y macrólidos si lo es, aunque la resistencia en niños es cercana al 50%11. En caso de fracaso terapeútico o aparición de complicaciones, pueden emplearse levofloxacino, telitromicina o linezolid, aunque se trata de fármacos de amplio espectro, no disponibles en suspensión (salvo linezolid) y con limitada experiencia en pediatría. En pacientes con intolerancia gástrica se administrará ceftriaxona por vía intramuscular en dosis de 50 mg/kg/día durante 3 días.
Si los síntomas persisten al cabo de 48-72 h se administrará amoxicilina en dosis altas si el paciente se encontraba en observación con analgésicos, amoxicilina-ácido clavulánico 100/12,5 mg si el niño había recibido únicamente amoxicilina o ceftriaxona intramuscular si había recibido amoxicilina-ácido clavulánico. Si persiste el fracaso terapéutico, se practicará una timpanocentesis para intentar aislar la bacteria responsable y seleccionar el tratamiento según el antibiograma.
La duración habitual del tratamiento de la OMA es de 10 días, aunque hay estudios que demuestran resultados satisfactorios con 5-7 días45. Estos tratamientos cortos no están aconsejados en los pacientes menores de 2 años, inmunodeprimidos o con historia de OMA recurrente. No existe ninguna indicación para el tratamiento con gotas óticas analgésicas ni antibióticas, excepto en casos con implantación de tubos de timpanostomía. Tampoco se recomienda utilizar gotas nasales, mucolíticos ni antihistamínicos46.
Correspondencia: Dr. Fernando Baquero-Artigao. Unidad de Enfermedades Infecciosas Pediátricas. Hospital Universitario Infantil La Paz. P.º de la Castellana, 261. 28046 Madrid. España. Correo electrónico: fbaquero@terra.es
Manuscrito recibido el 14-12-2006; aceptado el 16-5-2007.