Las bacteriemias por microorganismos anaerobios son poco frecuentes, no existiendo consenso sobre su predictibilidad clínica y la utilidad rutinaria de los medios de cultivo para anaerobios. El objetivo del estudio es crear y validar un modelo predictivo de bacteriemia por anaerobios.
MétodosEl modelo predictivo se realizó con 984 bacteriemias (45 anaerobios estrictos) durante 1985–86 y 1996–97. La validación durante 2005–06 con 320 bacteriemias.
ResultadosLos factores predictores de bacteriemia por anaerobios calculados en el análisis multivariante para la creación de un modelo estratificado con puntuaciones de 0–13 puntos (p) fueron: origen desconocido (OR: 3,46; IC 95%: 1,13–10,54) 3 p; origen abdominal y cutáneo (OR: 14,85; IC 95%: 6,37–34,62) 6 p; hipotensión (OR: 1,99; IC 95%: 0,98–4,04) 2 p; ausencia de manipulaciones vasculares (OR: 2,62; IC 95%: 1,04–6,60) 2 p y edad >60 años (OR: 3,21; IC 95%: 1,19–8,67) 3 p. Con >7 p el modelo tiene S:77,8%, E:78,3%, VPP: 14,7% y un VPN del 98,6%, área bajo curva ROC=0,84 (EE=0,011). IC 95%: 0,82–0,86 con prevalencia de bacteriemia por anaerobios estimada 4,6%. La validación del modelo se realizó con 320 bacteremias (55 de ellas por anaerobios estrictos). El 83,6% (IC 95%: 71,19–92,23) de las bacteriemias por anaerobios tienen >7 p, y el 72,7% tienen 9 p o más. El 26,4% (IC 95%: 21,2–32,15) de las bacteriemias por aerobios y aerobios-anaerobios facultativos tienen >7 p, y solo el 11,7% tienen 9 p o más.Área bajo curva ROC=0,82 (EE=0,02). IC 95%: 0,78–0,86. Prevalencia estimada 2%.
ConclusionesEl origen abdominal y cutáneo OR 14,85; origen desconocido OR 3,46; hipotensión OR 1,99; ausencia de manipulaciones vasculares OR 2,62 y edad >60 años OR 3,21 permiten crear un modelo clínico predictivo de bacteriemia por anaerobios con alta S y E. Por su baja prevalencia la importancia del modelo radica en su altísimo valor predictivo negativo.
Anaerobic bacteremias are uncommon. There is no agreement on their clinical predictability and the usefulness of anaerobic blood cultures. The objective of this study was to develop and validate a model for the prediction of anaerobic bacteremias.
MethodThe developing model was created with 984 bacteremias (45 anaerobic bacteremias) during 1985–1986 and 1996–1997. The validation model was made with 320 bacteremias during 2005–2006.
ResultsIndependent multivariate predictors of true anaerobic bacteremia were used to develop a model stratifying patients with scores of 0 to 13 points(p), which were: unknown focus OR 3.46 (CI: 1.13–10.54) 3 p; abdominal and skin focus OR 14.85 (CI: 6.37–34.62) 6p; hypotension OR 1.99 (CI: 0.98–4.04) 2p; absence of vascular manipulations OR 2.62 (CI: 1.04–6.60) 2p and age over 60 years OR 3.21 (CI: 1.19–8.67) 3p. In the derivation sets group with more than 7p the model had Sensitivity: 77.8%, Specificity: 78.3%, PPV:14.7%, and a NPV of 98.6%. The area under curve was ROC=0.84 (SE=0.011), 95% CI: 0.82–0.86 with an anaerobic bacteremia prevalence of 4.6%. The validation set was studied analysing 320 bacteremias. Of these, 83.6% (95% CI: 71.19%–92.23%) of anaerobic bacteremias had more than 7 points, and 72.7% had more than 9 points. There was 26.4% (95% CI: 21.2%–32.15%) aerobic and facultative anaerobic bacteremias with more than 7 points, and only the 11.7% with 9 or more points. The area under the curve was, ROC=0.82 (SE=0.02), 95% CI:0.78–0.86, and estimated prevalence, 2%.
ConclusionsAbdominal and skin focus OR 14,85; unknown focus OR 3,46; hypotension OR 1,99; absence of vascular manipulations OR 2,62 and age over 60 years enable us to make a predictive clinical model of probability of anaerobic bacteremia with a high sensitivity and specificity. The model particularly has a significant predictive negative value due to the low prevalence of anaerobic bacteremia.
Las bacteriemias por anaerobios estrictos forman con frecuencia parte de bacteriemias polimicrobianas, son poco prevalentes y presentan una elevada mortalidad1,2.
El debate sobre la rentabilidad de los medios de cultivo en anaerobiosis para el diagnóstico de bacteriemias lleva activo más de 20 años3. En la edad pediátrica, en la que el volumen de sangre extraído debe ser limitado, y dada la baja prevalencia de las bacteriemias por anaerobios, está prácticamente consensuado el no procesar la sangre en medios de cultivo en anaerobiosis. En los adultos, sin embargo, este procedimiento no está estandarizado ni consensuado, existiendo básicamente 2 opiniones al respecto: la primera es suspender los medios de cultivo en anaerobiosis y usarlos solo si existe sospecha clínica de bacteriemia por anaerobios estrictos4,5, basándose en la baja incidencia de las bacteriemias por anaerobios6,7, en su predictibilidad clínica8,9, en el aumento de las fungemias10,11 (con crecimiento de estas casi exclusivamente en aerobiosis), en la ausencia de modificación antibioterápica una vez conocido el crecimiento de microorganismos anaerobios, y en la no modificación del pronóstico de las bacteriemias por anaerobios estrictos en cuanto a su evolución a muerte independientemente de que el tratamiento antibiótico empírico recibido fuese adecuado o inadecuado12–14, ya que en la mayor parte de las ocasiones el tratamiento definitivo y resolutivo es el quirúrgico15–17. Segundo, el grupo que aboga por mantener los medios de cultivo en anaerobiosis de forma sistemática y que se basa en que las bacteriemias por anaerobios estrictos no son predecibles clínicamente18, en que el tratamiento antibiótico incorrecto aumenta significativamente la mortalidad19 y en que la aparición de resistencias bacterianas podrían hacer modificar las decisiones terapeúticas antibióticas19–21. Además en los medios de cultivo en anaerobiosis crecen otros microorganismos aerobios anaerobios facultativos que podrían infradiagnosticarse si la sangre extraída no se procesase en este medio de crecimiento20. Cada una de estas afirmaciones se realiza sobre la base de resultados de estudios locales, y por tanto susceptibles de ser aplicados de forma localmente.
El estudio realizado que se describe a continuación presenta un modelo clínico predictivo de bacteriemia por anaerobios estrictos, así como la validación del mismo.
El modelo clínico predictivo podría ser de utilidad en la toma de decisiones de extracción y procesamiento de sangre en medio de cultivo en anaerobiosis para el diagnóstico de bacteriemia.
MétodosEl objetivo del trabajo que se presenta a continuación es la determinación de los factores clínicos predictivos de las bacteriemias por anaerobios estrictos que permitan crear un modelo predictivo de bacteriemia por anaerobios a partir de 984 bacteriemias diagnosticadas durante los años 1985–86 y 1996–97 en el Hospital Universitario de la Princesa y validándolo con 320 bacteriemias diagnosticadas durante los años 2005–06 en el Hospital Universitario de Fuenlabrada y Hospital Fundación de Alcorcón.
Durante los periodos del 1 de enero de 1985 al 31 de diciembre de 1986 y del 16 de mayo de 1996 al 14 de mayo de 1997, se siguió de forma prospectiva a todos los pacientes que presentaron hemocultivo positivo, siguiendo la evolución de los mismos hasta la curación del episodio o fallecimiento del paciente y descartándose los contaminantes tras la valoración de los mismos. Para tal proceso y de acuerdo con el servicio de microbiología, diariamente se valoró a todos los pacientes que durante los periodos de estudio presentaron hemocultivos positivos. Los frascos negativos fueron incubados a 37°C durante 10 días y revisados diariamente para detectar signos macroscópicos de crecimiento). En el periodo 1996–97 el sistema automatizado de hemocultivos empleado fue el BACTEC NR 730.
Todos los casos de bacteriemia fueron discutidos por el grupo de trabajo (10 médicos). Los datos clínicos y analíticos de cada caso se recogieron siguiendo el mismo protocolo de recogida de datos en ambos periodos de estudio (se describe en el apartado «definiciones») para su posterior introducción y procesamiento con el paquete estadístico SPSS.
La validación del modelo predictivo se realizó con las bacteriemias diagnosticadas en dos centros hospitalarios del sur de Madrid (Hospital Universitario de Fuenlabrada y Hospital Fundación de Alcorcón), durante los años 2005–06. El Hospital Universitario de Fuenlabrada es un hospital de 350 camas. Hospital médico quirúrgico con los servicios de Cirugía general, Urología, Traumatología, Ginecología y Obstetricia, Pediatría, Unidad de Cuidados Intensivos, Hemato-Oncología, Medicina Interna, Digestivo y Cardiología. Los hemocultivos positivos fueron analizados por un equipo de 6 médicos quienes recogían el aviso dado por microbiología y analizaban el hemocultivo con la historia del paciente clasificándolo finalmente como hemocultivo verdadero o como contaminante. El sistema de hemocultivos empleado fue el BacT Alert, donde de forma habitual eran procesados y cultivados durante 1 semana, considerándolos negativos si a la semana no se había producido crecimiento. Se consideró el mismo episodio de bacteriemia si se producía una nueva extracción con crecimiento del mismo microorganismo en los 5 días siguientes a la primera extracción.
El Hospital Universitario Fundación de Alcorcón es un hospital de 450 camas formado por Servicios Médicos, Quirúrgicos y Unidades de Transplante de Médula ósea, Unidad de Cuidados Intensivos, Unidad de Diálisis, Unidad de Reanimación, Hospitales de Día de Onco-Hematología, de Enfermedades Infecciosas, Unidad de Medicina Ambulatoria, Unidad de Cirugía Ambulatoria, Pediatría y Obstetricia-Ginecología. Los hemocultivos positivos fueron analizados por dos médicos siguiendo los criterios anteriormente mencionados. El sistema de hemocultivos empleado fue el BACT Alert.
En los 3 centros hospitalarios en los que se ha realizado el estudio se extraían de forma sistemática un total de 20–30ml de sangre, procesando el mismo volumen de sangre en aerobiosis y en anaerobiosis.
En relación a los medios de cultivo durante el periodo de estudio, mencionar que existen diversos trabajos que demuestran una rentabilidad similar de los medios de cultivo en anaerobiosis de los sistemas BACTEC 730 y BacT Alert22, así como entre el BACTEC 9240 y el sistema BacT Alert con congruencia en el crecimiento de microorganismos de más del 95%21.
Definiciones- 1.
Episodio de bacteriemia y fungemia verdadera y contaminantes: Se consideró un hemocultivo verdadero positivo (bacteriemia) cuando se aisló, en al menos un frasco de hemocultivos, alguno de los siguientes microorganismos: cocos grampositivos (diferentes de Staphylococcus coagulasa-negativo y Micrococus sp), cocos gram negativos (Neisseria meningitidis fudamentalmente), bacilos gramnegativos u hongos. También se consideró positivo cuando en las 2 parejas de hemocultivos se aisló Staphylococcus coagulasa-negativo en al menos un frasco de cada pareja, pertenecientes a la misma especie, y el paciente presentaba clínica compatible con bacteriemia. El hemocultivo se consideró contaminante cuando se aisló, en un solo frasco, Staphylococcus coagulasa-negativo, Bacillus sp., Propionibacterium acnes, Microccocus sp o Corynebacterium sp sin clínica sugestiva. En el caso de que el aislamiento, en un solo frasco, de Staphylococcus coagulasa-negativo se asociara con catéter intravascular colonizado (>15 unidades formadoras de colonias) por el mismo microorganismo, se consideró el hemocultivo como positivo si su médico inició tratamiento a raíz de dicho resultado. Se consideró el mismo episodio de bacteriemia verdadera cuando se aislaron los mismos microorganismos durante los primeros 7 días. Ocasionalmente, periodos más largos fueron considerados si la situación clínica así lo indicaba (como pudiera ser por ejemplo el caso de las endocarditis).
- 2.
Edad: Los pacientes fueron distribuidos en 3 grupos: edad entre 15–40 años, 40–60 años y mayores de 60 años. Esta distribución se debe al hecho de que en el Hospital Universitario de La Princesa (hospital en el que se realizó el modelo predictivo), no se atienden a pacientes pediátricos. En la validación del modelo se han respetado estos mismos grupos no analizándose las bacteriemias en edad pediátrica.
- 3.
Adquisición: Durante los periodos 1985–86 y 1996–97 se consideró BF intrahospitalaria cuando la bacteriemia se desarrolló al menos tras 48h de ingreso hospitalario. El resto de las bacteriemias se clasificaron como extrahospitalarias. La clasificación actual de las bacteriemias por lugar de adquisición (comunitarias, nosocomiales y asociadas a cuidados sanitarios), se aplicó a las bacteriemias diagnosticadas durante el periodo 2005–06.
- 4.
Servicio: Servicio en el que se produjo la bacteriemia. Se dividieron en 3 grupos: Servicios Médicos, Servicios Quirúrgicos y Unidad de Cuidados Intensivos.
- 5.
Enfermedad de base: La enfermedad de base de cada paciente se clasificó siguiendo los criterios de Weinstein et al23,24.
- 6.
Factores predisponentes: Se incluyen en este apartado el tratamiento previo con antibióticos a dosis terapéuticas durante los 7 días previos, el uso de citostáticos, inmunosupresores, radioterapia, y el uso de esteroides a dosis iguales o superiores a 20mg/día de prednisona o sus equivalentes durante los 7 días previos. Se consideró neutropenia, cuando la cifra de neutrófilos estaba por debajo de 1.000/mm3.
- 7.
Manipulaciones: Se consideraron aquellas maniobras diagnósticas o terapéuticas realizadas durante los 7 días previos al desarrollo de la bacteriemia. Se incluyen manipulaciones digestivas (endoscopia alta y baja, laparoscopia con o sin biopsia), urológicas (sonda vesical, cistografía retrógrada, cistoscopia con o sin biopsia), respiratorias (intubación, endoscopia con o sin biopsia), vasculares (catéteres intravenosos, marcapasos, fístulas arteriovenosas) y cirugía.
- 8.
Foco de origen: La determinación del foco de origen se basó en hallazgos clínicos y/o microbiológicos. Cuando no se encontró ninguna localización o si los datos fueron confusos se determinó como origen desconocido. El resto de localizaciones fueron origen intravascular (catéteres intravenosos y endocarditis), abdominal, aparato respiratorio, tracto nefrourológico, osteoarticular, sistema nervioso central (SNC), piel y heridas quirúrgicas. Para la realización del modelo clínico predictivo se agruparon en un mismo apartado los focos abdominales e infección de piel y herida quirúrgica, dada la dificultad existente en ocasiones de distinguir infección de herida quirúrgica de infección intraabdominal o presentarse ambas simultáneamente.
- 9.
Datos clínicos y de laboratorio: Se consideró hipotensión o shock cuando la cifra de tensión sistólica estaba por debajo de 90mmHg en pacientes normotensos o una caída superior a 70mmHg en la tensión sistólica en pacientes hipertensos. Trombocitopenia si la cifra de plaquetas fue inferior a 100.000/mm3. Coagulación intravascular diseminada (CID) se estableció por datos clínicos y/o de laboratorio (disminución del tiempo de protrombina, aumento de tiempo de cefalina y trombopenia) no explicable por otros procesos.
- 10.
Tratamiento: Se define como tratamiento empírico al realizado después de la extracción de los hemocultivos y hasta la llegada del antibiograma. El tratamiento empírico se clasificó como no valorable, adecuado o inadecuado siguiendo los criterios que se mencionan a continuación: 1) no valorable: cuando el paciente estaba sometido a tratamiento antibiótico previo por otro proceso infeccioso o la muerte se produjo antes de poder instaurarse el tratamiento; 2) adecuado: si el tratamiento quirúrgico o la retirada de catéteres fueron suficientes sin tener que añadir antibióticos; utilización de al menos un antibiótico (posteriormente sensible «in vitro») a dosis y ruta de administración adecuadas y con una duración mínima de 5 días; 3) inadecuado: incluyó la no utilización de antibióticos siendo necesaria por la gravedad del proceso, la utilización de antibióticos frente a los cuales el microorganismo presentaba resistencia, dosis insuficientes, duración menor de 5 días y no realización de tratamiento quirúrgico cuando este estaba indicado.
En primer lugar, durante los periodos 1985–86 y 1996–97 se ha realizado un estudio descriptivo de las bacteriemia por anaerobios estrictos (incluidas las bacteriemias polimicrobianas en las que al menos uno de los microorganismos era un anaerobio estricto), comparándolas con las bacteriemias por otros microorganismos aerobios o aerobios-anaerobios facultativos. Se calcularon las frecuencias relativas de aparición de las distintas variables analizadas en los 2 grupos de estudio. La relación entre la presencia de bacteriemia por microorganismos anaerobios y las variables categóricas se evaluó mediante el test de Chi cuadrado con los adecuados grados de libertad, o test exacto de Fisher. Las variables que en el análisis univariado se correlacionaron con presencia de bacteriemia por anaerobios con p<0,15, entraron en un análisis de regresión logística por pasos.
El resultado del análisis multivariado se utilizó para crear un modelo predictivo de bacteriemia por anaerobios. Tras la realización de la regresión logística, cada coeficiente Beta obtenido de las variables con significación estadística (p≤0,05) fue dividido por un valor Beta de referencia, obteniendo un valor que se redondeaba al inmediatamente superior (por ejemplo, en un modelo con 3 variables con valores obtenidos de 1,5, 1,7 y 2,2; a las primeras 2 variables se les asignaría una puntuación de 2 y a la tercera una puntuación de 3). El índice de riesgo para un paciente individual se determinó asignando puntos (calculados para cada variable de la forma anteriormente mencionada) y sumándolos. Con todas las puntuaciones finales de cada una de las bacteriemias se realizó una curva ROC y se calcularon los valores de sensibilidades, especificidades, valores predictivos positivos y negativos26.
Todos los datos fueron procesados utilizando el paquete estadístico SPSS.
De forma paralela se realizó una comparación entre las proporciones de cada una de las variables cualitativas aplicando la macro para SPSS: macro para el cálculo del IC de la diferencia entre dos proporciones independientes de la OR 1998© J.M.Domenech-Massons y R.Granero-Perez, procesados en el procesador estadístico SPSS.
En una segunda fase se procedió a la validación del modelo predictivo previamente realizado. Para ello se analizaron todas las bacteriemias diagnosticadas en el Hospital Universitario de Fuenlabrada (excepto las diagnosticadas en UCI), durante los años 2005 y 2006. Se recogieron además todas las bacteriemias por anaerobios estrictos (independientemente de si formaban parte de una bacteriemia polimicrobiana o no) diagnosticadas durante los años 2005 y 2006 en el Hospital Fundación de Alcorcón. En este proceso intervinieron 3 médicos que desconocían los resultados del modelo predictivo previamente calculado.
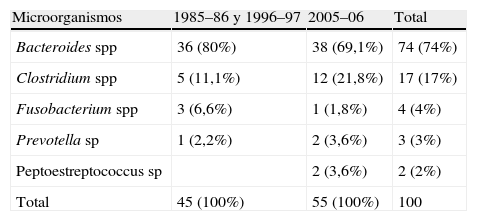
ResultadosGlobalmente se han incluido en el estudio 1.304 bacteriemias de las que 100 lo han sido por microorganismos anaerobios estrictos (tabla 1).
Bacteriemias por microorganismos anaerobios estrictos: períodos 1985–85, 1996–97 y 2005–06
| Microorganismos | 1985–86 y 1996–97 | 2005–06 | Total |
| Bacteroides spp | 36 (80%) | 38 (69,1%) | 74 (74%) |
| Clostridium spp | 5 (11,1%) | 12 (21,8%) | 17 (17%) |
| Fusobacterium spp | 3 (6,6%) | 1 (1,8%) | 4 (4%) |
| Prevotella sp | 1 (2,2%) | 2 (3,6%) | 3 (3%) |
| Peptoestreptococcus sp | 2 (3,6%) | 2 (2%) | |
| Total | 45 (100%) | 55 (100%) | 100 |
A) Creación del modelo clínico predictivo de bacteriemia por anaerobios: 984 bacteriemias correspondientes a 846 pacientes.
Durante el periodo 1985–86 y 1996–97 se obtuvieron un total de 16.916 tandas de hemocultivos (11.958 del primer periodo y 4958 del segundo), siendo positivas 2.433 tandas (1.333 del primer periodo y 1.100 del segundo) diagnosticándose un total de 984 bacteriemias (512 del primer periodo y 472 del segundo) de las que 45 fueron por microorganismos anaerobios estrictos (22 del primer periodo y 23 del segundo) y de las que 14 formaban parte de bacteriemias polimicrobianas. La prevalencia de bacteriemias por anaerobios estrictos sobre el total de las bacteriemias fue de 0,0457 (4,6%).
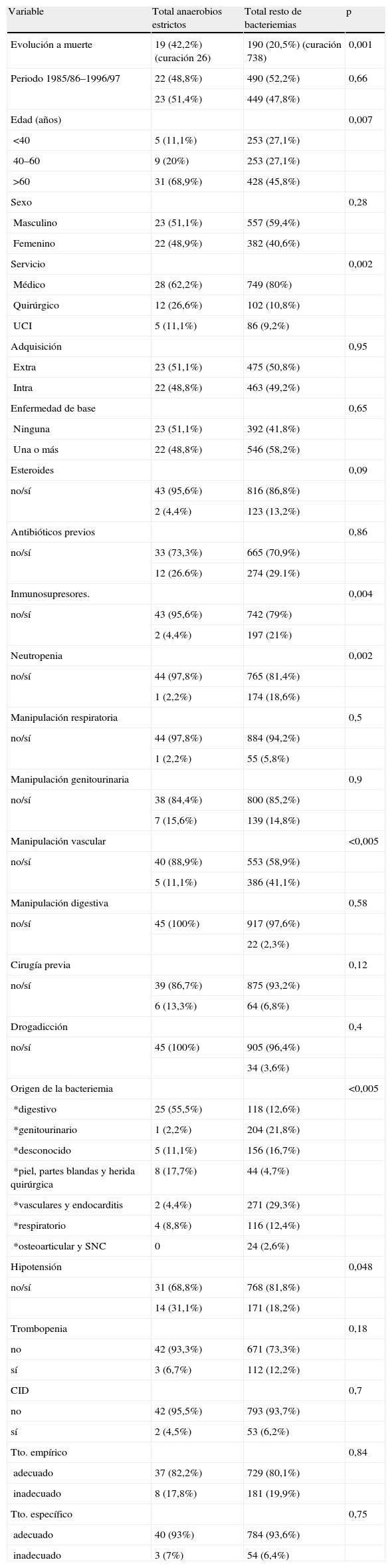
Las variables que en el análisis univariado presentaron significación estadística (p<0,15) para presentar una bacteriemia por microorganismos anaerobios estrictos frente al resto de microorganismos (tabla 2), fueron: evolución a muerte (p=0,001), edad (p=0,007 ), servicio (p=0,002), tratamiento con esteroides (p=0,09), tratamiento con otros inmunosupresores (p=0,004), presencia de neutropenia (p=0,002), ausencia de manipulación vascular previa (p=0,005), la realización de cirugía previa (p=0,12), origen de la bacteriemia (p=0,005), y la presencia de hipotensión (p=0,048).
Comparación bacteriemias por anaerobios estrictos frente a resto de bacteriemias 1985/86–1997/97
| Variable | Total anaerobios estrictos | Total resto de bacteriemias | p |
| Evolución a muerte | 19 (42,2%) (curación 26) | 190 (20,5%) (curación 738) | 0,001 |
| Periodo 1985/86–1996/97 | 22 (48,8%) | 490 (52,2%) | 0,66 |
| 23 (51,4%) | 449 (47,8%) | ||
| Edad (años) | 0,007 | ||
| <40 | 5 (11,1%) | 253 (27,1%) | |
| 40–60 | 9 (20%) | 253 (27,1%) | |
| >60 | 31 (68,9%) | 428 (45,8%) | |
| Sexo | 0,28 | ||
| Masculino | 23 (51,1%) | 557 (59,4%) | |
| Femenino | 22 (48,9%) | 382 (40,6%) | |
| Servicio | 0,002 | ||
| Médico | 28 (62,2%) | 749 (80%) | |
| Quirúrgico | 12 (26,6%) | 102 (10,8%) | |
| UCI | 5 (11,1%) | 86 (9,2%) | |
| Adquisición | 0,95 | ||
| Extra | 23 (51,1%) | 475 (50,8%) | |
| Intra | 22 (48,8%) | 463 (49,2%) | |
| Enfermedad de base | 0,65 | ||
| Ninguna | 23 (51,1%) | 392 (41,8%) | |
| Una o más | 22 (48,8%) | 546 (58,2%) | |
| Esteroides | 0,09 | ||
| no/sí | 43 (95,6%) | 816 (86,8%) | |
| 2 (4,4%) | 123 (13,2%) | ||
| Antibióticos previos | 0,86 | ||
| no/sí | 33 (73,3%) | 665 (70,9%) | |
| 12 (26.6%) | 274 (29.1%) | ||
| Inmunosupresores. | 0,004 | ||
| no/sí | 43 (95,6%) | 742 (79%) | |
| 2 (4,4%) | 197 (21%) | ||
| Neutropenia | 0,002 | ||
| no/sí | 44 (97,8%) | 765 (81,4%) | |
| 1 (2,2%) | 174 (18,6%) | ||
| Manipulación respiratoria | 0,5 | ||
| no/sí | 44 (97,8%) | 884 (94,2%) | |
| 1 (2,2%) | 55 (5,8%) | ||
| Manipulación genitourinaria | 0,9 | ||
| no/sí | 38 (84,4%) | 800 (85,2%) | |
| 7 (15,6%) | 139 (14,8%) | ||
| Manipulación vascular | <0,005 | ||
| no/sí | 40 (88,9%) | 553 (58,9%) | |
| 5 (11,1%) | 386 (41,1%) | ||
| Manipulación digestiva | 0,58 | ||
| no/sí | 45 (100%) | 917 (97,6%) | |
| 22 (2,3%) | |||
| Cirugía previa | 0,12 | ||
| no/sí | 39 (86,7%) | 875 (93,2%) | |
| 6 (13,3%) | 64 (6,8%) | ||
| Drogadicción | 0,4 | ||
| no/sí | 45 (100%) | 905 (96,4%) | |
| 34 (3,6%) | |||
| Origen de la bacteriemia | <0,005 | ||
| *digestivo | 25 (55,5%) | 118 (12,6%) | |
| *genitourinario | 1 (2,2%) | 204 (21,8%) | |
| *desconocido | 5 (11,1%) | 156 (16,7%) | |
| *piel, partes blandas y herida quirúrgica | 8 (17,7%) | 44 (4,7%) | |
| *vasculares y endocarditis | 2 (4,4%) | 271 (29,3%) | |
| *respiratorio | 4 (8,8%) | 116 (12,4%) | |
| *osteoarticular y SNC | 0 | 24 (2,6%) | |
| Hipotensión | 0,048 | ||
| no/sí | 31 (68,8%) | 768 (81,8%) | |
| 14 (31,1%) | 171 (18,2%) | ||
| Trombopenia | 0,18 | ||
| no | 42 (93,3%) | 671 (73,3%) | |
| sí | 3 (6,7%) | 112 (12,2%) | |
| CID | 0,7 | ||
| no | 42 (95,5%) | 793 (93,7%) | |
| sí | 2 (4,5%) | 53 (6,2%) | |
| Tto. empírico | 0,84 | ||
| adecuado | 37 (82,2%) | 729 (80,1%) | |
| inadecuado | 8 (17,8%) | 181 (19,9%) | |
| Tto. específico | 0,75 | ||
| adecuado | 40 (93%) | 784 (93,6%) | |
| inadecuado | 3 (7%) | 54 (6,4%) |
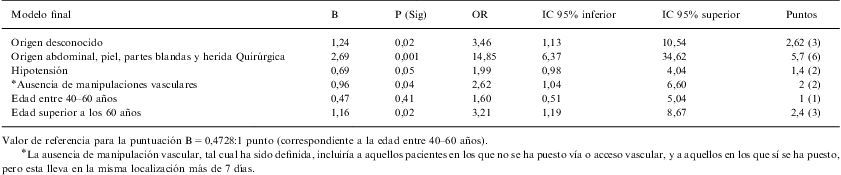
Tras la introducción de las variables mencionadas anteriormente en el modelo de regresión logística, las variables que presentaron significación clínica y estadística (p≤0,05) como predictivas de bacteriemia por anaerobios estrictos fueron (tabla 3): origen abdominal, partes blandas o herida quirúrgica (OR: 14,85; IC 95%: 6,37–34,62), p=0,001; origen desconocido de la bacteriemia (OR: 3,46; IC 95%: 1,13–10,54), p=0,02; edad superior a 60 años (OR: 3,21; IC 95%: 1,19–8,67), p=0,02; la ausencia de manipulaciones vasculares (OR: 2,62; IC 95%: 1,04–6,60), p=0,04 y la presencia de hipotensión (OR: 1,99; IC 95%: 0,98–4,04), p=0,05.
Modelo multivariado .Factores predictivos de bacteriemia por anaerobios
| Modelo final | B | P (Sig) | OR | IC 95% inferior | IC 95% superior | Puntos |
| Origen desconocido | 1,24 | 0,02 | 3,46 | 1,13 | 10,54 | 2,62 (3) |
| Origen abdominal, piel, partes blandas y herida Quirúrgica | 2,69 | 0,001 | 14,85 | 6,37 | 34,62 | 5,7 (6) |
| Hipotensión | 0,69 | 0,05 | 1,99 | 0,98 | 4,04 | 1,4 (2) |
| *Ausencia de manipulaciones vasculares | 0,96 | 0,04 | 2,62 | 1,04 | 6,60 | 2 (2) |
| Edad entre 40–60 años | 0,47 | 0,41 | 1,60 | 0,51 | 5,04 | 1 (1) |
| Edad superior a los 60 años | 1,16 | 0,02 | 3,21 | 1,19 | 8,67 | 2,4 (3) |
Valor de referencia para la puntuación B=0,4728:1 punto (correspondiente a la edad entre 40–60 años).
Para crear el modelo predictivo de bacteriemias por anaerobios estrictos se escogió como valor de referencia para la asignación de puntuaciones el correspondiente a la variable edad entre 40–60 años B=0,4728 (OR: 1,60; IC 95%: 0,51–5,04; p=0,4) a la que se le asignó 1 punto (tabla 3). Con este valor de referencia las variables significativas tras la realización de la regresión logística obtuvieron las siguientes puntuaciones: origen abdominal, piel, partes blandas o herida quirúrgica, 6 puntos; origen desconocido de la bacteriemia, 3 puntos; edad superior a 60 años, 3 puntos; presencia de hipotensión, 2 puntos, y ausencia de manipulaciones vasculares, 2 puntos.
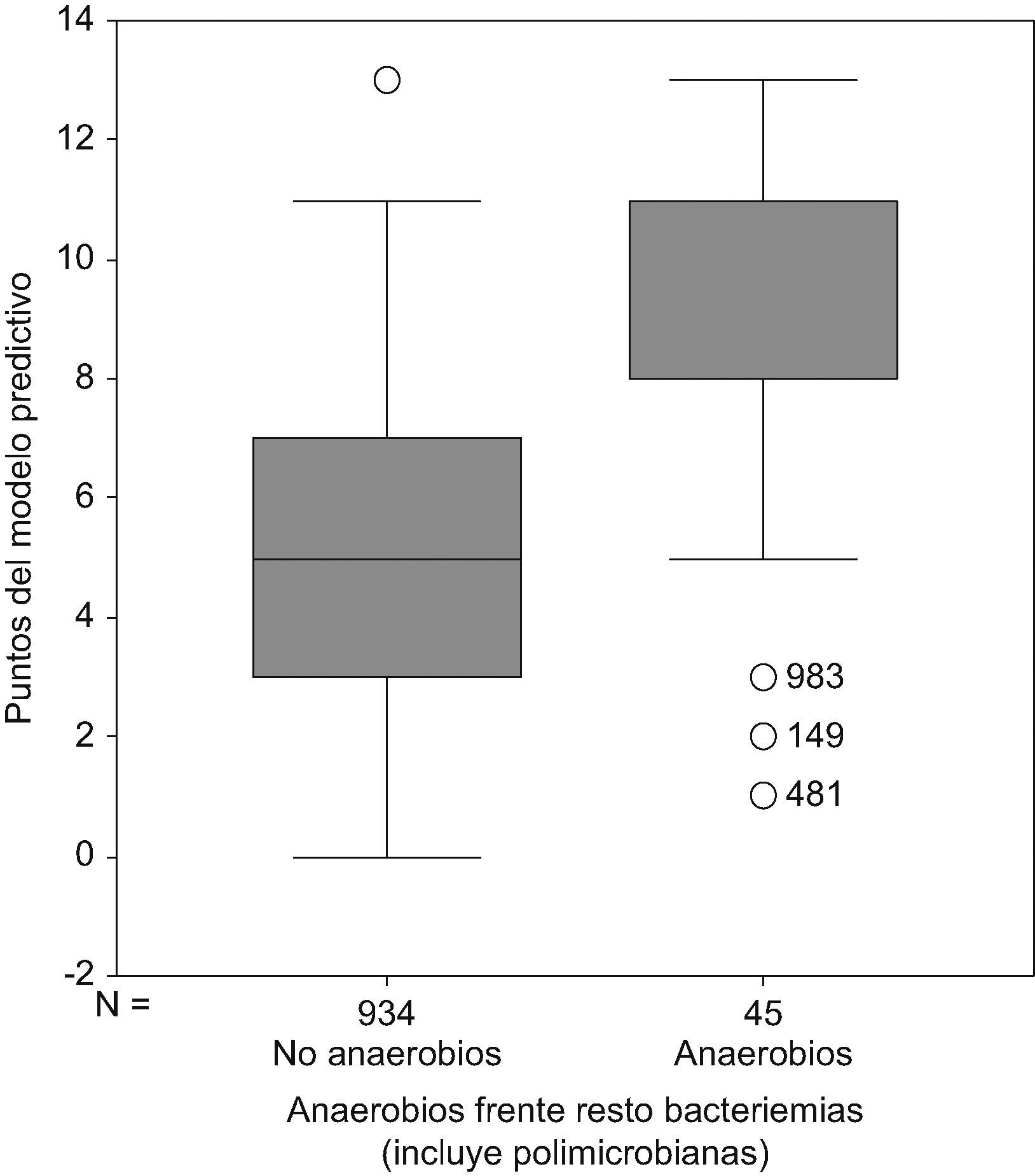
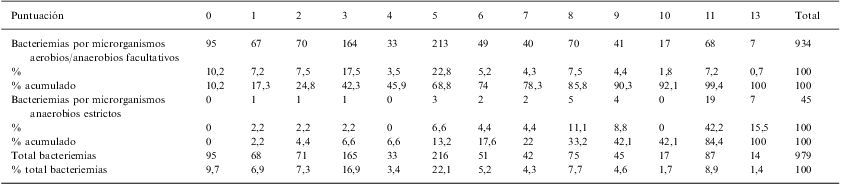
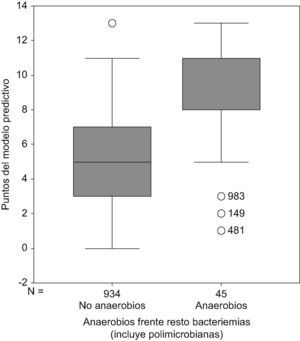
Con la suma de las puntuaciones en función de la presencia de estas variables en cada una de las bacteriemias se estableció una escala de puntuación de 0–13 puntos (tabla 4), en la que en el grupo con puntuación de 0 (ausencia de todas las variables predictivas de bacteriemia por anaerobios estrictos), estaba formado por 95 bacteriemias (10,2% del total), ninguna de ellas por microorganismos anaerobios estrictos; con la puntuación de 11 puntos o más se englobaban un total de 101 bacteriemias de las que 26 lo eran por microorganismos anaerobios estrictos (34,6% de este grupo). Con una suma de 13 puntos el 50% de las bacteriemias estaban causadas por microorganismos anaerobios estrictos (fig. 1).
Puntuaciones obtenidas en el grupo de bacteriemias de la creación del modelo predictivo. Periodo 1985–86 y 1996–97
| Puntuación | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 13 | Total |
| Bacteriemias por microrganismos aerobios/anaerobios facultativos | 95 | 67 | 70 | 164 | 33 | 213 | 49 | 40 | 70 | 41 | 17 | 68 | 7 | 934 |
| % | 10,2 | 7,2 | 7,5 | 17,5 | 3,5 | 22,8 | 5,2 | 4,3 | 7,5 | 4,4 | 1,8 | 7,2 | 0,7 | 100 |
| % acumulado | 10,2 | 17,3 | 24,8 | 42,3 | 45,9 | 68,8 | 74 | 78,3 | 85,8 | 90,3 | 92,1 | 99,4 | 100 | 100 |
| Bacteriemias por microrganismos anaerobios estrictos | 0 | 1 | 1 | 1 | 0 | 3 | 2 | 2 | 5 | 4 | 0 | 19 | 7 | 45 |
| % | 0 | 2,2 | 2,2 | 2,2 | 0 | 6,6 | 4,4 | 4,4 | 11,1 | 8,8 | 0 | 42,2 | 15,5 | 100 |
| % acumulado | 0 | 2,2 | 4,4 | 6,6 | 6,6 | 13,2 | 17,6 | 22 | 33,2 | 42,1 | 42,1 | 84,4 | 100 | 100 |
| Total bacteriemias | 95 | 68 | 71 | 165 | 33 | 216 | 51 | 42 | 75 | 45 | 17 | 87 | 14 | 979 |
| % total bacteriemias | 9,7 | 6,9 | 7,3 | 16,9 | 3,4 | 22,1 | 5,2 | 4,3 | 7,7 | 4,6 | 1,7 | 8,9 | 1,4 | 100 |
Nota: obsérvese que con 0 puntos en el modelo predictivo no hay bacteriemias por anaerobios, que con 13 puntos el 50% de todas las bacteriemias diagnosticadas lo son por anaerobios y que el 78% de todas las bacteriemias por anaerobios tiene más de 7 puntos.
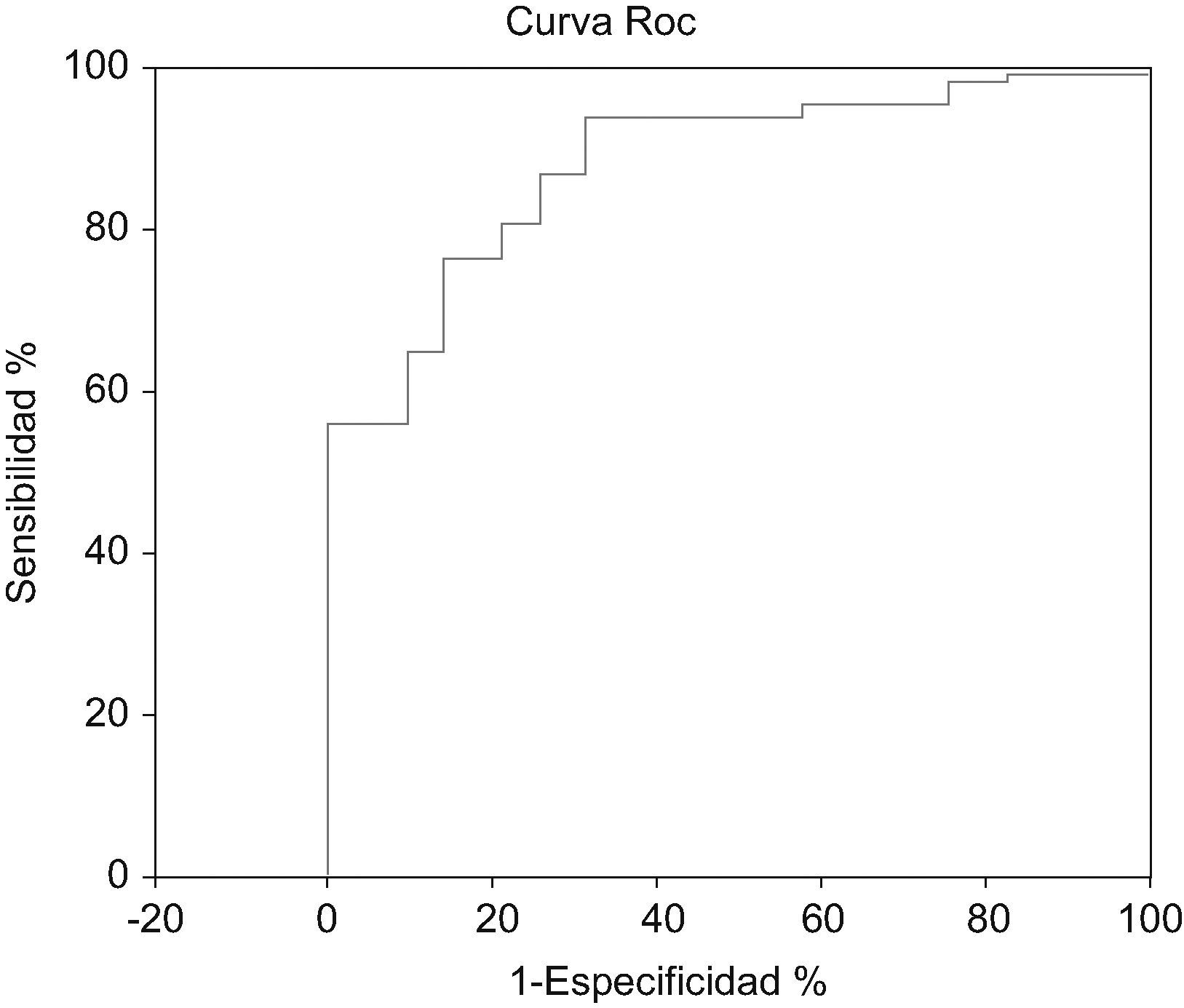
Para una puntuación de más de 7 puntos el modelo tiene una sensibilidad del 77,8% con una especificidad del 78,3% con un VPP (valor predictivo positivo) del 14,7%, y un VPN (valor predictivo negativo) del 98,6%.
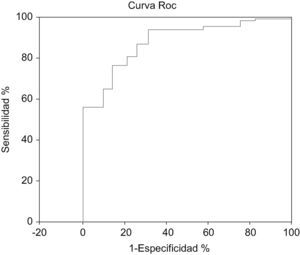
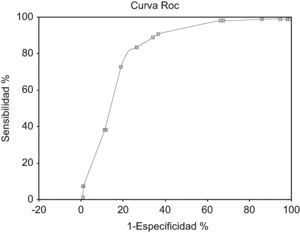
Al realizar la curva ROC se obtuvo un área bajo la curva =0,84 (EE=0,011).
IC 95% exacto: 0,82–0,86 (fig. 2).
B) Validación del modelo predictivo: Total 320 bacteriemias diagnosticadas en los años 2005–06 correspondientes a 299 pacientes.
El modelo predictivo creado con las bacteriemias de los años 1985–86 y 1996–97 se ha aplicado a las bacteriemias diagnosticadas en el Hospital de Fuenlabrada y Fundación Hospital de Alcorcón durante los años 2005–06, y que suponen un total 320 bacteriemias verdaderas en las que se incluyeron 55 bacteriemias por anaerobios estrictos.
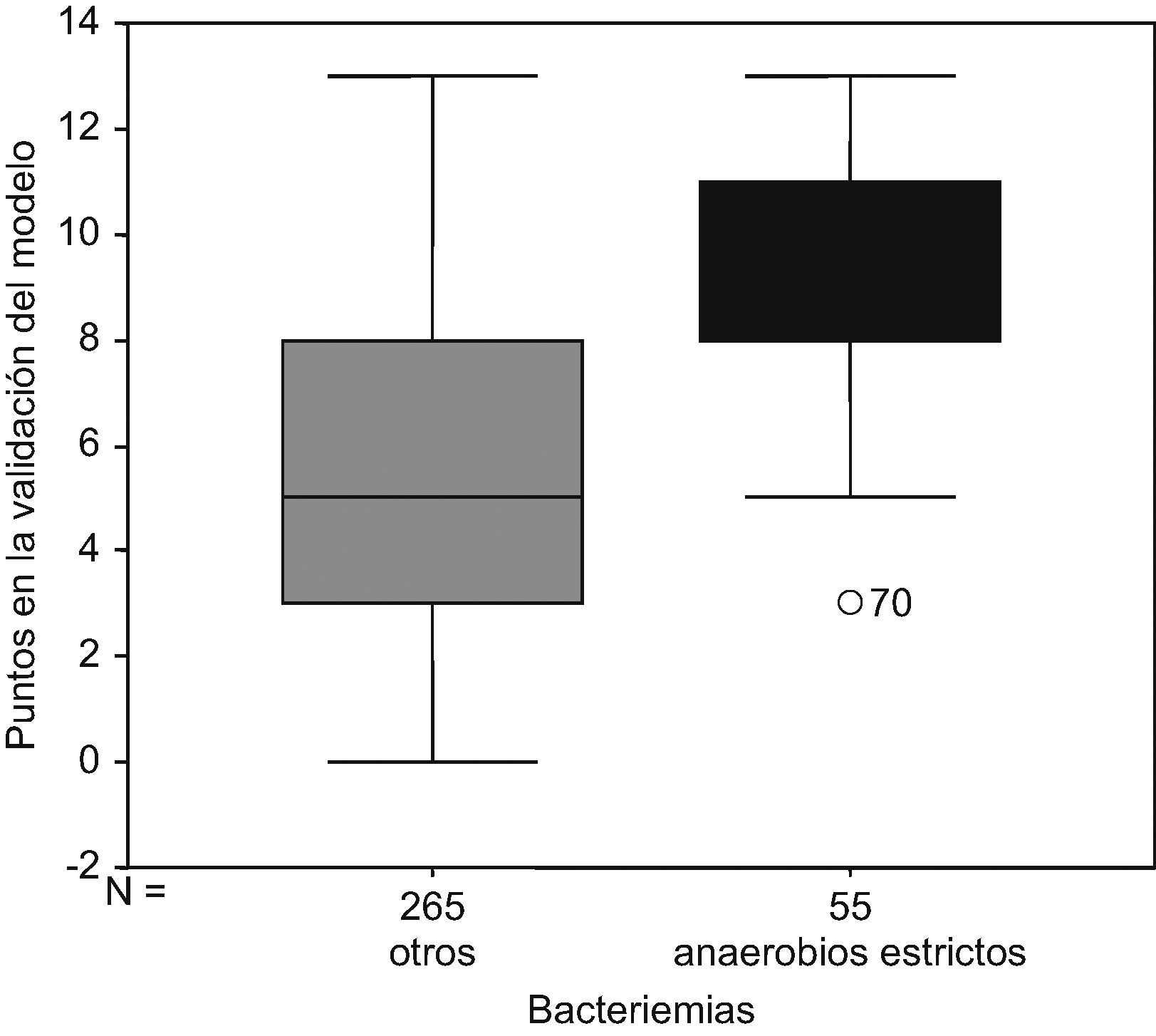
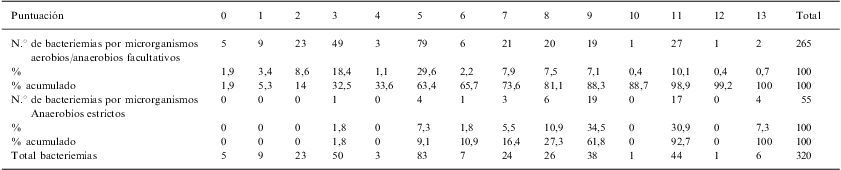
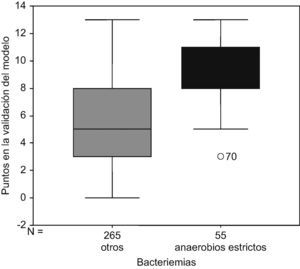
Al aplicar el modelo predictivo sobre las bacteriemias del grupo de validación (320 bacteriemias) se observa que no existen bacteriemias por microorganismos anaerobios estrictos con 0 puntos en el modelo predictivo. El 11,25% de todas las bacteriemias analizadas en la validación del modelo predictivo tenían menos de 3 puntos en el modeo predictivo, y ninguna de ellas fue causada por microorganismos anaerobios estrictos. El 83,4% (IC 95%: 71,19–92,23) de todas las bacteriemias por anaerobios estrictos tenían más de 7 puntos (fig. 3) obteniéndose con este punto de corte una S 83,6%, E 73,6%, VPP 6%, VPN 99,5%. Al aplicar el modelo predictivo exclusivamente sobre las bacteriemias por aerobios y aerobios anaerobios facultativos, se observa que tan solo el 26,4% (IC 95%: 21,2–32,15) de las bacteriemias por aerobios y aerobios-anaerobios facultativos tienen más de 7 puntos. La diferencia entre las proporciones de bacteriemias por anaerobios estrictos con más de 7 puntos y las bacteriemias por aerobios y anaerobios facultativos con más de 7 puntos es estadísticamente significativa Sig <0,05 (tabla 5).
Puntuaciones obtenidas en el grupo de bacteriemias de la validación del modelo predictivo. Periodo 2005–06
| Puntuación | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | Total |
| N.° de bacteriemias por microrganismos aerobios/anaerobios facultativos | 5 | 9 | 23 | 49 | 3 | 79 | 6 | 21 | 20 | 19 | 1 | 27 | 1 | 2 | 265 |
| % | 1,9 | 3,4 | 8,6 | 18,4 | 1,1 | 29,6 | 2,2 | 7,9 | 7,5 | 7,1 | 0,4 | 10,1 | 0,4 | 0,7 | 100 |
| % acumulado | 1,9 | 5,3 | 14 | 32,5 | 33,6 | 63,4 | 65,7 | 73,6 | 81,1 | 88,3 | 88,7 | 98,9 | 99,2 | 100 | 100 |
| N.° de bacteriemias por microrganismos Anaerobios estrictos | 0 | 0 | 0 | 1 | 0 | 4 | 1 | 3 | 6 | 19 | 0 | 17 | 0 | 4 | 55 |
| % | 0 | 0 | 0 | 1,8 | 0 | 7,3 | 1,8 | 5,5 | 10,9 | 34,5 | 0 | 30,9 | 0 | 7,3 | 100 |
| % acumulado | 0 | 0 | 0 | 1,8 | 0 | 9,1 | 10,9 | 16,4 | 27,3 | 61,8 | 0 | 92,7 | 0 | 100 | 100 |
| Total bacteriemias | 5 | 9 | 23 | 50 | 3 | 83 | 7 | 24 | 26 | 38 | 1 | 44 | 1 | 6 | 320 |
Nota: obsérvese que en las bacteriemias por aerobios o aerobios anaerobios facultativos el 73,6% tienen 7 puntos o menos.
Nota: obsérvese que en las bacteriemias por anaerobios estrictos el 16,4% tienen 7 puntos o menos.
Por tanto, el 83,6% de las bacteriemias por anaerobios estrictos tienen más de 7 puntos.
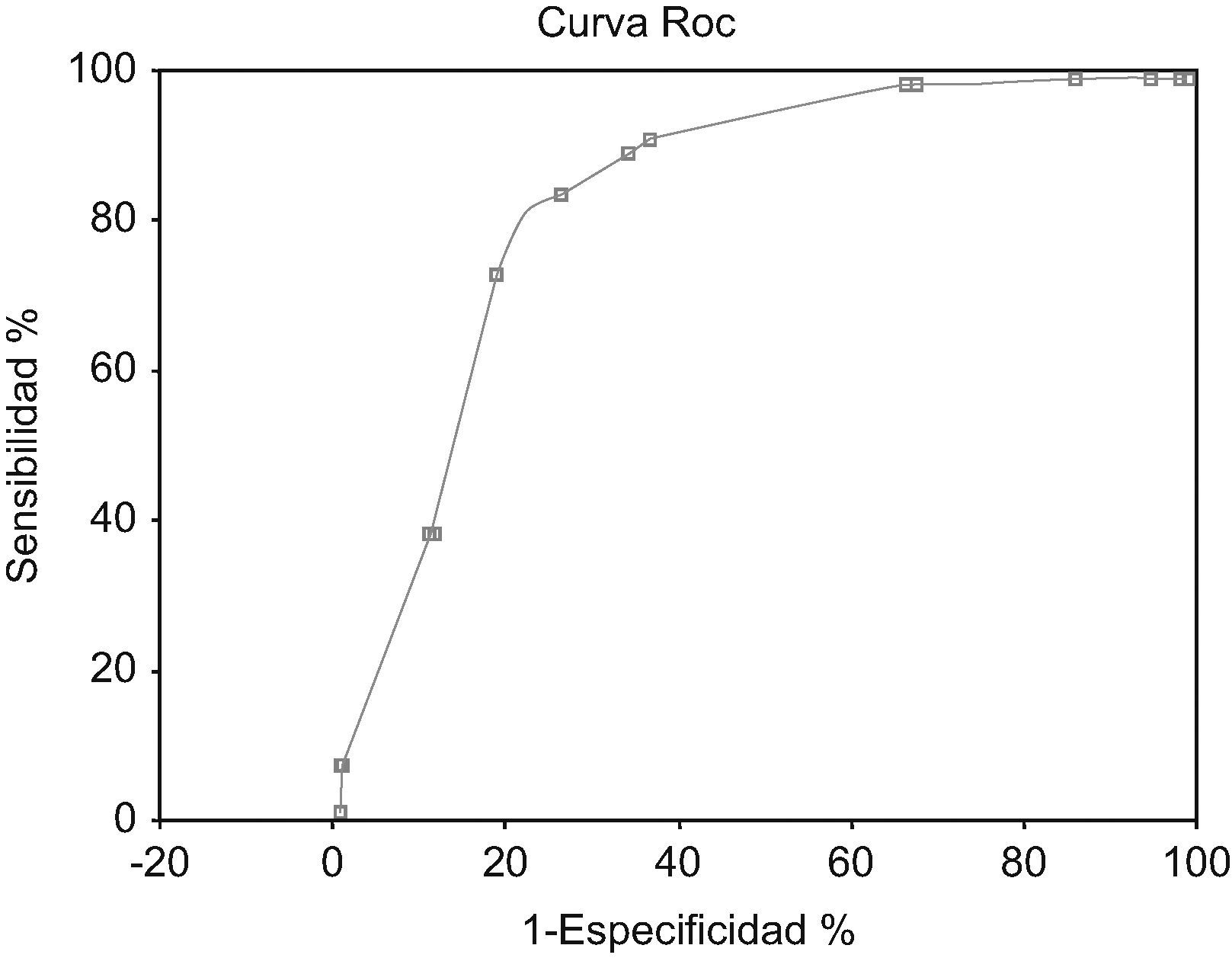
Al calcular el área bajo la curva ROC se obtiene un valor de 0,82 (EE=0,02). IC 95% exacto:0,78–0,86 (fig. 4). Los valores predictivos positivos y negativos se han calculado con una prevalencia estimada en el periodo 2005–06 de bacteriemia por anaerobios estrictos del 2%.
DiscusiónLa utilidad de los medios de cultivo para el diagnóstico de bacteriemias por anaerobios estrictos lleva discutiéndose más de 20 años, sin que hasta el momento exista un consenso sobre su utilización de forma sistemática. Según Lassmann et al27 que compara los periodos 1993–97 y 2000–04, existe un incremento en la frecuencia de los aislamientos de bacterias anaerobias en los hemocultivos. Este incremento, junto con la emergente resistencia a los antimicrobianos y la baja probabilidad de predecir los focos de infección según el investigador justificaría la rutinaria extracción de hemocultivos para anaerobios en centros similares a los que se realizó el estudio.
Por el contrario, otros investigadores proponen el uso de medios de cultivo para anaerobios basados en la presencia o ausencia de factores de riesgo para los mismos1,3,14. Dentro de estos factores de riesgo se han descrito la edad9, la presencia de malignidad (pacientes oncológicos), el antecedente de cirugía o los estados de inmunosupresión28, hecho este último que podría justificar el nuevo repunte de las bacteriemias por anaerobios en los últimos años.
Existen estudios en los que se presentan altos porcentajes de predictibilidad de bacteriemia por anaerobios (84%, 87%, 92%)13,29, aunque en dichos trabajos no se hace referencia a cuántas de las bacteriemias por microorganismos aerobios o aerobios-anaerobios facultativos presentan también esos mismos factores de predictibilidad, e incluso analizando más allá, sin saber cuántos pacientes a los que se les extraen hemocultivos presentan también dichos factores potencialmente predictores de una bacteriemia por anaerobios. En dichos estudios se menciona el origen abdominal de la mayoría de dichas bacteriemias por microorganismos anaerobios estrictos (64%)30, oscilando en otros trabajos entre 42–65%13 .En el trabajo aquí presentado el origen abdominal está presente en el 14,5% de todas las bacteriemias diagnosticadas (984), siendo en las bacteriemias por anaerobios el foco en 25 casos (54,3%) del total de las bacteriemias por anaerobios estrictos. El foco de origen desconocido también ha sido descrito como relacionado con bacteriemias por anaerobios estrictos hasta en el 16% de las mismas30, y en nuestro caso supone el origen en 171 casos, 6 de ellos por anaerobios (13% de todas las bacteriemias por anaerobios estrictos).
El modelo predictivo que se ha presentado en el estudio tiene una alta sensibilidad con un altísimo VPN. Con una puntuación de 0 puntos (e incluso con menos de 3 puntos en la validación del modelo), la probabilidad de presentar una bacteriemia por anaerobios es nula. Este grupo de pacientes con 0 puntos en el modelo predictivo supone en torno al 10% del total de la población con bacteriemia diagnosticada analizada. Sin embargo su VPP es bajo debido fundamentalmente a la baja prevalencia de las bacteriemias por anaerobios estrictos. Sabemos que el VPP de una prueba disminuye a medida que la prueba diagnóstica se aplica a poblaciones con prevalencia de enfermedad más baja, como es el caso en general de las bacteriemias por anaerobios estrictos.
Bien es verdad que esta última afirmación probablemente habría que matizarla, en el sentido de que la prevalencia de bacteriemia por anaerobios es variable según las distintas áreas hospitalarias, siendo más frecuentes en áreas quirúrgicas o ginecológicas que en áreas como las unidades de cuidados intensivos médicas donde su prevalencia es francamenten baja25. En cualquier caso el altísimo VPN del modelo se mantiene en todas esas unidades, y probablemente el VPP del modelo variaría según la unidad hospitalaria en la que se sospeche la bacteriemia.
En resumen, en virtud de los resultados obtenidos y, atendiendo exclusivamente al criterio de predictibilidad de bacteriemia por anaerobios, se podría plantear la suspensión de los medios de cultivo para anaerobios estrictos en los pacientes con las siguientes características: paciente con edad inferior a 60 años, sin hipotensión, con foco de bacteriemia distinto al abdominal, piel y partes blandas o desconocido, y con manipulaciones vasculares en la última semana previa al diagnóstico de bacteriemia teniendo en cuenta que habría que substituirlo por un volumen similar procesado en medio de cultivo en aerobiosis.
En cuanto a la validación del modelo predictivo se confirma que de forma significativa la puntuación obtenida es superior en las bacteriemias por anaerobios estrictos que en las bacteriemias por aerobios y aerobios-anaerobios facultativos. Así, una vez aplicado el modelo la primera pregunta que habría que responder es qué punto de corte de puntuación del modelo predictivo emplearíamos para tomar la decisión de extraer o no hemocultivos para anaerobios, sabiendo además que lo haríamos sobre bacteriemia sospechada, manejándonos con una prevalencia de bacteriemia por anaerobios en torno al 1,5 por mil hemocultivos extraídos (en la creación del modelo la prevalencia se encontraba en torno al 2 por mil). Por debajo de 3 puntos el VPN es prácticamente del 100%, y por encima de 7 puntos se diagnosticarían el 80% de todas las bacteriemias por anaerobios estrictos.
Una segunda pregunta a realizarse sería qué supondría perder ese 20% de bacteriemias por anaerobios sin diagnosticar si establecemos la puntuación de referencia de más de 7 puntos para tomar la decisión de extraer o no hemocultivos para anaerobios, que aunque poco prevalentes, podrían tener implicaciones diagnósticas y terapeúticas. Posiblemente poca, dado que se trataría de un número bajo de bacteriemias, la mayor parte cubierta empíricamente con antibioterapia de amplio espectro, y en muchas ocasiones con cuadros abdominales que precisan de un tratamiento quirúrgico curativo15–17. Existen además otras muestras cultivables en las que pueden crecer microorganismos anaerobios causantes de dichos cuadros.
Una tercera pregunta que surgiría a raíz de la posible suspensión de los medios de cultivo para anaerobios estrictos es qué supondría en cuanto a la rentabilidad diagnóstica del hemocultivo el procesar los 20–30ml de sangre recomendados en la extracción de hemocultivos solo en aerobiosis, frente a la clásica recomendación de 15ml en aerobiosis y otros 15ml en anaerobiosis. Probablemente la respuesta a esta pregunta deba de darse de forma individualizada y según el área hospitalaria en la que nos encontremos, valorando si los microorganismos existentes tienen crecimiento preferencial en aerobiosis o no.
En conclusión, la importancia del estudio presentado radica en que su realización y validación se han realizado en tiempos y centros hospitalarios distintos, lo que aumenta la potencia de los resultados. El modelo predictivo presentado tiene un área bajo la curva ROC de 0,84 (IC 95%: 0,82–0,86), y se confirma en la validación del mismo con un área bajo la curva ROC de 0,82 (IC 95%: 0,78–0,86). Un modelo predictivo útil debe tener un área bajo bajo la curva mayor de 0,7 y se considera que es un buen resultado cuando es mayor de 0,827. Dada la baja prevalencia de bacteriemia global por anaerobios estrictos su utilidad inicial radica en el alto VPN de los resultados (probabilidad nula de tener una bacteriemia por anaerobios con una puntuación de 0 puntos y probablemente por debajo de 3 puntos) y en su buena sensibilidad (con más de 7 puntos: sensibilidad del 77,8% con una especificidad del 78,3% con un VPP del 14,7%, y un VPN del 98,6%).
El inconveniente fundamental del estudio es que el modelo predictivo se ha realizado sobre bacteriemia diagnosticada y no sobre bacteriemia sospechada. Al aplicar el modelo sobre bacteriemia sospechada como ya se ha mencionado, la prevalencia de bacteriemias por anaerobios estrictos disminuye mucho más y, por tanto, el VPP también.
La decisión final de la suspensión de los medios de cultivo para anaerobios, pasando a procesar todo el volumen de sangre extraído en aerobiosis, dependerá primero, de la predictibilidad de la bacteriemia por anaerobios estrictos, negativa muy alta y predictibilidad positiva baja por la baja prevalencia de las mismas, modificándose este último valor en función del área hospitalaria en la que nos encontremos. Segundo, dependerá del criterio médico para la extracción general de hemocultivos, hecho que también modificará la prevalencia de bacteriemia por anaerobios sobre bacteriemia sospechada, y tercero dependerá de los microorganismos no anaerobios estrictos causantes de bacteriemia según la unidad hospitalaria en la que nos encontremos, ya que dichos microorganismos pueden presentar crecimiento preferente en aerobiosis como es el caso de los bacilos gram negativos no fermentadores, u hongos frecuentes en las unidades de cuidados intensivos, o bien crecimiento en anaerobiosis como es el caso de las enterobacterias (Escherichia coli, el más frecuente en las urgencias hospitalarias). Estos son los puntos que habrá que definir en posteriores trabajos para clarificar definitivamente la necesidad de extracción y procesamiento de hemocultivos en anaerobiosis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Hospital Universitario de Fuenlabrada: Juan Victor San Martín; Noemí Cabello; Ana Barrios; Juan Hinojosa; Antonio Zapatero.
Hospital Universitario de la Princesa: Alberto Pizarro; Felix La Hulla; Julia Mendez; Mercedes Fernandez; Fernando Hernandez; Isabel Hernandez; Juan Álvarez.
Hospital Universitario Fundación de Alcorcón: Juan Emilio Losa.