*La relación de hospitales que han contestado la encuesta se encuentra al final del texto. La información incluida en este artículo se ha presentado en el 33rd European Symposium on Clinical Pharmacy (ESCP), Praga, octubre 2004.
Introducción
En el tratamiento de infecciones graves, tradicionalmente, se ha recomendado la determinación de concentraciones plasmáticas de aquellos antibióticos con un margen terapéutico estrecho, en los que las concentraciones terapéuticas se aproximan a las tóxicas. Esta situación se produce, sobre todo, en el caso de los aminoglucósidos y vancomicina 1. Sin embargo, en los últimos años, se ha demostrado la importancia clínica de diferentes relaciones farmacodinámicas que se establecen entre las concentraciones plasmáticas de los antibióticos y la concentración inhibitoria mínima (CIM) de las bacterias como son la relación entre la concentración máxima plasmática y la CIM, el área bajo la curva y la CIM y el tiempo durante el cual la concentración plasmática se encuentra por encima de la CIM 2. La obtención de unos cocientes determinados de los diferentes indicadores se ha asociado con una mayor efectividad del antibiótico (aumento del poder bactericida y la lisis de las bacterias, así como una disminución de la aparición de cepas multirresistentes) 3-7. La indicación de la monitorización de concentraciones plasmáticas se podría ampliar en los próximos años a la mayoría de antibióticos utilizados en el tratamiento de infecciones graves y en especial en aquellos casos que cursan con mala evolución a pesar de recibir un tratamiento antibiótico adecuado.
En los pacientes críticos ingresados en servicios o unidades de cuidados intensivos (UCI) la determinación de concentraciones plasmáticas de antibióticos y el ajuste de dosis se justifica por la frecuente presencia de alteraciones hemodinámicas, insuficiencia renal y/o hepática, edemas generalizados y otras complicaciones que interfieren la distribución o eliminación de los antibióticos 8. Estos pacientes, en especial los quirúrgicos complicados, quemados, en ventilación mecánica y los cardiópatas descompensados, pueden presentar un importante aumento del volumen de distribución corporal, lo que influye en las concentraciones plasmáticas y/o tisulares alcanzadas 9. La inestabilidad hemodinámica y la insuficiencia renal así como la administración de fármacos que alteran el comportamiento farmacocinético (dopamina, furosemida) condicionan, así mismo, la eliminación de los antibióticos 10. Estas características modifican su comportamiento farmacocinético y justifican la amplia variabilidad interindividual en las concentraciones séricas obtenidas cuando se administran dosis similares.
Los escasos datos clínicos publicados hasta el momento en el área de la farmacocinética presentan importantes variaciones en los resultados que expresan las divergencias en los métodos utilizados en la monitorización de los fármacos (dosis administradas, extracción de muestras, proceso técnico), así como en la interpretación de los resultados. El Grupo de Estudio de Infección del Paciente Crítico de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (GEIPC-SEIMC) ha diseñado una encuesta para conocer el grado de desarrollo y las características de la monitorización de concentraciones plasmáticas de antibióticos en los hospitales españoles, como primer paso para proponer unas normas de actuación comunes en el ámbito de los pacientes críticos ingresados en UCI. Para su desarrollo se ha solicitado la colaboración de la Sociedad Española de Farmacia Hospitalaria (SEFH) y del Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (GTEI-SEMICYUC).
Material y métodos
Se trata de un estudio observacional y multicéntrico. Para la recogida de información se elaboró un cuaderno de recogida de datos en la que se incluyó información del hospital, antibióticos que se monitorizaban, día de la obtención de las muestras, técnicas utilizadas así como los procedimientos aplicados para el ajuste de dosis. Para su elaboración se ha contado con la participación de especialistas de Enfermedades Infecciosas, Medicina Intensiva, Microbiología y Farmacia Hospitalaria. La encuesta fue incluida en las webs de las tres sociedades participantes con la recomendación de las juntas directivas de las mismas para su cumplimentación. Las respuestas podían ser remitidas por correo electrónico o convencional. No se realizó una selección aleatoria de los hospitales, sino que se consideraron los hospitales generales de más de 150 camas incluidos en la Guía de Hospitales de España 11 como potenciales respondedores de la encuesta (221 hospitales). No se realizó ninguna auditoría para comprobar la veracidad de las respuestas.
Los hospitales se clasificaron atendiendo a su influencia en su entorno como: a) hospital general de referencia; b) hospital general, y c) hospital comarcal. Así mismo, se ha clasificado como docente cuando participaba en la formación de estudiantes de pregrado. Para cada uno de los antibióticos estudiados se solicitó información sobre el número de muestras analizadas en el año 2002 y el servicio que realizaba la técnica analítica, y se clasificaron éstos en servicios de Bioquímica, Farmacia, Farmacología, centros externos y otros servicios. Así mismo se incluyeron datos sobre el analizador utilizado para determinar las concentraciones, los tiempos de respuesta, métodos de ajuste de dosis y medios utilizados para la notificación de los niveles y del ajuste realizado.
Respecto al análisis estadístico, las variables cualitativas se describieron mediante la distribución de frecuencias de cada una de las categorías. Las variables cuantitativas se describieron con la media y el intervalo de confianza del 95 % (IC 95%).
Resultados
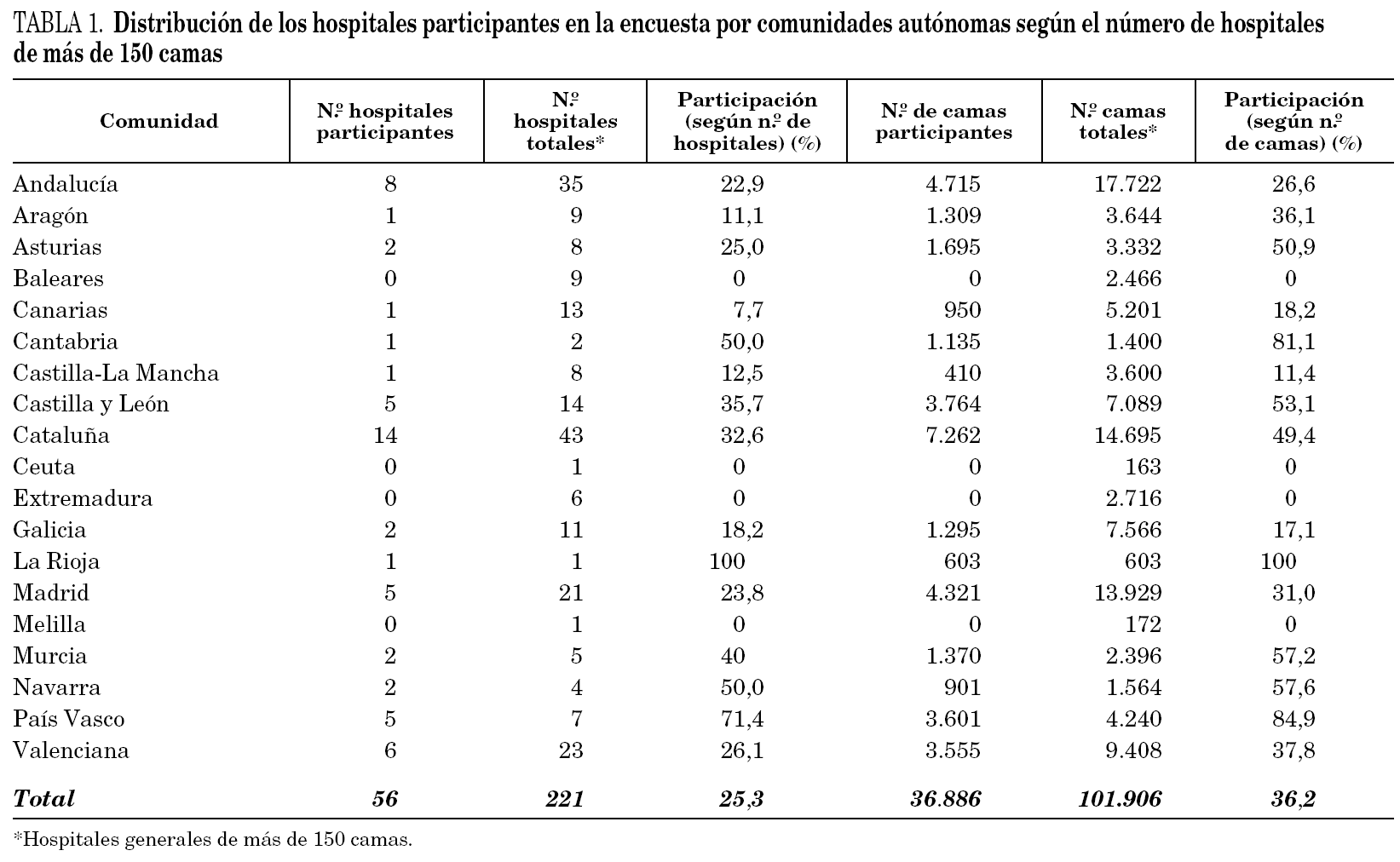
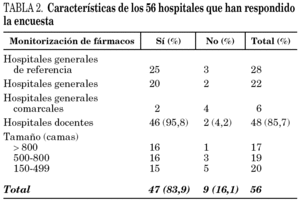
Se obtuvo información de 56 hospitales correspondientes a un total de 36.886 camas, de las que 933 (2,5%) eran de pacientes críticos. Los hospitales participantes representaron el 25,3% de los hospitales posibles, mientras que las camas incluidas alcanzaron el 36,2% del total de las censadas en los centros de más de 150 camas. La media del número de camas de los hospitales estudiados fue de 659 (IC 95%: 570-748). En la tabla 1 se incluye su distribución por comunidades autónomas. La mayor participación se ha producido en hospitales con más de 500 camas (32 de 74, 43,24%). En 48 casos (85,7%) los hospitales que contestaron la encuesta eran docentes.
En 47 hospitales (83,9%) se realizan determinaciones de concentraciones de uno o más antibióticos. Los hospitales que no disponían de ningún medio para la determinación de concentraciones de antibióticos atienden 4.084 camas (11,1% del total de camas participantes). En la tabla 2 se incluyen las características diferenciales entre los hospitales que realizan o no determinaciones de antibióticos.
Los antibióticos monitorizados con más frecuencia en los hospitales estudiados han sido vancomicina en 47 (83,9%), amikacina en 41 (73,2%) y gentamicina en 40 (71,2%). En la tabla 3 se especifican los servicios en los que se realizan dichos análisis. En el año 2002, se ha estimado que, en los hospitales encuestados, se han analizado 14.139 muestras para determinar concentraciones de vancomicina (media por hospital de 393; IC 95%: 224-562), seguido de la determinación de amikacina con 6.494 muestras (media por hospital de 203; IC 95%: 80-326) y de gentamicina con 6.437 (media por hospital de 201; IC 95%: 97-306) ocupando el último lugar tobramicina con 3.152 muestras (media por hospital de 121; IC 95%: 56-186). La monitorización de otros antibióticos es prácticamente nula.
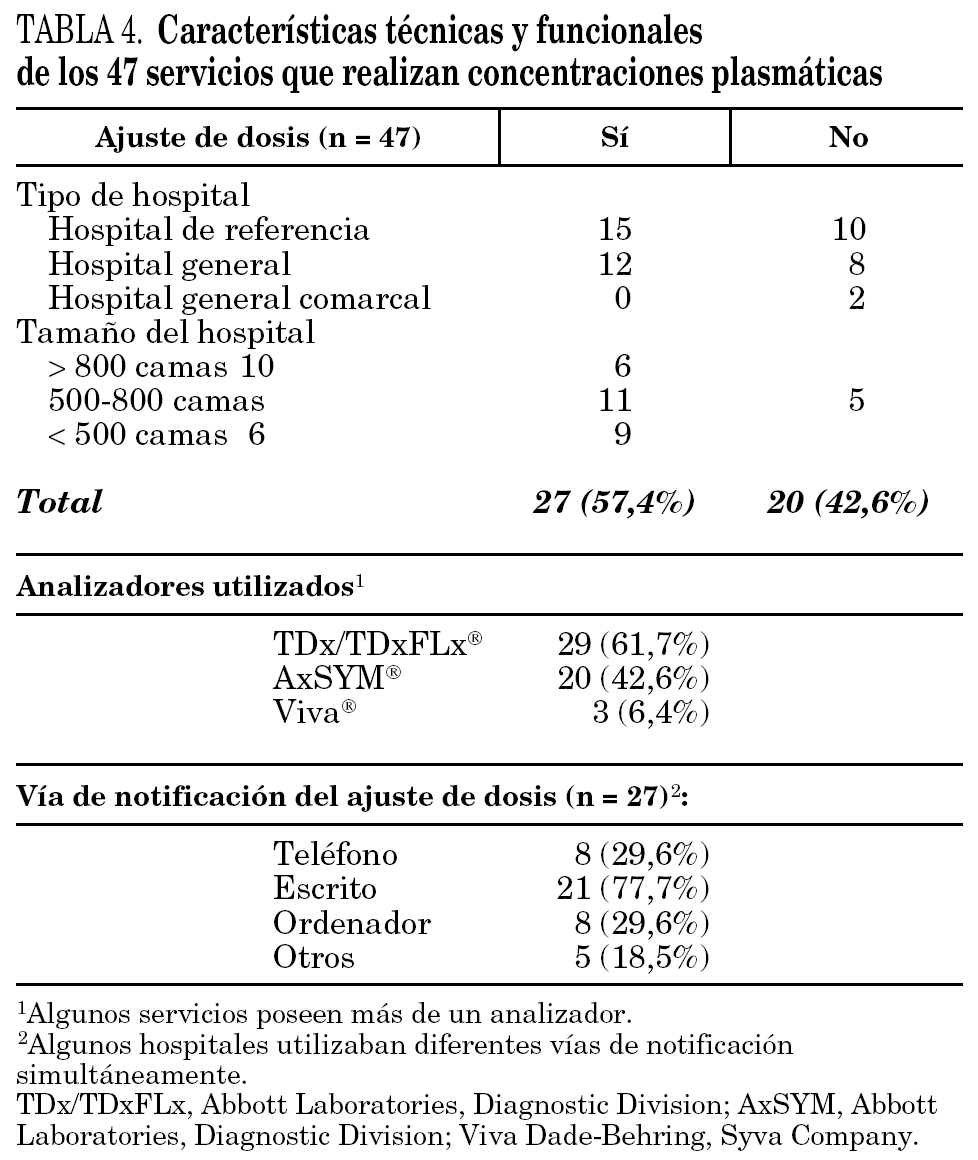
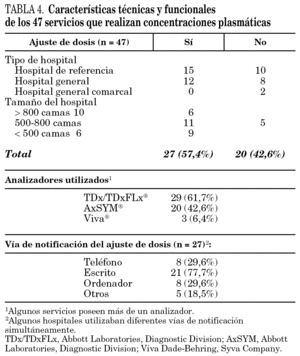
Las características técnicas y funcionales de los distintos servicios que realizaba la monitorización de concentraciones de antibióticos se incluye en la tabla 4. En el 34,0% de los casos los análisis se han realizado en servicios de Bioquímica, el 25,5% en servicios de Farmacia y el 8,5% en servicios de Farmacología; el resto corresponde a otros servicios o centros externos.
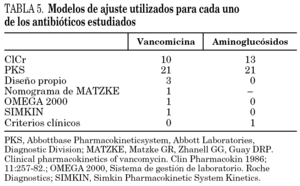
El analizador más utilizado ha sido el TDx/TDxFLx (61,7%) y únicamente el 57,4% de los servicios que determinan las concentraciones de los antibióticos efectúan ajustes de dosificación relacionados con los resultados obtenidos. En los casos en los que se han ajustado las dosis de antibióticos cuando las concentraciones no se consideraban adecuadas se han utilizado ocho modelos de ajuste distintos, de los que el más frecuente es el basado en el Abbottbase Pharmacokineticsystem (PKS) (Abbott Laboratories. Diagnostic Division) y en el aclaramiento de creatinina (tabla 5).
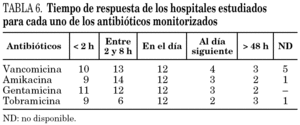
El método más utilizado para informar sobre los resultados y proponer el ajuste de la dosificación es la comunicación escrita, aunque varios hospitales utilizaban diferentes vías de notificación de manera simultánea. Los tiempos de respuesta de los distintos laboratorios para cada una de los antibióticos determinados se incluyen en la tabla 6. Predominan las respuestas rápidas (en el día de la extracción de la muestra), en especial para aquellos antibióticos en los que es más frecuente su monitorización.
Discusión
A pesar de que la encuesta tuvo el apoyo de tres de las sociedades científicas implicadas en la monitorización de fármacos, el número de hospitales que la cumplimentaron fue muy bajo. Esta situación podría atribuirse a que los hospitales que no han contestado la encuesta no realizan monitorización de forma rutinaria o simplemente no fue posible contactar con algún profesional de dichos centros responsable de la monitorización de fármacos.
Pese a la reducida proporción de hospitales que respondieron a la encuesta, cabe destacar que casi la mitad de los de más de 500 camas cumplimentaron la información solicitada. Estos hospitales representan la mitad del número total de camas correspondientes al Sistema Nacional de Salud. En cuanto al número de camas destaca la participación de las comunidades de La Rioja, País Vasco, Cantabria, Navarra y Comunidad de Murcia. Ello se ha debido, en parte, a la participación en el estudio de los hospitales generales de referencia de dichas comunidades y a la existencia de un menor número de hospitales con menos de 500 camas, los cuales han sido los que menos han respondido a la encuesta.
La mayoría de hospitales que han contestado la encuesta realizan una o más técnicas de monitorización plasmática de antibióticos. Sin embargo, un número considerable de pacientes ingresados en hospitales de agudos no tienen la posibilidad de beneficiarse del ajuste de dosis utilizando técnicas de monitorización, lo que supone una limitación en la calidad de su atención. De los resultados de la encuesta se desprende que los hospitales de menos de 500 camas, no docentes y comarcales son los menos implicados en la monitorización farmacocinética de antibióticos. El perfil de este tipo de hospital es el más frecuente en la red de hospitales españoles y el que menos ha respondido a la encuesta, por lo que el número de pacientes hospitalizados que no dispone de sistemas de monitorización de fármacos podría ser mucho mayor. Estos hospitales deberían concertar, con centros o laboratorios de referencia, la posibilidad de realizar estudios farmacocinéticos en los pacientes de mayor riesgo o con efectos adversos potencialmente relacionados con los antibióticos administrados.
El hecho de que vancomicina haya sido el antibiótico más monitorizado podría hacer pensar que se ha debido a que se ha prescrito más. Esta situación es discordante con los datos de un estudio español de consumo hospitalario de antibióticos 12 que situó tanto gentamicina como tobramicina por encima del observado para vancomicina. Por otro lado, la masiva utilización de los aminoglucósidos en una sola dosis diaria podría justificar la menor tendencia a monitorizar dichos fármacos ya que este régimen de dosificación se ha relacionado con una menor nefrotoxicidad 13.
Pocos hospitales efectúan la monitorización de los antibióticos con el objetivo de predecir eficacia o evitar la aparición de flora emergente o multirresistente. El conocimiento de las relaciones farmacodinámicas entre las CIM de los patógenos responsables de infecciones graves y las concentraciones máximas plasmáticas o el área bajo la curva serán, en un futuro próximo, una herramienta importante para optimizar el tratamiento de infecciones, en especial en pacientes críticos en los que es frecuente la selección de flora emergente o multirresistente. Estas variables farmacodinámicas deberán ser monitorizadas en pacientes seleccionados, con el compromiso de disponer de una respuesta rápida para modificar y ajustar la posología de los diferentes antibióticos.
En los últimos años la investigación de nuevos antibióticos se ha visto frenada por diferentes motivos. De manera paralela, se conoce la progresiva aparición de cepas de microorganismos habituales con CIM cada vez más altas, lo que obliga a la administración de los antibióticos disponibles en dosis elevadas. Es probable que en los próximos años se produzca una ampliación de la monitorización a otros grupos de antibióticos, que precisan de tecnología más compleja, con un consumo de recursos muy superior y con la necesidad de disponer de personal con formación mucho más especializada.
El analizador utilizado con preferencia para cuantificar las concentraciones de los antibióticos fue el TDx, seguido del AxSYM (ambos mediante técnica de inmunoensayo de polarización de fluorescencia FPIA). Estos analizadores son fáciles de manejar y disponen de reactivos comercializados para la mayoría de fármacos monitorizados en los hospitales. Sin embargo, no es posible emplearlos para la monitorización de otros antibióticos, como cefalosporinas, carbapenémicos o quinolonas.
La efectividad de las técnicas de monitorización de antibióticos reside en la posibilidad de obtener una respuesta en un plazo corto de tiempo (< 24 h), lo que se consigue en la mayoría de los hospitales para los antibióticos más frecuentemente monitorizados. La rápida respuesta permite realizar con rapidez un ajuste de dosis. Sin embargo, sólo la mitad de los servicios que realizan determinaciones plasmáticas proporcionan un posterior informe farmacocinético con la propuesta de ajuste de dosis individualizada. La determinación plasmática como única herramienta de la obtención de niveles terapéuticos y/o tóxicos carece de utilidad, ya que pueden dar lugar a una interpretación incorrecta si lo que se pretende es un simple ajuste a un rango terapéutico establecido incluido habitualmente en guías clínicas 14. Para una correcta monitorización debe considerarse un elevado número de factores que pueden afectar a la evolución de las concentraciones plasmáticas (paciente crítico, extracción previa al estado estacionario, localización de la infección, intravariabilidad de los grados de insuficiencia renal y/o hepática, asociación con fármacos vasoactivos, ventilación mecánica, presencia de edemas, etc.). Es posible que los servicios de Bioquímica no propongan ajustes de dosis, ya que, en su mayor parte, se limitan a la realización de la técnica, al igual que la de otros análisis realizados en dicho servicio, y dejan a los médicos la responsabilidad de decidir el ajuste de dosis.
La principal limitación de nuestro estudio reside en la falta de respuesta de un gran número de hospitales, en especial de los que disponen de un número menor de camas, que son, por otra parte, los que carecen con más frecuencia de la posibilidad de monitorizar concentraciones plasmáticas de antibióticos. La ausencia de respuesta de estos hospitales puede enmascarar los datos que se presentan en este estudio y ser mucho mayor la tasa de hospitales y el número de camas de hospitalización que no disponen de esta técnica de monitorización.
La principal aportación de este estudio observacional ha sido la de demostrar que existe una importante variabilidad en las distintas fases de la monitorización de concentraciones plasmáticas de antibióticos (analizadores, transmisión de la información, programas de ajuste de dosis). Todo ello dificulta la interpretación de los resultados y la posibilidad de comparar datos entre hospitales. De ello se deduce la necesidad de consensuar, con todos los servicios implicados en esta área técnica, un conjunto de recomendaciones para homogeneizar, en la medida de lo posible, la monitorización plasmática de antibióticos. Así mismo deben aplicarse las medidas necesarias para extender la monitorización de antibióticos a la totalidad de centros hospitalarios de nuestro país que atienden pacientes agudos.
Agradecimientos
A la Dra. Marta Pulido por su ayuda en la elaboración del manuscrito.
Relación de hospitales que han contestado la encuesta
Clínica Universitaria de Navarra (Pamplona); Complejo Asistencial de Burgos; Complejo Hospitalario de Jaén; Complejo Hospitalario de León; Complejo Hospitalario de Pontevedra; Complejo Hospitalario de Segovia; Complejo Hospitalario Nuestra Señora de Valme (Sevilla); Complejo Hospitalario San Millán-San Pedro (Logroño); Complejo Hospitalario Virgen de la Victoria (Málaga); Complejo Hospitalario Virgen Macarena (Sevilla); Complejo Hospitalario Xeral-Calde (Lugo); Consorcio Hospital General Universitario de Valencia; Corporació Sanitaria Parc Taulí, Sabadell (Barcelona); Hospital Arnau de Vilanova (Lérida); Hospital Central de Asturias (Oviedo); Hospital Clínic i Provincial de Barcelona; Hospital Clínico Universitario de Valladolid; Hospital Clínico Universitario (Valencia); Hospital de Basurto (Bilbao); Hospital de Cruces (Bilbao); Hospital de Donostia (Vizcaya); Hospital de Figueres (Gerona); Hospital de Galdakao (Vizcaya); Hospital de la Merced (Osuna, Sevilla); Hospital de la Santa Creu i Sant Pau (Barcelona); Hospital de L'Esperança (Barcelona); Hospital de Navarra (Pamplona); Hospital de Palamós (Gerona); Hospital de Sant Pau i Santa Tecla (Tarragona); Hospital General de Castellón; Hospital General de Granollers (Barcelona); Hospital General Universitario de Alicante; Hospital General Universitario de Elche (Alicante); Hospital General Universitario (Guadalajara); Hospital Infanta Elena (Huelva); Hospital Juan Ramón Jiménez (Huelva); Hospital Morales Meseguer (Murcia); Hospital Nuestra Señora de Candelaria (Santa Cruz de Tenerife); Hospital Ramón y Cajal (Madrid); Hospital San Juan de Dios (Sevilla); Hospital Santiago Apóstol (Vitoria); Hospital Universitari Joan XXIII (Tarragona); Hospital Universitario de Bellvitge (L'Hospitalet de Llobregat, Barcelona); Hospital Universitario de Getafe (Madrid); Hospital Universitario de La Princesa (Madrid); Hospital Universitario de Salamanca; Hospital Universitario del Mar (Barcelona); Hospital Universitario Doctor Peset (Valencia); Hospital Universitario Germans Trias i Pujol (Badalona, Barcelona); Hospital Universitario La Paz (Madrid); Hospital Universitario Marqués de Valdecilla (Santander); Hospital Universitario Miguel Servet (Zaragoza); Hospital Universitario Príncipe de Asturias (Alcalá de Henares, Madrid); Hospital Universitario Virgen de la Arrixaca (Murcia); Hospital Valle de Nalón (Langreo, Asturias); Hospital Vall d'Hebron (Barcelona).
Correspondencia: Dr. F. Álvarez-Lerma.
Servicio de Medicina Intensiva. Hospital del Mar.
P.º Marítimo, 25-29. 08003 Barcelona. España.
Correo electrónico: Falvarez@imas.imim.es
Manuscrito recibido el 9-3-2005; aceptado el 9-5-2005.