Introducción
El tratamiento antirretroviral de gran actividad (TARGA) representó una revolución en el tratamiento de los pacientes con infección por el virus de la inmunodeficiencia humana (VIH), con una importante disminución de la mortalidad y de la incidencia de enfermedades oportunistas. A pesar del indudable beneficio clínico obtenido, del 20 al 50% de los pacientes que inician TARGA presentan fracaso virológico el primer año de tratamiento y la incidencia de fracasos aumenta rápidamente en sucesivos tratamientos1-5. El fracaso del tratamiento se relaciona con múltiples factores, relacionados con el paciente, con el virus o con los fármacos utilizados6. La importancia de alcanzar una concentración terapéutica de los fármacos en el lugar donde se produce la multiplicación del virus para obtener una adecuada respuesta virológica es incuestionable. Si la concentración es superior a la que se necesita para inhibir al virus, se producirá una supresión de la replicación viral y se evitará el desarrollo de mutaciones de resistencia. Si la concentración es baja, se producirá una presión selectiva sobre el virus que conducirá al desarrollo de resistencia a uno o varios fármacos y al fracaso virológico. Si, por el contrario, la concentración del fármaco es muy elevada, su toxicidad puede ser mayor. Actualmente, la principal causa de suspensión del tratamiento y un importante factor de mala adherencia terapéutica es la toxicidad farmacológica.
La monitorización de la concentración plasmática de algunos fármacos se ha utilizado desde hace más de 30 años. La introducción de esta disciplina científica en la práctica clínica habitual ha permitido reducir la morbilidad, la mortalidad, los efectos adversos y la estancia hospitalaria de algunos pacientes, aunque sólo es aplicable a un reducido número de fármacos como los anticoagulantes orales, la digoxina, las teofilinas, los aminoglucósidos, la vancomicina, la ciclosporina y otros inmunosupresores o algunos antiepilépticos. En el tratamiento de la infección por VIH se utilizan dosis fijas de medicamentos y la monitorización terapéutica no forma parte de la práctica clínica habitual; sin embargo, los antirretrovirales tienen unas características que los hacen apropiados para la monitorización terapéutica. El valor de ajustar la dosis de los antirretrovirales para mantener unas determinadas concentraciones todavía es controvertido. En los últimos años ha cobrado un especial interés y se ha especulado mucho sobre el papel que puede desempeñar en la optimización del tratamiento antirretroviral (TAR)7-13.
Concepto de monitorización terapéutica de medicamentos
Es una estrategia mediante la cual la dosis de un fármaco se modifica en función de su concentración plasmática, para mantenerla dentro de unos límites terapéuticos previamente definidos, con objeto de mejorar la eficacia terapéutica y/o evitar la toxicidad.
Características necesarias para que la monitorización del fármaco sea potencialmente útil
Posibilidad de determinar la concentración plasmática del fármaco
Se han descrito numerosas técnicas de cromatografía líquida (HPLC) que permiten determinar con gran precisión la concentración plasmática o sérica de todos los inhibidores de la proteasa (IP) y los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) disponibles en la actualidad14-16. Además, en una única cromatografía puede determinarse simultáneamente la concentración de varios fármacos. Aunque sólo se han implementado en algunos grandes hospitales y centros de referencia, son técnicas que pueden realizarse en cualquier laboratorio de análisis clínicos que disponga de un cromatógrafo y tenga personal técnico cualificado. Actualmente, todos los laboratorios pueden participar en un programa internacional de control de calidad para la determinación de las concentraciones de IP y de ITINN17,18. El coste de determinar la concentración de un fármaco es bastante inferior al de otras pruebas que se realizan de manera sistemática en los pacientes con infección por el VIH. Por ejemplo, determinar la concentración mínima (Cmín) de un IP o de un ITINN en un laboratorio externo cuesta de 20 a 30 €.
La determinación de la concentración plasmática de los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) es igualmente factible. Sin embargo, dado que requieren ser fosforilados dentro de las células para ejercer su acción, no existe una buena correlación entre las concentraciones en sangre de la mayoría de estos compuestos y su actividad antirretroviral y/o su potencial toxicidad. Por consiguiente, los ITIAN no son actualmente candidatos para la monitorización terapéutica. El interés de monitorizar las concentraciones de ITIAN, de todos modos, ha servido para conocer que tenofovir incrementa las concentraciones plasmáticas de didanosina hasta el 40-60%; y en función de esta información se ha recomendado reducir las dosis de didanosina en pacientes que reciben tenofovir de forma concomitante.
Amplia variabilidad interindividual de los parámetros farmacocinéticos
Únicamente tiene sentido la monitorización terapéutica cuando la administración de una misma dosis de un fármaco a diferentes pacientes puede dar lugar a concentraciones muy variables. En el caso contrario la concentración del medicamento sería muy predecible y conocer la dosis prácticamente equivaldría a conocer la concentración plasmática.
Actualmente se administran las mismas dosis a todos los pacientes tratados con IP o con ITINN y uno de los problemas bien conocidos es la gran variabilidad interpaciente de sus concentraciones plasmáticas19-27. Es frecuente que el área bajo la curva (AUC), la concentración máxima (Cmáx) o la Cmín varíen hasta más de 10 veces entre diferentes pacientes que reciben la misma dosis. Esta gran variabilidad interpaciente se debe fundamentalmente a diferencias en la actividad de las isoenzimas del sistema citocromo P450 y de las proteínas transportadoras o bombas de eflujo (glucoproteína P, etc.) responsables de la absorción y del metabolismo de los IP y de los ITINN28-32. Otros factores como peso, edad, presencia de hepatopatía crónica e interacciones con otros fármacos también pueden tener un papel importante.
Incluso cuando se administran pequeñas dosis de ritonavir para inhibir el citocromo P450 y de las bombas de eflujo la variabilidad interindividual sigue siendo muy amplia33-35.
Escasa variabilidad intraindividual de los parámetros farmacocinéticos
Para que la monitorización terapéutica sea plausible es importante que una única determinación de la concentración del fármaco tenga un valor considerable. Si existiera una gran variabilidad intrapaciente la monitorización sería prácticamente imposible, pues determinar hoy la concentración del fármaco no nos informaría sobre cuál será la concentración de mañana, de la semana que viene o del próximo mes.
No se han realizado muchos estudios que evalúen la variabilidad intraindividual de los antirretrovirales, pero en los pocos que hay se ha observado que la concentración de los IP y de los ITINN en un mismo paciente es relativamente constante, con coeficientes de variación del 30-45%21-23,26,36. Así, una única determinación de estos fármacos nos dará una buena información de las concentraciones que mantiene el paciente. Evidentemente, la estabilidad farmacocinética se quebrará si se modifican algunas circunstancias del paciente, sobre todo si la adherencia no es buena, pero también si se altera la absorción (p. ej., diarrea y malabsorción intestinal) o si el paciente toma otros fármacos o productos no farmacológicos que interaccionan con los antirretrovirales.
Buena correlación entre la concentración plasmática y la eficacia terapéutica o la toxicidad
Si no existiera una buena correlación entre la concentración plasmática y la respuesta clínica la monitorización terapéutica no sería útil. Esto parece suceder con los ITIAN. No ha podido establecerse una correlación clara entre la concentración plasmática de los ITIAN y la respuesta terapéutica. Los ITIAN son profármacos que deben activarse en el interior de la célula por acción de las cinasas, transformándose en derivados trifosfatados activos. Estas reacciones limitan la cantidad de fármaco activo intracelular. La determinación de la concentración intracelular de ITIAN-trifosfato podría ser más útil para predecir la respuesta terapéutica37, pero únicamente puede determinarse mediante técnicas muy complejas. Se utilizan técnicas de espectrometría de masas, que actualmente no están disponibles más que en algunos laboratorios de investigación.
Al contrario de lo que sucede con los ITIAN, los IP y los ITINN no requieren metabolización intracelular para ser activos. Se han realizado múltiples estudios en los que se demuestra la asociación entre la concentración plasmática de IP y la respuesta terapéutica, sobre todo en los pacientes que no habían recibido TAR previo38-59. También se ha observado que existe relación entre concentraciones elevadas de ritonavir60, indinavir61-65, nelfinavir66 o amprenavir56 y una mayor incidencia de reacciones adversas. Algunos tipos de toxicidad digestiva de los IP se deben a su acción local sobre la mucosa y no es sorprendente que la concentración plasmática de nelfinavir no se asocie al desarrollo de diarrea67.
Con respecto a los ITINN, tanto efavirenz como nevirapina tienen una vida media durante la fase de eliminación más larga que los IP. Ello se traduce en unas oscilaciones menores en las concentraciones plasmáticas en cada paciente durante esta fase y la posibilidad de utilizar una única muestra a partir de las 4 h tras la toma de nevirapina cuando se administra cada 12 h o a partir de las 12 h, tanto para nevirapina como efavirenz, cuando se administran una vez al día para predecir las Cmín68-70. Sin embargo, las variaciones interindividuales en las concentraciones plasmáticas son tan importantes como con los IP23-26,69-71 y existen datos que apoyan una relación entre las concentraciones de ambos fármacos y su eficacia, aunque las concentraciones mínimas asociadas con eficacia a largo plazo no están claramente definidas ni validadas clínicamente23,24,26,72-74. Puede ser muy importante descubrir casos con concentraciones bajas de nevirapina o efavirenz dada la rapidez con que puede desarrollarse resistencia, pues una única mutación condiciona la pérdida de eficacia. La toxicidad de los ITINN también se ha relacionado con sus concentraciones plasmáticas. Concentraciones elevadas de efavirenz se han asociado a mayor frecuencia de alteraciones del sistema nervioso central (SNC)23,32,75,76, aunque en algún estudio no se ha observado esta asociación77. Asimismo, concentraciones elevadas de nevirapina se han asociado a hepatotoxicidad78 y a erupción cutánea79.
Teniendo en cuenta la correlación significativa que existe entre parámetros farmacocinéticas como AUC, Cmáx y/o Cmín y la respuesta al TAR o la toxicidad, es lógico suponer que el mantenimiento de las concentraciones plasmáticas dentro de unas determinadas concentraciones permitirá su optimización.
Estrecho margen terapéutico
En los fármacos con un amplio margen terapéutico es relativamente fácil administrar una dosis fija y conseguir unas concentraciones efectivas y no tóxicas. La monitorización terapéutica será más útil cuando la diferencia entre la concentración efectiva y la concentración tóxica es pequeña. La mayoría de los IP tienen un margen terapéutico relativamente pequeño. La Cmín media de los pacientes que reciben IP no potenciados se sitúa muy poco por encima de la concentración efectiva. Se ha estimado que alrededor del 30-40% de pacientes pueden presentar concentraciones de IP inferiores a las consideradas efectivas80,81. La administración de pequeñas dosis de ritonavir aumenta enormemente las concentraciones plasmáticas de los IP y en la actualidad todos los IP, salvo nelfinavir, suelen administrarse asociados a ritonavir33,82-84. Es excepcional que la concentración de saquinavir85, indinavir34, amprenavir86 o lopinavir87 potenciados con ritonavir sea infraterapéutica en los pacientes que no presentan resistencia a los IP, excepto en casos de mala cumplimentación del tratamiento. A pesar de ello, la monitorización terapéutica de los IP potenciados con ritonavir sigue siendo útil, dado que se mantiene una amplia variabilidad interindividual y que al aumentar la concentración del IP pueden aumentar los efectos adversos. Además, aunque la concentración sea terapéutica para virus no resistentes, puede ser insuficiente para virus con múltiples mutaciones.
Características que dificultan la monitorización terapéutica de los antirretrovirales
Confusión entre adherencia terapéutica y concentración plasmática
La adherencia al TAR es fundamental para obtener una eficacia terapéutica adecuada y duradera; sin embargo, es difícil mantener de manera indefinida una buena adherencia a todos los fármacos, teniendo en cuenta las dosis, los intervalos de dosificación y los requerimientos dietéticos. Para que la monitorización terapéutica pueda tener utilidad clínica es necesario un conocimiento de la adherencia y que esta sea buena. Encontrar una concentración plasmática adecuada no significa que la adherencia sea buena, pues es posible que el paciente tome mejor el tratamiento antes de la visita de monitorización. Una concentración plasmática baja puede reflejar un problema farmacocinético, una mala adherencia o ambos. Es importante evaluar y optimizar la adherencia88 y, si es posible, determinar la concentración del fármaco tras observar la ingesta de éste. Siempre que la concentración del fármaco resulte baja, debemos insistir en la adherencia al tratamiento, pues mesurar la adherencia al tratamiento puede ser difícil en algunos pacientes. En este contexto, el hallazgo de concentraciones plasmáticas infraterapéuticas puede ayudar a descubrir casos de mala adherencia. La concentración plasmática es más variable en los pacientes con mala adherencia al tratamiento88 y el hallazgo de concentraciones infraterapéuticas de IP o de ITINN se ha utilizado como un parámetro más que debe tenerse en cuenta en la evaluación de la adherencia89-92. La monitorización terapéutica resulta poco útil para conocer la adherencia a fármacos con una vida media corta, pero puede ser más útil en el caso de fármacos con una vida media prolongada, como los ITINN o algunos IP potenciados (p. ej., lopinavir/ritonavir). Si la adherencia es adecuada debemos descartar otras causas como interacciones farmacocinéticas o malabsorción intestinal, que pueden provocar concentraciones infraterapéuticas.
Dificultades para establecer la concentración eficaz
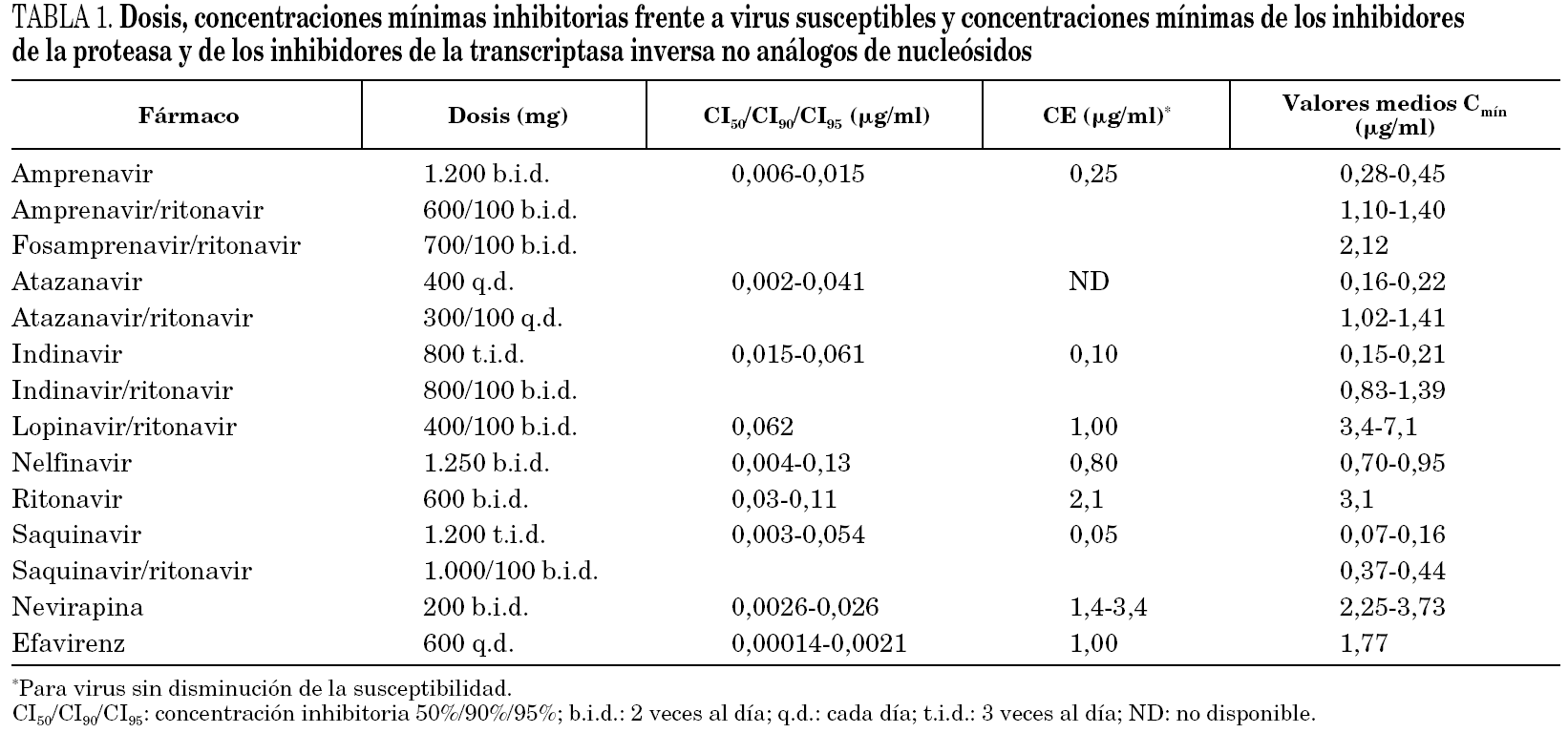
Aunque se disponga de abundante literatura médica que demuestra la relación entre la concentración del fármaco y la respuesta terapéutica, el rango terapéutico de los IP y de los ITINN en distintas situaciones no está claramente definido. La tabla 1 muestra las concentraciones terapéuticas propuestas en algunos estudios, pero no se debe olvidar que estos datos todavía no están suficientemente validados en la práctica clínica.
La primera duda que se plantea es cuál de los parámetros farmacocinéticos (AUC, Cmáx o Cmín) es el que mejor predice la eficacia clínica de los IP o de los ITINN. Se trata de tres parámetros muy correlacionados entre sí, pero que nos dan una información farmacocinética diferente.
El AUC nos informa sobre la exposición total al fármaco y se ha relacionado con la eficacia y con la toxicidad48,51,65,85. El principal inconveniente es que para calcular el AUC se requiere un elevado número de extracciones de sangre a lo largo del intervalo de dosificación (8, 12 o 24 h) y por tanto su determinación es mucho más compleja que las concentraciones aisladas, tanto para el paciente como para el personal sanitario.
La Cmáx indica la exposición máxima al fármaco y se ha relacionado fundamentalmente con la toxicidad56,60-62,65,85, aunque también con la eficacia virológica. En un estudio reciente la Cmáx de indinavir fue el único parámetro que se asoció con el incremento de linfocitos CD4 en pacientes con carga viral indetectable, sugiriendo una relación farmacocinética-farmacodinámica diferente en cuanto a los efectos sobre la reconstitución inmunológica y la eficacia virológica52. El problema de determinar la Cmáx es que el tiempo en que se alcanza tras la ingesta del fármaco es muy variable de un paciente a otro, de manera que para detectarla correctamente es preciso realizar varias extracciones de sangre en las primeras horas tras la toma del fármaco.
La Cmín indica la concentración plasmática más baja a lo largo del intervalo de dosificación del fármaco. La facilidad relativa para determinar este parámetro constituye una notable ventaja, pues basta con una sola extracción de sangre justo antes de la siguiente toma del fármaco. Para inhibir permanentemente la replicación del VIH se requieren concentraciones efectivas de los fármacos a lo largo de todo el intervalo terapéutico, de manera que si la Cmín es superior a la concentración efectiva, la inhibición del virus sería correcta. Esta supuesta concentración efectiva es un parámetro teórico que puede encontrarse en la literatura médica y que se ha calculado in vitro a partir de un estudio fenotípico de cepas sensibles del virus. De esta manera puede determinarse la concentración del fármaco necesaria para inhibir el 50% (CI50), el 90% (CI90) o el 95% (CI95) de la replicación viral. Esta concentración inhibitoria se corrige por la unión a proteínas plasmáticas del fármaco para obtener un parámetro que teóricamente correspondería a la concentración efectiva (CE50, CE90, CE95). Esta corrección por la unión a proteínas puede realizarse de distintas maneras, con resultados muy diferentes12. Ya que debe inhibirse al máximo la replicación viral, la CE95 o la CE90 serían más adecuadas que la CE50; sin embargo, suele utilizarse la CE50 debido a que su determinación es mucho más precisa.
La Cmín es el parámetro farmacocinético más estudiado en la literatura especializada y el que mejor se ha relacionado con la eficacia virológica48,50,56,65,85,93,94, aunque también se ha relacionado con la toxicidad60,63. La Cmín probablemente es el parámetro más útil en cuanto a la relación coste-beneficio para la monitorización terapéutica de los IP, sin embargo cabe resaltar tres inconvenientes de su determinación. Un primer problema lo constituye el hecho que para algunos IP la concentración sigue bajando durante un tiempo tras la ingesta del fármaco, hasta que la absorción intestinal revierte esta tendencia. Por esto se diferencia entre concentración predosis o valle (Cvalle o Ctrough en inglés), que es la que habitualmente se determina, y Cmín, que realmente corresponde a la concentración más baja. Estos términos son confusos en la literatura médica y por lo general se habla de Cmín refiriéndose a Cvalle. Para la mayoría de fármacos ambas concentraciones son muy similares, pues la concentración empieza a aumentar al poco tiempo de la ingesta, sin que la confusión teminológica tenga importancia clínica. Para otros fármacos como lopinavir o ritonavir la diferencia puede ser considerable, pues la concentración sigue bajando durante 1 o 2 h95. Afortunadamente, tanto la concentración Cvalle como la Cmín de lopinavir son muy superiores a la concentración necesaria para inhibir a los virus sensibles, pero cuando el virus ha acumulado un cierto número de mutaciones de resistencia a los IP esta diferencia podría ser importante. Un segundo inconveniente de la Cmín es el ritmo circadiano de algunos IP, como nelfinavir o saquinavir, con concentraciones considerablemente inferiores por la noche que por la mañana96. En estos casos la concentración más baja a lo largo del intervalo de dosificación sería la Cmín de la noche. Un tercer problema viene determinado por el hecho de que, a diferencia de lo que habitualmente ocurre con la Cmáx y la AUC, la Cmín suele determinarse sin observar directamente la administración de la dosis previa del fármaco, de manera que es difícil que la extracción de sangre se realice a la hora prevista (8, 12 o 24 h después de la ingesta, según el intervalo de dosificación), ya sea porque el paciente se adelanta o se retrasa en la toma del medicamento, porque llega tarde a la visita o por el volumen de trabajo de la persona que realiza la extracción. Con los IP la mala elección del tiempo de extracción de la sangre puede producir una muestra no representativa de lo que se desea evaluar. Los ITINN, sobre todo efavirenz, tienen una vida media prolongada, de manera que las imprecisiones en el tiempo de toma de la muestra tienen menos influencia en los resultados. En el estudio de Marzolini et al23, donde se relaciona la concentración de efavirenz con la eficacia terapéutica y la toxicidad, la extracción de las muestras se realizó indistintamente entre las 8 y las 20 h tras la administración.
A partir de los datos de la literatura especializada, se han generado recientemente unas curvas concentración-tiempo que incluyen los percentiles 10, 25, 50, 75 y 90 de las concentraciones simuladas de los principales regímenes terapéuticos con IP potenciados y no potenciados y con ITINN97. Estas curvas permiten extrapolar el resultado de una muestra obtenida a cualquier intervalo de tiempo a los parámetros poblacionales con una precisión que parece bastante aceptable. Este método requiere conocer con mucha exactitud la hora en que se administró el fármaco y la hora en que se extrajo la muestra. Para fármacos con una vida media corta, como la de la mayoría de IP, errores de pocas horas pueden hacer que el resultado sea muy inexacto. Para fármacos con una vida media prolongada, como la de los ITINN este error es poco importante.
Como problema adicional para determinar si la concentración obtenida en un paciente está dentro de los márgenes terapéuticos, debemos conocer que lo que determinamos es la concentración total de fármaco y no la fracción libre, que es la que difunde a los tejidos e inhibe al virus. Tanto para los IP como para los ITINN la mayor parte del fármaco que se encuentra en el plasma está fijado a las proteínas plasmáticas, principalmente a la a1-glucoproteína ácida y también a la albúmina. La a1-glucoproteína es un reactante de fase aguda y sus concentraciones pueden variar de manera considerable en algunas circunstancias12, por ejemplo cuando se padecen infecciones intercurrentes. Por ello puede ser importante determinar la concentración del medicamento en una situación clínica estable. Existe una notable variabilidad interpaciente e intrapaciente en la fracción de indinavir fijada a las proteínas98 y también se han observado cambios en la proporción de lopinavir libre a lo largo del intervalo terapéutico99, aunque su significado clínico se desconoce.
La presencia de metabolitos activos que contribuyen en la eficacia global de los fármacos puede dificultar también la interpretación de la concentración plasmática. Nelfinavir es el único fármaco susceptible de monitorización terapéutica del que se conoce un metabolito activo denominado M8, con concentraciones mensurables en plasma. El M8 es tan activo como el propio nelfinavir y está menos fijado a las proteínas plasmáticas. Se desconoce cuál es el papel exacto que representa M8 en la actividad global de nelfinavir. La coadministración de ritonavir y nelfinavir incrementa poco la concentración de nelfinavir, pero aumenta mucho el cociente M8/nelfinavir100,101.
Finalmente, no se debe olvidar que la concentración necesaria del medicamento debe interpretarse en función del contexto individual del paciente. Los pacientes con historial terapéutico previo o infectados por virus con mutaciones que les confieren una disminución de la susceptibilidad a los IP pueden requerir concentraciones más elevadas de los mismos (v. apartado "Cociente inhibitorio"). También será importante el resto de medicamentos que recibe el paciente, que pueden ser más o menos potentes y presentar sinergia con el fármaco que monitorizamos.
Todas las dificultades mencionadas hacen necesarios unos considerables conocimientos farmacocinéticos y farmacodinámicos para la interpretación de la concentración plasmática de un medicamento y un adecuado ajuste de la dosis.
Resultados de los ensayos clínicos
Para que la monitorización de los antirretrovirales pueda ser aplicable a la práctica clínica es imprescindible disponer de los resultados de estudios aleatorizados que validen esta estrategia terapéutica. Se han realizado o están en marcha varios estudios tanto al inicio de un tratamiento, para prevenir el fracaso virológico o evitar los efectos adversos, como en pacientes con fracasos previos, para adaptar la concentración del fármaco a la resistencia del virus.
En el primer estudio102,103 se incluyeron 40 pacientes sin tratamiento previo que iniciaron tratamiento con zidovudina, lamivudina e indinavir (800 mg/8 h), y que fueron aleatorizados para recibir las dosis estándar o para realizar monitorización terapéutica de los tres fármacos. Se excluyeron 7 pacientes que abandonaron precozmente el tratamiento. En el grupo de monitorización, las dosis se ajustaron la semana 4 a partir de la concentración plasmática de la semana 2. Se modificó la dosis de zidovudina, lamivudina e indinavir en el 44, 31 y 81% de los pacientes, respectivamente. Se alcanzaron las concentraciones terapéuticas definidas a priori en 14 de los 16 pacientes monitorizados y en 3 de los 17 que recibieron dosis estándar. Al año de seguimiento la proporción de pacientes con carga viral inferior a 50 copias/ml fue superior en los pacientes monitorizados (15 de 16 comparado con 9 de 17). Aunque el número de pacientes estudiados es pequeño, las diferencias son significativas a favor del grupo de monitorización terapéutica.
En el estudio ATHENA104 se incluyeron 147 pacientes no tratados previamente que iniciaron una pauta que incluyó nelfinavir (n = 92) o indinavir (n = 55) y se aleatorizaron para realizar monitorización terapéutica o no. En ambos grupos se determinó la concentración del IP y en el grupo de monitorización se comunicó el resultado al médico responsable, junto con un consejo para ajustar las dosis si se consideraba necesario, mientras que en el grupo control no se comunicó el resultado. La concentración del fármaco se expresó como un cociente entre el valor obtenido en una muestra extraída a cualquier tiempo tras la administración y el valor de referencia poblacional de una curva concentración-tiempo. Para nelfinavir se aumentaba la dosis si el cociente era menor a 0,9, mientras que para indinavir se aumentaba o se disminuía la dosis si el cociente no estaba en el rango de 0,75 a 2. Al año de seguimiento la proporción de pacientes con carga viral inferior a 500 copias/ml por intención de tratar (pérdida = fracaso) fue significativamente superior en el grupo de monitorización que en el grupo control (78,2 y 55,1%). Así mismo, una menor proporción de pacientes interrumpieron el tratamiento en el grupo de monitorización (17,4 y 39,7%). En los pacientes tratados con nelfinavir, la mejor evolución del grupo de monitorización se debió principalmente a un menor número de fracasos virológicos (2,4 y 17,6%); mientras que en los pacientes tratados con indinavir fue debida a menos cambios de tratamiento por toxicidad (14,3 y 29,6%). La conclusión de los autores es que la monitorización terapéutica mejora la respuesta al tratamiento.
En el estudio PharmaAdapt105,106 los pacientes con fracaso virológico recibieron un tratamiento de rescate adaptado al genotipo del virus y fueron aleatorizados para comparar el seguimiento con monitorización terapéutica y el seguimiento estándar. Se incluyeron 257 pacientes y se han presentado los resultados de los 183 que recibieron IP. Se consideró terapéutica aquella Cvalle superior a la IC50 corregida por la unión a proteínas plasmáticas descrita en la literatura especializada para virus no resistentes. En el grupo de monitorización terapéutica la dosis del IP se modificó la semana 8 en el 23,5% de los pacientes en función de la Cmín de la semana 4. A la semana 12 y a la semana 32 no se observaron diferencias en el descenso de la carga viral ni en la proporción de pacientes con carga viral indetectable entre ambos grupos. Sin embargo, no puede concluirse que la monitorización terapéutica no es útil porque existen varios problemas metodológicos que probablemente invalidan los resultados de este estudio. El primero es la elección de las concentraciones terapéuticas, que, aun con algunas dudas, podría ser adecuada en pacientes no tratados previamente, pero no en pacientes con fracaso virológico previo. Además, el ajuste de la dosis no se realiza hasta la semana 8, tiempo que puede ser suficiente para que aparezcan nuevas mutaciones.
El estudio GENOPHAR107 todavía no se ha publicado y sólo se dispone de los datos de una comunicación en un congreso. Se aleatorizaron 134 pacientes con fracaso virológico, comparando la eficacia del tratamiento adaptado sólo al genotipo con la del tratamiento adaptado al genotipo y con monitorización terapéutica. Las dosis se modificaron la semana 8 en el 20% de pacientes y los resultados se analizaron la semana 12, sin observar diferencias significativas con o sin monitorización terapéutica. Este estudio tiene importantes problemas en el diseño y la interpretación de los datos, algunos superponibles a los del estudio PharmaAdapt. Además no queda claro qué criterios se utilizan para ajustar las dosis y el análisis se realiza a las 4 semanas de ajustar las dosis.
Selección de pacientes en los que la monitorización terapéutica puede ser especialmente útil
La eficacia del TAR que inician actualmente los pacientes es elevada, de manera que hasta el 80-85% de pacientes con buena adherencia tiene una carga viral indetectable al año de tratamiento. Con estas cifras, la aportación de la monitorización terapéutica universal no puede ser muy grande. A menos que también se utilice como una medida más de la adherencia, a lo sumo podrá mejorar en un 5% la eficacia del TAR. Con las limitaciones citadas, el coste y la dificultad que supone su implementación, la monitorización terapéutica difícilmente es aplicable a todos los pacientes. Por el contrario, algunos grupos de pacientes que tengan un riesgo especial de presentar concentraciones subinhibitorias o excesivamente elevadas pueden obtener un beneficio considerable.
En primer lugar, la monitorización es aconsejable cuando puedan producirse interacciones farmacocinéticas. La cantidad de interacciones posibles en los pacientes con infección por VIH que reciben TAR es enorme12,28, dependiendo principalmente de la inhibición o la inducción de los sistemas enzimáticos encargados de la absorción o del metabolismo de los medicamentos (citocromo P450, proteínas transportadoras). En general los IP son inhibidores y los ITINN inductores enzimáticos. Otros muchos medicamentos que pueden recibir los pacientes pueden ser importantes inductores (p. ej., rifampicina, rifabutina) o inhibidores (p. ej., azoles) enzimáticos. Una de las enfermedades que a menudo se asocia a la infección por VIH y en la que puede ser recomendable la monitorización terapéutica de algunos fármacos por las interacciones medicamentosas que condiciona es la tuberculosis108-111. Incluso la llamada "medicina natural" puede ser una fuente de interacciones con los antirretrovirales112. A veces se asocian varios inhibidores y/o inductores que pueden provocar interacciones muy complejas e imprevisibles, como se ha observado recientemente con la asociación de lopinavir/ritonavir y amprenavir, que origina descensos marcados de la concentración tanto de lopinavir como de amprenavir113,114, siendo en estos casos fundamental la monitorización terapéutica. Existen algunas guías que pueden orientarnos sobre cómo dosificar los fármacos con interacciones conocidas, pero no se debe olvidar que generalmente las recomendaciones se basan en las concentraciones medias. La gran variabilidad interindividual hace que en muchos casos las concentraciones obtenidas sean infraterapéuticas o excesivamente elevadas. En el caso de interacciones, si es posible, sería conveniente conocer la concentración del antirretroviral antes y después de añadir el nuevo fármaco con el fin de valorar la magnitud de la interacción y modificar oportunamente la dosis.
Otra situación en la que la monitorización terapéutica puede ser muy útil es la aparición de efectos adversos. A veces no es fácil saber qué medicamento es responsable de una determinada toxicidad, pero muchos de los efectos adversos se asocian claramente a unos fármacos concretos y la reducción de la dosis puede revertir por ejemplo la toxicidad renal de indinavir o la toxicidad de otros IP60,61.
La monitorización terapéutica también puede ser importante en los tratamientos administrados una vez al día con fármacos que no tiene una vida media muy prolongada, como son los IP potenciados con ritonavir. La Cmín de la mayoría de IP potenciados con ritonavir y también de nevirapina es inferior si se administra la misma dosis del fármaco una vez al día que si reparte en dos tomas69,85,87,115-119. Es importante conocer la Cmín para evitar la exposición a concentraciones subinhibitorias, sobre todo cuando ya existe un cierto grado de resistencia del virus al fármaco.
Cuando se produce un fracaso virológico la monitorización terapéutica puede ser particularmente importante. El propio fracaso ya puede estar relacionado con una concentración infraterapéutica del fármaco y en algunos casos al incrementar dicha concentración (p. ej., IP potenciando con ritonavir) puede que el fármaco vuelva a ser eficaz120,121. La eficacia terapéutica de sucesivas pautas terapéuticas tras fracasos virológicos es cada vez inferior. En pacientes con escasas opciones terapéuticas, es necesario optimizar al máximo el TAR para que la respuesta sea aceptable y unas correctas concentraciones farmacológicas permitirán aumentar la eficacia virológica y disminuir la toxicidad (v. apartado "Cociente inhibitorio").
En los pacientes con hepatopatía crónica se han descrito una mayor variabilidad122 o concentraciones más elevadas de algunos fármacos123,124, que pueden incrementar la toxicidad125. En este sentido, la monitorización terapéutica puede ser especialmente útil en casos de hepatopatía avanzada para intentar reducir la toxicidad en pacientes ya propensos a presentar múltiples complicaciones.
Algunas covariables como el peso, el sexo o la raza pueden modificar la farmacocinética de los antirretrovirales. Globalmente, la correlación entre concentración y peso no es muy buena y en adultos ni los IP ni los ITINN se ajustan al peso; sin embargo, en pacientes con pesos extremos sí puede existir una influencia notable. En los pacientes con peso muy elevado puede ser útil determinar la concentración para corregir concentraciones subterapéuticas y en los de muy bajo peso la monitorización puede ser útil para evitar la toxicidad del medicamento. En el sexo femenino se han descrito concentraciones elevadas de algunos fármacos como saquinavir, independientemente de su peso o masa corporal95,126. Esta mayor concentración en mujeres se ha relacionado con una mayor eficacia, pero también con una mayor toxicidad, de manera que si aparece toxicidad puede ser útil determinar la concentración y reducir la dosis si aquella es elevada. El riesgo de presentar reacciones adversas a nevirapina (erupción cutánea y hepatotoxicidad) es considerablemente más elevado en mujeres que en hombres127. Una mención especial merecen las diferencias raciales relacionadas con un polimorfismo en el codón 516, que puede ser responsable de concentraciones más elevadas y de toxicidad por efavirenz. Este hallazgo avala la futura posibilidad de realizar en el futuro estudios de farmacogenómica junto a los de farmacocinética para optimizar el tratamiento.
Las mujeres embarazadas constituyen una población donde la monitorización terapéutica es importante128,129. Se ha demostrado que el embarazo puede modificar la farmacocinética de algunos medicamentos, sobre todo durante el tercer trimestre, con una gran variabilidad en las concentraciones plasmáticas130-134. Las concentraciones de indinavir y de saquinavir no potenciados descienden a menudo hasta valores infraterapéuticos, mientras que la de nelfinavir se modifica poco. Si se determina la Cmín durante el primer trimestre podremos tener una referencia de la concentración basal. Si durante el segundo o tercer trimestre disminuye puede ajustarse la dosis para evitar concentraciones infraterapéuticas.
La monitorización terapéutica puede ser especialmente útil en niños135. Aunque cada vez se dispone de más resultados de estudios farmacocinéticos realizados en niños41,130,136-142, muchos antirretrovirales no se han estudiado en recién nacidos o en niños pequeños. La farmacocinética de muchos medicamentos es diferente en niños que en adultos y además puede cambiar con el tiempo al madurar el organismo. En los niños muchos antirretrovirales se dosifican en mg/kg o en mg/m2, pero esto no nos asegura unas concentraciones adecuadas y la monitorización terapéutica puede ser muy recomendable para administrar una dosis que proporcione unas concentraciones adecuadas. En una revisión de estudios clínicos en los que se analiza el TAR en niños, 4 de los 23 estudios analizados utilizan ajuste de la dosis en función de los parámetros farmacocinéticos. En estos estudios la eficacia terapéutica es superior a la de los otros estudios que utilizan dosis fijas136. En los niños la monitorización terapéutica también se ha mostrado útil para conocer la adherencia.
Cociente inhibitorio
Cuando utilizamos la Cmín referida a la CE50 teórica del virus sensible u otros métodos similares para la monitorización terapéutica de los IP, presuponemos que el virus del paciente es completamente sensible al fármaco que se monitoriza. Esto puede ser cierto en los pacientes no tratados previamente102-104, pero a menudo no lo es en los pacientes que han presentado uno o varios fracasos virológicos. Aunque presentan algunas dudas metodológicas, los estudios de monitorización terapéutica que han utilizado estos parámetros en pacientes con fracaso virológico previo no han demostrado que esta estrategia resulte útil105-107. En los pacientes que reciben tratamiento con IP, los fracasos virológicos suelen comportar la aparición de mutaciones que disminuyen la susceptibilidad del virus a todos los IP, de manera que la concentración del fármaco que es efectiva frente a virus sensibles, no lo es frente a virus con susceptibilidad disminuida. Para intentar resolver este problema ha surgido el concepto de cociente inhibitorio143.
El cociente inhibitorio es un parámetro que relaciona la concentración del fármaco con la susceptibilidad del virus. Es un cociente en el cual el numerador corresponde a la exposición al fármaco y el denominador a la resistencia del virus. Así, cuanto mayor sea la concentración del fármaco y menor la resistencia del virus más elevado será el cociente inhibitorio, mientras que cuanto menor sea la concentración y mayor la resistencia, más bajo será. Como medida de la exposición al fármaco podría utilizarse cualquiera de los parámetros farmacocinéticos (AUC, Cmáx o Cmín), pero prácticamente siempre se ha utilizado la Cmín. Como medida de la resistencia del virus suele utilizarse la CE50 (CI50 corregida para la unión a proteínas plasmáticas). El cociente inhibitorio indica, por lo tanto, el número de veces que la Cmín del fármaco está por encima de la concentración necesaria para inhibir el 50% de la replicación viral y, en teoría, sería un buen parámetro para valorar si un fármaco será efectivo frente a un virus con una determinada susceptibilidad.
Uno de los principales problemas para utilizar el cociente inhibitorio como parámetro de referencia para la monitorización terapéutica radica en la necesidad de realizar la fenotipificación del virus. La técnica necesaria es muy compleja, sólo la realizan muy pocos laboratorios de todo el mundo y resulta cara. Por lo tanto, no cabe pensar que pueda aplicarse a la práctica clínica. Para solucionar este problema, se ha desarrollado el denominado cociente inhibitorio virtual, en el cual, en lugar de utilizar el fenotipo real, se utiliza el fenotipo virtual. El fenotipo virtual es una interpretación del genotipo que puede realizarse gracias a que se dispone de un banco de datos con muchos genotipos y con el fenotipo real correspondiente a este genotipo. Así, para conocer el fenotipo virtual sólo se necesita conocer el genotipo del virus y aplicar un programa informático que permita interpretarlo. El resultado viene dado como el número de veces que está reducida la susceptibilidad del virus. Para calcular el denominador del cociente inhibitorio virtual debemos multiplicar el valor del fenotipo virtual por la CE50 del virus sensible referida en la literatura especializada.
Tanto en el cociente inhibitorio como en el virtual interviene la CI50 corregida por la unión del fármaco a las proteínas plasmáticas. Como se ha comentado anteriormente, esta CI50 corregida no está estandarizada y puede calcularse de distintas maneras, con resultados muy diferentes. Para evitar este problema ha surgido el cociente inhibitorio normalizado. El numerador del cociente inhibitorio normalizado es el cociente inhibitorio virtual del paciente y el denominador es un cociente inhibitorio virtual de referencia correspondiente al cociente virtual que en los estudios realizados se ha mostrado útil para predecir la eficacia de fármaco. Tanto en el numerador como en el denominador interviene la misma CI50 corregida y por lo tanto pueden eliminarse. De esta manera, en el numerador queda el producto de la Cmín por el fenotipo (número de veces que está reducida la susceptibilidad) y en el denominador un valor de referencia diferente para cada fármaco, que corresponde al producto entre la Cmín poblacional y el fenotipo por debajo del cual el fármaco conserva su eficacia clínica. Este valor de referencia sólo se ha establecido para unos pocos fármacos.
Recientemente se ha definido otro cociente inhibitorio que utiliza el genotipo como medida de resistencia del virus, evitando la necesidad de disponer del fenotipo real o virtual. Es el cociente inhibitorio genotípico, que se define como el cociente entre la Cmín y el número de mutaciones que confieren disminución de la susceptibilidad al fármaco.
En todos los estudios realizados144-161 se ha observado que cualquiera de los cocientes inhibitorios comentados se relacionan mucho mejor que la Cmín aislada con la respuesta terapéutica a los diferentes IP en los pacientes con fracasos virológicos previos y disminución de la susceptibilidad del virus. Sin duda, el cociente inhibitorio será muy útil en este contexto, sin embargo, la gran variedad de formas de calcular el cociente inhibitorio y los requerimientos de algunas de ellas hacen necesaria una estandarización consensuada antes de poder aplicarlo a la práctica clínica habitual162-165. La tabla 2 muestra los diferentes tipos de cociente inhibitorio y su correlación con la respuesta terapéutica.
Comentarios finales y conclusiones
1. La individualización de la dosificación de los medicamentos en función de las concentraciones plasmáticas es una estrategia terapéutica que suscita un creciente interés para mejorar la eficacia del TAR y disminuir su toxicidad.
2. El objetivo inmediato de la monitorización terapéutica es la detección y la corrección de problemas farmacocinéticos. La intervención terapéutica que se realiza no consiste únicamente en aumentar o disminuir la dosis de un fármaco, sino que deberá incidirse sobre el problema farmacocinético subyacente en cada caso (p. ej., cambiar otro fármaco que interacciona con los antirretrovirales, educación del paciente en problemas concretos, etc.). No se debe olvidar que la monitorización terapéutica no es una estrategia para tratar la concentración del fármaco, sino para tratar al paciente. Por ejemplo, si la concentración del fármaco es muy elevada pero el paciente no presenta ningún tipo de toxicidad, difícilmente encontraremos motivos suficientes para reducir la dosis. A veces la monitorización terapéutica se ha utilizado como un parámetro complementario para determinar la adherencia al tratamiento.
3. Los criterios que debe cumplir un medicamento para ser candidato a la monitorización terapéutica son:
a) Posibilidad de determinar la concentración del fármaco mediante métodos precisos en laboratorios que sean accesibles a la práctica clínica habitual.
b) Buena relación entre la concentración plasmática del fármaco, la eficacia terapéutica y la aparición de efectos adversos, de manera que mantener dicha concentración dentro de unos márgenes determinados pueda ser beneficioso.
c) Estrecho margen terapéutico, con una relativa facilidad para presentar concentraciones infraterapéuticas o concentraciones tóxicas.
d) Amplia variabilidad interindividual y escasa variabilidad intraindividual de la concentración del fármaco.
4. Los IP y los ITINN satisfacen los criterios necesarios para ser candidatos a la monitorización terapéutica. Los ITIAN no los satisfacen y actualmente no pueden considerarse candidatos a la monitorización terapéutica.
5. Algunas limitaciones que pueden restringir la aplicación de la monitorización terapéutica son las siguientes:
a) Puede existir confusión entre problemas farmacocinéticos que condicionan una baja concentración del medicamento y mala adherencia al tratamiento.
b) Los parámetros que se deben monitorizar para medir la exposición al fármaco y la concentración eficaz del mismo no se han definido adecuadamente. Se han utilizado diferentes parámetros farmacocinéticos para medir la exposición al fármaco, siendo recomendable para aplicar a la clínica la toma de una sola muestra, habitualmente la Cmín. Pueden haber dificultades en conocer con precisión cuál es el tiempo de la recogida de la muestra respecto a la toma del medicamento, dato que es más importante para los IP que para los ITINN. La concentración determinada debe referirse a una concentración considerada terapéutica. Esta puede obtenerse mediante cálculos matemáticos a partir de unas curvas concentración-tiempo teóricas, pero con frecuencia se toma como referencia la CI50 del fármaco corregida por la unión a proteínas plasmáticas, que se encuentra en la literatura especializada. Esta corrección puede realizarse de distintas maneras, con resultados diferentes. Además, la fracción libre del fármaco puede variar en determinadas circunstancias. En el caso de nelfinavir, la presencia de un metabolito activo en cantidades considerables puede dificultar la interpretación de la concentración del fármaco. En todo caso, la concentración necesaria de un medicamento debe interpretarse en el contexto individual del paciente, teniendo en cuenta que los pacientes con virus parcialmente resistentes requerirán concentraciones más elevadas del fármaco y que la eficacia del tratamiento dependerá de todos los medicamentos asociados, pudiendo observarse sinergia entre ellos.
6. El número de ensayos clínicos aleatorizados que se han realizado para valorar la utilidad de la monitorización terapéutica no es muy elevado; sin embargo, todos los estudios efectuados en pacientes no tratados previamente han demostrado que la monitorización terapéutica mejora la eficacia del tratamiento. Los estudios realizados en pacientes con fracaso terapéutico no han observado diferencias en la eficacia; sin embargo, adolecen de importantes problemas de planteamiento y metodología que imposibilitan la interpretación de los resultados. Entre estos problemas destaca la elección de unas concentraciones eficaces de referencia que pueden no ser útiles para los virus parcialmente resistentes.
7. El concepto de cociente inhibitorio integra datos de farmacocinética y de resistencia del virus. De esta manera puede evaluarse si la concentración plasmática del medicamento es la concentración apropiada para un virus con una determinada susceptibilidad. El cociente inhibitorio se relaciona con la eficacia del tratamiento en los pacientes con virus que presentan una disminución de la susceptibilidad y puede ser útil para la monitorización terapéutica; sin embargo, es necesaria una estandarización metodológica y una validación clínica antes de poder aplicarlo a la práctica clínica habitual.
8. La monitorización terapéutica será particularmente útil cuando el riego de presentar concentraciones subterapéuticas o tóxicas es muy elevado. Por ello, se recomiendan en los pacientes que presenten alguna o algunas de las siguientes características:
a) Sospecha de interacciones farmacocinéticas de importancia clínica.
b) Sospecha de malabsorción intestinal.
c) Aparición de efectos adversos que puedan mejorar con la reducción de la concentración plasmática del medicamento, especialmente en pacientes con muy bajo peso, en mujeres y en pacientes con cirrosis hepática.
d) Fracaso virológico sin una causa evidente.
e) Mujeres embarazadas y niños, en los cuales la farmacocinética puede sufrir modificaciones.
f) Pacientes que inician TAR con algunos medicamentos que proporciones concentraciones relativamente bajas, como por ejemplo los IP no potenciados o los tratamientos administrados una vez al día con algunos IP potenciados.
9. La potenciación de los IP con ritonavir aumenta notablemente su concentración plasmática; sin embargo, esto no invalida la utilidad de la monitorización terapéutica, puesto que persiste una elevada variabilidad farmacocinética y los virus con disminución de la susceptibilidad pueden requerir concentraciones más elevadas del IP.
10. Es importante que cualquier programa de monitorización terapéutica se acompañe de medidas para monitorizar y mejorar la adherencia, facilitando de esta manera la interpretación de las concentraciones de los fármacos y una respuesta terapéutica adecuada.
11. En definitiva, existe un fundamento claro para pensar que la monitorización terapéutica puede ser una herramienta útil para optimizar el TAR en determinadas circunstancias. Antes de recomendar su amplia aplicación como método de rutina en la práctica clínica habitual es preciso estandarizar los parámetros que deben utilizarse y realizar estudios con una metodología adecuada y que incluyan a un elevado número de pacientes para perfilar el papel de la monitorización terapéutica en diferentes situaciones clínicas. Probablemente también es necesario desarrollar programas educativos tanto para médicos, farmacéuticos y personal sanitario, como para pacientes, para que la información derivada de la monitorización se utilice adecuadamente.
Agradecimientos
Agradecemos a la Dra. Rosa M.ª López Galera su colaboración en la elaboración del manuscrito.