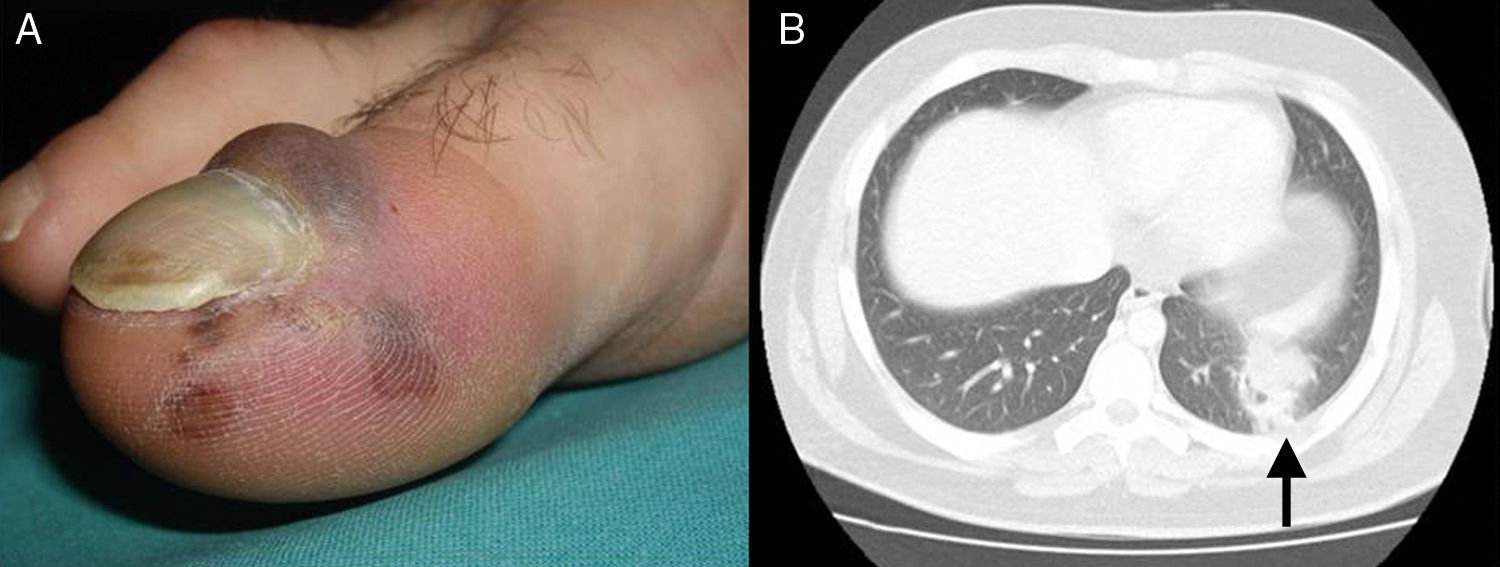
Presentamos el caso de un varón español de 16 años, sin antecedentes de interés, que acudió por un cuadro de fiebre de hasta 40°C, tos con expectoración verdosa y dolor pleurítico de 13 días de evolución, a pesar de haber recibido tratamiento empírico con amoxicilina-clavulánico y posteriormente levofloxacino, apareciendo durante la evolución lesiones cutáneas. Presentaba temperatura de 38,5°C con exploración cardiaca, pulmonar y abdominal normales. Se hallaron lesiones ampollosas de contenido hemorrágico y base eritematosa, localizadas en la cara lateral del 5° dedo y en el área periungueal del 1.er dedo del pie derecho (fig. 1, panel A) y pápulas purpúricas en palmas y plantas. En la analítica destacaba proteína C reactiva 36mg/dl, procalcitonina 3,4ng/ml, leucocitos 13.440/μl, neutrófilos 10.300/μl, linfocitos 1.510/μl y complemento e inmunoglobulinas normales. Los hemocultivos confirmaron el crecimiento de Staphylococcus aureus sensible a meticilina (SAMS) por lo que se inició tratamiento con cloxacilina. La radiografía de tórax y un ecocardiograma transesofágico resultaron normales. La biopsia de las lesiones dérmicas objetivó necrosis dermo-hipodérmica extensa con focos de abscesificación y oclusión trombótica focal compatibles con vasculitis de origen séptico. Se solicitó una TAC torácica observándose una neumonía cavitada en lóbulo inferior izquierdo (fig. 1, panel B). Tras 10 días de tratamiento desapareció la fiebre, con curación clínica sin secuelas. Dada la agresividad del cuadro, se solicitó la determinación de la leucocidina de Panton-Valentine (PVL). El estudio mostró una cepa del complejo clonal 30 (CC30), productora de PVL, tipo capsular 81,2, determinadas mediante PCR e hibridación en microarrays. Era también productora de otros factores de virulencia, como enterotoxinas (cluster egc), genes codificadores de hemolisinas, genes asociados a la producción de biopelículas icaA, icaC e icaD1y genes relacionados con la inmunoevasión como el antígeno B inmunodominante (isaB), lisil-fosfatidil glicerol sintetasa, proteínas de unión a la transferrina y DNAasas. También se demostró la presencia de adhesinas pertenecientes a los grupos de proteínas de unión, a la sialoproteína ósea (BBP), factores de coagulación (clumping factors) A y B, factores de unión al colágeno, factores de unión a la fibronectina o factores de unión al fibrinógeno, muchos de ellos análogos a los de la cepa MRSA 252. Era productora de penicilinasa, y portadora tanto de algunos genes de resistencia habituales en S. aureus, como de otros mucho menos frecuentes2 de resistencia a lincosamidas (linA), aminoglicósidos (aadD) y tetraciclinas (tetK).
El S. aureus productor de PVL se ha asociado a infecciones cutáneas graves3 y neumonías necrosantes en pacientes sin déficits de la inmunidad4, como es el caso que presentamos especialmente en edades tempranas5. Las series recogidas en la literatura española de cepas productoras de PVL incluyen fundamentalmente S. aureus resistente a meticilina6–9. No existen series españolas que describan la prevalencia de SAMS positivo para PVL. Sin embargo, dado que el CC30 es uno de los complejos clonales frecuentes en Europa, es conveniente recordar que las cepas de SAMS también pueden tener esta característica. En resumen, se presenta el caso de una neumonía necrotizante con afectación cutánea por SAMS adquirido en la comunidad con múltiples factores de virulencia, entre ellos la producción de PVL, en un paciente inmunocompetente. La información epidemiológica sobre cepas similares en España es escasa, pero es de esperar que las nuevas técnicas de biología molecular faciliten su estudio y caracterización.
Agradecemos al Dr. Miguel Marcos Martín su contribución en este artículo.