Sr. Editor: La leucocidina de Panton-Valentine (LPV), identificada en 19321, es una exotoxina específica de Staphylococcus aureus con propiedades leucotóxicas en polimorfonucleares y macrófagos humanos. Está producida por menos del 1% de los aislados de S. aureus2. Las cepas de S. aureus productoras de LPV están relacionadas con infecciones piógenas de la piel (como los forúnculos) y, con menor frecuencia, con la neumonía necrosante grave3. También se ha asociado con el recientemente conocido S. aureus resistente a meticilina (SARM) comunitario4. A continuación presentamos el caso de un paciente con una neumonía nosocomial por SARM productor de LPV.
Varón de 34 años, natural de la India aunque residente en España desde hace 6 años, trabajador en la hostelería en Mallorca, fumador y bebedor importante (con dependencia alcohólica). Fue traído a urgencias en abril de 2007 por un traumatismo craneoencefálico con hematoma subdural. El paciente ingresó en la unidad de cuidados intensivos (UCI) intubado y conectado a ventilación mecánica, y recibió tratamiento antibiótico empírico con amoxicilina-ácido clavulánico. La cifra de leucocitos en sangre era de 12,05 x 103/μl. En el primer día del ingreso se realizó un broncoaspirado (BAS). En el cultivo creció una flora mixta respiratoria. A los 8 días del ingreso presentó fiebre y secreciones purulentas espesas, y en la radiografía de tórax se objetivó una neumonía en el lóbulo inferior izquierdo complicada con atelectasias bibasales. La concentración de leucocitos en sangre era en ese momento de 4,10 x 103/μl. Se recogió una nueva muestra de BAS en la que se aislaron más de 106 unidades formadoras de colonia (ufc) de S. aureus. En el antibiograma, realizado con el método de difusión con discos siguiendo los criterios del Clinical and Laboratory Standards Institute (CLSI), este aislado (cepa 05015862) era únicamente resistente a todos los antibióticos betalactámicos (incluyendo la oxacilina), y sensible a la eritromicina, clindamicina, ciprofloxacino, cotrimoxazol, vancomicina, teicoplanina, rifampicina, linezolid, gentamicina, tobramicina, tetraciclina, cloranfenicol, mupirocina y ácido fusídico. Se suspendió el tratamiento antibiótico anterior y se administró vancomicina. En el posterior estudio de colonización de SARM (cultivo de exudados nasal, axilar e inguinal), realizado a los 10 días del ingreso, se aisló este microorganismo en el exudado nasal con el mismo patrón de resistencia. El paciente recibió tratamiento con ácido fusídico intranasal y lavados con clorhexidina en axilas e ingles durante 5 días. A los 15 días del ingreso se volvió a aislar SARM en el cultivo del BAS con el mismo antibiograma. A los 17 días se le retiró la intubación. La cifra de leucocitos a partir de este momento y hasta el alta se mantuvo entre 9 y 13 x 103/μl. A los 22 días, se aisló en el BAS más de 106 ufc de Pseudomonas aeruginosa sin aislarse SARM, por lo que se asoció ceftazidima y tobramicina a la vancomicina, y se administraron los tres antibióticos durante 18 días. A los 30 días, el paciente ingresó en planta. En un estudio de colonización, realizado a los 35 días, se aisló SARM en el exudado axilar con el mismo antibiograma, por lo que se repitieron los lavados con clorhexidina en axilas e ingles durante 5 días. Los siguientes tres estudios de colonización fueron negativos para SARM, la evolución fue buena y el paciente fue dado de alta y derivado a un centro de rehabilitación.
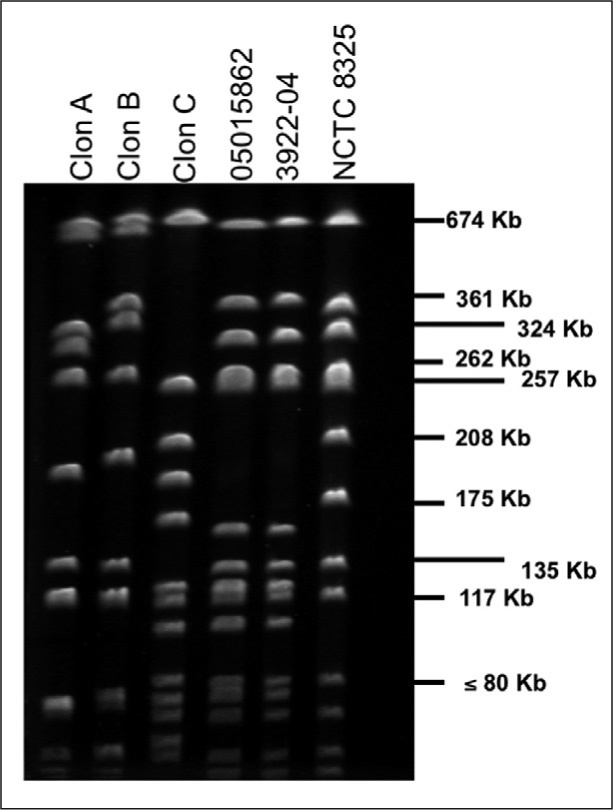
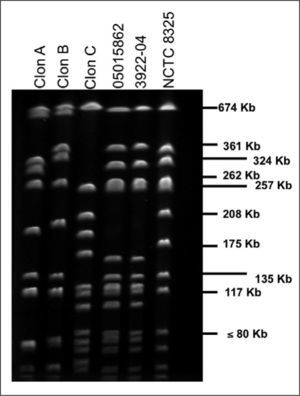
Se realizó una reacción en cadena de la polimerasa (PCR) múltiple en las dos primeras cepas de SARM del paciente (la del BAS y la del exudado nasal) para los genes mecA (resistencia a la meticilina), nuc (específico de S. aureus) y luk-PV (producción de LPV)3. En ambas cepas, la PCR fue positiva a los tres genes. Se utilizó como control positivo la cepa de SARM comunitario 3922-04, aislada en un absceso glúteo de un niño de origen ecuatoriano y proporcionada por la doctora Emilia Cercenado, del Hospital Gregorio Marañón de Madrid5. Se efectuó otra PCR múltiple para la tipificación del complejo del gen de la recombinasa del casete cromosómico (ccr)6, en la que presentaron el casete cromosómico estafilocócico mec (SCCmec) de tipo IV. En el estudio de epidemiología molecular por electroforesis en campo pulsado (ECP), usando SmaI como enzima de restricción, las dos cepas del paciente fueron idénticas entre sí, diferentes de los tres clones intrahospitalarios mayoritarios en Mallorca (clones A, B, C)7, e interesantemente presentaron un patrón de bandas idéntico al de la cepa de referencia 3922-04 (Figura 1).
Figura 1. Electroforesis en campo pulsado de cepas de SARM usando SmaI como enzima de restricción. Carriles: 1 Clon A, 2 Clon B, 3 Clon C (EMRSA-15), 4 cepa 05015862, 5 cepa 3922-04 productora de LPV (proporcionada por la doctora Cercenado), 6 cepa control de Staphylococcus aureus NCTC 8325 utilizada como marcador de peso molecular.
La neumonía producida por cepas de S. aureus productoras de LPV se caracteriza por ser más frecuente en adultos jóvenes previamente sanos y se suele manifestar con fiebre alta, hemoptisis, elevada frecuencia cardíaca y leucocitopenia, con una elevada mortalidad8. Recientemente, se están detectando en nuestro país algunas neumonías causadas por cepas de SARM productoras de LPV en localizaciones geográficas diversas como Tenerife9 (clon ST125-MRSA-IV) y Galicia10 (clon ST80-MRSA-IV), aunque, actualmente, el genotipo predominante en España entre las cepas de SARM productoras de LPV es el ST8-MRSA-IV, relacionado con el clon USA300, que es la cepa de SARM comunitaria más prevalente en los Estados Unidos11.
El patrón de ECP de nuestra cepa, así como el de la cepa 3922-04, es idéntico al del clon (D1) descrito por primera vez en Madrid en 2003, responsable de varias infecciones cutáneas de origen extrahospitalario, particularmente en la población pediátrica12. Aunque no se ha realizado tipificación mediante multilocus sequence typing (MLST) de nuestra cepa, este clon parece pertenecer al ST8-MRSA-IV (Fernando Chaves, comunicación personal).
A pesar de ser la neumonía de adquisición nosocomial, lo más probable es que el paciente estuviera previamente colonizado por esta cepa en la orofaringe, puesto que la colonización por SARM puede durar de meses a años. Posteriormente, el paciente, tras la intubación y el tratamiento antibiótico con amoxicilinaácido clavulánico como factores predisponentes, desarrollaría la neumonía por la aspiración de las secreciones orofaríngeas. Un estudio estima que hasta en el 80% de los casos globales de infección nosocomial por S. aureus, el paciente estaba colonizado por este microorganismo antes del ingreso13. Además, hasta el momento, esta cepa no se ha detectado en ningún otro paciente ingresado en nuestro hospital, incluyendo un estudio de colonización de SARM efectuado en los pacientes ingresados en la misma unidad de UCI, lo que va más a favor de la adquisición extrahospitalaria de dicha cepa. En cualquier caso, la emergente diseminación de clones de SARM productores de LPV en España obliga a mantener una vigilancia activa de este fenómeno por sus notables consecuencias clínicas y terapéuticas.
AgradecimientosAgradecemos a la doctora Emilia Cercenado el proporcionarnos la cepa de SARM comunitaria productora de LPV 3922-04 utilizada como control y al doctor Fernando Chaves el compartir con nosotros datos no publicados.