Introducción
Acinetobacter baumannii es un bacilo gramnegativo que se encuentra frecuentemente colonizando y/o infectando pacientes ingresados en hospitales españoles 1. Aunque se han comunicado casos de infecciones adquiridas en la comunidad, A. baumannii está generalmente asociado a brotes de infecciones nosocomiales en pacientes debilitados. En los últimos años, ha habido un incremento en el número de infecciones intrahospitalarias causadas por este microorganismo 1. La capacidad de A. baumannii para causar infecciones nosocomiales se relaciona con su habilidad para desarrollar rápidamente resistencia a los antibióticos, junto con la capacidad que tiene este organismo para sobrevivir durante mucho tiempo en el hábitat hospitalario 2.
El elevado nivel de resistencia a los agentes antimicrobianos ocasiona frecuentemente un problema para elegir el antimicrobiano adecuado para el tratamiento de infecciones ocasionadas por este microorganismo. De hecho, en estos momentos, la mayoría de las cepas de A. baumannii que causan infecciones nosocomiales son resistentes a múltiples antibióticos, incluyendo en ocasiones a los carbapenemes, considerados de elección para el tratamiento de infecciones graves ocasionadas por patógenos multirresistentes 3. Por este motivo, es interesante investigar todas las potenciales alternativas terapéuticas. Recientemente, Wood et al 4 han descrito que la doxiciclina y minociclina podrían ser una posible opción terapéutica para tratar infecciones por A. baumannii.
Las tetraciclinas son antibióticos de amplio espectro que presentan un efecto bacteriostático debido a la asociación reversible entre el antibiótico y el ribosoma 5. Estos antibióticos actúan uniéndose a la subunidad 30S del ribosoma de la bacteria durante la fase inicial de la síntesis de proteínas; de este modo, evitan la unión del aminoacyl-tRNA a su lugar de unión en el ribosoma 6.
Esta clase de antibióticos ha sido ampliamente usada, pero después de su introducción en la agricultura y para uso veterinario, la resistencia a estos antibióticos aumentó considerablemente. Uno de los problemas ha sido el uso de tetraciclinas como promotores de crecimiento y en 1969, el Swann report sugirió que el uso de dosis subterapéuticas de antibióticos podría contribuir al incremento de bacterias patógenas en humanos resistentes a estos antibióticos 5.
Los principales mecanismos de resistencia a tetraciclinas son: a) la protección ribosomal, y b) la expulsión activa 6,7. La protección ribosomal es debida a la unión de una proteína citoplasmática al ribosoma que impedirá que la tetraciclina se una a esta diana 6. Uno de los genes relacionados con la protección ribosomal es tetM; este gen se ha descrito en un aislamiento clínico de A. baumannii, sin embargo tiene una baja prevalencia en aislamientos clínicos 8. El mecanismo de resistencia mejor estudiado es la expulsión activa de las tetraciclinas. Los genes tet codifican una proteína de membrana citoplasmática (Tet) que actúa como un transportador activo; esta proteína intercambia un protón por un complejo tetraciclina-catión 6. El proceso de resistencia está regulado por 2 genes: uno codifica una bomba de expulsión activa y el otro una proteína represora; la actividad de estos genes está regulada por la presencia o ausencia de tetraciclina 5. En bacterias gramnegativas, los genes que más comúnmente producen resistencia a tetraciclina son tetA-tetE, tetG y tetH. El gen tetA, junto con el gen tetR (codifica la proteína reguladora de tetA) se han localizado en un transposón en aislamientos clínicos de A. baumannii 9, lo que indica la posibilidad de adquisición por transferencia horizontal entre microorganismos. TetA y tetB son los determinantes de resistencia a tetraciclinas más ampliamente distribuidos en Enterobacteriaceae7.
El objetivo de este estudio fue estudiar el predominio de los genes tetA y tetB en una colección de cepas de A. baumannii no relacionadas epidemiológicamente, aisladas de diversos hospitales españoles.
Métodos
Cepas
En este estudio se analizaron un total de 79 cepas representantes de cada uno de los 79 clones no relacionados entre ellos por los criterios y métodos anteriormente referidos 1. Brevemente: las cepas de A. baumannii habían sido recogidas en 25 hospitales españoles participantes en el estudio GEIH Ab 2000. Estas cepas fueron identificadas como A. baumannii mediante ARDRA (análisis del patrón de restricción resultante de la digestión con enzimas de restricción de elevada frecuencia de corte del producto de amplificación del ADNr 16S). La relación epidemiológica se determinó mediante análisis del cromosoma bacteriano digerido con una enzima de restricción de baja frecuencia de corte SmaI y electroforesis de campo pulsado (PFGE).
PCR de los genes tetA y tetB
La detección de los genes tetA y tetB se hizo mediante reacción en cadena de la polimerasa (PCR) con cebadores específicos para tetA ( 5'-GTA ATT CTG AGC ACT GTC GC-3' y 5'-CTG CCT GGA CAA CAT TGC TT-3') y para tetB ( 5'-TTG GTT AGG GGC AAG TTT TG-3' y 5'-GTA ATG GGC CAA TAA CAC CG-3'). Los controles utilizados fueron cepas de Salmonella sp. procedentes del Hospital Clínic, Barcelona, que contenían los genes tetA y tetB. Una colonia de cada aislamiento clínico fue resuspendida en 25 μl de agua y hervida durante 10 min. La amplificación se realizó usando 200 μM dNTPs, 0,5 μM de cada cebador y 2,5 unidades de Taq polimerasa en un volumen final de 50 μl. Las condiciones de amplificación fueron de 30 ciclos de 94 °C durante 1 min, 55 °C durante 1 min y 72 °C durante 1 min, con una extensión final de 72 °C durante 5 min. El producto de PCR fue separado en un gel de agarosa al 1,5%. Se tomó una cepa en representación de cada uno de los 59 clones resistentes a tetraciclina (40 de estos clones también eran resistentes a minociclina) para estudiar el predominio de los genes tetA y tetB (tabla 1).
Determinación de la sensibilidad a los antimicrobianos
La sensibilidad a tetraciclina y minociclina fue determinada por E-test siguiendo las instrucciones de los productores (AB Biodisk®, Sölna, Sweden). Se tomó como punto de corte para tetraciclina una CIM de 16 mg/l (las cepas con una CIM de 16 mg/l se consideraron resistentes) y para minociclina una CIM > 1 mg/l (las cepas con una CIM de 1 mg/l se consideraron sensibles).
Resultados y discusión
De 221 cepas estudiadas, 131 (59,3%) fueron resistentes a tetraciclina y minociclina, 40 (18%) fueron resistentes a tetraciclina, pero sensibles a minociclina, y el resto (22,6%) sensibles. Agrupadas por clones, 59 (74,7%) de los 79 clones eran resistentes a tetraciclina, de los cuales 40 (50,6% del total de clones) eran también resistentes a minociclina. No había ninguna cepa sensible a tetraciclina y resistente a minociclina.
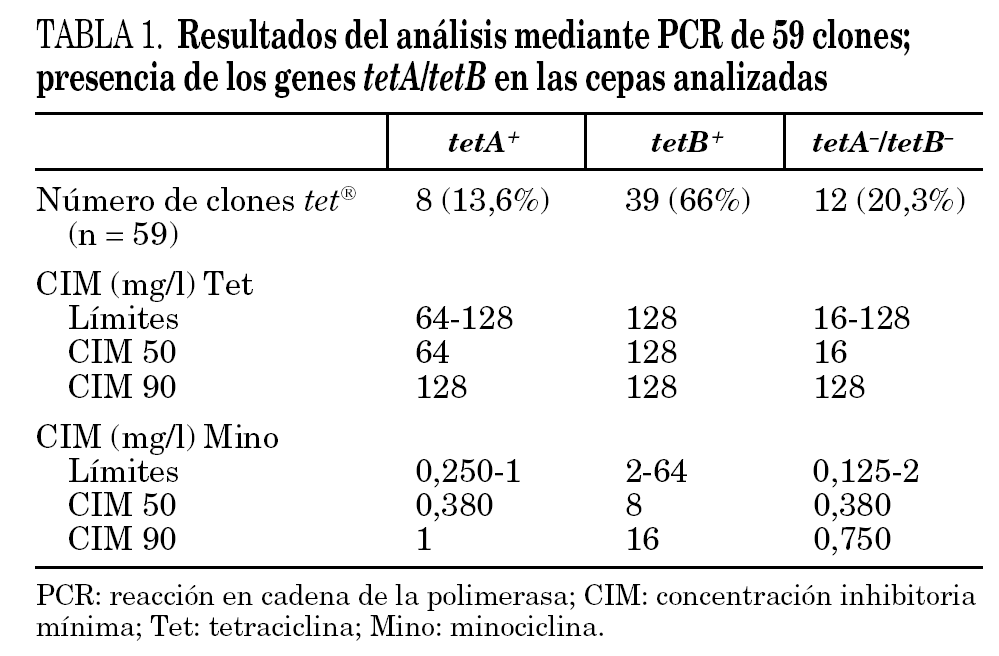
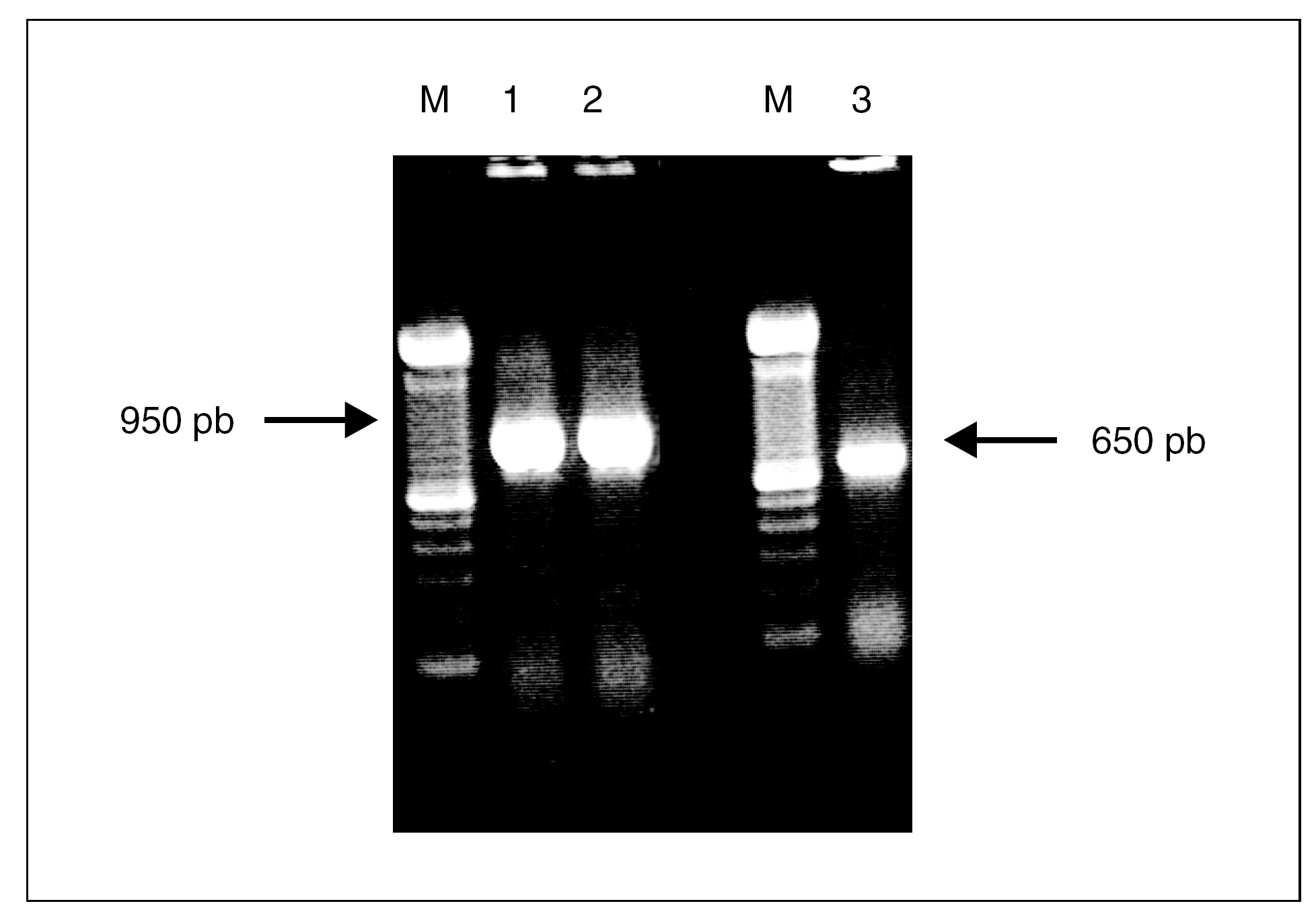
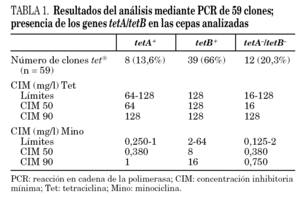
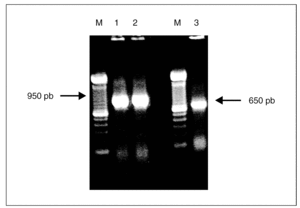
Las cepas de A. baumannii elegidas para este estudio fueron analizadas mediante PCR con cebadores específicos para los genes tetA y tetB. El tamaño de los productos de PCR era de 950 pb para el gen tetA y 650 pb para tetB y se correspondía con el tamaño de los controles positivos usados para estos 2 genes (fig. 1). El análisis por PCR de las cepas dio como resultado que un total de 39 clones (66%) poseían el gen tetB, mientras que sólo 8 clones (13,6%) fueron positivos para el gen tetA. El análisis de la cepa representativa de cada uno de los 12 clones restantes no mostró la presencia de tetA ni tetB, pese a presentar un fenotipo propio de las tetA+ (tabla 1). La CIM de las cepas con el gen tetB eran siempre de 128 mg/l, mientras que la mitad de las cepas que tenían el gen tetA tenían una CIM de 64 mg/l.
Figura 1. Amplificación mediante PCR de los genes tetA y tetB. Carriles M, marcador de ADN de 100 pb; carriles 1 y 2, gen tetA; carril 3, gen tetB.
Los resultados también demostraron que hay una relación entre la presencia del gen tetB y la resistencia a tetraciclina y minociclina. Las cepas resistentes a tetraciclina presentaron esta resistencia por adquisición del gen tetA, tetB o posiblemente otro gen tet. Treinta y nueve de las 40 cepas resistentes a tetraciclina y minociclina adquirieron esta resistencia debido a la presencia del gen tetB; se encontró sólo una cepa que no tenía el gen tetB y que, sin embargo, era resistente a tetraciclina y minociclina (en este caso podría haber otro gen que afectara la resistencia a la minociclina). Esta cepa tiene una CIM a tetraciclina y minociclina que es similar a otras cepas (CIM tetraciclina = 128 mg/l y CIM minociclina = 2 mg/l); todas las cepas que tenían esta CIM eran positivas para el gen tetB. Estos resultados confirman la conclusión de Guardabassi et al10 cuando afirmaba que los genes tetA y tetB estaban presentes frecuentemente en aislamientos clínicos de A. baumannii resistentes a tetraciclina, mientras que eran infrecuentes en cepas acuáticas de Acinetobacter spp. 10.
Las tetraciclinas no han sido generalmente usadas para tratar infecciones causadas por A. baumannii, y aun así, la resistencia de este microorganismo a las tetraciclinas es muy alta. Los genes tetA y tetB están ampliamente diseminados entre las bacterias gramnegativas y se encuentran normalmente localizados en transposones que a su vez están insertados dentro de plásmidos, lo que les proporciona movilidad y les facilita la diseminación entre diferentes tipos de bacteria. A. baumannii puede colonizar el tracto intestinal de pacientes hospitalizados fundamentalmente en hospitales con una endemia elevada 11. Este nicho ecológico presenta las condiciones óptimas para que A. baumannii adquiera los genes tetA y tetB mediante transferencia horizontal a partir de otras bacterias gramnegativas presentes en él.
El gen tetB codifica la bomba de expulsión más eficaz y de esta manera proporciona resistencia a tetraciclina y también a minociclina 7. Los resultados obtenidos en este trabajo están de acuerdo con esta descripción del gen tetB ya que el 95% de las cepas resistentes a minociclina tenían el gen tetB, en contraposición a las cepas resistentes únicamente a tetraciclina, en las cuales diferentes genes tet podían estar involucrados en esta resistencia.
En un estudio piloto reciente realizado en Estados Unidos, Wood et al 4, sugieren que la minociclina o la doxicilina podrían ser efectivas en el tratamiento de neumonías causadas por cepas de A. baumannii multirresistentes. Según este estudio, la terapia con minociclina o doxicilina fue efectiva en 6 de los 7 pacientes incluidos. Sin embargo, en España la utilización de esta clase de antibióticos queda invalidada por la elevada frecuencia de resistencias 12.
Como conclusión se puede decir que las cepas clínicas de A. baumannii aisladas en España son frecuentemente resistentes a tetraciclina debido a la adquisición de los genes tetB y, en menor medida tetA. El menor número de cepas resistentes a minociclina es debido a que hay menos genes que proporcionan resistencia a este antimicrobiano; en este estudio, únicamente TetB proporcionaba resistencia a minociclina.
Agradecimiento
Los autores agradecen al Grupo de Estudio de Infección Hospitalaria (GEIH) su colaboración para el desarrollo de este estudio. Este trabajo ha sido apoyado parcialmente por una ayuda de investigación de Merck Sharp & Dohme, España, y por la Red Española de Investigación en Patología Infecciosa (Instituto de Salud Carlos III, C03/14).
Relación de miembros del GEIH
Javier Ariza, M.ª Ángeles Domínguez, Miquel Pujol y Fe Tubau (Ciutat Sanitaria i Universitaria Vall d'Hebron, Barcelona); Juan Pablo Horcajada y Anna Ribera (Hospital Clínic i Provincial, Barcelona); Jordi Cuquet, Carmina Martí y Dolors Navarro (Hospital General de Granollers, Barcelona); Francisco Álvarez Lerma y Margarita Salvadó (Hospital del Mar, Barcelona); Fernando Chaves y Antonio Sánchez Porto (Hospital del SAS de la Línea de la Concepción, Cádiz); Fernando Rodríguez López y Elisa Vidal (Hospital Universitario Reina Sofía, Córdoba); Alejandro Beceiro (Hospital Juan Canalejo, A Coruña); Manuel de la Rosa (Hospital Virgen de las Nieves, Granada); Fernando Chaves y Manuel Lisazoain (Hospital 12 de Octubre, Madrid); Paloma García Hierro y Josefa Gómez Castillo (Hospital Universitario de Getafe, Madrid); Belén Padilla (Hospital Universitario Gregorio Marañón, Madrid); Jesús Martínez Beltrán (Hospital Ramón y Cajal, Madrid); Manuel López Brea y Lucía Pérez (Hospital Universitario de La Princesa, Madrid); Manuel Causse y Pedro Manchado (Complejo Hospitalario Carlos Haya, Málaga); Inés Dorronsoro y José Javier García Irure (Hospital de Navarra, Pamplona); Almudena Tinajas (Hospital Santo Cristo de Piñor, Orense); Gloria Esteban y Begoña Fernández (Hospital Santa María Nai, Orense); Nuria Borrell y Antonio Ramírez (Hospital Universitario Son Dureta, Palma de Mallorca); Isabel Álamo y Diana García Bardeci (Hospital de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria); José Ángel García Rodríguez (Hospital Universitario de Salamanca); Carmen Fariñas y Carlos Fernández Mazarrasa (Hospital Universitario Marqués de Valdecilla, Santander); Eduardo Varela y Mercedes Treviño (Hospital Universitario de Santiago de Compostela, A Coruña); Ana Barreros y Trinidad Prados (Hospitales Universitarios Virgen del Rocío, Sevilla); Frederic Ballester (Hospital Universitari Sant Joan de Reus, Tarragona); María Eugenia García Leoni y Ana Leturia (Hospital Nacional de Parapléjicos, Toledo); Susana Brea y Enriqueta Muñoz (Hospital Virgen de la Salud, Toledo); Joaquina Sevillano e Irene Rodríguez Conde (Policlínico de Vigo SA, Vigo).
Correspondencia: Dr. J. Vila.
Servicio de Microbiología. Centro de Diagnóstico Biomédico.
Hospital Clínic. Villarroel, 170.
08036 Barcelona. España.
Correo electrónico: jvila@ub.edu
*Al final del artículo se ofrece la relación de los miembros del Grupo de Estudio de Infección Hospitalaria (GEIH).Manuscrito recibido el 24-2-2005; aceptado el 12-4-2005.