Introducción
Durante muchos años las principales intervenciones para mejorar y prolongar la vida de las personas infectadas por el virus de la inmunodeficiencia humana (VIH) fueron la profilaxis de las infecciones oportunistas y la asistencia por profesionales con experiencia en sida1,2. Aunque en los países desarrollados, la incidencia de estas infecciones se redujo de forma drástica coincidiendo con el uso del tratamiento antirretroviral de gran actividad (TARGA)3,4, en los países con pocos recursos económicos, estas infecciones son todavía muy frecuentes y constituyen la principal causa de mortalidad asociada al VIH.
Sabemos desde hace algunos años que la inhibición de la replicación viral por el TARGA evita el deterioro inmunitario en los pacientes infectados por el VIH. Además, en aquéllos con enfermedad avanzada, estos tratamientos dan lugar, a partir de 3 a 6 meses, a un aumento paulatino de linfocitos T CD4+ naïve y de memoria que tienen capacidad de proliferar in vitro y de generar citoquinas en respuesta a patógenos oportunistas. Además, se recupera la respuesta retardada a antígenos y se normaliza progresivamente la activación inmunitaria inespecífica5,6.
Sin género de dudas, el TARGA es la mejor estrategia para prevenir las infecciones oportunistas en estos enfermos; lo que no equivale a decir que debamos olvidarnos de las profilaxis. En la práctica clínica, estas últimas continúan siendo necesarias en los países con pocos recursos económicos, en pacientes muy inmunodeprimidos hasta que el TARGA logra sus efectos, en los que no desean o no pueden tomar TARGA, en aquellos en los que éste fracasa y en el pequeño grupo de infectados que son incapaces de recuperar cifras adecuadas de linfocitos T CD4+ a pesar de una buena inhibición de la replicación viral. Es importante mencionar finalmente que la prevención de las infecciones oportunistas es un campo en donde todavía se lleva a cabo investigación clínica, especialmente en el de la retirada de las profilaxis secundarias.
Por todos los motivos antes expuestos, la Junta Directiva de GESIDA y la Secretaría del Plan Nacional sobre el SIDA han considerado conveniente la actualización de sus recomendaciones sobre prevención de las infecciones oportunistas en pacientes adultos y adolescentes infectados por el VIH7, incorporando las aportaciones de estos últimos años. Para la clasificación de la fuerza y de la calidad de las recomendaciones hemos seguido en esta ocasión el sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de los Estados Unidos de América (USPHS) (tabla 1)8.
Infecciosas (IDSA) y el Servicio de Salud Pública de los Estados Unidos de América (USPHS)
Profilaxis de las infecciones causadas por virus
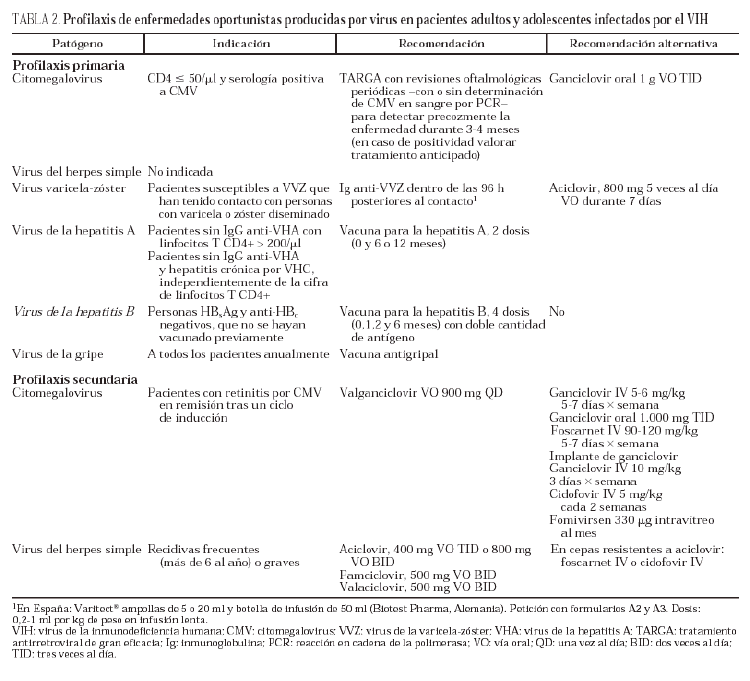
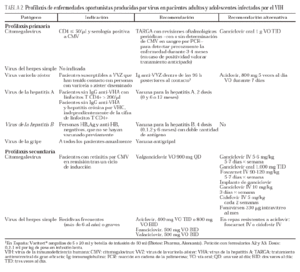
Citomegalovirus (tabla 2)
Antes de la introducción del TARGA desarrollaban enfermedad por citomegalovirus (CMV) aproximadamente el 45% de los pacientes coinfectados por el VIH y CMV. Además, en aquellos coinfectados que tenían una cifra de linfocitos T CD4+ < 100/μl, el 22% desarrollaba en el plazo de 2 años una retinitis por CMV; un problema grave e incapacitante cuyas frecuentes recaídas y complicaciones podían llegar a ocasionar pérdida de la visión9.
El TARGA redujo drásticamente la incidencia de esta enfermedad y cambió de forma espectacular su historia natural con prolongación de la supervivencia y disminución de las recaídas y complicaciones10,11. De hecho, en un gran ensayo clínico aleatorizado en donde se comparaban tres tratamientos anti-CMV, la frecuencia de nueva enfermedad por CMV fue menor en los pacientes que recibieron inhibidores de la proteasa (IP) independientemente del grupo terapéutico asignado12. Por todas estas razones, se puede concluir que el TARGA desempeña en la actualidad un papel de primer orden en la profilaxis y el tratamiento de la enfermedad por CMV independientemente del antiviral que estén recibiendo los pacientes. Un efecto adverso que conviene tener presente en los pacientes con retinitis por CMV que inician TARGA es la vitritis por recuperación inmune que en ocasiones produce una pérdida importante de la visión13-15.
Medidas para prevenir la exposición al patógeno
Los pacientes que pertenezcan a grupos de población con baja frecuencia de infección por CMV y en los que no se pueda presumir la seropositividad frente al virus deben ser estudiados serológicamente para el CMV, estos pacientes incluyen entre otros a los que nunca han consumido drogas por vía parenteral y a los varones que no han tenido relaciones homosexuales (B3). Los pacientes con serología negativa a CMV no deben recibir transfusiones de hemoderivados procedentes de pacientes con serología positiva a CMV (B3) y deben evitar los contactos sexuales sin preservativo (AII). El riesgo de adquisición de CMV puede disminuirse mediante buenas prácticas higiénicas como el lavado de manos. Dichas prácticas higiénicas son particularmente importantes en ambientes como guarderías donde el riesgo de contagiarse con CMV es mayor (B3)16.
Profilaxis primaria
Se han publicado dos ensayos clínicos prospectivos, aleatorizados, doble ciego y controlados con placebo de profilaxis primaria con ganciclovir por vía oral (VO) en pacientes coinfectados por el VIH y CMV. En el primero (con más de 700 pacientes con una cifra de linfocitos T CD4+ ≤ 50/μl o < 100/μl y antecedente de infección indicativa de sida) la incidencia acumulada de enfermedad visceral por CMV a los 12 meses fue del 14% en el grupo de ganciclovir y 26% en el grupo placebo y la incidencia acumulada de retinitis por CMV fue del 12 y 24%, respectivamente (riesgo relativo [RR] 0,49; p < 0,001); no se detectaron diferencias en mortalidad17. El segundo, con más de 900 pacientes, difería del anterior en dos puntos importantes. En primer lugar, el criterio de inclusión en el estudio respecto a la cifra basal de linfocitos T CD4+ era ≤ 100/μl. En segundo lugar, cuando el estudio estaba en marcha, tras conocerse los resultados del estudio anterior, se aceptó que todos los pacientes tuvieran acceso a ganciclovir. No se encontraron diferencias con respecto a incidencia de enfermedad por CMV y mortalidad hasta la fecha de modificación del estudio ni hasta el final de éste. Sin embargo, se detectaron más efectos adversos, sobre todo neutropenia, en el grupo de ganciclovir que en el grupo de placebo18.
La profilaxis primaria con ganciclovir VO para la enfermedad por CMV no se recomienda debido a los resultados contradictorios respecto a su eficacia, el nulo impacto en la supervivencia, la posibilidad de desarrollo de resistencias, la toxicidad del fármaco y su coste (CI). La mejor estrategia preventiva es la administración de TARGA para restaurar el sistema inmunológico (AI).
Es muy importante tener presente que en los pacientes que inician TARGA con linfocitos T CD4+ < 50/μl existe un período de riesgo de 3 a 4 meses durante los cuales pueden sufrir retinitis por CMV (y otras infecciones oportunistas), incluso con cifras de linfocitos T CD4+ > 100/μl. En estos casos es aconsejable realizar estudios de antigenemia o reacción en cadena de la polimerasa (PCR) de CMV dado que la probabilidad de desarrollar R-CMV es del 38% para los pacientes con una prueba positiva frente a 2% para los pacientes con una prueba negativa (p < 0,001) (CII)10. Los pacientes con una prueba positiva deben ser revisados mediante fundoscopia cada 2 o 4 semanas durante los primeros 3 meses para detectar precozmente la enfermedad (CIII). En estos casos puede que tenga sentido administrar tratamiento anticipado anti-CMV, una intervención que se está evaluando actualmente mediante un ensayo clínico aleatorizado (estudio ACTG A5030). En este estudio se aspira a incluir a 750 pacientes infectados por el VIH con serología positiva para CMV y con cifra de linfocitos T CD4+ < 100/μl a pesar del TARGA. Todos serán revisados cada 2 meses mediante PCR del ADN del CMV y cada 6 meses con una exploración oftalmológica. Aquellos en los que se detecte viremia de CMV serán aleatorizados para recibir valganciclovir o placebo. Actualmente se han incluido más de la mitad de los pacientes previstos y tendremos que esperar unos años para conocer los resultados del estudio.
Profilaxis secundaria
La estrategia terapéutica de la retinitis por CMV está bien delineada desde hace años; consta de una fase de inducción que pretende controlar la infección seguida de una fase de mantenimiento para evitar o retrasar las recaídas9,19. Para esta segunda indicación disponemos de fármacos que se pueden administrar por vía intravenosa (IV) como ganciclovir, foscarnet y cidofovir; fármacos que nunca han sido comparados entre sí y que tienen un perfil toxicológico diferente. Por VO se dispone de ganciclovir y de valganciclovir que es el éster de valina del ganciclovir. La biodisponibilidad del ganciclovir VO es muy pobre, lo que le resta eficacia con respecto al ganciclovir IV y obliga a los pacientes a tomar un gran número de comprimidos20. El valganciclovir, sin embargo, se metaboliza por enzimas del tubo digestivo y se transforma prácticamente en un 100% en ganciclovir21. En un ensayo clínico aleatorizado y abierto llevado a cabo con 160 pacientes con sida y retinitis por CMV recién diagnosticada se ha comprobado que el valganciclovir VO es tan eficaz como el ganciclovir IV como tratamiento de inducción y resulta muy cómodo y eficaz para la fase de mantenimiento12. Por vía tópica se dispone del implante de ganciclovir (sin rival para el tratamiento de la retinitis por CMV) aunque antes del TARGA necesitaba el uso concomitante de ganciclovir VO para evitar tanto la enfermedad del ojo vecino como la extraocular22. En un estudio reciente que comparó el implante de ganciclovir con o sin ganciclovir VO y ganciclovir IV se comprobó que en el subgrupo de pacientes tratados con TARGA, la incidencia de recaídas o de nueva enfermedad fue baja y de la misma magnitud en todos los grupos23. Por vía tópica también puede administrarse el fomivirsen, un oligonucleótido antisentido que inhibe la replicación del CMV y que se administra por inyección intravítrea. En la fase de mantenimiento la dosis es de 330 μg al mes. Los efectos adversos son aumento de la presión e inflamación ocular transitorios o reversibles con tratamiento esteroideo tópico; en la actualidad está indicado para el tratamiento de las recidivas24.
En vista de las numerosas opciones para la profilaxis secundaria de la retinitis por CMV lo recomendable es elegir el fármaco que mejor se adapte al paciente25 aunque dada su demostrada eficacia y su comodidad, podría considerarse al valganciclovir VO como fármaco de elección (AI). De forma general, no debería utilizarse tratamiento de mantenimiento exclusivo con ganciclovir VO, de forma prolongada, en pacientes que no pueden recibir TARGA o en los que no se espera una mejoría inmunológica (DIII).
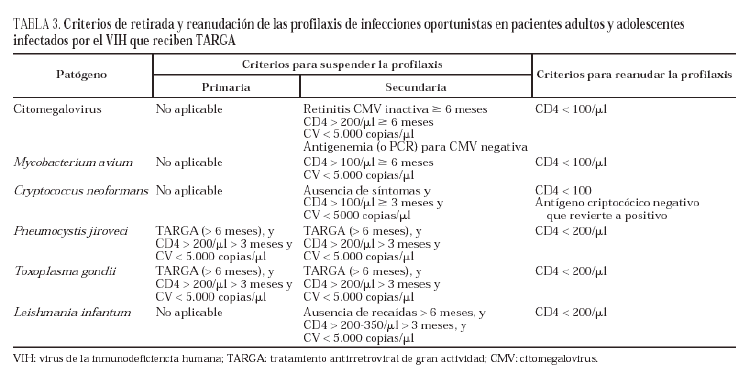
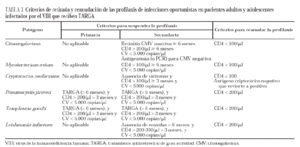
Retirada de la profilaxis secundaria
Varios estudios con reducido número de pacientes han mostrado la posibilidad de retirar la profilaxis secundaria anti-CMV en pacientes que se recuperan con el TARGA26,27. En los últimos años se han publicado cuatro estudios de retirada de la profilaxis secundaria anti-CMV. En el primero se incluyeron 14 pacientes y no se detectaron recaídas tras una mediana de seguimiento de 16,4 meses28. En el segundo estudio, 3 de 22 pacientes que suspendieron la profilaxis secundaria sufrieron una recidiva de la retinitis por CMV29. En los 3 casos, los pacientes habían experimentado fracaso al TARGA y tenían una cifra de linfocitos T CD4+ < 50/μl en el momento de la recaída. El tercer estudio fue multinacional e incluyó a 48 pacientes de los que dos sufrieron una recaída de la enfermedad por CMV: retinitis en un caso y neuropatía periférica en el segundo. Sorprendentemente, las cifras de linfocitos T CD4+ en el momento de la recaída fueron de 352/μl y de 106/μl, respectivamente30. Finalmente, en un cuarto estudio multicéntrico español, se retiró la profilaxis secundaria a 36 pacientes y tras una mediana de seguimiento de 90 semanas, no se observó reactivación o progresión de la retinitis en los 35 que tuvieron una buena respuesta al TARGA. Sin embargo, en un paciente se documentó recaída de la retinitis a las 44 semanas de haber suspendido la profilaxis y en el contexto de fracaso inmunológico. En el momento de la recaída la cifra de linfocitos T CD4+ era de 62/μl31.
Tomados en conjunto, los resultados de estos cuatro estudios avalan la seguridad de la interrupción de la profilaxis secundaria anti-CMV en pacientes con sida y retinitis por CMV inactiva que experimentan un incremento en la cifra de linfocitos T CD4+ con el TARGA. Sin embargo, se desconoce cuál es la cifra de linfocitos T CD4+ a partir de la cual resulta seguro suspender la profilaxis. Si se combinan los datos de los cuatro estudios (79 pacientes) se puede observar que la mediana de linfocitos T CD4+ en el momento de la retirada de la profilaxis fue de 269/μl con un rango intercuartílico de 167-360/μl. Más de dos tercios de los pacientes tenían linfocitos T CD4+ > 200/μl, menos de un tercio tenía linfocitos T CD4+ entre 100 y 200/μl y tan sólo 3 pacientes tenían linfocitos T CD4+ < 100/μl. Todo lo anterior permite concluir que la retirada de la profilaxis secundaria es una opción razonable y segura en pacientes con retinitis por CMV inactiva y que tienen una buena respuesta al TARGA caracterizada por una cifra de linfocitos T CD4+ superior a 200/ml durante al menos 6 meses (BII). En algunos casos puede considerarse la retirada de la profilaxis secundaria anti-CMV en pacientes que presentan una cifra de linfocitos T CD4+ entre 100 y 200/μl dado que la mayoría de los pacientes que recayeron en los estudios mencionados tenían CD < 100/μl (CIII). Tras la retirada de la profilaxis secundaria, los pacientes pueden ser monitorizados con determinaciones periódicas de la cifra de linfocitos T CD4+ (BIII). En aquellos que experimenten fracaso inmunológico, se debe optar o bien por revisiones oftalmológicas frecuentes o por reanudación de la profilaxis secundaria, dependiendo del riesgo que tengan de sufrir una pérdida irrecuperable de la visión (BIII) (tabla 3).
Otros virus (tabla 2)
Los pacientes infectados por el VIH padecen con frecuencia infección mucocutánea y digestiva por virus del herpes simple (VHS) pero no se recomienda profilaxis primaria frente a este virus (DIII). Las recaídas responden bien al tratamiento, por lo que tampoco se aconseja instaurar tratamiento supresor exceptuando al herpes genital con recaídas frecuentes (≥ 6 recidivas al año) y/o graves (AI). Para el este fin se recomienda lo siguiente: para pacientes infectados por el VIH: aciclovir (400-800 mg dos a tres veces al día) o famciclovir (500 mg dos veces al día) o valaciclovir (500 mg dos veces al día)32. En infecciones por cepas de VHS resistente a aciclovir debe usarse foscarnet IV o cidofovir IV o tópico (AII). Dado que la frecuencia de recaídas se reduce con el tiempo en muchos pacientes, se recomienda de forma periódica (p. ej., cada año) valorar la retirada del tratamiento supresor (BII)32.
No se debe vacunar con el virus de la varicela-zóster (VVZ) a personas infectadas por el VIH, pero sí a las que conviven con ellos en caso de que sean susceptibles al VVZ (aquellos sin anticuerpos específicos IgG) (BIII). Los pacientes con infección por el VIH susceptibles al VVZ deben evitar los contactos con personas con varicela o zóster (AII). Para la profilaxis postexposición en sujetos susceptibles se recomienda administrar gammaglobulina específica dentro de las 96 h siguientes al contacto (AIII). Otra opción más barata y logísticamente más sencilla es la administración de aciclovir oral (CIII), aunque la eficacia de esta medida sólo se ha probado en niños inmunocompetentes tras exposición domiciliaria16,33,34.
Se recomienda la vacunación frente al virus de la hepatitis A (VHA) para todos los pacientes infectados por el VIH que no tengan anticuerpos IgG anti-VHA y que presenten una cifra de linfocitos linfocitos T CD4+ > 200/μl (AIII)35. Esta práctica es especialmente recomendable en pacientes con hepatopatía crónica por VHC dado que existe riesgo de hepatitis fulminante y muerte en la superinfección por VHA36.
También se recomienda la vacunación frente al virus de la hepatitis B (VHB) a todos los pacientes infectados por el VIH que sean negativos para el antígeno de superficie de la hepatitis B (HBsAg) y antihepatitis B del core (anti-HBc) total y que no se hayan vacunado previamente (AIII). La pauta estándar de vacunación frente al VHB son tres inyecciones (0, 1 y 6 meses) con 20 μg de antígeno. Sin embargo, la respuesta inmunogénica con la pauta estándar de administración de la vacuna de VHB está disminuida en los pacientes infectados por el VIH y guarda relación con la cifra de linfocitos T CD4+. Dado que la respuesta a la vacuna frente al VHB en pacientes inmunodeprimidos puede incrementarse hasta el 90% con mayores dosis de antígeno y/o aumentando el número de inyecciones, algunos organismos como GESIDA y el Plan Nacional sobre el Sida recomiendan para este tipo de pacientes la vacunación con cuatro inyecciones (0, 1, 2 y 6 meses) con doble cantidad de antígeno (40 μg en vez de 20 μg) (BIII)35.
Se sabe poco acerca de la frecuencia y consecuencias de la coinfección por el VIH y virus de la gripe. En algunos estudios retrospectivos se ha encontrado que la gripe tiene mayor morbimortalidad en pacientes infectados por el VIH que entre la población general. Sin embargo, existen pruebas que nos indican que los ingresos hospitalarios por gripe han disminuido de forma significativa a partir de la introducción del TARGA, alcanzando tasas similares a las de otros grupos de población considerados de "alto riesgo"37. Por estas razones y puesto que la vacunación antigripal puede producir un título de anticuerpos protectores en pacientes infectados por el VIH, se recomienda que todos ellos (incluso las mujeres embarazadas) reciban la vacuna con carácter anual (AIII)16,38.
El TARGA es la única intervención que puede prevenir la leucoencefalopatía multifocal progresiva y que puede interrumpir el ciclo lítico del virus JC. Según datos recientes, un tercio de los pacientes con sida y leucoencefalopatía multifocal progresiva que reciben TARGA sobreviven y, de ellos, aproximadamente la mitad experimentan algún grado de mejoría en la función neurológica. La mortalidad es mayor en aquellos con cifra de linfocitos T CD4+ < 100/μl39.
Profilaxis de las infecciones por bacterias y micobacterias
Mycobacterium tuberculosis (tabla 4)
La infección por el VIH es el factor de riesgo más importante para la progresión de tuberculosis latente a tuberculosis activa y además favorece la progresión a enfermedad tuberculosa tras la infección de reciente adquisición40,41. Por este motivo, la notificación de casos de tuberculosis aumentó de manera significativa en los países con gran prevalencia de infección por el VIH. Afortunadamente, en diferentes países se ha constatado una disminución de casos de coinfección por el VIH y tuberculosis tras la introducción del TARGA42.
Medidas para prevenir la exposición al patógeno
Las personas infectadas por el VIH deben ser informadas sobre cómo se transmite la tuberculosis, del riesgo que tienen de desarrollarla y del significado de la prueba de Mantoux. En la medida de lo posible deben evitar trabajar en ambientes de alto riesgo como cárceles, albergues para indigentes y unidades de hospitalización con enfermos con tuberculosis activa (BIII). También deben conocer la conveniencia de consultar a su médico cuando tengan síntomas indicativos de tuberculosis o tras haber tenido contacto con una persona con tuberculosis pulmonar activa (BIII).
Profilaxis primaria
Evaluación del riesgo de desarrollo de tuberculosis. Tras la primera visita es obligado realizar la prueba de Mantoux (AI). Hace años también se recomendaban las pruebas de anergia cutánea; sin embargo, estudios recientes han mostrado su escasa consistencia y fiabilidad así como la falta de beneficio de la quimioprofilaxis en los pacientes anérgicos, especialmente si pueden recibir TARGA43-46. Por estos motivos no se recomienda actualmente realizar estas pruebas para tomar decisiones sobre el tratamiento de la infección tuberculosa latente47 (DII). Se ha sugerido que la reconstitución inmune mediada por el TARGA podría positivizar la prueba de Mantoux u otras pruebas cutáneas en pacientes previamente anérgicos47. Sin embargo, en un estudio multicéntrico español en el que se incluyeron pacientes infectados por el VIH con menos de 50 linfocitos CD4+/μl y anergia cutánea, se observó reversión de la anergia en algo más de un tercio de los pacientes que incrementaron su cifra de linfocitos CD4+ tras tratamiento prolongado con TARGA sin que se observará en ningún caso respuesta a la tuberculina48. No existe por lo tanto fundamento para repetir la prueba de Mantoux como medida de reconstitución inmune tras el TARGA. La prueba sí debe repetirse para evaluar el riesgo de conversión en personas que viven en zonas con alto riesgo de transmisión de tuberculosis activa (BIII).
Existen dos grupos de pacientes que, sin género de dudas, deben recibir tratamiento para la infección tuberculosa latente: los que tienen una prueba de Mantoux positiva (≥ 5 mm) (AI) y los que han tenido contacto estrecho con una persona bacilífera (BII). El riesgo de tuberculosis entre los pacientes anérgicos varía mucho de unos estudios a otros, por lo que no pueden darse recomendaciones universales49-51. La profilaxis está indicada en los pacientes anérgicos con mayor riesgo de infección por M. tuberculosis como son los que han tenido previamente una prueba de Mantoux positiva, los que han estado en contacto estrecho y prolongado con personas con tuberculosis activa y los que han estado durante mucho tiempo en centros penitenciarios sin recibir profilaxis adecuada (CIII). Antes de iniciar la quimioprofilaxis es importante descartar tuberculosis activa mediante evaluación clínica y radiografía de tórax; ante la menor sospecha de enfermedad tuberculosa deben realizarse además estudios microbiológicos.
Fármacos y pautas. Para la quimioprofilaxis antituberculosa en estos enfermos han demostrado eficacia la isoniazida a diario o 2 días por semana durante 6-12 meses52-55, rifampicina con pirazinamida durante 2 o 3 meses a diario56 o a días alternos57 e isoniazida con rifampicina durante 3 meses44 (AI). En las directrices más recientes de la American Thoracic Society y los Centers for Disease Control and Prevention se recomiendan pautas con isoniazida durante 9 meses y se desaconsejan las pautas de 6 o 12 meses58. Además se recomienda la supervisión directa de la quimioprofilaxis cuando se administre a días alternos, especialmente en las pautas cortas, y también cuando se utilicen pautas de 6 meses de isoniazida en personas muy inmunodeprimidas. No existen datos que hagan pensar que la administración de isoniazida durante más de 12 meses o de por vida confiera ventajas adicionales por lo que se desaconsejan estas estrategias (EIII).
En caso de infección por M. tuberculosis resistente a isoniazida puede utilizarse rifampicina sola durante 4 meses. También podría contemplarse una pauta corta de rifampicina y pirazinamida pero a la luz de lo comentado anteriormente resulta prudente evitar esta pauta cuando se pueda utilizar algún otro régimen eficaz60.
Interacciones con fármacos antirretrovirales. La isoniazida puede administrarse con cualquier combinación de antirretrovirales. La rifampicina no debe administrarse simultáneamente con algunos IP (indinavir, nelfinavir, saquinavir, amprenavir, lopinavir/ritonavir) ni con algunos inhibidores de la transcriptasa inversa no nucleósidos (ITINN) (delavirdina). Pueden administrarse con rifampicina todos los análogos de nucleósidos (ITIAN), ritonavir como único IP61 y los ITINN nevirapina y efavirenz62,63 y quizá también la combinación de dos IP64. La rifabutina se recomienda como alternativa a la rifampicina en pacientes que reciben fármacos antirretrovirales que interaccionan con esta última; aunque conviene dejar claro que no existen estudios clínicos que avalen esta recomendación. Cuando se combine con indinavir, nelfinavir o amprenavir, la rifabutina puede administrase a diario, pero a mitad de dosis o bien a dosis completas pero 2 o 3 días por semana. En estos casos también habrá que aumentar la dosis de los IP65. La rifabutina en combinación con ritonavir o con lopinavir/ritonavir debe administrarse a mitad de dosis y 2 o 3 días por semana.
La rifampicina aumenta el metabolismo hepático de la metadona y suele precipitar síntomas de abstinencia en personas en programa de deshabituación con este opiáceo. Es importante informar al paciente sobre este efecto e incrementar la dosis de metadona hasta donde sea necesario.
Vacunación con bacilo de Calmette-Guérin (BCG). Esta vacuna está contraindicada en personas infectadas por el VIH por lo controvertido de su eficacia y por el riesgo de enfermedad diseminada por BCG66 (EIII).
Profilaxis secundaria
No se recomienda profilaxis secundaria en pacientes con tuberculosis documentada (EIII).
Complejo Mycobacterium avium (tabla 4)
Medidas para prevenir la exposición al patógeno
El complejo M. avium (MAC) es un microorganismo ubicuo en el ambiente (incluyendo el agua y los alimentos) y no se conocen medidas eficaces para prevenir su adquisición.
Profilaxis primaria
La administración de claritromicina (500 mg/12 h) o azitromicina (1.200 mg, 1 vez por semana) previene la infección diseminada por MAC67,68 (AI). Sin embargo, esta estrategia no se recomienda en nuestro medio dada la baja incidencia de esta infección oportunista incluso antes de la introducción del TARGA (DIII). En un estudio de cohortes llevado a cabo en España en la era del TARGA que incluyó a 200 pacientes con cifras de linfocitos CD4+ menores de 50/μl la incidencia de infección diseminada por MAC fue de 2 casos por 100 pacientes-año. En situaciones especiales, por ejemplo en pacientes con cifras de linfocitos CD4+ persistentemente inferiores a 50/μl y sin posibilidad de recibir TARGA, puede contemplarse la profilaxis primaria con alguna de las pautas arriba mencionadas. La profilaxis primaria puede interrumpirse con seguridad en pacientes que logran mantener cifras de linfocitos CD4+ por encima de 100/μl durante períodos superiores a 3-6 meses69 (AI).
Profilaxis secundaria
Los pacientes con infección diseminada por MAC deben recibir tratamiento con claritromicina (o azitromicina como alternativa) y etambutol mientras persistan con inmunosupresión grave (AI).
Retirada de las profilaxis
Antes del TARGA se recomendaba mantener el tratamiento de mantenimiento de por vida; sin embargo, se van acumulando datos que avalan su retirada en pacientes que mantienen cifras de linfocitos CD4+ por encima de 100/μl durante más de 6 meses (BII) (tabla 3)70-73.
Otras bacterias (tabla 4)
Streptococcus pneumoniae
Existe controversia respecto a la recomendación de administrar la vacuna neumocócica a persona infectadas por el VIH. Algunos estudios observacionales han mostrado cierto grado de protección con la vacuna. Sin embargo, en un estudio aleatorizado y doble ciego llevado a cabo en África, no se encontró ningún efecto beneficioso con la vacuna y se pudo observar una asociación entre la vacunación y un mayor riesgo de enfermedad neumocócica74. En un estudio reciente donde se revisan los estudios llevados a cabo hasta la fecha, se concluye que la vacuna neumocócica no muestra beneficio y se desaconseja su uso sistemático75 (CI). En caso de utilizarla, se recomienda la administración de la vacuna neumocócica en personas con una cifra de linfocitos CD4+ superiores a 200/μl o incluso en personas con recuentos inferiores, aunque la respuesta puede ser todavía más incierta. Es probable que sea necesaria la revacunación cada 5 años, pero no existen datos que apoyen esta recomendación.
Haemophilus influenzae
Los niños infectados por el VIH deben recibir vacuna frente a H. influenzae según el calendario de vacunación habitual (AI). Esta vacuna no está indicada, ni contraindicada, en adultos.
Miscelánea
No se recomienda actualmente ninguna forma de profilaxis primaria ni secundaria de las infecciones por Salmonella no-typhi, Campylobacter spp. o Bartonella spp. (EIII).
Profilaxis de las infecciones causadas por hongos
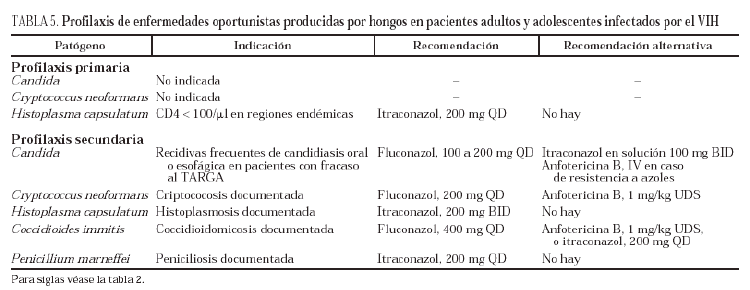
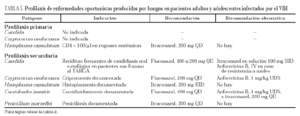
Candida (tabla 5)
Medidas para prevenir la exposición al patógeno
La candidiasis orofaríngea es la infección oportunista más frecuente en los pacientes con infección por el VIH. Candida albicans (C. albicans), el principal patógeno en esta micosis, es un comensal del tracto digestivo en humanos por lo que no cabe plantearse medidas para evitar su adquisición.
Profilaxis primaria
No se recomienda profilaxis primaria para esta micosis (DII).
Profilaxis secundaria
La candidiasis oral responde muy bien a los antifúngicos sistémicos pero en situaciones de inmunodepresión avanzada cerca del 80% de los pacientes sufren recaídas en los primeros 3 meses después de haber finalizado el tratamiento. Diferentes estudios han mostrado que el fluconazol o itraconazol en solución reducen las recidivas; sin embargo, no se recomienda su uso sistemático, puesto que éstas revisten poca gravedad, pueden diagnosticarse fácilmente y responden bien al tratamiento (DII). Además, la profilaxis secundaria con fluconazol puede favorecer las infecciones por cepas de Candida resistentes a los azoles. El TARGA es actualmente la mejor estrategia para evitar la candidiasis orofaríngea76 (AII). Tampoco se recomienda profilaxis secundaria para la candidiasis esofágica por motivos idénticos a los anteriormente expuestos (DII). Cuando el TARGA fracasa y el paciente presenta recaídas frecuentes se puede contemplar la profilaxis secundaria con dosis diarias de fluconazol (100 a 200 mg) pues no se ha demostrado que las dosis semanales sean tan eficaces en la candidiasis esofágica77 (CIII). Algunos pacientes acaban desarrollando candidiasis resistente a azoles y requieren tratamiento supresor crónico con anfotericina B (CIII).
Cryptococcus neoformans (tabla 5)
Medidas para prevenir la exposición al patógeno
La criptococosis es la micosis más grave en pacientes infectados por el VIH. No se conocen medidas efectivas para evitarla pese a que se sabe que en la mayoría de los casos el hongo penetra en el organismo por vía respiratoria.
Profilaxis primaria
Se han publicado muchos trabajos (series retrospectivas, estudios de casos y controles y ensayos clínicos aleatorizados) que han demostrado la reducción del riesgo de criptococosis con dosis diarias e incluso semanales de 100 a 200 mg de fluconazol. Pese a ello, tampoco se recomienda la profilaxis primaria para esta micosis por su relativa baja incidencia en países desarrollados, porque no se ha demostrado que mejore la supervivencia de los pacientes77,78, por su coste y por la posibilidad de que favorezca el desarrollo de micosis resistentes (DI).
Profilaxis secundaria
Antes de la introducción del TARGA, las recaídas de criptococosis asociada al sida eran muy frecuentes tras finalizar el tratamiento de inducción y distintos estudios demostraron la eficacia de la profilaxis secundaria para prevenirlas. En estudios recientes, se ha observado que en los pacientes que se recuperan inmunológicamente con el TARGA disminuye el riesgo de recidiva de criptococosis79,80. En cualquier caso, todos los pacientes deben realizar profilaxis secundaria tras el tratamiento de la fase aguda de la criptococosis. La pauta de elección es fluconazol (200 mg/día) que reduce la frecuencia de recaídas al 2-4% (AI)81. Las alternativas son anfotericina B, 1 mg/kg a la semana, con un porcentaje de recaídas del 17%81 e itraconazol, 200 mg/día, con un 23% de recaídas82.
Retirada de las profilaxis
Existe un ensayo clínico83 y un estudio de cohortes84 que nos indican que la retirada de la profilaxis puede llevarse a cabo con seguridad en pacientes que están asintomáticos y que tienen una cifra de linfocitos T CD4+ superiores a 100/μl durante al menos 3 meses y una carga viral plasmática de VIH inferior a 5.000 copias/μl, sin que sea necesario que el antígeno criptocócico sea negativo (BII). Tras la retirada de la profilaxis secundaria los pacientes deben ser revisados periódicamente clínica y analíticamente. Es prudente reanudar las profilaxis en caso de que se documente un descenso en la cifra de linfocitos T CD4+ o cuando un antígeno criptocócico negativo revierta a positivo (BIII).
Otros hongos (tabla 5)
Histoplasma capsulatum
Es la micosis regional más frecuente en pacientes con sida. En zonas endémicas, la histoplasmosis se puede prevenir evitando actividades de riesgo como las visitas a cuevas, la exposición al polvo ambiental, el talado de árboles, la limpieza de gallineros y el derribo o desescombro de edificios (CIII). La profilaxis primaria sólo está indicada en pacientes con una cifra de linfocitos T CD4+ menor de 100/μl y con alto riesgo por exposición ocupacional o que vivan en zonas hiperendémicas (CI)85. En España podría plantearse en inmigrantes infectados por VIH originarios de países endémicos. Para la profilaxis secundaria se recomienda itraconazol a dosis de 200 mg/12 h (AII)86. Para la retirada de la profilaxis secundaria en pacientes que se recuperan inmunológicamente con el TARGA se aplican los mismos criterios que con la criptococosis (CIII).
Penicillium marneffei
La peniciliosis es una micosis endémica en el sudeste asiático que responde bien al tratamiento con anfotericina B o itraconazol. No se conoce bien el reservorio del hongo ni la puerta de entrada de la infección, por lo que no pueden recomendarse medidas para evitar el contagio. En zonas endémicas, la profilaxis primaria con itraconazol reduce la incidencia de peniciliosis en pacientes con infección por el VIH e inmunosupresión grave (especialmente con linfocitos T CD4+ < 100/μl), pero no se ha demostrado que esta intervención prolongue la supervivencia de los pacientes87 (CII). Las recidivas tras el tratamiento son muy frecuentes, pero un estudio prospectivo, aleatorizado y controlado con placebo ha demostrado la eficacia de la profilaxis secundaria con itraconazol 200 mg/día88 (AI). No se conoce bien el impacto del TARGA sobre las recidivas de esta infección oportunista.
Miscelánea
Para la coccidioidomicosis se recomienda profilaxis secundaria con fluconazol 400 mg/día o itraconazol 200 mg dos veces al día (AII)89. No existen estudios acerca de la profilaxis secundaria para la aspergilosis, la blastomicosis ni la paracoccidioidomicosis16.
Profilaxis de las infecciones por parásitos
La mayoría de las enfermedades parasitarias en pacientes infectados por el VIH se deben a reactivaciones de infecciones latentes en situaciones de inmunodepresión profunda y su incidencia refleja la prevalencia de los distintos parásitos en la población general90. Algunas de estas reactivaciones se pueden prevenir con quimioprofilaxis.
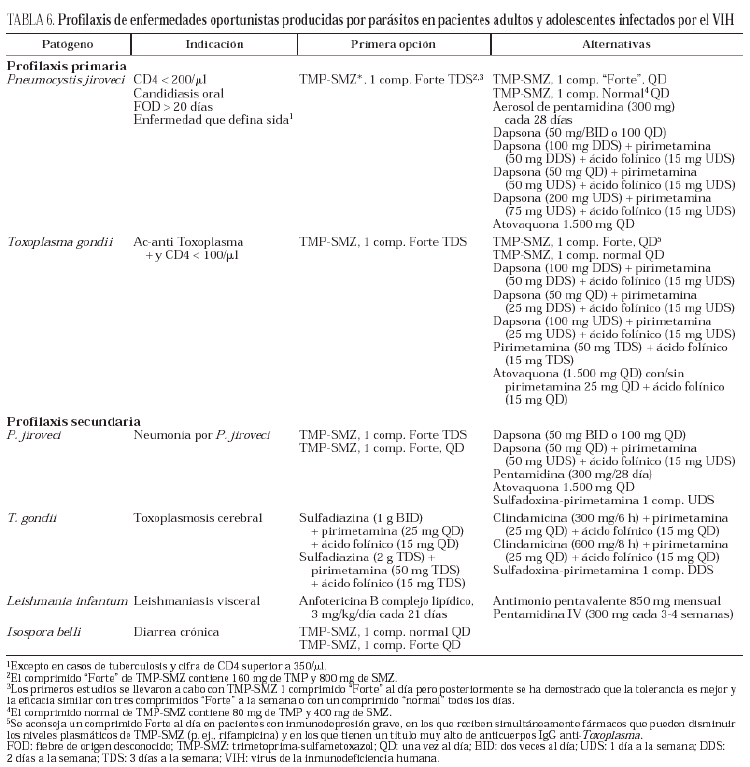
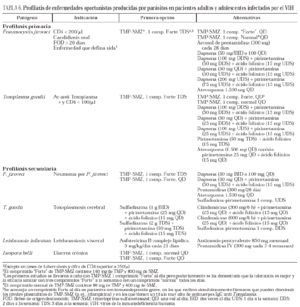
Pneumocystis jiroveci (antes Pneumocystis carinii) (tabla 6)
Pneumocystis jiroveci es un hongo, pero se incluye en este apartado porque su profilaxis y tratamiento se lleva a cabo con fármacos antiparasitarios y no con antifúngicos. La taxonomía del organismo ha cambiado. Actualmente se reserva el nombre de P. jiroveci para la especie que infecta a los seres humanos y se denomina Pneumocystis carinii (P. carinii) a la especie que infecta a los roedores91. A pesar del cambio de nomenclatura, el acrónimo PCP se puede mantener, puesto que también es la abreviatura de "Pneumocystis pneumonia". La neumonía por P. jiroveci puede aparecer cuando la cifra de linfocitos T CD4+ es inferior a 200/μl92. Ha sido la enfermedad marcadora de sida más frecuente y la primera en la que se demostró la eficacia de la quimioprofilaxis. Aunque su incidencia ha disminuido con el TARGA3,93,94, sigue siendo la forma más común de manifestarse el sida en pacientes que no se saben infectados por el VIH. En los países que carecen de TARGA sigue teniendo una prevalencia muy elevada95.
Medidas para prevenir la exposición al patógeno
Tradicionalmente se ha asumido que P. jiroveci penetra al organismo por vía respiratoria durante la infancia, produciendo una infección latente que puede reactivarse en situaciones de inmunodepresión grave96. Recientemente se han comunicado datos que sugieren que la infección puede transmitirse de pacientes con neumonía por P. jiroveci a personas susceptibles. Sin embargo, la transmisión entre enfermos debe ser muy baja si es que llega a ocurrir97,98. Por ello no se puede recomendar que los pacientes en situación de riesgo eviten el contacto estrecho con otros con neumonía por P. jiroveci (CIII).
Profilaxis primaria
Debe iniciarse cuando la cifra de linfocitos T CD4+ sea inferior a 200/μl y siempre que exista alguna enfermedad definitoria de sida, candidiasis oral o fiebre inexplicada de más de 20 días de duración (AI). Puede considerase la profilaxis cuando el porcentaje de linfocitos T CD4+ sea inferior al 14% o cuando la cifra de linfocitos T CD4+ esté entre 200-250/μl y no se pueda controlar al paciente cada 3 meses99 (BII). La combinación de trimetoprima-sulfametoxazol (TMP-SMZ) se considera el fármaco de elección por su eficacia, comodidad y relación coste/beneficio (AI). Los primeros estudios se llevaron a cabo con dosis diarias de TMP-SMZ de 160/800 mg (1 comprimido Forte)1, pero posteriormente se ha demostrado que la tolerancia es mejor y la eficacia similar con tres comprimidos "Forte" a la semana (AI) o con un comprimido "normal" (80/400) todos los días (AI)100,101. Si se presentan reacciones de hipersensibilidad debe intentarse la desensibilización antes prescribir un fármaco alternativo16. La pentamidina en aerosol se considera el fármaco de segunda elección; este aerosol debe administrarse con un equipo especial (Respigard® II o Fisoneb®) (BI)102. Esta profilaxis es menos eficaz que el TMP-SMZ oral y no protege frente a formas extrapulmonares u otras infecciones como toxoplasmosis103. Entre sus inconvenientes destacan el broncospasmo y el sabor metálico. Además p uede ocasionar problemas en el entorno sanitario como irritabilidad de la vía aérea y riesgo de diseminación de tuberculosis por lo que el aerosol se debe de administrar en un local aislado y bien ventilado. Son alternativas válidas, pero menos estudiadas, la dapsona (BI), dapsona/pirimetamina (BI) y atovaquona (BI)101,104,105 que pueden requerir la administración de más de un fármaco dificultando por tanto el cumplimiento de la profilaxis o el TARGA.
Profilaxis secundaria
Tras una neumonía por P. jiroveci se debe administrar profilaxis secundaria para prevenir recidivas (AI). El TMP-SMZ (1 comprimido "Forte" a diario o 3 días por semana) es más eficaz que la pentamidina en aerosol para prevenir recidivas locales y/o extrapulmonares106 (AI).
Retirada de las profilaxis
La profilaxis primaria se puede retirar en aquellos enfermos con TARGA durante más de 6 meses que tengan buen control de la carga viral (indetectable o < 5.000 copias/μl) y una cifra de linfocitos T CD4+ superiores a 200/μl durante al menos 3 meses107-110 (AI). Esos mismos criterios son válidos para la suspensión de la profilaxis secundaria107,108,111-113 (AI). La retirada de las profilaxis reduce la toxicidad farmacológica, simplifica el tratamiento y puede facilitar el cumplimiento del TARGA porque se reduce el número de pastillas. Se han descrito algunos casos de recidiva de la enfermedad tras la retirada de la profilaxis. En general, estos pacientes tenían edad avanzada, habían desarrollado la neumonía por P. jiroveci con cifras de linfocitos T CD4+ superiores a 200/μl, tenían otro tipo de inmunosupresión (p. ej., linfoma) o habían abandonado el TARGA.
Reinicio de la profilaxis
Aunque no hay datos al respecto, se aconseja reanudar la profilaxis si la cifra de linfocitos T CD4+ desciende de 200/μl o el paciente presenta un episodio de neumonía por P. jiroveci (CIII).
Toxoplasma gondii (tabla 6)
La toxoplasmosis cerebral es la encefalitis más común en el sida y ocurre en pacientes cuya cifra de linfocitos T CD4+ es inferior a 100/μl. Esta infección puede complicar el curso de un 10-20% de los enfermos infectados por el VIH con serología positiva para T. gondii114 aunque su incidencia ha descendido por el uso de T MP-SMZ y TARGA.
Medidas para prevenir la exposición al patógeno
T. gondii se adquiere por el consumo de carne, huevos, verduras y hortalizas contaminados y por exposición a heces de gato115. Los pacientes con serología negativa deben comer la carne bien hecha (el interior no debe estar rosado). Aquellos pacientes que no quieran renunciar a la carne poco hecha, pueden congelarla previamente a una temperatura inferior a 20 °C. También deben lavar bien la fruta y la verdura para evitar la infección (BIII). Se aconseja el lavado de manos tras haber tocado carne cruda, verduras o tierra (jardinería) (BIII). Si se tiene un gato como animal de compañía, se le debe alimentar con dietas comerciales y la carne que consuma también debe estar bien hecha. Además, se deben limpiar sus excretas a diario con guantes (BIII).
Profilaxis primaria
Debe iniciarse el tratamiento profiláctico en enfermos con serología positiva (anticuerpos IgG antitoxoplasma) y cifras de linfocitos T CD4+ inferiores a 100/μl (AII), aunque algunos autores recomiendan iniciarla con linfocitos T CD4+ menores de 200/μl101,116 (BII). Los primeros trabajos de profilaxis fueron estudios observacionales retrospectivos de enfermos con profilaxis para P. jiroveci con TMP-SMZ. La toxoplasmosis se puede prevenir con un comprimido diario normal de TMP-SMZ (80/400) o un comprimido forte (160/800) 3 días por semana116 (AII). Sin embargo, se aconseja un comprimido "forte" al día en pacientes con inmunodepresión grave, en los que reciben simultáneamente fármacos que pueden disminuir los niveles plasmáticos de TMP-SMZ (p. ej., rifampicina) y en los que tienen un título muy alto de anticuerpos IgG anti-Toxoplasma117-119 (BII). En enfermos que no toleran el TMP-SMZ se puede administrar dapsona en combinación con pirimetamina y ácido folínico (BI), atovaquona (sola o en combinación con pirimetamina y ácido folínico) (CIII) o pirimetamina (CI)101,116,120,121.
Profilaxis secundaria
Si no se administra tratamiento de mantenimiento, la toxoplasmosis cerebral recidiva en el 60-100% de los casos entre los 6 a 12 meses tras finalizar el tratamiento de inducción122. De las pautas aceptadas para profilaxis secundaria, la más eficaz es la combinación de pirimetamina con sulfadiazina, que puede administrase a diario o a días alternos123,124 (AI). En caso de que no se pueda administrar sulfadiazina, ésta se puede cambiar por clindamicina123 (BI). Si hay intolerancia a ambos fármacos, existe muy poca experiencia con otras alternativas. En estos enfermos se recomienda mantener el tratamiento con el fármaco que se ha usado en la fase aguda: pirimetamina sola o asociada a atovaquona, azitromicina, minociclina o doxicilina, 5-fluorouracilo y clindamicina, y minociclina o doxicilina con sulfadiazina. Igualmente existe muy poca experiencia con dapsona y pirimetamina o con cotrimoxazol123,125-142 (CII). También se ha utilizado claritromicina (1 g/12 h) en lugar de azitromicina, pero no se recomienda dado que la claritromicina a esas dosis se asociara a un exceso de mortalidad en un estudio de profilaxis frda de las profilaxis
Aunque no existen muchos estudios, se considera que la profilaimaria para P. jiroveci: TARGA durante al menos 6 meses, una cifra de linfocitos T CD4+ superior a 200 μl y la carga viral controlada144-147 (AI). No existen datos suficientes en la literatura médica que avalen totalmente la retirada de la profilaxis secundaria frente a este patógeno. Sin embargo, a la luz de los estudios existentes puede deducirse podría suspenderse cuando se cumplan los mismos criterios de retirada de la profilaxis primaria73,111,144,148-151 (CIII) (tabla 3).
Leishmania spp. (tabla 6)
La leishmaniasis visceral es una de las parasitosis asociadas al VIH más frecuentes en España y otros países mediterráneos. Se presenta en individuos muy inmunodeprimidos y su prevalencia varía en función de la presencia de Leishmania infantum (agente causal) en los reservorios (en nuestro medio, cánidos). Existen algunas pruebas de que el TARGA ha modificado la incidencia de la leishmaniasis visceral152-154 y ha reducido sus recidivas en pacientes infectados por el VIH152,155. Sin embargo, pueden ocurrir recidivas en pacientes que permanecen con una cifra baja de linfocitos T CD4+ a pesar del TARGA155.
Medidas para prevenir la exposición al patógeno
Es probable que la leishmaniasis pueda transmitirse de persona a persona por el intercambio de jeringuillas154,156, lo que constituye un argumento más para desaconsejar esa práctica (CIII). Por otra parte, en áreas donde los reservorios caninos presenten una elevada prevalencia de infección debería evitarse al perro como animal de compañía (CIII).
Profilaxis primaria
No se ha establecido ninguna profilaxis primaria para esta infección.
Profilaxis secundaria
En la época anterior al TARGA la incidencia acumulada de recaídas tras un primer episodio de leishmaniasis visceral tratado correctamente era del 60% a los 6 meses y 90% a los 12 meses156,157. El valor de la profilaxis secundaria en pacientes infectados por el VIH ha sido probado en un estudio español, multicéntrico, prospectivo y aleatorizado que comparó la eficacia de anfotericina B complejo lipídico (3 mg/kg/día, cada 21 días) con otro grupo control. El análisis por intención de tratamiento a los 12 meses de seguimiento mostró que el 50% de los pacientes que recibieron profilaxis estaba libre de recidivas frente al 22% del grupo control158 (BI). En un estudio retrospectivo no aleatorizado se encontró que la profilaxis secundaria con una dosis mensual de 850 mg de antimonio pentavalente (Glucantime) reducía la frecuencia de recidivas de leishmaniasis visceral en comparación con controles históricos y con un grupo tratado con alopurinol157, hallazgos que no se han confirmado en estudios prospectivos. La miltefosina es un fármaco de administración oral de reciente introducción tan eficaz como la anfotericina B para tratamiento de la leishmaniasis visceral en pacientes no infectados por el VIH159; sin embargo, existe muy poca experiencia con este fármaco para el tratamiento de la leishmaniasis en pacientes infectados por el VIH, tanto para la fase aguda como para el mantenimiento.
Retirada de la profilaxis
No se puede dar una clara recomendación para la retirada de la profilaxis secundaria frente a este patógeno, pero podría considerarse su aplicación en pacientes que logran permanecer al menos 6 meses sin recaídas y que tienen una cifra de linfocitos T CD4+ superior a 200/μl y preferiblemente 350/μl160 (BII) (tabla 3).
Otros parásitos (tabla 6)
Cryptosporidium spp.
Es un protozoo intracelular que produce diarrea en animales y humanos. De las especies conocidas, C. parvum y otras especies (C. muris, C. maleagridis) infectan al ser humano161. El parásito se adquiere por vía digestiva al ingerir agua o alimentos contaminados y por contacto con animales o humanos infectados. Produce una diarrea crónica refractaria al tratamiento en pacientes infectados por el VIH con linfocitos T CD4+ inferiores a 100/μl. Su frecuencia varía entre el 10-15% en occidente y hasta el 50% en países en vías de desarrollo162,163. Una proporción menor de enfermos presentan afectación biliar. Para prevenir la criptosporidiasis debe informarse al paciente sobre la ubicuidad del parásito, sobre todo en alimentos que se consumen crudos (verduras, ostras, etc.), agua y excretas. Además, se debe evitar el contacto con enfermos infectados o, en su defecto, extremar las medidas higiénicas16 (BIII). No existe quimioprofilaxis eficaz para esta infección; sin embargo, se ha sugerido que la profilaxis para MAC con rifabutina o claritromicina podría reducir su incidencia, aunque los datos no son concluyentes164,165.
Microsporidios
La microsporidiasis es la causa más común de diarrea crónica en enfermos con inmunodepresión grave sin patógeno demostrable por métodos convencionales166. La vía de transmisión no está aclarada y su prevalencia no se conoce bien, dado lo difícil del diagnóstico. En nuestro medio se ha encontrado en el 22% de los enfermos con sida y diarrea crónica167. La mayoría de episodios están causados por Enterocytozoon bieneusi y menos frecuentemente por Encephalitozoon intestinalis que, a su vez, puede producir infecciones sistémicas. No existe quimioprofilaxis para esta infección. El tratamiento prolongado con albendazol puede controlar la sintomatología.
Isospora belli
Era un agente causante de diarrea crónica durante los primeros años de la epidemia de sida, pero en la actualidad ha desaparecido prácticamente por la profilaxis con TMP-SMZ168,169. Tras una isosporidiasis se debe instaurar profilaxis secundaria con TMP-SMZ (CIII).
Agradecimientos
Queremos agradecer a Luis Guerra su colaboración en la anterior edición de este documento y a Daniel Podzamczer los comentarios que ha efectuado a este documento durante el tiempo que ha estado en la página web de GESIDA.
El Dr. José M.ª Miró recibió una beca de investigación del Institut dInvestigacions Biomèdiques August Pi i Sunyer (IDIBAPS) (Barcelona).