La enfermedad de Chagas en zonas no endémicas, como nuestro país, se adquiere fundamentalmente por transmisión vertical. La prevalencia de la enfermedad en embarazadas latinoamericanas oscila entre el 0,7 y el 54% en función del país de origen, la procedencia rural o la edad de la madre, situándose la tasa de transmisión vertical entre el 5 y el 6%. Se sabe que el tratamiento en fases precoces y en concreto en el niño <15 años tiene altas tasas de curación y parece que el tratamiento de la embarazada tras el parto podría prevenir la transmisión en otros embarazos. Todo ello justificaría el diagnóstico y tratamiento precoz de esta entidad en ambos grupos. En este documento se exponen las recomendaciones actuales de diagnóstico y tratamiento de la enfermedad en el niño y la embarazada. Estas recomendaciones han sido elaboradas por un grupo de trabajo formado por especialistas en Enfermedades Infecciosas, Microbiología Clínica, Ginecología y Pediatría.
Congenital transmission of Chagas disease now occurs in areas where the disease is non-endemic, and also from one generation to another. According to epidemiological data from Latin America, the prevalence of the disease in pregnant women is 0.7%-54%, and the prevalence of vertical transmission is around 5%-6%. Congenital T. cruzi infection is an acute infection in newborns that should be treated with anti-parasitic therapy. The treatment of pregnant women could also have an impact on the control of the disease. This article has been prepared following the recommendations suggested by a group of experts in Infectious Diseases, Microbiology, Gynaecology and Paediatrics.
La enfermedad de Chagas está producida por un protozoo denominado Trypanosoma cruzi (T. cruzi). En las zonas endémicas su transmisión es fundamentalmente vectorial, por medio de la picadura de un triatomino. Existen otros mecanismos de transmisión, como la ingestión de alimentos o bebidas contaminados, la manipulación de animales infectados o de material de laboratorio, las transfusiones de sangre, el trasplante de órganos y la transmisión vertical, siendo esta última la más frecuente en nuestro medio.
Actualmente, con el aumento de la inmigración a partir de los años ochenta ha dejado de ser un problema de salud limitado a regiones endémicas, para observarse también en áreas sin transmisión vectorial como Europa y Estados Unidos, registrándose prevalencias entre el 3,5 y el 9,7% en mujeres, con un máximo del 27,7% en mujeres bolivianas y del 0,7-54% en mujeres embarazadas latinoamericanas, en función del país de origen, la procedencia rural o la edad de la madre1,2 (tabla 1), situándose la tasa de transmisión vertical entre el 5 y el 6%1-3. Por otro lado, la mayor parte de las infecciones en la enfermedad de Chagas tienen lugar en niños con poca expresión clínica en la fase aguda, por lo que se diagnostican ya en la fase indeterminada o crónica. Así, la mayoría de las muertes atribuidas a las complicaciones cardiacas de la enfermedad de Chagas (más de 7.000 muertes anuales) ocurren en adultos que se infectaron siendo niños. Dado que el tratamiento en fases precoces de la enfermedad puede curar y prevenir la progresión de la enfermedad, es de gran importancia la evaluación y el cribado universal en grupos de riesgo, y en especial en el niño y la embarazada.
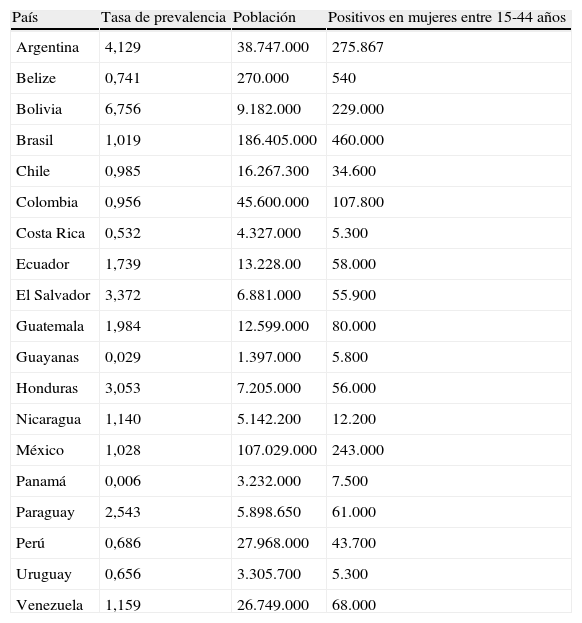
Estimación cuantitativa de la enfermedad de Chagas en las Américas (2006)
| País | Tasa de prevalencia | Población | Positivos en mujeres entre 15-44 años |
| Argentina | 4,129 | 38.747.000 | 275.867 |
| Belize | 0,741 | 270.000 | 540 |
| Bolivia | 6,756 | 9.182.000 | 229.000 |
| Brasil | 1,019 | 186.405.000 | 460.000 |
| Chile | 0,985 | 16.267.300 | 34.600 |
| Colombia | 0,956 | 45.600.000 | 107.800 |
| Costa Rica | 0,532 | 4.327.000 | 5.300 |
| Ecuador | 1,739 | 13.228.00 | 58.000 |
| El Salvador | 3,372 | 6.881.000 | 55.900 |
| Guatemala | 1,984 | 12.599.000 | 80.000 |
| Guayanas | 0,029 | 1.397.000 | 5.800 |
| Honduras | 3,053 | 7.205.000 | 56.000 |
| Nicaragua | 1,140 | 5.142.200 | 12.200 |
| México | 1,028 | 107.029.000 | 243.000 |
| Panamá | 0,006 | 3.232.000 | 7.500 |
| Paraguay | 2,543 | 5.898.650 | 61.000 |
| Perú | 0,686 | 27.968.000 | 43.700 |
| Uruguay | 0,656 | 3.305.700 | 5.300 |
| Venezuela | 1,159 | 26.749.000 | 68.000 |
Modificada de los datos de la OPS (OPS Estimación cuantitativa de la enfermedad de Chagas en las Américas. Organización Pamamericana de laSalud. Montevideo, Uruguay, 2006).
La OMS recomienda el cribado serológico de las gestantes latinoamericanas como medida para la prevención de la diseminación de la infección por T. cruzi en áreas no endémicas4. Por tanto, la prevención de la enfermedad de Chagas congénita representa un nuevo reto para nuestro sistema de salud. Además, distintos estudios confirman la rentabilidad económica del cribado de la enfermedad en las embarazadas5. El objetivo fundamental del cribado es la detección de madres infectadas y, de esa forma, determinar aquellos recién nacidos a los que hay que realizar estudio y tratarlos precozmente, en caso de positividad. Por otra parte, no es infrecuente que el embarazo y el parto supongan el único contacto de estas mujeres con el sistema sanitario, brindándonos la oportunidad de realizar el estudio y el diagnóstico, determinar las posibles complicaciones asociadas a la enfermedad e instaurar su tratamiento. El tratamiento tripanocida mejora la evolución de la enfermedad, y por ello parece que, transcurrido el periodo de lactancia, el tratamiento específico podría evitar la transmisión de T. cruzi a futuras gestaciones, que a su vez evitaría los casos congénitos de segunda generación.
El cribado debe extenderse a todas las embarazadas de origen latinoamericano (a excepción de las islas de Caribe), las que han vivido en una zona endémica durante periodos prolongados (en especial en áreas rurales) y aquellas con madres procedentes de Suramérica aunque ellas hayan nacido en un área no endémica (salvo que su madre haya sido cribada y sea negativa)6. No hay estudios concluyentes acerca de cuándo realizar el estudio de la infección. Se recomienda que el cribado se realice con la analítica del primer trimestre, pero si esto no ha sido posible, puede realizarse en cualquier momento de la gestación, incluido el momento del parto. Se debe informar a la gestante del programa de cribado y de sus beneficios.
Para el cribado se puede usar cualquier test serológico, como el ELISA, o un test rápido, como la inmunocromatografía (sensibilidad ELISA 99% vs. inmunocromatografía 92%), en función de la disponibilidad de cada centro:
- •
Si es positivo, se confirmará con otro test serológico (ELISA recombinante o inmunofluorescencia indirecta), se informará a la paciente y se hará constar en su historial. Después del parto, se estudiará al recién nacido, a la madre e incluso, si tiene más hijos, a toda su descendencia.
- •
Si el test ELISA es negativo, no es preciso confirmar, y tras informar a la embarazada se hará constar en su historial7,8. Si es un test rápido de inmunocromatografía, se recomienda confirmar con un test diferente.
- •
En caso de resultados discordantes se recomienda utilizar otro test serológico diferente y valorar solicitar PCR para T. cruzi. Hay que tener en cuenta que en la fase de parasitación crónica la PCR en sangre puede ser negativa, por lo que un resultado negativo no descarta la infección, siendo de utilidad únicamente un resultado positivo.
Una vez que se haya confirmado la serología positiva en la gestante, habrá que completar una anamnesis detallada y una exploración física para descartar formas sintomáticas. Debe realizarse una evaluación clínica, también un ECG, y, si existe afectación cardíaca, derivarse al cardiólogo. En el caso de sospecha de afectación digestiva es recomendable posponer algunas de las pruebas radiológicas (enema opaco) hasta el posparto (ver el siguiente apartado). Si la mujer no tiene afectación orgánica, el seguimiento del embarazo puede hacerse en el centro habitual, restringiendo la consulta de alto riesgo para casos de enfermedad materna9,10. En cuanto al estado microbiológico, hay que tener en cuenta que el riesgo de transmisión vertical depende del nivel de parasitemia, del estado inmunológico materno, de la cepa infectante y de factores placentarios (se ha encontrado más casos de transmisión en gestaciones múltiples que en simples)11. Además, aunque la transmisión puede ocurrir en cualquier fase de la enfermedad, el riesgo es mayor en la fase aguda, como también lo es el riesgo de aborto11,12. Sin embargo, lo habitual es que en nuestro medio las embarazadas estén ya en fase crónica, en la cual la parasitemia es menor y el riesgo de infección fetal es más infrecuente, y de ocurrir suele producirse a partir de la semana 191.En el seguimiento ecográfico fetal han de buscarse signos de restricción del crecimiento y signos fetales comunes al grupo TORCH2. Si bien la mayoría de los casos de transmisión vertical son asintomáticos, la ausencia de signos ecográficos prenatales o en el nacimiento no descarta la infección. Por último, la infección también se ha correlacionado con mayor riesgo de prematuridad y aborto12.
En cuanto al tratamiento materno, está contraindicado durante la gestación, pues se ha visto que es teratogénico en animales, si bien no hay estudios en humanos. Ahora bien, la exposición accidental al fármaco no es criterio para la interrupción del embarazo en gestación. Por último, la infección per se no justifica la realización de cesárea programada en estas pacientes.
Abordaje de la mujer con diagnóstico de enfermedad de Chagas tras el partoTras el parto, la anamnesis deberá incluir una revisión de síntomas que puedan sugerir afectación cardiaca o gastrointestinal (tabla 2). Se debe ofrecer el cribado para la enfermedad de Chagas a otros familiares, incluidos los otros hijos de la mujer si los tuviese, y se debe informar a la paciente sobre otras posibles vías de transmisión, como la donación de sangre y órganos. Aunque en la mayoría de los casos se habrá realizado cribado de infección por VIH durante el embarazo, es importante comprobar este resultado y descartar otras posibles causas de inmunosupresión (la coinfección por VIH puede aumentar el riesgo de transmisión vertical y precisa unas consideraciones especiales)13. A todas las pacientes se les realizará un ECG (12 derivaciones) con tira de ritmo (30s). El resto de las pruebas se solicitarán en función de los síntomas/signos presentes. En la práctica se recomienda realizar tanto ECG como ecocardiograma a los pacientes asintomáticos.
Síntomas sugestivos de enfermedad de Chagas en el adulto/embarazada
| Síntomas cardiacos |
| Arritmias y afectación del sistema de conducción cardiaco |
| Palpitaciones |
| Síncope |
| Presíncope o mareo |
| Insuficiencia cardiaca congestiva |
| Disnea |
| Intolerancia al ejercicio |
| Edemas periféricos |
| Otros |
| Fenómenos tromboembólicos (isquemia transitoria o ictus) |
| Dolor torácico típico o atípico |
| Síntomas gastrointestinales |
| Esofágicos |
| Disfagia (líquidos y sólidos) |
| Disfagia progresiva |
| Regurgitación y aspiración |
| Odinofagia |
| Pérdida de peso |
| Colónicos |
| Estreñimiento |
| Dolor abdominal agudo (vólvulo o isquemia) |
La forma indeterminada se da en una paciente asintomática con serología positiva frente a T. cruzi, examen físico normal, ECG normal y estudio radiológico de tórax, esófago y colon normales. Dado que los pacientes asintomáticos con ECG normal tienen buen pronóstico, algunos autores refieren que el seguimiento anual de los asintomáticos con solo ECG sin realizar otras pruebas adicionales puede ser suficiente14,15. En las pacientes con clínica o ECG sugestivos de afectación cardiaca se debería realizar prueba de esfuerzo y monitorización ECG ambulatoria durante 24h (Holter) y ocasionalmente otras pruebas adicionales. Los cambios electrocardiográficos característicos (y más frecuentes) de la enfermedad de Chagas son: bloqueo completo de rama derecha, bloqueo incompleto de rama derecha con QRS 0,10-0,11 (en adultos), hemibloqueo anterior izquierdo, bloqueo AV de primer grado, bloqueo AV de segundo grado, bloqueo AV completo, bradicardia y otras manifestaciones de disfunción del seno, extrasístoles ventriculares (frecuentes, multifocales) y taquicardia ventricular (sostenida o no sostenida). Se realizarán estudios baritados en las pacientes con síntomas gastrointestinales. La manometría esofágica podría ser de utilidad en las pacientes en las que los resultados radiológicos son inconcluyentes. Los pacientes con megaesófago podrían tener un riesgo aumentado de cáncer de esófago y la endoscopia digestiva alta estaría indicada si hay síntomas nuevos o progresivos.
Con respecto a la lactancia materna, debe tenerse presente que la parasitemia circulante es fluctuante y de bajo grado en los pacientes crónicos asintomáticos, y que salvo casos excepcionales, en madres que se encontraban en la fase aguda de la infección, no se ha demostrado la presencia de T. cruzi en la leche materna16,17. Así, únicamente se han descrito casos aislados de infección aguda en lactantes de madres crónicamente infectadas, que se atribuyeron a la ingesta de sangre por fisuras en los pezones de la madre18,19. En un estudio reciente con roedores de laboratorio, la primoinfección experimental no resultó en ninguna infección secundaria en las crías lactantes20. Además, la inoculación experimental del calostro o leche materna de madres con enfermedad de Chagas a ratones tampoco produjo infección en otro estudio21. No obstante, la inoculación oral y peritoneal a ratones con leche humana materna artificialmente contaminada con T. cruzi puede causar la infección en las crías, pero el tratamiento térmico, por pasteurización o en horno de microondas (63°C) de esta leche, produce la esterilización e impide la transmisión22,23. Por lo tanto, no se aconseja interrumpir la lactancia cuando la madre ha sido diagnosticada de enfermedad de Chagas crónica, aunque podría ser conveniente interrumpirla temporalmente si existieran heridas mamarias sangrantes20,22. En este último caso podría ser recomendable el tratamiento térmico de la leche antes de su administración.
Respecto al tratamiento materno, los únicos fármacos tripanosomicidas con eficacia demostrada en humanos son el benznidazol y el nifurtimox. Ambos fármacos tienen una tasa elevada de efectos adversos, especialmente en adultos, y el tratamiento es prolongado (60-90días). Suele estar indicado para los adultos entre 19-50años, salvo afectación cardiaca avanzada, teniendo en cuenta la eficacia menor y la mayor tasa de efectos secundarios comparado con el tratamiento en niños (existen otras indicaciones de tratamiento que no se revisan en este apartado). El uso de estos fármacos está contraindicado durante el embarazo y está desaconsejado durante la lactancia. Según un estudio reciente, el riesgo de exposición del recién nacido a nifurtimox a través de la lactancia, si la madre está tomando el fármaco, probablemente sea bajo; sin embargo, dado que hay pocos datos y dado que el tratamiento de la enfermedad de Chagas crónica no es urgente, se considera que es mejor demorarlo hasta que haya finalizado el periodo de lactancia23. Para las mujeres en edad fértil (no embarazadas) el tratamiento podría ser una estrategia útil para disminuir la transmisión vertical en futuros embarazos, dado que se ha demostrado una correlación entre la parasitemia de la madre y la infección congénita24,25. Por ello, tras el parto debe derivarse a la madre (si no se derivó previamente) a un centro de referencia para valorar el inicio de tratamiento. Ahora bien, debería aprovecharse cualquier oportunidad para realizar el cribado a las mujeres de edad fértil (consulta de atención primaria, consulta de ginecología…).
Diagnóstico del niño con enfermedad de ChagasRecién nacido hijo de madre con enfermedad de ChagasEl seguimiento del hijo de madre con enfermedad de Chagas se debe realizar al menos durante los 9 primeros meses de vida. En los primeros meses debe recurrirse a técnicas parasitológicas, más rentables en el niño que en adulto, al estar este en fase aguda y presentar mayor parasitemia. Solo a partir del noveno mes la serología puede ser útil, pues la negativización de anticuerpos maternos sucede, en general, hacia el 9.° mes de vida. Por ello, en los primeros meses de vida la detección de anticuerpos no es indicativa de infección en el niño. Sin embargo, su seguimiento permite apreciar la caída progresiva de los niveles de anticuerpos maternos que se observa principalmente en ausencia de infección. Las pruebas parasitológicas más recomendadas son el micrométodo y la reacción en cadena de la polimerasa (PCR) al nacimiento en sangre periférica y al mes de vida (tabla 3). En la visita del 9.° mes se realiza una determinación de anticuerpos frente a T. cruzi, asumiendo la desaparición de los anticuerpos maternos transferidos pasivamente al recién nacido26. Es recomendable también repetir en esta determinación la PCR y así decartar cualquier posible estado de inmunodepresión. Las diferencias de sensibilidad entre PCR y micrométodo son elevadas en los países no endémicos, y dado que se ha detectado un alto número de falsos negativos del microhematocrito, en nuestro medio es recomendable la utilización sistemática de la PCR para el cribado de la infección congénita por T. cruzi.
Diagnóstico de la enfermedad de Chagas en el niño según el momento de estudio
| Diabnóstico de la enfermedad de Chagas | |
| Primer año de vida | Tras el año de vida |
| Al nacimiento y al mes: PCR y micrométodo en sangre periféricaA los 9 meses de vida: serología (por 2 técnicas distintas) y PCR | Realización de 2 pruebas serológicas (una de ellas ELISA o IFI)PCRb en caso de resultado discordante |
| Diagnóstico de enfermedad de Chagas:1. PCR (+) (independientemente del momento de realización)2. Persistencia de serología (+)a | Diagnóstico de enfermedad de Chagas:1. Dos pruebas serológicas (+)c |
Aunque la serología puede negativizarse a partir del 8 mes, en ocasiones puede permanecer positiva mas tiempo sin que haya infección; en estos casos es importante realizar una titulación de anticuerpos para comprobar si tienden a negativizarse (no infección) o si por el contrario se mantienen estables o aumentan.
Tras el primer año de vida debe realizarse el estudio de enfermedad de Chagas a todo niño procedente de área endémica o hijo de madre con enfermedad de Chagas que no hubiera sido seguido en el periodo neonatal. El diagnóstico de enfermedad de Chagas en el niño mayor de 12meses se realiza como en el adulto, utilizando técnicas microbiológicas indirectas. El método diagnóstico de elección es la serología, utilizando 2 técnicas serológicas en las que se empleen diferentes antígenos; al menos una de ellas debe ser ELISA o IFI, ya que son la técnicas serológicas más sensibles27. La inmunocromatografía de anticuerpos presenta una sensibilidad menor, por lo que solo emplearemos esta última si las anteriores no están disponibles. Una vez confirmado el diagnóstico serológico y antes de iniciar el tratamiento tripanomicida es recomendable determinar la parasitemia. En caso de resultados serodiscordantes debe realizarse una serología por otro método, pudiendo ser de utilidad la realización de PCR para la detección de ADN de T. cruzi28–30.
Seguimiento clínico y analítico del niño con enfermedad de ChagasUna vez realizado el diagnóstico de enfermedad de Chagas según los criterios especificados (tabla 3), es necesario realizar una historia clínica y una exploración detallada, así como diferentes pruebas complementarias encaminadas a la detección de la posible afectación de órganos diana. Este estudio dependerá del momento del diagnóstico (fase de la enfermedad) y de la edad del paciente.
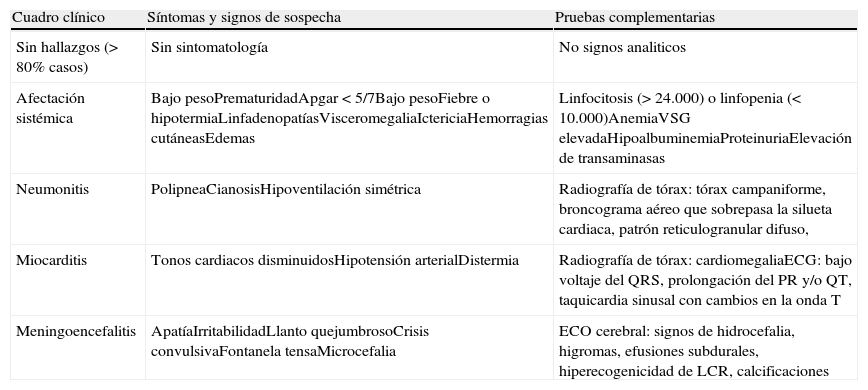
Neonato hijo de madre con enfermedad de ChagasEn los menores en los que se establece el diagnóstico en el momento del nacimiento es preciso descartar la existencia de signos y síntomas de afectación sistémica, propios de la fase aguda de la enfermedad, si bien hasta el 80% de los recién nacidos permanecerán asintomáticos (tabla 4). Por ello se recomienda la realización de pruebas complementarias a todo recién nacido con enfermedad de Chagas aunque la exploración física sea normal, incluyendo: hemograma, bioquímica sanguínea y de orina, radiografía de tórax, ecografía (ECO) cerebral, fondo de ojo, ECO abdominal, potenciales evocados, ecocardiografía y electrocardiograma (ECG).
Principales signos y síntomas de sospecha en el recién nacido con enfermedad de Chagas
| Cuadro clínico | Síntomas y signos de sospecha | Pruebas complementarias |
| Sin hallazgos (> 80% casos) | Sin sintomatología | No signos analiticos |
| Afectación sistémica | Bajo pesoPrematuridadApgar < 5/7Bajo pesoFiebre o hipotermiaLinfadenopatíasVisceromegaliaIctericiaHemorragias cutáneasEdemas | Linfocitosis (> 24.000) o linfopenia (< 10.000)AnemiaVSG elevadaHipoalbuminemiaProteinuriaElevación de transaminasas |
| Neumonitis | PolipneaCianosisHipoventilación simétrica | Radiografía de tórax: tórax campaniforme, broncograma aéreo que sobrepasa la silueta cardiaca, patrón reticulogranular difuso, |
| Miocarditis | Tonos cardiacos disminuidosHipotensión arterialDistermia | Radiografía de tórax: cardiomegaliaECG: bajo voltaje del QRS, prolongación del PR y/o QT, taquicardia sinusal con cambios en la onda T |
| Meningoencefalitis | ApatíaIrritabilidadLlanto quejumbrosoCrisis convulsivaFontanela tensaMicrocefalia | ECO cerebral: signos de hidrocefalia, higromas, efusiones subdurales, hiperecogenicidad de LCR, calcificaciones |
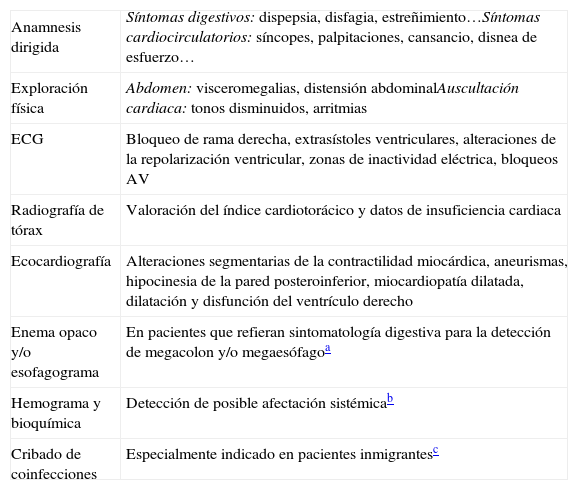
La mayor parte de los pacientes en los que se realiza el diagnóstico tras el primer año de vida se encuentran en la fase indeterminada de la enfermedad, caracterizada por ausencia de síntomas y de afectación orgánica. Debido a que la afectación orgánica es progresiva, es necesario realizar una búsqueda activa de afectación orgánica para la detección de posibles alteraciones en estadios precoces. Deben realizarse una historia clínica, exploración y pruebas complementarias dirigidas a la posible existencia de sintomatología relacionada con los principales órganos diana (tabla 5)8,31-33.
Historia clínica y pruebas complementarias a realizar en pacientes pediátricos con enfermedad de Chagas
| Anamnesis dirigida | Síntomas digestivos: dispepsia, disfagia, estreñimiento…Síntomas cardiocirculatorios: síncopes, palpitaciones, cansancio, disnea de esfuerzo… |
| Exploración física | Abdomen: visceromegalias, distensión abdominalAuscultación cardiaca: tonos disminuidos, arritmias |
| ECG | Bloqueo de rama derecha, extrasístoles ventriculares, alteraciones de la repolarización ventricular, zonas de inactividad eléctrica, bloqueos AV |
| Radiografía de tórax | Valoración del índice cardiotorácico y datos de insuficiencia cardiaca |
| Ecocardiografía | Alteraciones segmentarias de la contractilidad miocárdica, aneurismas, hipocinesia de la pared posteroinferior, miocardiopatía dilatada, dilatación y disfunción del ventrículo derecho |
| Enema opaco y/o esofagograma | En pacientes que refieran sintomatología digestiva para la detección de megacolon y/o megaesófagoa |
| Hemograma y bioquímica | Detección de posible afectación sistémicab |
| Cribado de coinfecciones | Especialmente indicado en pacientes inmigrantesc |
Por lo general, los niños menores de 14años tienen menos efectos adversos y mejor tolerancia de la medicación que los adultos, y presentan una proporción de negativización de los anticuerpos más elevada. Sin embargo, a veces los pacientes y los familiares pueden desear aplazar o rechazar el tratamiento debido a la ansiedad que genera en ellos el tratamiento prolongado y los posibles efectos adversos. En estos casos es importante informar a las familias de que la efectividad del tratamiento se relaciona, en la mayoría de los casos, con la precocidad del inicio del mismo y explicar bien la pauta y sus efectos adversos antes del inicio, para asegurar una buena adherencia al mismo, así como la monitorización del paciente durante el tratamiento.
Fármacos y dosificaciónActualmente solo disponemos, como ya se ha dicho en el apartado referente a la madre, de 2 fármacos aceptados para el tratamiento de esta enfermedad: el benznidazol y el nifurtimox, con similares efectos adversos. En ninguno de ellos existe una formulación pediátrica (solución) de momento, por lo que la administración del fármaco requiere fraccionar las tabletas de adultos. El tratamiento de elección es el benznidazol; en nuestro país es difícil encontrar el nifurtimox, que debe usarse como fármaco de segunda línea. Tanto uno como otro se deben solicitar como medicación extranjera.
Según las características farmacocinéticas del fármaco (buena biodisponibilidad oral, volumen aparente de distribución de 0,56l/kg y semivida de eliminación de 12-15h), se estableció el régimen posológico óptimo de benznidazol para el tratamiento de la enfermedad de Chagas de un mínimo de 5mg/kg/día hasta 8-10mg/kg/día, repartido en 2 tomas. Teóricamente, con esta posología no sería esperable alcanzar concentraciones plasmáticas máximas de fármaco superiores a 20mg/l, cifra que se relaciona con un mayor número de efectos adversos. Con respecto a los lactantes, los últimos estudios realizados en niños demuestran que responden bien al tratamiento, con negativización demostrable de los anticuerpos contra T. cruzi por serología y con bajo riesgo de padecer efectos adversos. La posología recomendada en el periodo neonatal varía en función de la edad gestacional:
- •
En los recién nacidos con peso <3.200g, los prematuros o recién nacidos que presenten comorbilidad se iniciará el tratamiento con benznidazol a 5mg/kg, incrementando la dosis en la segunda semana hasta 8-10mg/kg/día, hasta completar al menos 30días, e idealmente 60días.
- •
En el recién nacido a término sin patología concomitante, la posología y la duración del tratamiento serán iguales que en el paciente pediátrico.
El nifurtimox (Lampit) se usa como alternativa en caso de no tolerancia al benznidazol y su dosis es de 15-20mg/kg/día en 4dosis y durante 90días.
Otros fármacos con actividad frente al tripanosoma son el posaconazol y el pro-ravuconazol, que actualmente están en fase de ensayo clínico. A estos se unen también otros como el itraconazol, los inhibidores de la cisteína-proteasa (cruzipaína) (CRA-3314 o K-777), los inhibidores del metabolismo del pirofosfato y los inhibidores de la síntesis y del metabolismo del tripanotión.
Efectos adversosMás del 30% de los adultos tratados con benznidazol presentan alguna incidencia o efectos adversos, incluyendo neuropatía, reacciones cutáneas graves, síntomas gastrointestinales y/o alteraciones en el hemograma, función renal y hepática, y más del 20% interrumpen el tratamiento. En niños el benznidazol presenta un perfil de efectos adversos menor, pudiendo estar relacionado con las concentraciones séricas del mismo. Esto se confirma en el estudio realizado por Freilij, en el que la tasa de efectos secundarios en pacientes pediátricos es muy baja, siendo excepcionales los graves, como también muestran estudios previos24,34-36.
Los efectos adversos más frecuentes son, principalmente, digestivos (falta de ganancia ponderal en neonatos y lactantes) o cutáneos. También se han descrito alteraciones hematológicas y/o neurológicas y, con menor incidencia, depresión de la médula ósea y síndrome de Stevens-Johnson.
- •
Benznidazol: gastrointestinales (anorexia, vómitos, dolor abdominal), cutáneos (exantema, urticaria), neurológicos (neuropatía periférica) y hematológicos (anemia, leucopenia, trombocitopenia, que puede originar agranulocitosis y púrpura).
- •
Nitrofurano nifurtimox: gastrointestinales (anorexia, vómitos, dolor abdominal), reacciones de hipersensibilidad cutánea y neurológicos (convulsiones, cefaleas, psicosis, neuropatía periférica).
La presencia de efectos adversos graves obliga a la interrupción del tratamiento. Se consideran efectos adversos graves: síndrome de Stevens-Johnson, eosinofilia con síntomas sistémicos, reacción cutánea tóxica con necrosis epidérmica, discrasia sanguínea grave y neuropatía periférica.
Los síntomas cutáneos moderados o leves pueden tratarse con antihistamínicos y reducción de la dosis de benznidazol (nunca a menos de 5mg/kg/día). En casos de prurito intenso se ha observado mejor respuesta con la administración de loratadina oral. En caso de abdominalgias, se aconseja administrar un protector gástrico. Las cefaleas persistentes obligan a interrumpir el tratamiento, que se puede reiniciar en cuanto mejore la sintomatología.
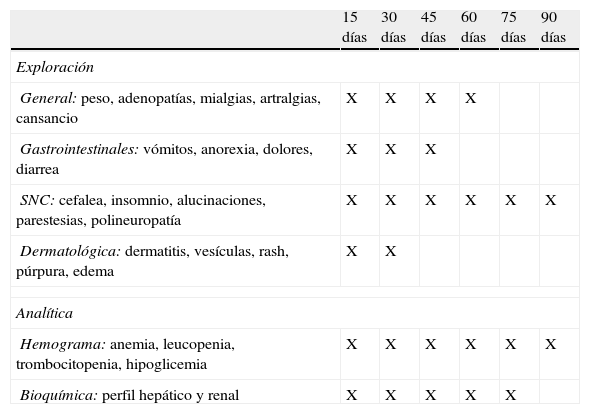
Seguimiento del niño en tratamientoSeguimiento clínico y analítico para monitorización del tratamientoTodo paciente precisa de una monitorización clínica y analítica durante el tiempo que dure el tratamiento, teniendo en cuenta que los efectos adversos descritos pueden presentarse en las primeras semanas, e incluso hasta 4 semanas después de su finalización. En la tabla 6 se ejemplifica la pauta de monitorización clínico-analítica recomendada durante el tratamiento15,32,37.
Controles clínicos y analíticos en el paciente en tratamiento
| 15 días | 30 días | 45 días | 60 días | 75 días | 90 días | |
| Exploración | ||||||
| General: peso, adenopatías, mialgias, artralgias, cansancio | X | X | X | X | ||
| Gastrointestinales: vómitos, anorexia, dolores, diarrea | X | X | X | |||
| SNC: cefalea, insomnio, alucinaciones, parestesias, polineuropatía | X | X | X | X | X | X |
| Dermatológica: dermatitis, vesículas, rash, púrpura, edema | X | X | ||||
| Analítica | ||||||
| Hemograma: anemia, leucopenia, trombocitopenia, hipoglicemia | X | X | X | X | X | X |
| Bioquímica: perfil hepático y renal | X | X | X | X | X | |
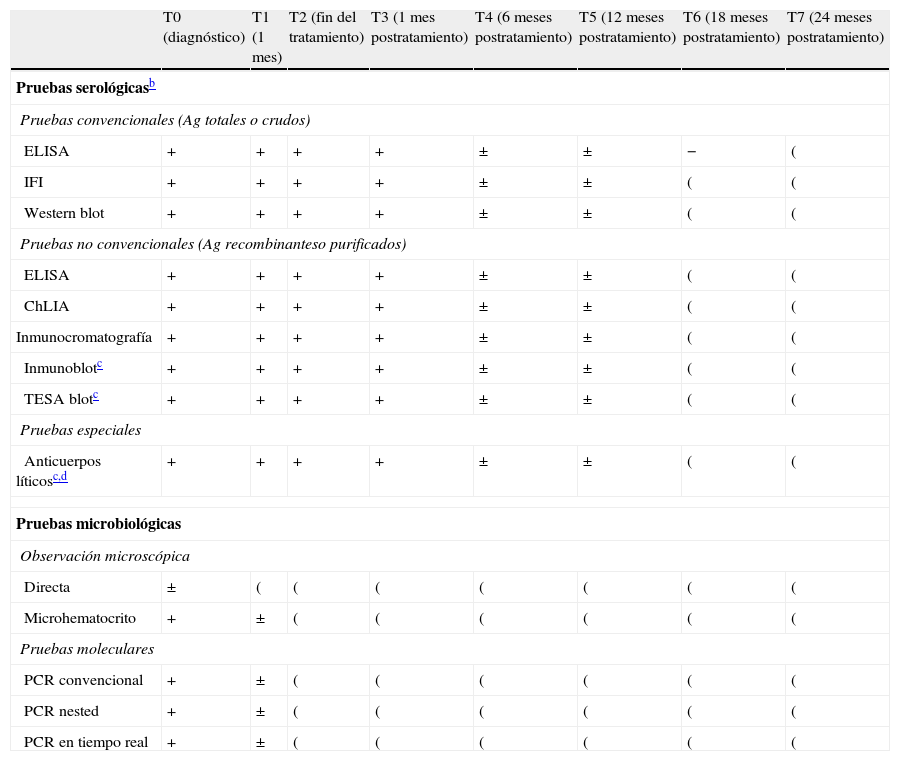
Tras el tratamiento eficaz, los niveles de anticuerpos específicos anti-T. cruzi disminuyen progresivamente hasta una completa negativización38. El tiempo en el que se evidencia esta caída varía dependiendo de la interacción entre el parásito y el hospedador38,39. La demostración de la negativización serológica se debe realizar mediante al menos 2 pruebas con diferentes antígenos (tabla 7)40.
Estimación cualitativa de los resultados esperados en las pruebas serológicas y parasitológicas tras el tratamiento etiológico de la infección por T. cruzi en neonatos y niños menores de un añoa
| T0 (diagnóstico) | T1 (1 mes) | T2 (fin del tratamiento) | T3 (1 mes postratamiento) | T4 (6 meses postratamiento) | T5 (12 meses postratamiento) | T6 (18 meses postratamiento) | T7 (24 meses postratamiento) | |
| Pruebas serológicasb | ||||||||
| Pruebas convencionales (Ag totales o crudos) | ||||||||
| ELISA | + | + | + | + | ± | ± | − | ( |
| IFI | + | + | + | + | ± | ± | ( | ( |
| Western blot | + | + | + | + | ± | ± | ( | ( |
| Pruebas no convencionales (Ag recombinanteso purificados) | ||||||||
| ELISA | + | + | + | + | ± | ± | ( | ( |
| ChLIA | + | + | + | + | ± | ± | ( | ( |
| Inmunocromatografía | + | + | + | + | ± | ± | ( | ( |
| Inmunoblotc | + | + | + | + | ± | ± | ( | ( |
| TESA blotc | + | + | + | + | ± | ± | ( | ( |
| Pruebas especiales | ||||||||
| Anticuerpos líticosc,d | + | + | + | + | ± | ± | ( | ( |
| Pruebas microbiológicas | ||||||||
| Observación microscópica | ||||||||
| Directa | ± | ( | ( | ( | ( | ( | ( | ( |
| Microhematocrito | + | ± | ( | ( | ( | ( | ( | ( |
| Pruebas moleculares | ||||||||
| PCR convencional | + | ± | ( | ( | ( | ( | ( | ( |
| PCR nested | + | ± | ( | ( | ( | ( | ( | ( |
| PCR en tiempo real | + | ± | ( | ( | ( | ( | ( | ( |
Ag: antígenos; ChLIA: inmunoensayo quimioluminiscente; ELISA: ensayo inmunoenzimático; IFI: inmunofluorescencia indirecta; TESA blot: western blot utilizando antígenos de excreción/secreción; +: resultado positivo; −: resultado negativo; ±: resultado positivo o negativo o indeterminado.
Actualmente en España se dispone de numerosas pruebas comerciales convencionales y no convencionales. La Organización Mundial de la Salud (OMS), conjuntamente con diferentes centros de referencia a nivel internacional, está revisando constantemente el estado actual de la sensibilidad y especificidad de esas pruebas. Para conocer la situación actual es conveniente consultar las guías de la OMS o a los respectivos centros de referencia.
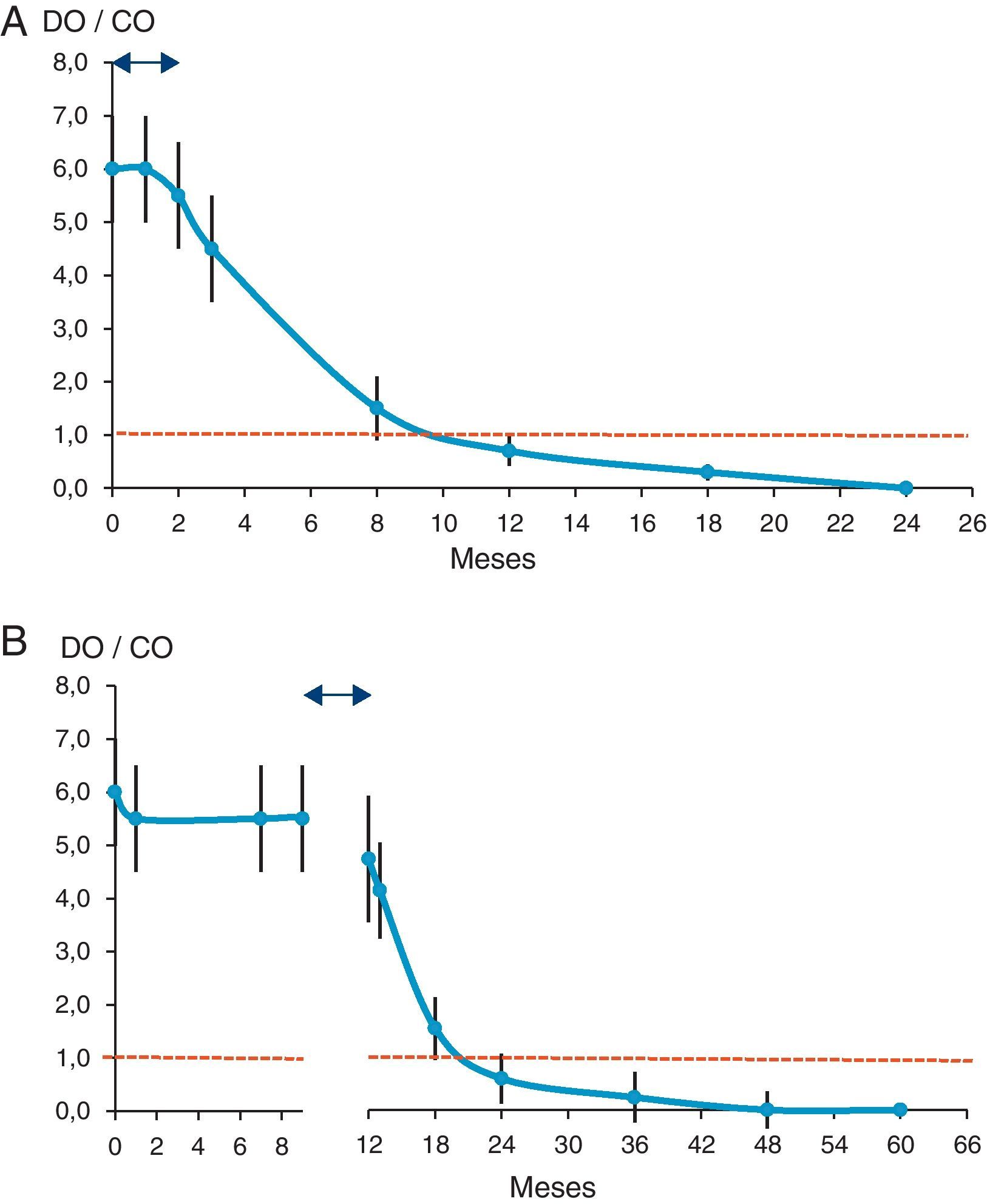
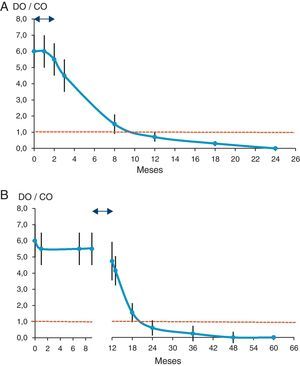
En los neonatos tratados, la cinética de anticuerpos anti-T. cruzi será similar a la de los niños no infectados hijos de madres seropositivas, con la consiguiente desaparición de los anticuerpos de origen materno ante la ausencia del estímulo antigénico, tras la eliminación del parásito38 (fig. 1A). En los niños en los que se empieza el tratamiento por encima de los 9 meses, los anticuerpos anti-T. cruzi son de origen propio y su desaparición, después del tratamiento, puede ocurrir en un tiempo mayor al observado en los neonatos41 (fig. 1B). En ambas situaciones, la negativización serológica debe mantenerse en al menos 2 controles consecutivos realizados en intervalos de 6 o 12 meses entre sí. Paralelamente, se debe realizar la detección del parásito en sangre periférica mediante observación microscópica directa, o por concentración (microhematocrito), y mediante pruebas moleculares (PCR convencional o en tiempo real). La ausencia de parasitemia generalmente es patente desde la primera semana después de haber iniciado el tratamiento42. En este sentido, finalizado el tratamiento y si este fue eficaz, las pruebas parasitológicas presentarán resultados negativos; un resultado positivo en cualquiera de ellas indicaría la persistencia del parásito y, por lo tanto, implicaría que el tratamiento debe prolongarse o modificarse. Un resultado positivo al mes de la conclusión del tratamiento, o en un control posterior, estaría relacionado con fallo terapéutico42. En condiciones de inmunodepresión, los resultados del seguimiento parasitológico son los únicos relevantes para el seguimiento postratamiento.
Cinética estimada de los anticuerpos anti-T. cruzi tras el tratamiento. A) En neonatos (adaptado de Chippaux et al.38). B) En niños mayores de 9 meses de edad (adaptado de Sosa-Estani et al.41). Línea discontinua: cut off de la prueba; flecha de doble punta: periodo de tratamiento (2 meses); DO/CO: índice de reactividad.
El seguimiento clínico del paciente tras finalizar el tratamiento dependerá del estadio de la enfermedad al inicio del mismo. En los casos de enfermedad indeterminada que permanezcan asintomáticos se recomienda la realización de un ECG y radiografía de tórax anual mientras no se cumplan los criterios analíticos de curación. En los casos en los que se demostrara afectación orgánica de cualquier tipo al inicio del tratamiento, así como en los pacientes inmunodeprimidos, el seguimiento clínico se individualizará según cada caso.
Criterios de curación de la enfermedad de ChagasLa problemática actual respecto al tratamiento de la enfermedad de Chagas radica en que no se conoce con certeza su efectividad. Debido a la complejidad de la infección por T. cruzi, la definición de los criterios de curación es controvertida y depende de la fase en la que se inicia el tratamiento tripanocida. En términos generales, se considera que los criterios de curación son: a)eliminación del parásito en sangre periférica; b)desaparición de anticuerpos previamente presentes o seroconversión negativa, y c)evolución clínica favorable39.
En la fase aguda de la infección —y por lo tanto en los casos congénitos diagnosticados en el primer año de vida— estos criterios pueden evidenciarse en el 100% de los casos41. En la infección crónica (reciente) en niños menores de 14 años y adultos, la eliminación del parásito no está estrictamente relacionada con la administración del tratamiento, y como la evolución clínica es lenta, el criterio de curación recae principalmente en la demostración de la seroconversión negativa. Para ello se recomiendan periodos de seguimiento similares al tiempo en el cual el parásito ha convivido e interactuado con el individuo infectado (años)43. Algunos investigadores presumen que el tratamiento ha sido efectivo si después de 5 a 10 años de seguimiento se observa una tendencia a la negativización serológica, es decir, se evidencia una disminución progresiva en el título de anticuerpos de al menos 3 veces con respecto al título inicial o si los niveles de anticuerpos líticos se han negativizado39,41,44,45. Para otros autores es un criterio de curación, en los cardiópatas, la ausencia de alteraciones cardiacas tras 12años de seguimiento. Actualmente, otros investigadores postulan como marcadores tempranos de curación: la disminución de células productoras de IFN-γ específicas contra T. cruzi, cambios serológicos a múltiples antígenos recombinantes y cambios en los factores de hipercoagulabilidad y otros factores de homeostasis46-48.
ConclusiónLa enfermedad de Chagas por transmisión vertical es la forma más prevalente en nuestro medio. Su diagnóstico y tratamiento precoz en la mujer en edad fértil antes del embarazo, o de esta tras el parto y en el niño, tienen impacto en la salud pública en nuestro medio y a buen seguro tendrán impacto en el control de la enfermedad a escala mundial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer a los presidentes de las sociedades de SEIMC, SEGO y de SEIP el apoyo recibido para realizar este documento. También queremos agradecer al Dr. Efren Salto y a la Dra Mellado, a la Dra Navarro y a la Dra Hernández Sampelayo, como presidentas de SEIP, sus sugerencias y su estímulo para la realizacion del mismo.
Miembros de la Sociedad Española de Infectología Pediátrica (SEIP)
María Isabel González-Tomé, Mercedes Rivera Cuello, Victoria Fumadó, Milagros García Lopez Hortelano, Luis Ignacio González Granado, María del Mar Santos Sebastian
Miembros de la Sociedad de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)
Rogelio López-Vélez, Francesca Norman, Maria Delmans Flores-Chavez
Miembros de la Sociedad Española de Ginecología y Obstetricia (SEGO)
Isabel Camaño Gutierrez, Antonio García Burguillo, Leire Rodríguez Gómez, Olatz Avila Arzanegui
Los autores son especialistas pertenecientes a la Sociedad Española de Infectología Pediátrica (SEIP), la Sociedad de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y la Sociedad Española de Ginecología y Obstetricia (SEGO). La filiación de cada uno de ellos se detalla en el Anexo 1.