La monitorización de concentraciones plasmáticas de los antimicrobianos utilizados para el tratamiento de infecciones en pacientes críticos es una de las estrategias planteadas para mejorar los resultados clínicos. El objetivo de la monitorización es doble: limitar los efectos adversos y aumentar la efectividad de los antimicrobianos.
Su desarrollo clínico se limita prácticamente a la monitorización de vancomicina y aminoglucósidos, aunque es deseable su extensión, en el futuro, al resto de antimicrobianos. La aplicación de esta técnica está sometida a múltiples variaciones entre hospitales, lo que dificulta la interpretación y comparación de resultados. Por este motivo, representantes de diversas sociedades científicas relacionadas con el área de la farmacocinética han elaborado un conjunto de recomendaciones para la monitorización plasmática de antimicrobianos utilizando como referencia la vancomicina y los distintos aminoglucósidos. La recomendaciones se realizan en torno a 14 preguntas que abarcan todas las etapas de proceso: indicación de la prueba, extracción de la muestra (tiempo de extracción, cantidad de sangre, tubos), traslado al laboratorio, técnicas aplicables, valores de normalidad, ajuste de dosis y comunicación de resultados. El objetivo de las recomendaciones es homogeneizar en la medida de lo posible el proceso de la monitorización de estos antimicrobianos y facilitar con ello la realización de estudios multicéntricos y la comparación e interpretación de los resultados.
Monitoring plasma concentrations of antimicrobial agents used to treat infection in critically ill patients is one of the recommended strategies for improving clinical outcome. Drug monitoring has a double aim: to limit adverse events and to increase the effectiveness of the drugs. In clinical practice, however, this approach is mainly limited to monitoring plasma concentrations of vancomycin and aminoglycosides, although future extension to other antimicrobial agents would be desirable. Application of this technique varies considerably between hospitals, and this makes interpretation and comparison of the results obtained difficult. For this reason, representatives of various scientific societies related to the pharmacokinetic area have developed a series of recommendations for monitoring plasma concentrations of antimicrobials using vancomycin and several aminoglycosides as the reference.
The recommendations are based on 14 questions encompassing all steps of the process: indication for the test, blood sampling (timing of blood collection, blood volume, tubes), transport to the laboratory, techniques applied, normal values, dose adjustment, and reporting the results. The purpose of these guidelines is to develop a process of monitoring plasma antimicrobial concentrations that is as homogeneous as possible to facilitate the design of multicenter studies, as well as the interpretation and comparison of results.
La posibilidad de ajustar la dosis de los antimicrobianos a partir de la determinación de sus concentraciones en plasma y/o tejidos infectados ha constituido uno de los avances más importantes producidos en las últimas décadas en el tratamiento de infecciones graves en pacientes críticos ingresados en servicios o unidades de cuidados intensivos (UCI). Inicialmente, el objetivo de monitorizar las concentraciones plasmáticas de antibióticos obedecía al intento de evitar toxicidad por sobredosificación o ineficacia por infradosificación1. Actualmente, se han propuesto diferentes relaciones farmacocinéticas y farmacodinámicas que se han asociado con efectividad y con prevención de la multirresistencia2-5. Estos aspectos son especialmente importantes en pacientes críticos en los que es necesario optimizar precozmente las concentraciones de antibióticos en el lugar de la infección y en los que, por otra parte, existen múltiples situaciones que modifican las concentraciones esperadas con la administración de las dosis establecidas (alteraciones del metabolismo y/o excreción, cambios en el volumen de distribución, interacciones farmacológicas)6-8. Lamentablemente, la práctica de la determinación de las concentraciones de antimicrobianos se ha limitado a unos pocos antibióticos en los que el intervalo entre su concentración eficaz y concentración tóxica es muy estrecho (aminoglucósidos, glucopéptidos)9. Por otro lado, la práctica habitual de la determinación de las concentraciones de estos antibióticos se efectúa en un número reducido de hospitales de nuestro país e incluso en éstos son pocos los que, a través de los datos obtenidos en la determinación, se implican de forma activa en el tratamiento antiinfeccioso de los pacientes9. Asimismo, son excepcionales los centros hospitalarios en los que es posible la determinación de las concentraciones de aquellos antibióticos más utilizados en la práctica clínica (betalactámicos, quinolonas) o la de los antibióticos de más reciente introducción (linezolid, tigeciclina, daptomicina).
Una de las principales limitaciones para la aplicación clínica de los datos de farmacocinética y/o farmacodinamia (PK/PD) reside en la variabilidad en los procesos llevados a cabo para su determinación. Tanto la obtención de las muestras (tiempos, intervalos, transporte) como las técnicas utilizadas para su determinación, los sistemas de corrección de dosis, e incluso los tiempos de respuesta, varían ampliamente entre los hospitales españoles, lo que dificulta la comparación de resultados y la realización de estudios multicéntricos que permitan evaluar las ventajas clínicas de su aplicación9. De igual manera, la determinación de las concentraciones en los tejidos infectados presenta importantes dificultades, no sólo en la obtención de las muestras (en ocasiones únicamente es posible durante actos quirúrgicos), sino en la estandarización de su recogida y posterior manipulación.
Finalmente, también ha dificultado el establecimiento de normas generales la modificación, en los últimos años, de las pautas de administración de los antimicrobianos. Los aminoglucósidos se administran según “régimen convencional” (varias administraciones diarias), o “en ampliación del intervalo”, en una única administración10. A su vez, vancomicina puede administrarse en infusión continua11.
El Grupo de Estudio de Infección en el Paciente Crítico (GEIPC-SEIMC) ha promovido conjuntamente con la Sociedad Española de Farmacia Hospitalaria (SEFH) la elaboración de unas normas o recomendaciones de consenso para los antibióticos que se monitorizan con mayor frecuencia en plasma y tejidos, con la intención de homogeneizar esta práctica en las UCI españolas y facilitar la realización de estudios clínicos que permitan demostrar su interés terapéutico.
Material y métodoSe ha organizado un equipo de trabajo (task force) formado por especialistas en farmacia hospitalaria, medicina intensiva, bioquímica y farmacología clínica, todos ellos con especial dedicación y experiencia en la monitorización de concentraciones plasmáticas de fármacos y/o en el tratamiento de infecciones de pacientes críticos. La mayoría de ellos fueron nombrados para participar en el equipo de trabajo por sus respectivas sociedades científicas (Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias [SEMICYUC], SEFH, Sociedad Española de Farmacología Clínica [SEFC], Sociedad Andaluza de Análisis Clínicos [SANAC]) y firmaron un documento de conflicto de intereses con la industria farmacéutica.
Para el desarrollo de las recomendaciones se han formulado 14 preguntas (tabla 1), a partir de una revisión de la literatura médica, que fueron asignadas para su respuesta a cada uno de los especialistas. Los resultados de la revisión fueron expuestos en una reunión presencial del grupo (19 de octubre de 2006) en la que se debatieron diferentes alternativas y se formularon una o varias recomendaciones para cada una de las preguntas, con las que se elaboró un primer borrador. Posteriormente, a partir de la evidencia científica de cada una de las recomendaciones, éstas se clasificaron siguiendo los criterios de la American Thoracic Society/Infections Disease Society of America [ATS/IDSA] (tabla 2)12. Asimismo se procedió a refrendar las recomendaciones por los miembros del grupo de expertos, indicándose para cada una de ellas el grado de aceptación.
Preguntas formuladas en la reunión de consenso
|
Categorización de la evidencia y clasificación de las recomendaciones
| Nivel | Definición |
| Fuerza de la recomendación | |
| A | Buena evidencia para recomendar su uso |
| B | Moderada evidencia para recomendar su uso |
| C | Pobre evidencia para recomendar su uso |
| D | Moderada evidencia para desaconsejar su uso |
| E | Buena evidencia para desaconsejar su uso |
| Grado | Definición |
| Calidad de la evidencia | |
| I | Evidencia de ≥ 1 ensayo clínico aleatorizado y controlado |
| II | Evidencia de ≥ 1 ensayo clínico no aleatorizado, o estudio de cohortes o casos-control, preferiblemente de más de un centro |
| III | Recomendación de expertos, basada en experiencia clínica o descripción de casos |
¿En qué tipo de pacientes críticos debe solicitarse la determinación de concentraciones de antibióticos en plasma y/o tejidos infectados?
En los pacientes críticos se produce un conjunto de modificaciones que van a condicionar los procesos farmacocinéticos de los antibióticos administrados. Estas modificaciones se centran en dos aspectos:
- a)
Variaciones en el volumen de distribución. El aumento de éste se debe al incremento del agua extracelular y, por lo tanto, afecta más a la cinética de antibióticos hidrosolubles, como aminoglucósidos, glucopéptidos y betalactámicos que, como consecuencia, experimentan una disminución de sus concentraciones plasmáticas. Por el contrario, los antibióticos liposolubles (macrólidos, tetraciclinas, quinolonas, etc.) se ven menos afectados por estas variaciones. El incremento del volumen de distribución se produce en situaciones de edema generalizado, ascitis, derrame pleural, ventilación mecánica, administración de fluidos o nutrición parenteral o hipoalbuminemia13. Asimismo, existe una relación directa entre el incremento del volumen de distribución de los aminoglucósidos y el estado de gravedad14.
- b)
Variaciones en el aclaramiento hepático y renal. El aclaramiento de un antibiótico puede verse incrementado en estados hiperdinámicos (como ocurre en situaciones iniciales de sepsis), tras la administración de fármacos vasoactivos y en fases tardías en pacientes quemados13. El incremento en la excreción renal y en el aclaramiento, junto con el aumento del volumen de distribución, conducen a un descenso de las concentraciones plasmáticas del antibiótico, llegando a ser insuficientes en el lugar de la infección. Por el contrario, en situaciones de insuficiencia multiorgánica, secundaria a la sepsis, existe una disminución de la excreción de antimicrobianos, por lo que se incrementan las concentraciones plasmáticas, y esto puede suponer mayores efectos tóxicos. Otros factores que pueden alterar las características farmacocinéticas en todos los pacientes, incluidos los pacientes críticos, son la edad, el peso (y su estimación) y las interacciones medicamentosas. Cabe también considerar la hipoalbuminemia como factor condicionante de la farmacocinética de aquellos fármacos con alta unión a proteínas plasmáticas, puesto que en éstos las concentraciones de fármaco esperadas pueden verse alteradas por un incremento de la fracción de antibiótico libre en plasma. Además, y según algunos autores, en pacientes críticos con una larga estancia en UCI, como ocurre en los pacientes de edad avanzada o en los inmovilizados, la pérdida de masa muscular reduce las concentraciones de creatinina plasmática, de tal forma que su medida puede no reflejar adecuadamente la función renal y, por tanto, los ajustes de dosis de antimicrobianos basados en este parámetro pueden ser inadecuados15,16.
En pacientes sépticos se concentran muchas de las alteraciones descritas17 ya que, por una parte, se incrementa el volumen de distribución y el aclaramiento del fármaco (por estados hiperdinámicos, fármacos vasoactivos) y, por otra, con facilidad se produce una insuficiencia multiorgánica que conlleva una disminución de la eliminación del antibiótico. La línea que divide ambas situaciones es muy estrecha, por lo que será imprescindible realizar un ajuste de las dosis basado en la monitorización de antimicrobianos, principalmente aquellos de carácter hidrofílico o levemente lipofílico.
RecomendaciónLos pacientes críticos subsidiarios de monitorización antimicrobiana serían aquellos que presenten una de las siguientes condiciones: shock séptico o sepsis grave, fracaso hepático o renal, variaciones importantes del volumen de distribución (por hipoalbuminemia, fluidoterapia agresiva, nutrición parenteral, terapia con fármacos vasoactivos o ventilación mecánica), así como los que presenten mala evolución clínica o aparición de efectos adversos relacionados con los antimicrobianos (grado de evidencia I, nivel de recomendación A).
¿En qué dosis se debe hacer la primera determinación de concentraciones de antibióticos?
En el caso de vancomicina, el momento idóneo para la realización de la extracción de muestras para la determinación de concentraciones plasmáticas y/o en tejidos es una vez alcanzado el estado de equilibrio estacionario o steady state (SS)18-22. Dicho SS depende de la semivida de eliminación del fármaco (t1/2), que, a su vez, depende de la función renal del paciente en los casos en los que la eliminación de los fármacos se realiza preferentemente por esta vía, como ocurre con aminoglucósidos y vancomicina. En un paciente con función renal normal, la t1/2 de vancomicina es aproximadamente de 5-6 h, por lo que el SS se alcanzará el segundo día de tratamiento (5 × t1/2). Un tiempo de muestreo adecuado sería en la tercera dosis18,19,22,23. Sin embargo, en los casos de sospecha de toxicidad algunos autores24 recomiendan no esperar a alcanzar el SS. En pacientes no críticos, otros recomiendan esperar 4 o 5 días25,26 en caso de que continúe la terapia con vancomicina (a excepción de pacientes con alteraciones de la función renal, tratamientos con fármacos nefrotóxicos, tratamientos con dosis elevadas, pacientes obesos, pacientes en hemodiálisis y en pacientes pediátricos, especialmente neonatos). Asimismo, existe la recomendación de no determinar concentraciones plasmáticas en aquellos tratamientos que no superen las 48 h24. En el caso de la perfusión continua de vancomicina, ésta debe ir precedida de una dosis de carga de 0,5-1 g, con el fin de alcanzar concentraciones eficaces en el menor tiempo posible.
La monitorización de aminoglucósidos se recomienda, al igual que en el caso de vancomicina, una vez alcanzado el SS18-21,25,27. No obstante, debido a la corta t1/2 de los aminoglucósidos (2-3 h en pacientes con función renal normal), dicho SS se obtiene en las primeras 12-24 h. En el caso de la administración en régimen convencional el momento idóneo sería, al igual que en vancomicina, en la tercera dosis19-21,27. En el caso de administración en régimen de ampliación del intervalo puede extraerse en cualquier dosis, incluso desde la primera20,27.
Recomendaciones- 1.
La obtención de muestras para la determinación de concentraciones plasmáticas de vancomicina debe realizarse a partir de la tercera dosis, en los casos en los que la administración del antibiótico se realiza en régimen de dosis múltiple con infusión de 60 min de duración (grado de evidencia I, nivel de recomendación A).
- 2.
La obtención de muestras para la determinación de concentraciones plasmáticas de aminoglucósidos debe realizarse en las primeras 24-48 h de tratamiento, en los casos en los que la administración del antibiótico se realiza en régimen de administración convencional con infusión de 15-30 min de duración (grado de evidencia I, grado de recomendación A).
- 3.
Cuando se administran los aminoglucósidos en régimen de ampliación del intervalo la determinación de concentraciones plasmáticas puede efectuarse después de finalizar la perfusión de la primera dosis (grado de evidencia III, nivel de recomendación A).
- 4.
Cuando se administra vancomicina de forma intermitente con un intervalo posológico mayor de 24 h la determinación de concentraciones plasmáticas debe efectuarse en la primera dosis (grado de evidencia III, nivel de recomendación A).
- 5.
Cuando se administra vancomicina en perfusión continua la determinación de concentraciones plasmáticas debe efectuarse a partir de las 24 h de haberse iniciado el tratamiento (grado de evidencia III, nivel de recomendación A).
¿En qué momento se deben extraer las muestras sanguíneas para la determinación de concentraciones?
En el caso de tratamiento con vancomicina, existen controversias sobre cuál es el índice PK/PD que mejor predice el resultado terapéutico, ya que algunos autores consideran que es el cociente entre el área bajo la curva (ABC) y la concentración mínima inhibitoria (CMI), mientras que otros clasifican a este antibiótico como “tiempo-dependiente”. Prácticamente la totalidad de autores están de acuerdo en que la extracción de la concentración mínima (Cmín) debe efectuarse entre 0,5 y 1 h previa a la dosis, aunque otros recomiendan la extracción inmediatamente antes de la administración de una dosis. La determinación de la concentración máxima (Cmín) de vancomicina ha sido considerada de escasa utilidad por algunos autores19-21,25,27, excepto en el caso de pacientes críticos con alteraciones de peso20, o en casos de infecciones localizadas en tejidos poco vascularizados. Se ha propuesto que cuando se determine la Cmáx no es necesaria su extracción repetida en las sucesivas monitorizaciones25, a menos que la evolución clínica del paciente no sea favorable. El tiempo de muestreo recomendado para la Cmáx oscila entre 1 y 2 h tras finalizar la perfusión de vancomicina, dependiendo del modelo farmacocinético aplicado18,20,25,26,28. En los pacientes en hemodiálisis, para asegurar que la redistribución de este glucopéptido no interfiere en la monitorización, las muestras deben extraerse al menos 2 h tras finalizar la misma25.
En el caso de los aminoglucósidos el tiempo de muestreo depende del régimen de administración prescrito. En la administración en régimen de dosis convencional deben extraerse 2 muestras, Cmáx y Cmín, al tratarse de antibióticos cuyo efecto depende de la concentración. La muestra para la Cmín debe extraerse en los 30 min previos a la dosis siguiente, recomendándose inmediatamente antes de la nueva administración19-21,25,27,29. Para la Cmáx existe más controversia, algunos autores recomiendan obtener la muestra inmediatamente después de finalizar la perfusión18 y otros hasta 30 o 60 min más tarde21,27. El tiempo con más aceptación es 30 min tras finalizar la perfusión20,21,25,27,29. Para una correcta interpretación de los resultados es de suma importancia conocer el momento exacto de extracción, así como la duración de la perfusión, que puede variar entre 15 y 30 min. En el caso de la administración del aminoglucósido por vía intramuscular, el tiempo de muestreo para la Cmáx oscila entre 6020,29 y 90 min21 después de su administración.
Cuando se administran los aminoglucósidos en régimen de ampliación del intervalo, la Cmáx suele presentar valores superiores a los deseados, por lo que hay autores que consideran innecesaria su determinación30,31. Las concentraciones máxima y mínima en este régimen de administración pueden encontrarse en valores que den lugar a “error del ensayo” (máximos muy elevados, y mínimos indetectables). Desde el trabajo de Nicolau et al32, existe consenso en la extracción de una muestra entre las 6 y las 14 h tras el inicio de la primera dosis19,25,27,29,31, anotando exactamente el momento de la extracción para posteriormente aplicar el método Hartford32. Otros autores21 recomiendan la reducción de este intervalo de extracción a las 8-12 h tras completar la perfusión. Existen recomendaciones de determinar Cmáx y Cmín, aunque se trate de la administración con ampliación del intervalo, en pacientes obesos, pacientes con alteraciones del grado de hidratación o presencia de ascitis, debido a las posibles alteraciones del volumen de distribución29.
Recomendaciones- 1.
La obtención de muestras para la determinación de Cmín de vancomicina administrada en perfusión intermitente debe efectuarse inmediatamente antes de la administración de la dosis siguiente (grado de evidencia I, nivel de recomendación A).
- 2.
La obtención de muestras para la determinación de Cmáx de vancomicina administrada en perfusión intermitente debe efectuarse a las 2-3 h de finalizar la infusión del antibiótico (grado de evidencia I, nivel de recomendación A).
- 3.
Cuando se administra vancomicina en perfusión continua la determinación de concentraciones plasmáticas debe efectuarse a las 24 h de haberse iniciado el tratamiento si se ha administrado la dosis de carga (grado de evidencia III, nivel de recomendación A).
- 4.
La obtención de muestras para la determinación de Cmín de aminoglucósidos administrados en régimen convencional debe efectuarse inmediatamente antes de la administración de la dosis siguiente (grado de evidencia I, nivel de recomendación A).
- 5.
La obtención de muestras para la determinación de Cmáx de aminoglucósidos, tanto en régimen convencional como en régimen en ampliación del intervalo, debe efectuarse a los 30 min de finalizar la infusión intravenosa o a los 60 min de la administración intramuscular (grado de evidencia I, nivel de recomendación A).
- 6.
Cuando se administran los aminoglucósidos con ampliación del intervalo debe obtenerse una muestra adicional entre 8 y 12 h después de finalizada la infusión (grado de evidencia I, nivel de recomendación A).
¿Qué cantidad de sangre?
Existe poca información sobre la cantidad necesaria de sangre ya que, en muchas ocasiones, depende de la técnica empleada. Los analizadores utilizados más frecuentemente (TDx, TDxFLx, AxSYM, Cobas, Viva)9 requieren un volumen de muestra pequeño (100 μl de suero o plasma), por lo que serían suficientes muestras de 2 ml de sangre. En el caso concreto de neonatos, este volumen puede reducirse a menos de 1 ml. Cuando se pretende determinar aminoglucósidos, debido a su distribución intraeritrocitaria, debe evitarse la hemólisis de la muestra, puesto que los verdaderos valores de concentración pueden verse falseados.
Recomendaciones1. La cantidad de sangre necesaria para la determinación de concentraciones plasmáticas en adultos debe ser de 2 ml. En pacientes con dificultad de obtención de muestras debe extraerse una cantidad mínima de 0,3 ml (grado de evidencia III, nivel de recomendación A).
¿Qué tipo de tubo?
En la mayoría de los casos puede utilizarse indistintamente suero o plasma debido a las pocas diferencias observadas entre ambas muestras. En el caso de obtenerse plasma, éste no debe ser plasma heparinizado, ya que la presencia de heparina puede interferir o alterar la estabilidad del antibiótico21,27. No se han demostrado diferencias en la utilización de tubos de vidrio o plástico33.
Existe controversia en cuanto a la utilización de tubos con gel separador (SST®), mientras algunos autores no encuentran inconvenientes en su uso27,34, otros lo desaconsejan debido a la posible adsorción del antibiótico al gel que podría reducir sus concentraciones33,35.
Recomendaciones1. Los tubos más adecuados para la recogida de muestras para la determinación de concentraciones plasmáticas deben ser preferentemente de vidrio, sin anticoagulante y sin gel (grado de evidencia I, nivel de recomendación A).
¿Cómo deben conservarse las muestras hasta llevarlas al laboratorio? ¿En cuánto tiempo?
Para evitar alteraciones de los resultados, las muestras extraídas para determinar concentraciones de antibióticos deben llevarse al laboratorio lo antes posible. En caso de que este tiempo se prolongue, las características físico-químicas de la muestra y la concentración de sus componentes químicos pueden modificarse. Debido a la escasa estabilidad de la muestra, si ésta es conservada a temperatura ambiente, sería conveniente realizar la determinación dentro de las primeras 2 h tras la extracción21. En caso contrario, la muestra debe mantenerse en nevera hasta un máximo de 24 h, o congelar el plasma/suero para evitar degradaciones, especialmente si la muestra contiene aminoglucósidos junto a betalactámicos27.
Deben evitarse los tubos neumáticos para el transporte, ya que pueden hemolizar la muestra y alterar los valores de las concentraciones de aminoglucósidos. Las muestras deben estar debidamente identificadas para que no haya posibilidad de confusión durante el transporte y posterior procesamiento en el laboratorio.
Recomendaciones- 1.
Las muestras deben ser enviadas al laboratorio lo antes posible. En el caso de que no puedan enviarse inmediatamente deben, guardarse en nevera (4 °C), como máximo en 24 h (grado de evidencia I, nivel de recomendación A).
- 2.
Si el paciente recibe conjuntamente aminoglucósidos y betalactámicos, debido a la interacción fisicoquímica entre ambos antibióticos, sería recomendable el envío de la muestra de forma inmediata al laboratorio para la determinación de las concentraciones del aminoglucósido (grado de evidencia I, nivel de recomendación A).
¿Qué información mínima debe acompañar a la solicitud de una determinación de concentraciones plasmáticas?
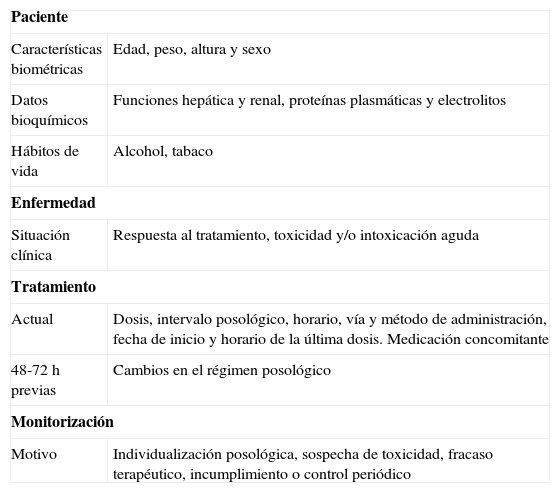
Es imprescindible la consideración de una serie de variables en el momento de interpretar el valor numérico que indica el resultado de las concentraciones séricas de un fármaco en un paciente determinado, debido a que pueden influir y modificar considerablemente el significado clínico del mismo. Estas variables dependen de las características del paciente, de su enfermedad y del tratamiento recibido, así como de las condiciones de muestreo36. En la práctica y con objeto de facilitar las labores de monitorización, así como de procesar la información obtenida, los laboratorios de farmacocinética clínica elaboran hojas específicas para la petición de monitorización (tabla 3)37.
Variables que se deben considerar para la interpretación de las concentraciones séricas de un fármaco
| Paciente | |
| Características biométricas | Edad, peso, altura y sexo |
| Datos bioquímicos | Funciones hepática y renal, proteínas plasmáticas y electrolitos |
| Hábitos de vida | Alcohol, tabaco |
| Enfermedad | |
| Situación clínica | Respuesta al tratamiento, toxicidad y/o intoxicación aguda |
| Tratamiento | |
| Actual | Dosis, intervalo posológico, horario, vía y método de administración, fecha de inicio y horario de la última dosis. Medicación concomitante |
| 48-72 h previas | Cambios en el régimen posológico |
| Monitorización | |
| Motivo | Individualización posológica, sospecha de toxicidad, fracaso terapéutico, incumplimiento o control periódico |
Las instrucciones sobre tiempos de muestreo, volumen de sangre necesario y características del tubo de recogida de muestra deben estar recogidas en el Manual de toma de muestras del laboratorio que, junto con el Manual de procedimientos normalizados de trabajo, constituirán las fuentes básicas de información ante cualquier duda sobre la extracción de la muestra por parte del personal de enfermería y/o facultativos responsables.
El tubo de recogida de muestra debe estar identificado adecuadamente. Las etiquetas con códigos de barras constituyen la tecnología de elección, pues permiten asociar de forma inmediata los datos de la solicitud analítica con los de la muestra biológica38-40.
RecomendaciónPara la monitorización de antimicrobianos se recomienda el etiquetado directo del tubo de recogida de muestra, preferiblemente con código de barras que incluya una información mínima (tabla 4) (grado de evidencia III, nivel de recomendación A).
¿Qué tipo de técnica debe de emplearse?
Los ensayos de polarización de fluorescencia (FPIA), inmunoenzimáticos (EMIT) y turbidimétricos (PETINIA) son los más comúnmente usados en los laboratorios clínicos americanos21. Esta circunstancia se justifica debido a que estos tipos de inmunoensayos son fáciles de usar y automatizar en las grandes plataformas analíticas y permiten conseguir un tiempo de respuesta corto en la emisión de resultados. Otras técnicas, como el radioinmunoanálisis (RIA), la cromatografía líquida de alta eficacia (HPLC), la cromatografía de gases (GC) y la cromatografía gas-líquido (GLC) pueden ser de interés, pero en el momento actual presentan importantes limitaciones.
Aunque el RIA permitió por primera vez la cuantificación de concentraciones de fármaco en nanogramos por milílitro (ng/ml), este método presenta algunos inconvenientes, como gran complejidad, larga duración, problemas de eliminación de residuos radiactivos y falta de menú variado para un gran número de fármacos. La GLC permite la separación del fármaco en estudio de sus metabolitos y su diferenciación de otros fármacos coadministrados y compuestos endógenos de estructura similar, por lo que se planteó la posibilidad de su implantación sistemática41. Sin embargo, la necesidad de grandes volúmenes de muestra para garantizar una buena sensibilidad analítica y la aplicación de derivaciones químicas para asegurar que el analito tuviera el requisito previo de volatilidad supusieron un freno para su implantación en el laboratorio clínico. Los detectores de espectrometría de masas acoplados con cromatógrafos de gases y la aplicación de columnas capilares han permitido aumentar la sensibilidad de esta técnica analítica.
Las técnicas de HPLC ofrecen versatilidad con mínima preparación y pequeños volúmenes de muestra, buena sensibilidad, especificidad, y relativa facilidad de uso, circunstancias que la sitúan como una buena alternativa a la GLC y, por ende, frente a los inmunoensayos42. Al mismo tiempo, se pueden combinar con espectrómetros tandem-masa, hecho que ha revolucionado el análisis de fármacos. En la actualidad se considera la técnica que se deberá implantar en el futuro en laboratorios de referencia con grandes volúmenes de muestras. Entre sus inconvenientes deben mencionarse la necesidad de personal cualificado bien entrenado para el manejo diario en el laboratorio y su elevado coste43.
En los hospitales españoles se ha observado un predominio en el uso de autoanalizadores Abbott (TDx/TDxFlx y Axsym) y en menor grado los Dade Behring (Viva, V-Twin, Dimension Xpand Plus)9. Estas empresas dominan el mercado en nuestro país, con testimoniales incursiones de otros laboratorios de diagnóstico.
Abbott realizó el lanzamiento en 1981 del TDx, aún en uso hoy en día, basado en la técnica del FPIA. Se trata de un inmunoensayo homogéneo competitivo de polarización fluorescente que usa complejos de anticuerpo-antígeno como medio para generar un resultado perceptible. Esta tecnología es la predominante en los hospitales españoles9. En 1991, en un esfuerzo por mejorar la eficacia del procesamiento de estos ensayos, se introduce el sistema TDxFlx que incluye funciones de acceso aleatorio. Posteriormente se introdujeron el Axsym, Aeroset y Architect, plataformas analíticas que consolidan diferentes tipos de inmunoensayos de tercera generación. Así, amikacina y gentamicina están disponibles en TDx, Architect y Aeroset. Sin embargo, tobramicina y vancomicina únicamente están disponibles en Axsym y TDx. Recientemente, se ha incorporado otro tipo de inmunoensayos magnéticos quimioluminiscentes debido al significativo aumento de sensibilidad44.
Por su parte, Dade Behring ofrece dos tipos de ensayos para la medición de antimicrobianos, el EMIT, técnica de inmunoanálisis enzimático homogéneo que se basa en la competencia entre el fármaco presente en la muestra y el fármaco marcado con la enzima glucosa-6-fosfatodeshidrogenasa por los sitios de unión al anticuerpo45, y el PETINIA, ensayo homogéneo turbidimétrico de inmunoinhibición que utiliza un reactivo de partícula de látex unido al fármaco y un anticuerpo monoclonal específico del fármaco46.
Recomendaciones- 1.
Para la determinación de concentraciones plasmáticas de aminoglucósidos y vancomicina se recomiendan las técnicas de inmunoensayo. En pacientes con insuficiencia renal tratados con vancomicina no debe utilizarse el FPIA policlonal debido al riesgo de sobreestimación de las concentraciones (grado de evidencia I, nivel de recomendación A).
- 2.
Se puede optar por el HPLC, patrón de referencia, cuando el personal de laboratorio esté bien entrenado y las casas comerciales suministradoras del aparato tengan un buen servicio técnico que responda inmediatamente ante cualquier problema técnico (grado de evidencia III, nivel de recomendación A).
- 3.
Los laboratorios deben participar activamente en programas de control de calidad internos y externos que garanticen la validez y utilidad del dato emitido (grado de evidencia I, nivel de recomendación A).
- 4.
La información sobre el método de ensayo que se utiliza en cada hospital se debe publicar en un manual de recogida de muestras, en el que se indicarán claramente el método analítico, los márgenes de concentraciones terapéuticas y tóxicas, valores de pánico, volumen de muestra requerido y especificaciones de los tubos de recogida de muestra (grado de evidencia III, nivel de recomendación A).
¿Cuáles son los niveles óptimos para cada tipo de infección?
Es importante recalcar que las concentraciones de antibióticos consideradas fuera de un contexto clínico no permiten predecir el éxito o fracaso terapéutico, ya que es necesario interpretarlas en relación con la fisiopatología y con otros síntomas y signos de eficacia y toxicidad.
AminoglucósidosLos antibióticos aminoglucósidos más empleados actualmente en clínica son gentamicina, tobramicina y amikacina. Cuando se administran en régimen convencional, gentamicina y tobramicina comparten margen terapéutico: CminSS: < 2 mg/l y CmáxSS: 6-10 mg/l; siendo para amikacina: CmínSS: < 4 mg/l y CmáxSS: 20-30 mg/l.
Los aminoglucósidos son fármacos que dependen de la concentración. A valores de Cmáx más elevados, mayor efecto bactericida, mayor efecto postantibiótico y mayor probabilidad de éxito terapéutico. En función de este concepto, en los últimos años se ha promovido la dosificación en regímenes con ampliación del intervalo. Moore et al47 estudiaron 236 pacientes con infecciones por microorganismos gramnegativos sensibles a gentamicina, tobramicina y amikacina, en los que se observó muy buena correlación entre Cmáx elevadas y respuesta clínica (p < 0,001). En este estudio, la regresión logística ajustada por gravedad permitió observar una relación directa entre Cmax/CMI superior a 10-12 y respuesta clínica satisfactoria. Estudios posteriores desarrollaron nomogramas de dosificación de los aminoglucósidos en ampliación del intervalo32. Dosis de 15-20 mg/kg/día de amikacina o de 5-7 mg/kg/día de tobramicina/gentamicina, permiten alcanzar una relación Cmáx/CMI por encima de 10 en la mayoría de los pacientes48. Con estas dosis, la mayoría de los pacientes con función renal normal presentan con gentamicina/tobramicina, CmínSS: < 1 mg/l y CmáxSS: > 12 mg/l y con amikacina, CmáxSS: < 1 mg/l y CmáxSS: > 35 mg/l. Puesto que en general la CMI frente a microorganismos sensibles suele ser de 0,1 a 1 mg/l para gentamicina/tobramicina y de 1a 8 mg/l para amikacina, en la mayoría de los casos es posible optimizar la relación Cmáx/CMI.
Sin embargo, cabe destacar que dicho margen terapéutico puede variar en función de la patología, indicación y/o población que tratar. En pacientes críticos con neutropenia los aminoglucósidos presentan menor eficacia por lo que es necesario incrementar las Cmáx para obtener una buena actividad bactericida49. Estudios previos in vitro ya habían demostrado que la capacidad fagocítica de los leucocitos está aumentada después de su exposición a concentraciones altas de aminoglucósidos. En esta población de pacientes, parece recomendable mantener las concentraciones plasmáticas de gentamicina/tobramicina entre: CmáxSS: < 2 mg/l y CmáxSS: 15-20 mg/l, y de amikacina: CmáxSS: < 4 mg/l y CmáxSS: 45-60 mg/l, lo que probablemente se relacionará con valores de Cmáx/CMI por encima de 15.
VancomicinaEs un antibiótico glucopeptídico cuya actividad tiempodependiente frente a gérmenes grampositivos. Todavía está en discusión cuál es el índice PK/PD que mejor se correlaciona con eficacia terapéutica: el tiempo supra-CMI (T > CMI) o el ABC por encima de la CMI (ABC0-24/CMI).
En un estudio realizado en pacientes geriátricos con infección de las vías respiratorias bajas por Staphylococcus aureus, no se observaron diferencias significativas en el% de T > CMI entre los pacientes con evolución clínica y microbiológica favorable y los que fracasaron al tratamiento, dado que en todos ellos el T > CMI fue del 100%50. Por el contrario, se evidenció la capacidad predictiva de los valores de ABC0-24/CMI, respecto a mejoría clínica y al tiempo hasta la erradicación microbiológica. Se observó que eran aproximadamente 30 días para obtener erradicación microbiológica cuando los valores de ABC0-24/CMI inferiores a 400, mientras que el tiempo se reducía a 10 días cuando los valores de ABC0-24/CMI eran iguales o superiores a 400.
De las experiencias clínicas comunicadas es posible estimar que concentraciones de vancomicina en predosis (Cmín) y posdosis (Cmáx) de 10 mg/l y 30 mg/l, respectivamente, están asociadas a ABC0-24 de vancomicina de aproximadamente 250 mg/h/l. Esto supone que para microorganismos con CMI inferiores a 1 mg/l, el valor del ABC0-24/CMI suele ser siempre superior a 350-400, mientras que para microorganismos con CMI superiores o iguales a 1, será muy difícil optimizar los valores de ABC0-24/CMI, por lo que no estaría indicado el tratamiento con vancomicina. Además, la poca penetración de este glucopéptido a ciertos tejidos y fluidos corporales, dificulta aún más el tratamiento cuando la biofase se encuentra fuera del torrente circulatorio. Algunos casos interesantes, principalmente por su repercusión clínica, se exponen a continuación:
Neumonía. Numerosos estudios demuestran que la penetración de vancomicina al tejido pulmonar y líquido pleural difiere según la inflamación y grado de sepsis del paciente. En general, la concentración pulmonar del antibiótico parece ser de aproximadamente el 40% de la concentración sérica51. Es por ello por lo que parece recomendable aconsejar concentraciones séricas superiores a las establecidas como estándar: CmínSS: 15-20 mg/l y CmáxSS: 30-40 mg/l. Dichas concentraciones podrían ser alcanzadas con dosis superiores (15 mg/kg/8 h) y posiblemente permitirían la obtención de concentraciones adecuadas de vancomicina en tejido pulmonar mínimas y máximas próximas a 10 mg/l y 30 mg/l, respectivamente. De nuevo, según la CMI para el microorganismo causante de la neumonía, sería posible o no conseguir índices PK/PD óptimos en biofase.
Osteomielitis. La penetración y distribución de vancomicina al tejido óseo es también un factor limitante en el tratamiento de las osteomielitis por microorganismos sensibles al fármaco. Vuagnat et al52 observaron que la concentración de vancomicina en hueso se sitúa entre el 15 y el 20% de la concentración en suero. Ante esta evidencia, sería muy recomendable mantener concentraciones séricas del antibiótico en torno a CmínSS: 20-25 mg/l y CmáxSS: 30-40 mg/l, lo que se conseguiría en la mayoría de los pacientes con función renal normal con dosis altas de fármaco: 15 mg/kg/8 h o 20 mg/kg/12 h. La posibilidad de instaurar o recomendar su administración mediante infusión continua es, en estos momentos, motivo de estudio. La erradicación microbiológica y la eficacia clínica final dependen de la CMI para el microorganismo responsable de la infección.
Meningitis. El paso de vancomicina al líquido cefalorraquídeo (LCR) desde el torrente circulatorio depende en gran medida del grado de inflamación de las meninges y oscila entre el 22 y el 50%53. Esto supone que para poder alcanzar concentraciones de fármaco en el LCR dentro del intervalo considerado como terapéutico, es necesario mantener concentraciones sanguíneas de: CmáxSS: 15-20 mg/l y CmáxSS: 30-40 mg/l Dosis superiores a las habituales, tales como 15 mg/kg/8h, podrían permitir alcanzar dichas concentraciones en el LCR y según la CMI para el microorganismo causante de la infección, optimizar o no la relación ABC0-24/CMI. Esto, no obstante, no garantizará en todos los casos la concentración suficiente en LCR, lo que puede motivar la administración intratecal o intraventricular de vancomicina.
Endocarditis. Requiere especial atención la endocarditis causada por microorganismos sensibles a vancomicina. En este caso, el fármaco debe penetrar en el tejido cardíaco, y según un estudio realizado por Martin et al54 la concentración en miocardio es muy variable, el 3-20% de la concentración sérica, lo que justificaría la comunicación frecuente de ineficacia de vancomicina en esta patología. Las concentraciones séricas que permitirían alcanzar valores adecuados en biofase serían similares (o incluso superiores) a las comunicadas para osteomielitis, con el consiguiente riesgo de nefrotoxicidad. Para microorganismos con valores de CMI superiores a 1 mg/l, principalmente cepas de S. aureus con sensibilidad intermedia a glucopéptidos (GISA), las concentraciones séricas de vancomicina descritas anteriormente, si bien muestran un %T > cmi igual a 100, no permiten optimizar el índice PK/PD: ABC/CMI ≈ 400 h, en el lugar de la infección. Terapias combinadas y/o nuevos fármacos están en estos momentos en estudio y discusión.
Otros antibióticos que se monitorizan y son utilizados en combinación en el tratamiento de endocarditis son los aminoglucósidos. Se desconoce si los índices PK/PD óptimos de estos antibióticos coinciden con los observados en otras infecciones. Parece ser que la actividad sinérgica de los aminoglucósidos en endocarditis se alcanza con concentraciones inferiores. Es esperable que las CmáxSS recomendadas consigan optimizar el índice PK/PD: CmáxSS/CMI > 10-12 para la gran mayoría de microorganismos sensibles a aminoglucósidos. En los casos de microorganismos con sensibilidad intermedia o disminuida, como es el caso de Pseudomonas aeruginosa con CMI superiores a 4 mg/l para amikacina o 2 mg/l para gentamicina/tobramicina, debería plantearse la sustitución del aminoglucósido por otro fármaco dada la dificultad para alcanzar los valores PK/PD óptimos.
Recomendaciones1. Los valores de Cmáx y Cmín óptimos para cada antibiótico dependen del régimen de administración del antibiótico y de la gravedad de la infección tratada. Estos valores se incluyen en las tablas 5 y 6.
Recomendaciones de las concentraciones óptimas para aminoglucósidos dependiendo del régimen de administración10,31,32,55-58
| Antibiótico | Concentraciones séricas recomendadas | |
| Infección grave | Infección con compromiso vital | |
| Régimen de dosificación convencional de aminoglucósidos | ||
| Gentamicina | CmínSS = 0,5-1,5 mg/l | CmínSS = 1-2 mg/l |
| Tobramicina | CmáxSS = 6-8 mg/l | CmáxSS = 8-10 mg/l |
| Amikacina | CmínSS = 1-4 mg/l | CmínSS = 1-4 mg/l |
| CmínSS = 20-25 mg/l | CmínSS = 25-30 mg/l | |
Recomendaciones de las concentraciones óptimas para vancomicina dependiendo de su régimen de administración y del tipo de infección50,52,59-61
| Tipo de infección | Concentraciones séricas recomendadas | |
| Perfusión continua | Régimen de dosis múltiple | |
| Infección grave | ||
| Neumonía | ČSS = 20-25 mg/l | CmínSS = 15-20 mg/l |
| Meningitis | CmáxSS = 30-40 mg/l* | |
| Osteomielitis | ||
| Infección de una herida/abcesos | ||
| Bacteriemia | ČSS = 15-20 mg/l | CmínSS = 7-15 mg/l |
| CmáxSS = 20-40 mg/l* | ||
¿Cuál es el tiempo de respuesta óptimo?
Considerando que este tipo de antibióticos se utiliza en pacientes con infecciones graves, en situaciones clínicas comprometidas (insuficiencia renal, inestabilidad hemodinámica) y que los tratamientos son relativamente cortos, el tiempo de respuesta debería ser lo más corto posible. Lo ideal sería que el médico responsable del paciente tuviera la información necesaria para prescribir la dosis ajustada antes de la siguiente dosis del antibiótico. Por otra parte, en el caso de los aminoglucósidos se ha demostrado una mayor supervivencia en pacientes con sepsis, en los que la individualización posológica basada en la monitorización se realiza en las primeras 24-48 h de tratamiento y se consiguen niveles terapéuticos máximos.
Recomendaciones1. La respuesta del resultado de la determinación de concentraciones plasmáticas de aminoglucósidos y vancomicina debe efectuarse antes de la administración de la siguiente dosis.
Corrección de dosis. ¿Qué metodología se propone?
Es aconsejable individualizar la posología utilizando estadística bayesiana que combina datos demográficos y clínicos del paciente, las concentraciones séricas obtenidas y modelos farmacocinéticos de población semejante al tipo de paciente monitorizado (paciente crítico, insuficiencia renal, pediátricos). Estos métodos pueden aplicarse utilizando programas informáticos apropiados, disponibles actualmente en los hospitales. Sin embargo, es importante considerar la enorme variabilidad de los parámetros farmacocinéticos en los pacientes críticos, situación que dificulta la posible predicción de concentraciones y hace necesaria la monitorización y ajustes repetidos de dosis.
Recomendaciones1. Para la corrección de dosis se recomienda utilizar estadística bayesiana empleando la información de las concentraciones séricas combinada con un modelo de población específico aplicado a pacientes críticos.
¿Cómo se comunican los resultados?
La comunicación de resultados debe realizarse de forma escrita, preferentemente utilizando el propio impreso de petición de monitorización de concentraciones séricas. En el caso de disponer de intranet en el hospital, éste puede ser otro buen medio para comunicar los resultados. En el informe sería necesario destacar los siguientes aspectos: concentraciones séricas obtenidas y su relación con el intervalo terapéutico para la situación del paciente y tipo de tratamiento, recomendaciones posológicas, hora de implantación, posteriores tomas de muestra, control de la función renal, etc. En los casos en los que deba modificarse la pauta de administración de un antibiótico, es aconsejable establecer una comunicación directa con el médico responsable del paciente.
Recomendaciones- 1.
El sistema óptimo de comunicación de resultados debe basarse en la comunicación directa con el médico responsable.
- 2.
Los resultados de las concentraciones plasmáticas y las recomendaciones efectuadas deben quedar documentados en la historia clínica del paciente, junto con la información utilizada para la realización del informe.
¿Cuándo debe repetirse la extracción?
Es necesario optimizar el número de extracciones basándose en los resultados de las determinaciones de las concentraciones séricas. En pacientes clínicamente inestables suelen realizarse muestreos periódicos relativamente frecuentes. Con carácter general, en pacientes en los que se realizan modificaciones posológicas, conviene extraer muestras de sangre en las 24-48 h posteriores a la modificación de la posología, una vez alcanzado de nuevo el equilibrio estacionario. En pacientes con concentración de antibiótico potencialmente tóxica conviene realizar un muestreo previo a la implantación del nuevo régimen. En el caso de pacientes estables los muestreos pueden distanciarse más en el tiempo.
Recomendaciones- 1.
Cuando las concentraciones plasmáticas se encuentran dentro de los márgenes normales, se recomienda una nueva extracción a los 3-4 días para los aminoglucósidos y a los 7 días para vancomicina, a menos que la evolución clínica justifique una determinación en intervalos más cortos.
- 2.
Se repetirá una nueva determinación siempre que se modifiquen las dosis, por cualquier motivo, en las 24-48 h posteriores a la modificación de la posología.
¿Cuándo se deben extraer muestras complementarias? (líquido pleural, líquido cefalorraquídeo, líquido abdominal, etc.)
En pacientes con infecciones graves sería aconsejable medir la concentración de antibióticos en los líquidos o tejidos a los que se tenga acceso coincidiendo con la extracción de la muestra de sangre. Esta muestra puede ayudar a decidir una modificación de la dosis, aun cuando las concentraciones observadas en suero se hayan considerado adecuadas. Vancomicina y aminoglucósidos tiene especial dificultad para llegar al pulmón, al sistema nervioso central y a los órganos con barreras. Por ello, cualquier información suplementaria ayudará a mejorar la posología. La obtención de muestras en tejidos u otros líquidos corporales no está estandarizada.
Recomendaciones1. La información disponible es muy limitada, corresponde a estudios de investigación clínica y no está validada para su aplicación en la práctica clínica habitual. En la actualidad, este tema está siendo objeto de debate.