Introducción
Durante los últimos años se ha producido un aumento significativo en las tasas de resistencia de los principales patógenos respiratorios a algunos de los antibióticos más utilizados en el ámbito comunitario. De especial interés es el aumento sostenido de la prevalencia de resistencia durante la última década a macrólidos y penicilina en Streptococcus pneumoniae, el agente bacteriano implicado con mayor frecuencia en las infecciones del tracto respiratorio1.
Datos procedentes del Proyecto Sensibilidad a los Antimicrobianos Utilizados en la Comunidad de España (SAUCE), realizado entre 1998 y 1999 por el Grupo Español de Vigilancia de Patógenos Respiratorios, reflejan una prevalencia de resistencia en S. pneumoniae del 35% a eritromicina, del 22% a penicilina (50% si se incluyen las cepas con resistencia intermedia) y del 7% a ciprofloxacino2. Como consecuencia del fenotipo de resistencia a eritromicina predominante en España (fenotipo MLSB), cuando una cepa de neumococo es resistente a eritromicina, lo es también al resto de macrólidos, a diferencia de lo que ocurre con los betalactámicos y fluoroquinolonas, donde la resistencia a penicilina y ciprofloxacino no se traduce siempre como resistencia al resto de antibióticos del grupo. La prevalencia de resistencia a penicilina (concentración inhibitoria mínima [CIM] ≥2 mg/l) difiere según el tipo de aislados, siendo menor en los procedentes de hemocultivos (16,5%) que en los procedentes de muestras respiratorias (22,4%) y del oído medio (27,4%). Similares resultados se producen con eritromicina con prevalencias de resistencia de 18,8, 33,2 y 46,8% en aislados procedentes de hemocultivos, muestras del tracto respiratorio inferior y oído medio, respectivamente.
Teniendo como premisa el incremento continuado de la prevalencia de resistencias, a lo largo de este artículo se revisarán: a) la importancia que puede tener la erradicación bacteriana tanto en lo referido a la contención del incremento de resistencias como en lo referido a su relación con la eficacia clínica; b) la implicación clínica de las resistencias para cada una de las familias antibióticas utilizadas habitualmente en el tratamiento de la infección respiratoria, y c) la utilidad de los parámetros farmacocinéticos y farmacodinámicos (FC/FD) a la hora de predecir la eficacia terapéutica de distintos antimicrobianos.
Erradicación bacteriológica como objetivo del tratamiento
Clásicamente se ha considerado la erradicación bacteriológica como un objetivo secundario de las infecciones del tracto respiratorio, siempre por detrás de la eficacia clínica. La alta tasa de resolución espontánea de las infecciones respiratorias adquiridas en la comunidad conlleva que sea muy difícil apreciar diferencias entre antimicrobianos, aun cuando éstas existan realmente. Esto es lo que Marchant et al3 denominaron "fenómeno Pollyanna" a partir de un estudio en el que observaron que tasas de erradicación bacteriana del 100% en niños diagnosticados de otitis media aguda conseguían porcentajes de curación clínica del 90% y no del 100%, debido a casos de etiología vírica que no se habían resuelto completamente. Por otro lado, cuando se conseguían tasas de erradicación mucho más bajas (27%) la curación clínica no disminuía linealmente, alcanzándose la curación clínica en el 74% de los casos. Por lo tanto, al medir la eficacia de un tratamiento en función de la mejoría sintomática, antibióticos con muy buena actividad antibacteriana parecen menos eficaces de lo que realmente son y, al contrario, antibióticos con pobre actividad antibacteriana parecen más eficaces de lo que son en realidad.
Nadie duda de que la erradicación bacteriológica es un requisito indispensable para alcanzar la curación clínica en cuadros como la endocarditis, la meningitis, la osteomielitis y la infección en el paciente neutropénico4. Por lo que se refiere a la infección respiratoria, la faringoamigdalitis estreptocócica ha sido la única en la que la erradicación bacteriológica se ha utilizado de forma habitual como variable de eficacia primaria en los estudios5,6, fundamentalmente por tres motivos: a) el principal objetivo del tratamiento antibiótico en este proceso infeccioso es la prevención de la fiebre reumática, lo cual se consigue con la erradicación del patógeno de la orofaringe en los primeros 9 días7; b) tanto el diagnóstico etiológico inicial como la confirmación de que S. pyogenes se ha erradicado es sencillo de realizar y muy específico8, y c) la dificultad de la evaluación e interpretación de la curación clínica. Si bien es cierto que el tratamiento antibiótico acelera la resolución de la sintomatología de la faringoamigdalitis durante las primeras 48 h9,10, también lo es el hecho de que la mayoría de los pacientes presentan una marcada mejoría en las primeras 72 h de haberse iniciado el cuadro, incluso cuando no se instaura tratamiento antimicrobiano11. Esto significa que la evaluación clínica realizada en muchos estudios varios días después de haber finalizado el tratamiento carece de valor, ya que es muy difícil saber si la curación clínica del paciente se debe al antibiótico o a la evolución normal de la infección.
En cuanto al resto de infecciones del tracto respiratorio, en la actualidad existen datos para poder afirmar que la erradicación bacteriana tiene un papel importante a la hora de alcanzar una respuesta clínica óptima en la otitis media aguda, la sinusitis y las infecciones del tracto respiratorio inferior1,4.
La otitis media aguda es una entidad con elevada resolución clínica espontánea, con tasas incluso por encima del 80%12,13 en algunos estudios, lo que hace muy difícil demostrar diferencias en la eficacia clínica entre diferentes antimicrobianos. Incluso si nos referimos a erradicación bacteriológica, en el 48% de los casos originados por Haemophilus influenzae y en el 16% de los producidos por S. pneumoniae ésta se produce de manera espontánea tras 3-6 días14. Sin embargo, y a pesar de la elevada tasa de resolución clínica espontánea, hay dos estudios clásicos que ilustran claramente la influencia que la erradicación bacteriana tiene sobre la curación clínica. En el primero de ellos se revisaron retrospectivamente los resultados obtenidos de diferentes ensayos clínicos doble ciego en niños diagnosticados de otitis media aguda bacteriana a lo largo de 9 años15. En este estudio, en el 93% (236/253) de los niños en los que se consiguió la erradicación bacteriológica se produjo la resolución clínica del cuadro, en contraste con el 63% (25/40) alcanzado entre aquellos en los que no se consiguió la erradicación (p = 0,002). Estos datos fueron confirmados posteriormente por Dagan et al16 en un estudio prospectivo en el se consiguió la curación clínica en el 97% (64/66) de los niños en los que se consiguió erradicar el agente etiológico comparado con el 63% (36/57) conseguido en aquellos niños en los que no se alcanzó la erradicación bacteriológica (p < 0,001), lo cual puso por tanto de manifiesto la asociación entre fracaso clínico y la no erradicación del patógeno causal. En este estudio también se observó que en los pacientes con erradicación bacteriológica la resolución de los síntomas era más rápida que en aquellos que presentaban un cultivo positivo a las 72-96 h de haberse iniciado el tratamiento.
A diferencia de lo que ocurre en la faringoamigdalitis estreptocócica y en menor medida en la otitis media aguda, en las infecciones del tracto respiratorio inferior el diagnóstico etiológico de certeza no es una tarea nada sencilla. El valor del esputo como muestra diagnóstica es limitado, ya que la presencia de bacterias potencialmente patógenas no prueba que éstas sean la causa de la infección. La diferenciación entre lo que es simple colonización e infección a menudo es imposible. No obstante, existen estudios que muestran la influencia de la erradicación bacteriológica en la resolución clínica en pacientes con exacerbación bacteriana aguda de bronquitis crónica (EBABC). En un revisión de 12 estudios realizados en pacientes con diagnóstico de EBABC17 se observó una estrecha correlación entre la tasa de fracaso en la erradicación y la tasa de fracaso clínico (r = 0,91), hecho que viene a apoyar la teoría de que la erradicación microbiológica es determinante en el resultado clínico, o en otras palabras, el fracaso en la erradicación predice el fracaso clínico1, siendo éstos más frecuentes cuando se utilizan antimicrobianos poco activos con elevadas prevalencias de resistencia o antimicrobianos que la desarrollan durante el tratamiento18,19. La erradicación bacteriológica en la EBABC también tiene influencia sobre los resultados a largo plazo, disminuyendo la tasa de recaídas cuando se alcanza la erradicación bacteriológica1,20.
Por otro lado, el fracaso en la erradicación bacteriológica también puede agravar la selección de clones resistentes y la posterior diseminación de éstos en una población. Si no se consigue la erradicación del agente etiológico, tanto del foco infeccioso como de la nasofaringe (estado de portador), los clones resistentes asumirán el proceso de recolonización de las mucosas después de finalizar el tratamiento, lo cual aumentará el número de poblaciones resistentes en el individuo, favoreciendo de esta manera la transmisión de clones resistentes a la población4.
En resumen, se puede concluir que la erradicación bacteriana en la infección respiratoria supone una mayor eficacia clínica, una resolución más rápida de síntomas, una disminución de las recaídas y una menor selección y diseminación de resistencias1,4,16,17,20.
Implicación de las resistencias en la eficacia del tratamiento antibiótico
A pesar del importante aumento acaecido en los últimos 15-20 años en la prevalencia de resistencia de S. pneumoniae a varios antimicrobianos utilizados habitualmente en el tratamiento de la infección respiratoria2,21,22, los resultados procedentes de los ensayos clínicos y de la práctica clínica diaria no sugieren en muchas ocasiones el impacto y la repercusión de dichas resistencias en el resultado clínico. En el caso de los ensayos clínicos esto puede explicarse por diferentes razones, entre las que estaría la elevada resolución espontánea de estas infecciones con independencia del tratamiento que se administre, la realización de estos estudios en zonas con baja prevalencia de resistencia, la no inclusión de pacientes con sospecha de infección por microorganismos resistentes23, así como la no inclusión de pacientes con infecciones graves24. En el caso de la práctica clínica diaria influiría el hecho de que la mayor parte de las infecciones respiratorias adquiridas en la comunidad son de carácter leve o moderado y esto favorece la resolución espontánea, así como la ausencia habitual de diagnóstico etiológico que llevaría a tratar con antibióticos infecciones virales con buena evolución clínica y baja frecuencia de complicaciones.
Además, hay que tener presente que incluso en aquellos casos en los que el tratamiento fracasa, es muy difícil probar que dicho fracaso se debe a la infección por una bacteria resistente24. El mejor indicador del fracaso de un antibiótico es la persistencia de la bacteria en el lugar de la infección. Sin embargo, esto es muy difícil de documentar en infecciones del tracto respiratorio inferior como la neumonía y la EBABC, debido a que, si bien la persistencia de la bacteria en muestras respiratorias es indicativa de fracaso bacteriológico, también puede deberse a la contaminación de la muestra en la orofaringe y en la boca. Únicamente la persistencia de la bacteria en muestras potencialmente estériles como la sangre, el líquido pleural y algunas muestras respiratorias (p. ej., obtenidas por punción transtorácica aspirativa o cepillo bronquial protegido) serían pruebas inequívocas de fracaso del tratamiento25.
Aunque la documentación de fracasos terapéuticos debidos a resistencia de la cepa infectante entraña una gran dificultad, en los últimos años han aparecido en la literatura médica casos y estudios que confirman la importancia de las resistencias en el resultado clínico.
Macrólidos
Hay dos mecanismos principales de resistencia a macrólidos en S. pneumoniae: el primero se produce como resultado de la modificación de la diana ribosómica del macrólido por la elaboración de una metilasa adicional [codificada por el gen ermB], lo cual se traduce en una pérdida de afinidad entre el macrólido y su diana ribosómica. Los neumococos que albergan al gen ermB presentan el fenotipo MLSB (macrolides, lincosamides and streptogramin B) que confiere resistencia de alto nivel a macrólidos de 14, 15 y 16 átomos, clindamicina y estreptograminas del grupo B26, y son además el fenotipo predominante en España. La presencia del gen ermB afecta ligeramente la actividad de telitromicina, con incremento de sólo una dilución en su CIM9027. El segundo mecanismo de resistencia se relaciona con una actividad de bombeo o expulsión activa del antibiótico (codificada por genes mef) una vez dentro del interior de la bacteria. Los neumococos con este gen presentan el llamado fenotipo M28, que confiere resistencia de bajo nivel a macrólidos de 14 y 15 átomos, pero no a los de 16 átomos (josamicina, midecamicina), ni a clindamicina. Mientras que en Estados Unidos el 85% de los aislados resistentes tienen este fenotipo, en España únicamente representan el 5,6%2.
Recientemente se han descrito 2 nuevos mecanismos, relacionados con mutaciones en genes que codifican proteínas ribosómicas y la subunidad 23S del ARN ribosomal, que en algunos casos conllevan un incremento de 500 veces en la CIM de telitromicina29.
Los macrólidos son el grupo de antimicrobianos de los que se han comunicado más casos de fracasos asociados a resistencia antibiótica30-37. En todos ellos se describe la persistencia de cultivos positivos de neumococo resistente a eritromicina en sangre o en otras muestras estériles tanto en niños como en adultos tratados con macrólidos de 14, 15 y 16 átomos. En un estudio de casos y controles publicado recientemente se constató que el 22% de los pacientes con bacteriemia por neumococo resistente a eritromicina estaban tomando un macrólido cuando se obtuvieron los hemocultivos frente al 0% de los pacientes con bacteriemia por neumococo sensible (p = 0,00000004). De igual forma, cuando se tuvieron en cuenta únicamente aquellos pacientes con cepas de bajo nivel de resistencia a eritromicina (fenotipo M), 5 de los 21 pacientes con un aislado de este tipo estaban recibiendo un macrólido frente a ninguno de los 53 pacientes control (p = 0,00157), lo que indica que en el caso de la bacteriemia, tanto la resistencia de bajo nivel como la de alto nivel tienen relevancia clínica36, en contra de la hipótesis de algunos autores sobre la poca importancia de la resistencia de bajo nivel en el resultado clínico, quienes llegaron a sugerir que aislados de neumococo con CIM ≤ 32 mg/l deberían considerarse sensibles38, en contraposición con el punto de corte establecido por el National Committee for Clinical Laboratory Standards (NCCLS) de ≤ 0,5 mg/l39. Estos datos llevan a la conclusión de que en países como España con una alta prevalencia de resistencia a macrólidos, los macrólidos no deben utilizarse en el tratamiento empírico de infecciones respiratorias en las que S. pneumoniae pueda estar implicado25,31,34,36.
Fluoroquinolonas
La acción bactericida de las fluoroquinolonas se debe a la interferencia con la enzima ADN girasa (codificada por los genes gyrA y gyrB) y topoisomerasa IV (codificada por los genes parC y parE). La resistencia a fluoroquinolonas en neumococo está mediada principalmente por modificaciones en las regiones determinantes de resistencia a quinolonas de los genes parC y gyrA, aunque también se ha descrito la presencia de bombas de expulsión activa40,41. Una primera mutación en parC o gyrA, dependiendo de la fluoroquinolona, conlleva una disminución de la sensibilidad o una resistencia de bajo nivel. Una mutación posterior en el otro gen (parC o gyrA) habitualmente se traduce en una resistencia completa23,42. Además, estudios recientes han demostrado que la transferencia de genes parC y gyrA mutados entre estreptococos del grupo viridans y S. pneumoniae sería otro factor que contribuiría a la diseminación de cepas resistentes43. Estas razones, unidas al mayor consumo de fluoroquinolonas, ha traído como consecuencia un aumento significativo en la prevalencia de resistencia de S. pneumoniae a estos antimicrobianos documentada en algunas zonas44,45, especialmente de Asia.
Sin embargo, todavía no se ha observado una elevación preocupante de S. pneumoniae resistente a fluoroquinolonas de una manera generalizada, lo que podría explicarse por un lado al hecho de que su utilización en pediatría ha sido marginal hasta la fecha y, por otra, que históricamente su consumo en infecciones del tracto respiratorio ha sido menor que el de otras familias de antimicrobianos. En relación a lo primero, en la actualidad se están llevando a cabo estudios con algunas fluoroquinolonas en niños con el fin de conseguir la indicación en este segmento de la población46. La utilización sistemática de fluoroquinolonas en niños, quienes tienen tasas más altas de colonización por neumococo que los adultos, seguramente influiría de manera crucial en la rápida diseminación de cepas resistentes, tanto a niños como a adultos47,48. Respecto al uso de fluoroquinolonas como tratamiento de primera línea en las infecciones respiratorias, y más en concreto en la exacerbación aguda de la bronquitis crónica, puede ser otro factor determinante en la selección y diseminación de resistencias, debido al riesgo que produce la exposición previa a estos antibióticos y el paciente con tos como fuente de transmisión47, respectivamente.
A lo largo de los últimos años se han documentado bastantes fracasos confirmados bacteriológicamente con ciprofloxacino y más recientemente con levofloxacino25,49-51.
A diferencia de lo que ocurre con los betalactámicos, en los que las cepas resistentes son casi siempre el resultado de la adquisición de un gen de resistencia antes del inicio del tratamiento, en las fluoroquinolonas es frecuente que la resistencia se desarrolle durante la terapia49, lo cual explicaría la existencia de fracasos terapéuticos poco después de su comercialización en zonas con baja prevalencia de resistencias. De hecho, el consumo previo de fluoroquinolonas se ha identificado como un factor de riesgo de colonización e infección por neumococo resistente a levofloxacino (odds ratio [OR], 10,7), al igual que la enfermedad pulmonar obstructiva crónica (EPOC), la estancia en residencia de ancianos y el origen nosocomial de la bacteria52,53, razones por las cuales algunos autores recomiendan no utilizarlas de primera elección tanto en pacientes que han recibido previamente fluoroquinolonas como en aquellos diagnosticados de EPOC49,52.
Betalactámicos
Hasta la fecha no se han descrito fracasos terapéuticos en la neumonía neumocócica tratadas con penicilina, amoxicilina, amoxicilina-ácido clavulánico, carbapenemes y cefalosporinas de tercera generación con buena actividad antineumocócica en las dosis adecuadas4,25.
Sí se han encontrado fracasos en la infección respiratoria con otros betalactámicos como ticarcilina y algunas cefalosporinas con menor actividad frente a neumococo54-56. También hay descrito un caso de fracaso con cefotaxima a dosis bajas, en un paciente con meningitis infectado por una cepa de S. pneumoniae resistente (CIM, 6 mg/l) que fue tratado con cefotaxima y gentamicina57. Recientemente se ha publicado un estudio en el que se describe el desarrollo de bacteriemia de brecha en pacientes con neumonía tratados con cefaclor, cefadroxil y amoxicilina-ácido clavulánico, siendo la causa más probable de estos fracasos el empleo de dosis subóptimas de 250 mg/8 h en el caso de cefaclor y 500 mg/12 h en el caso de amoxicilina-ácido clavulánico37, lo cual pone de manifiesto la importancia de una posología correcta y adecuada en el tratamiento de la infección respiratoria.
A pesar de que durante los últimos años se ha venido produciendo un aumento constante en la prevalencia de resistencia a penicilina, esto no se ha asociado a un aumento en el número de fracasos terapéuticos de aquellos betalactámicos con una actividad frente a neumococo igual o superior a la de penicilina. Esto debe llevar a plantearse si los puntos de corte actuales para penicilina son correctos, al menos desde una consideración de eficacia clínica. Si bien es patente que el valor de la penicilina como marcador de resistencia a muchos betalactámicos e incluso a otras familias de antimicrobianos (macrólidos) es incuestionable y que, por lo tanto, los actuales puntos de corte pueden considerarse adecuados desde el punto de vista epidemiológico, no lo son ni desde el punto de vista farmacodinámico ni desde el clínico. De hecho, la ausencia de datos referentes a fracaso terapéutico con penicilina y otros betalactámicos en infecciones respiratorias neumocócicas ha llevado, en el caso de la penicilina, a replantear en más de una ocasión la elección de puntos de corte para infecciones extrameníngeas58, y en los casos de la amoxicilina, cefotaxima y ceftriaxona a la modificación de éstos59.
Herramientas para predecir eficacia: farmacodinamia
La farmacología de los antimicrobianos puede dividirse en dos componentes: la farmacocinética y la farmacodinamia. Cuando hablamos de las características farmacocinéticas de un fármaco nos estamos refiriendo a su absorción, distribución, metabolismo y eliminación, factores que unidos al régimen posológico determinan la concentración que alcanza el fármaco en el suero y en los tejidos a lo largo del tiempo. Por su parte, la farmacodinamia se ocupa de la interrelación entre las concentraciones séricas del antibiótico y su actividad antimicrobiana para un determinado microorganismo, utilizando como medida de esta última la CIM del antibiótico para el microorganismo en estudio60,61.
Atendiendo a la actividad y duración de su efecto, los antimicrobianos se clasifican en dos grandes grupos: dependientes de la concentración y dependientes del tiempo. El primer grupo estaría representado por los aminoglucósidos, fluoroquinolonas, azitromicina, telitromicina y vancomicina, antimicrobianos con prolongado efecto postantibiótico (el efecto antibiótico persiste durante varias horas, aun cuando su concentración esté por debajo de la CIM) y cuyo efecto bactericida se incrementa a medida que aumenta la concentración del antimicrobiano62. En el segundo grupo se incluirían los betalactámicos, macrólidos (eritromicina, claritromicina), clindamicina y linezolida, siendo lo fundamental en este caso mantener concentraciones ligeramente superiores a la CIM durante el mayor tiempo posible. En este grupo de antibióticos, concentraciones mayores de cuatro o cinco veces la CIM generalmente no se traducen en un mayor efecto bactericida61.
En función del tipo de antibiótico, hay una serie de parámetros FC/FD que se correlacionan con la eficacia bacteriológica y clínica, y que pueden utilizarse para seleccionar antibióticos y pautas posológicas con la máxima capacidad de erradicación y el mínimo potencial para desarrollar resistencias1,63-65. Los parámetros FC/FD que más se correlacionan con la eficacia clínica y bacteriológica en los antibióticos dependientes de la concentración son por un lado el cociente de dividir el área bajo la curva (AUC) de concentración sérica de 24 h del antibiótico por la CIM del microorganismo (AUC24 h/CIM) que predice eficacia bacteriológica y clínica de aminoglucósidos, fluoroquinolonas, azitromicina, telitromicina, vancomicina, tetraciclinas y quinupristina/dalfopristina y, por otro, el cociente inhibitorio, que no es más que el resultado de dividir la concentración sérica máxima del antibiótico por la CIM del microorganismo (Cmáx/CIM) y que predice eficacia de fluoroquinolonas y aminoglucósidos60,61,66. En ambos casos, únicamente debe considerarse la proporción de antibiótico no unido a proteínas o antibiótico libre67. Diferentes estudios realizados tanto en animales como en seres humanos con fluoroquinolonas han mostrado que mientras que en las infecciones por bacilos gramnegativos son necesarios valores de AUC24 h/CIM superiores a 100-125 para predecir la eficacia terapéutica67, en las infecciones neumocócicas serían suficientes índices por encima de 25-3065,68,69.
En un estudio realizado en 134 pacientes hospitalizados con infección bacteriana del tracto respiratorio, piel y partes blandas o urinaria tratados con 500 mg/día de levofloxacino por vía intravenosa durante 5-14 días, Preston et al65 observaron que en el grupo de pacientes en los que el cociente AUC24h/CIM era menor de 25 había una tasa de fracasos clínicos del 43%, en aquellos cuyo cociente estaba entre 25 y 100 la tasa de fracasos fue del 12% y, finalmente, en aquellos en los que la tasa AUC24 h/CIM era mayor de 100 el porcentaje de fracaso clínicos fue del 1%65.
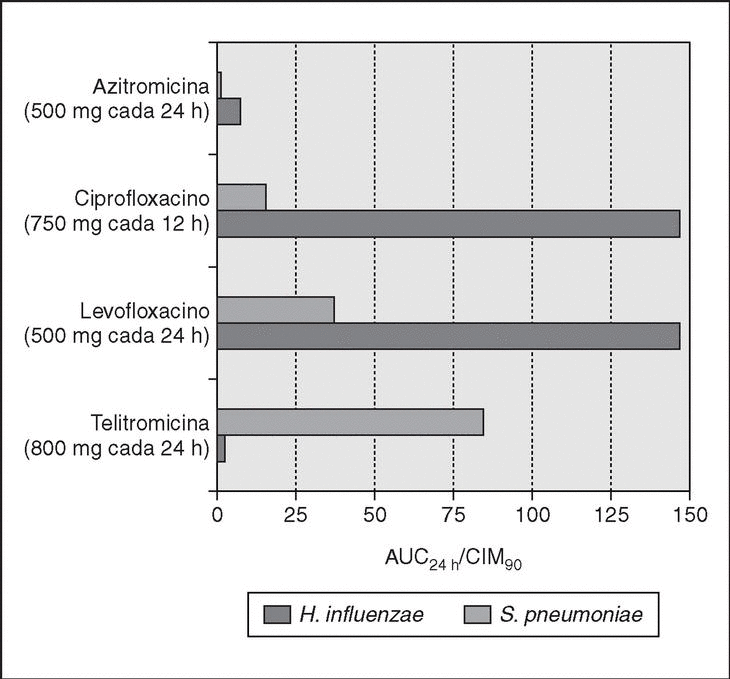
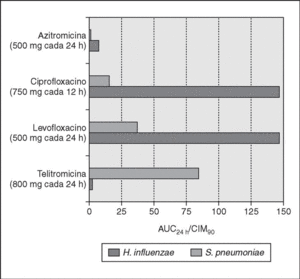
El AUC24 de levofloxacino y azitromicina (ambos por vía oral) es de 35 y 3 mg/h/l, respectivamente62, lo que explicaría los fracasos clínicos descritos anteriormente en pacientes infectados con cepas de neumococo con CIM de 4 y 8 mg/l para levofloxacino superior o igual a 4 mg/l para azitromicina36,49. Acorde con todas estas consideraciones, el punto de corte FC/FD de sensibilidad de S. pneumoniae y H. influenzae podría situarse para levofloxacino en inferior o igual a 1 mg/l y para azitromicina en inferior o igual a 0,12 mg/l62,70, es decir, por debajo de los establecidos por el NCCLS (≤ 2 y ≤ 0,5 mg/l en el caso de S. pneumoniae y ≤ 4 mg/l tanto para levofloxacino como para azitromicina en el caso de H. influenzae). Con respecto a telitromicina, el AUC24 de fármaco libre es de 5 mg/h/l, por lo que el punto de corte farmacodinámico sería de 0,2 mg/l, menor del establecido por el NCCLS (≤ 0,5 mg/l). En la figura 1 pueden observarse las tasas de AUC24h/CIM90 de S. pneumoniae y H. influenzae a diferentes antibióticos en España. Sólo levofloxacino conseguiría valores por encima de 25 tanto para S. pneumoniae como para H. influenzae. La telitromicina alcanzaría buenos valores para S. pneumoniae, pero no para H. influenzae, mientras que azitromicina quedaría por debajo frente a ambos patógenos.
Figura 1. Tasas de AUC24 h/CIM90 para diferentes antimicrobianos por vía oral. Datos de AUC24 h adaptados de Jacobs62. CIM90 de S. pneumoniae2,27,79: azitromicina, ≥ 64 mg/l; ciprofloxacino, 2 mg/l; levofloxacino, 1 mg/l; telitromicina, 0,06 mg/l. CIM90 de H. influenzae80-82: azitromicina, 2 mg/l; ciprofloxacino, 0,025; levofloxacino, 0,03; telitromicina, 4 mg/l.
Con respecto a los antibióticos dependientes del tiempo, el parámetro que mejor se correlaciona con eficacia terapéutica es el tiempo que la concentración del antibiótico permanece por encima de la CIM para el microorganismo entre dos dosis (T > CIM). Datos procedentes de estudios realizados tanto en animales como en seres humanos confirman que el tiempo durante el cual la concentración sérica libre de antibiótico debe estar por encima de la CIM para el microorganismo (T > CIM) es de un 40% para penicilinas y de un 40-50% para cefalosporinas y macrólidos61,71. En estudios realizados en animales infectados con S. pneumoniae en los que la variable primaria era la mortalidad, cuando el tiempo que el antibiótico libre superaba la CIM era mayor o igual al 40% del intervalo entre dosis, la supervivencia que se conseguía era del 90-100%. Por el contrario, cuando el tiempo por encima de la CIM era menor o igual al 20% del intervalo entre dosis las tasas de supervivencias eran prácticamente del 0%72.
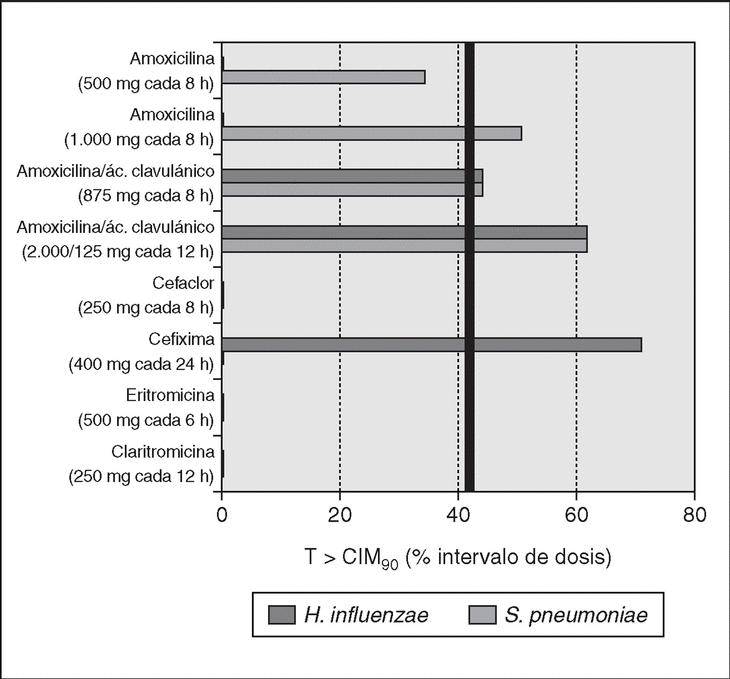
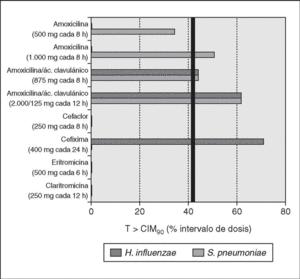
Entre los antibióticos orales cuya actividad es dependiente del tiempo sólo la amoxicilina en dosis altas, en presencia o no de ácido clavulánico (el ácido clavulánico no mejora la actividad de la amoxicilina frente al neumococo, debido a que este microorganismo no produce betalactamasas) consigue tiempos adecuados frente al 90% de los neumococos aislados en España (fig. 2). Si nos referimos a H. influenzae, únicamente la amoxicilina-ácido clavulánico y cefixima alcanzarían tiempos por encima del 40% de intervalo de dosis frente al 90% de las cepas (fig. 2).
Figura 2. Tiempo por encima de la CIM para diferentes antimicrobianos por vía oral. Datos de T > CIM90 adaptados de Soriano83 y Kaye76. Cmáx para amoxicilina 1 g, 13,6 mg/l84. CIM90 de S. pneumoniae2: amoxicilina y amoxicilina-ácido clavulánico, 2 mg/l; cefixima ≥4 mg/l; cefaclor, eritromicina y claritromicina, ≥64 mg/l. CIM90 de H. influenzae80: amoxicilina, ≥ 16 mg/l; amoxicilina-ácido clavulánico, 2 mg/l; cefaclor, 8 mg/l; cefixima, ≤0,25 mg/l; eritromicina, 8 mg/l; claritromicina, 16 mg/l.
Como ya se ha comentado, los parámetros FC/FD también son de utilidad a la hora de seleccionar pautas posológicas. Tan importante es la selección del antibiótico correcto como la de su posología, la cual debería incluso adecuarse al nivel local de resistencias. Por ejemplo, el abordaje terapéutico de una neumonía extrahospitalaria en la República Checa podría ser diferente al de España, si se tiene en cuenta que en el primero la CIM90 de neumococo a penicilina es menor o igual a 0,06 mg/l (0% de resistencia a penicilina) y la prevalencia de resistencia a macrólidos es de un 2,2%73, situación completamente distinta de la de nuestro país, donde la CIM90 de penicilina y amoxicilina es de 2 mg/l y la prevalencia de resistencia a macrólidos se sitúa en torno al 35%2.
En este sentido, se ha diseñado una nueva formulación mejorada farmacocinéticamente de amoxicilina-ácido clavulánico (2.000/125 mg liberación prolongada) que administrada dos veces al día permite erradicar cepas de S. pneumoniae resistentes a penicilina y amoxicilina con CIM de 4 e incluso de 8 mg/l74-78, lo que le convierte en el betalactámico oral con mayor cobertura frente al neumococo, y por lo tanto en una futura opción para el tratamiento de infecciones respiratorias de probable etiología neumocócica en áreas con alta prevalencia de resistencia a penicilina y macrólidos, como es el caso de nuestro medio, especialmente si se quiere mantener bajo control el consumo de fluoroquinolonas23,58. Datos procedentes de 9 ensayos clínicos mostraron una tasa de erradicación del 98,2% (55/56) en pacientes infectados por neumococo resistente a penicilina (CIM ≥ 2 mg/l), incluyendo el 95,2% (20/21) de los casos producidos por neumococo resistente a amoxicilina (CIM de 4 y 8 mg/l)75. Esta es la primera vez que un antibiótico aumenta la cobertura frente a cepas consideradas resistentes, disminuyendo además el número de administraciones del mismo.
Conclusiones
El aumento en la prevalencia de resistencias de los principales patógenos respiratorios, sobre todo de neumococo, unido a los nuevos conocimientos disponibles acerca de la importancia de la erradicación microbiológica y de los parámetros farmacodinámicos en la predicción y consecución del éxito terapéutico hace necesaria una modificación en las pautas de tratamiento en muchas partes del mundo. La prescripción debería basarse en principios farmacodinámicos predictores de eficacia, erradicación bacteriana y prevención de resistencias, utilizando siempre como base los patrones locales de resistencia1,4,23.
Agradecimientos
Los autores queremos agradecer al Dr. L. Aguilar la revisión crítica de este artículo y sus aportaciones al mismo.