Describimos el caso clínico de una paciente de 34 años, que desarrolló un shock séptico grave por Streptococcus pneumoniae relacionado con una asplenia congénita aislada (ACA), no diagnosticada previamente.
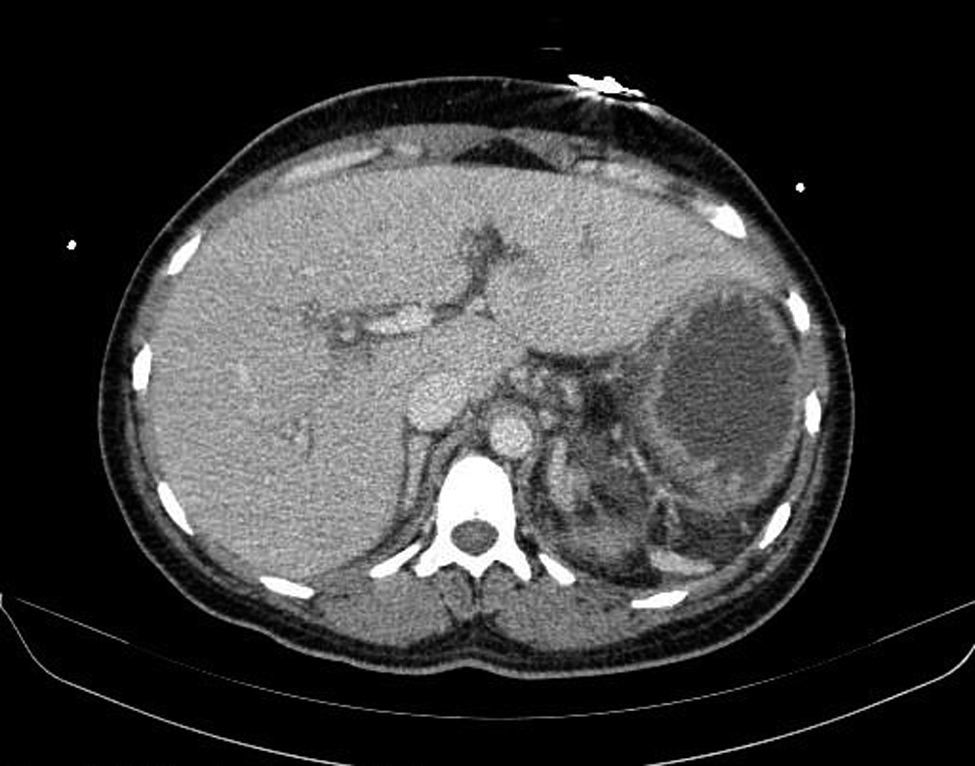
Como único antecedente destaca una infección de la herida quirúrgica por Enterococcus faecalis después de una cesárea. Acude a urgencias con mal estado general de 24h de evolución, dolor abdominal y en miembros, con evidencia de hipoperfusión en zonas acras e hipotensión severa refractaria a la fluidoterapia. Sin más signos ni síntomas de focalidad infecciosa, se realiza una TAC de abdomen para filiar el foco infeccioso que mostró una asplenia no conocida, sin otras malformaciones asociadas (fig. 1). La antigenuria de neumococo fue positiva, y los hemocultivos confirmaron la etiología neumocócica del cuadro. El resto de cultivos microbiológicos fue negativo. La cepa se clasificó como serotipo 22S (Centro Nacional de Microbiología, Majadahonda, Madrid). Tras iniciar el tratamiento con ceftriaxona 2g/12h, los hemocultivos de control se negativizaron, finalizando dicha pauta el décimo día de tratamiento. La paciente precisó autoinjertos cutáneos en la mano derecha. La ecocardiografía descartó afectaciones estructurales cardíacas. Recibió vacuna antineumocócica (13-valente y 23-valente), y frente a meningococo C y Haemophilus influenzae tipo B.
El estudio ecográfico de extensión realizado a familiares de primer grado (padres e hija) no mostró asplenia u otras anomalías o malformaciones viscerales asociadas.
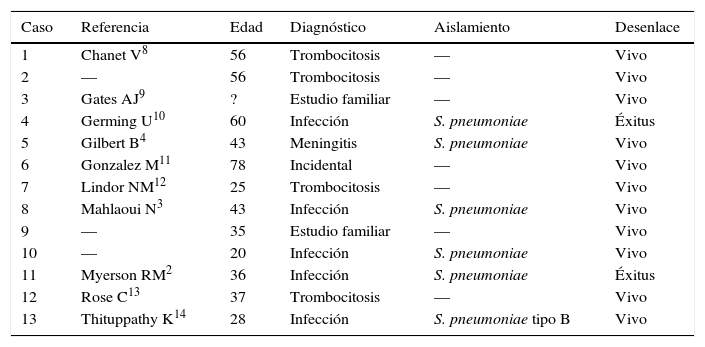
En el origen, la asplenia (ausencia de bazo) puede ser adquirida o congénita, siendo la causa más común la esplenectomía quirúrgica. La asplenia congénita puede presentarse asociada a síndromes malformativos, cardiopatías congénitas (síndrome de Ivemark), malformaciones viscerales o hacerlo de forma aislada1. El primer caso de ACA, fue descrito por Myerson y Koelle en 19562. Se trata de una enfermedad muy infrecuente, especialmente en los adultos. De todos los 47 casos documentados en la bibliografía, 34 pacientes (70,2%) se diagnosticaron en la infancia, mientras que tan solo 13 pacientes (27,7%) se diagnosticaron en la etapa adulta3,4. Se desconoce la incidencia real, aunque en una serie de 20 casos de Mahloui et al. (15 casos confirmados y 5 probables), describen una prevalencia aproximada de 0,51 por millón de nacimientos, es probable que la enfermedad este infra-diagnosticada y esta sea mayor5.
Se han demostrado asociaciones familiares y genéticas3,5. Mahloui et al. encontraron asociación familiar en 15 de los 20 casos3. En cuanto al aspecto genético, la asplenia se ha relacionado con determinantes moleculares implicados en la organogénesis de las de origen familiar (connexin 43 y ZIC3), y más recientemente en las congénitas aisladas6.
Desde principios del siglo xx se conoce el papel fundamental del bazo en el sistema inmunológico. Por tanto, es lógico comprender que exista un aumento de la susceptibilidad a las infecciones, especialmente por bacterias capsuladas. De hecho, más del 70% de los casos totales con ACA comenzaron con procesos infecciosos. En el adulto, por el contrario, más del 50% de los casos fueron diagnosticados en estudios familiares o afecciones hematológicas. La otra mitad comenzaron con procesos infecciosos, 2 de ellos con meningitis. El aislamiento más frecuente fue el Streptococcus pneumoniae (tabla 1). Estos hallazgos son similares a los encontrados en pacientes esplenectomizados donde Streptococcus pneumoniae es la causa del 50-90% de las infecciones3,4. La mortalidad en el grupo de pacientes adultos que comenzó con infección fue del 33%, algo inferior a los pacientes con ACA infantil o en la esplenectomía quirúrgica donde se observan mortalidades superiores al 50%7. Se ha descrito mayor frecuencia de ciertos serotipos (12,22,24), como es el caso de nuestra paciente, pero no es posible establecer asociaciones sólidas.
Pacientes adultos diagnosticados de asplenia congénita aislada
| Caso | Referencia | Edad | Diagnóstico | Aislamiento | Desenlace |
|---|---|---|---|---|---|
| 1 | Chanet V8 | 56 | Trombocitosis | — | Vivo |
| 2 | — | 56 | Trombocitosis | — | Vivo |
| 3 | Gates AJ9 | ? | Estudio familiar | — | Vivo |
| 4 | Germing U10 | 60 | Infección | S. pneumoniae | Éxitus |
| 5 | Gilbert B4 | 43 | Meningitis | S. pneumoniae | Vivo |
| 6 | Gonzalez M11 | 78 | Incidental | — | Vivo |
| 7 | Lindor NM12 | 25 | Trombocitosis | — | Vivo |
| 8 | Mahlaoui N3 | 43 | Infección | S. pneumoniae | Vivo |
| 9 | — | 35 | Estudio familiar | — | Vivo |
| 10 | — | 20 | Infección | S. pneumoniae | Vivo |
| 11 | Myerson RM2 | 36 | Infección | S. pneumoniae | Éxitus |
| 12 | Rose C13 | 37 | Trombocitosis | — | Vivo |
| 13 | Thituppathy K14 | 28 | Infección | S. pneumoniae tipo B | Vivo |
A diferencia de los casos de asplenia quirúrgica o funcional, el diagnóstico de la ACA suele ser tardío, impidiendo anticipar medidas preventivas para poder evitar infecciones fatales. Es fundamental sospecharla en pacientes con infecciones recurrentes, antecedentes familiares, cardiopatía congénita u otras malformaciones viscerales. Se recomienda la vacunación en los pacientes con ACA, incluyendo la anti-neumocócica (23-valente y 13-valente conjugada) para el Haemophilus influenzae tipo B, y la meningocócica aunque su eficacia en este escenario está mal estudiada7. En el caso de nuestra paciente, ninguna de las vacunas citadas hubieran incluido el serotipo 22 del Streptococcus pneumoniae, causa de la infección. Por tanto, es dudoso que un diagnóstico previo hubiera prevenido de la infección mediante una vacunación.
En conclusión, la ACA es una enfermedad infrecuente, pero que puede estar infradiagnosticada. Estos pacientes están predispuestos a un aumento de infecciones potencialmente letales, siendo el Streptococcus pneumoniae el agente etiológico más frecuente. Su sospecha y un mejor conocimiento diagnóstico, terapéutico y profiláctico puede ser vital.
FinanciaciónEste manuscrito no ha recibido financiación para su realización.