La infección por el VIH exige una alta adherencia al tratamiento a largo plazo al tratarse este de un tratamiento de por vida. Darunavir/cobicistat/emtricitabina/tenofovir alafenamida (Symtuza®) es la primera tri-terapia con un inhibidor de la proteasa (IP) en un comprimido. Combina la potencia y una alta barrera genética del mejor IP, darunavir, con la seguridad renal y ósea de tenofovir alafenamida. Estudios en fase III han demostrado que esta coformulación no es inferior en alcanzar la supresión virológica y en el mantenimiento de la eficacia en pacientes inmunosuprimidos, incluso con antecedentes de fracaso previo. Aunque son precisos datos a largo plazo, Symtuza® se convierte en una opción preferente de uso en la mayoría de los pacientes y, en especial, en pacientes en quienes se sospecha baja adherencia, que necesitan un inicio rápido del tratamiento antirretroviral por presentación tardía o infección oportunista, que tienen limitaciones respecto a otras coformulaciones y en aquellos con antecedentes de fracaso previo o resistencias a otras familias. Información sobre el suplemento: este artículo forma parte del suplemento titulado «Darunavir, cobicistat, emtricitabina y tenofovir alafenamida coformulados en el tratamiento de la infección por el VIH», que ha sido patrocinado por Janssen.
Because lifelong therapy is needed in HIV infection, high long-term adherence is necessary. Darunavir/co-bicistat/emtricitabina/tenofovir alafenamide (Symtuza®) is the first triple therapy combining a protease inhibitor (PI) in a single tablet regimen. This drug combines the potency and high genetic barrier of the most effective PI, darunavir, with the renal and bone safety of tenofovir alafenamide. Phase 3 studies have demonstrated its non-inferiority in achieving virologic suppression and maintaining efficacy in virological-ly suppressed patients, even in those with previous failure. Although long-term data are needed, Symtuza® has become a preferred option in most patients. The drug is especially useful in patients with suspected poor adherence, those requiring rapid treatment initiation because of late presentation or opportunistic infection, patients with limitations for other alternatives, and those with a history of previous failure or resistance to other classes of drugs. Supplement information: This article is part of a supplement entitled “Co-formulated cobicistat-boosted darunavir, emtricitabine, and tenofovir alafenamide for the treatment of HIV infection”, which is sponsored by Janssen.
Desde su introducción en 1996, los fármacos inhibidores de la pro-teasa (IP) encabezaron el marcado descenso en la morbilidad y mortalidad asociadas con la infección por el VIH y se convirtieron en la base del denominado tratamiento antirretroviral de gran actividad (TAR) que durante años consiguió revertir o impedir la progresión del deterioro inmunológico en estos pacientes1. Con esta familia en cabeza o como parte importante de las distintas combinaciones, la infección por el VIH ha dejado de ser una de las causas de muerte prematura en la mayoría de las regiones del mundo donde el tratamiento está disponible. Sin embargo, a diferencia de otras pandemias, esta infección vírica no puede ser erradicada y precisa un tratamiento de por vida2.
En busca de los mejores tratamientos posibles, en eficacia y en tolerancia, en los últimos años se ha asistido al desarrollo e introducción de nuevas familias de fármacos y nuevas combinaciones, y a la progresiva selección de los mejores fármacos dentro de cada clase con la intención de evitar riesgos innecesarios a los pacientes y para mejorar los tratamientos3. Para obtener la mejor adherencia a un tratamiento crónico, una premisa fundamental para lograr el máximo beneficio, durante años se dispuso solamente de la combinación de una triterapia coformulada en un comprimido a dosis única (STR, single tablet regimen), Atripla®. Hoy existen más de 30antirretrovirales para el tratamiento de la infección por el VIH, entre los cuales hay 8 STR diferentes (tabla 1).
Combinaciones a dosis fijas de diferentes fármacos antirretrovirales según familias
| Combinaciones | Nombre comercial |
|---|---|
| NRTI | |
| Zidovudina + lamivudina | Combivir® |
| Abacavir + lamivudina | Kivexa® y Epzicom® |
| TDF + emtricitabina | Truvada® |
| Zidovudina + lamivudina + abacavir | Trizivir® |
| NNRTI | |
| TDF + emtricitabina + efavirenz* | Atripla® |
| TDF + emtricitabina + rilpivirina* | Eviplera® y Complera® |
| TAF+ emtricitabina + rilpivirina* | Odefsey® |
| IP | |
| Darunavir/cobicistat | Rezolsta® y Prezcobix® |
| Atazanavir/cobicistat | Evotaz® |
| Darunavir/cobicistat/emtricitabina/TAF* | Symtuza® |
| INSTI | |
| TDF + emtricitabina + elvitegravir/cobicistat* | Stribild® |
| TAF + emtricitabina + elvitegravir/cobicistat* | Genvoya® |
| Abacavir + lamivudina + dolutegravir* | Triumeq® |
| TAF + emtricitabina + bictegravir* | Biktarvy® |
Indican combinaciones de triple terapia en un solo comprimido una vez al día. INSTI, inhibidores de la transferencia de cadenas de la integrasa (integrase strand transfer inhibitor); IP, inhibidores de la proteasa; NNRTI, inhibidores no nucleosídicos de la transcriptasa inversa (non-nucleoside reverse transcriptase inhibitor); NRTI, inhibidores nucleosídicos de la transcriptasa inversa (nucleoside reverse transcriptase inhibitor); TAF, tenofovir alafenamida; TDF, tenofovir disoproxil fumarato.
De esta forma, los regímenes actuales son potentes, bien tolerados y cómodos en dosificación. Casi todos ellos alcanzan tasas de supresión virológica superiores al 80-90% a las 48 semanas, tanto en países desarrollados como en desarrollo, y la buena evolución ha producido un aumento de la expectativa de vida, similar a la de la población sin infección por el VIH.
Sin embargo, no todos los pacientes son iguales. En pacientes sin tratamiento previo, la falta de adherencia o la existencia de características basales que aumenten el riesgo de diferentes toxicidades puede comprometer el éxito terapéutico. En pacientes sin tratamiento previo con resistencias basales transmitidas o en pacientes pretra-tados con fracasos virológicos previos, los tratamientos de elección deben ser eficaces en presencia de esas características para lograr la supresión virológica. Para continuar esta mejoría en el tratamiento de la infección por el VIH, es fundamental disponer de fármacos que permitan individualizar el tratamiento, es decir, que permitan aprovechar las tasas de alta eficacia sin toxicidad.
En la familia de los IP, ha habido un proceso de selección natural marcado por la combinación de eficacia, toxicidad/tolerancia y alta barrera genética que ha determinado la elección de darunavir (DRV) como el IP de referencia en las distintas guías de tratamiento4. Además, en los últimos años, el cambio a cobicistat (c) como potenciador, con el objetivo de evitar algunos de los problemas de intolerancia asociados con ritonavir, y, recientemente, la combinación con tenofovir alafenamida (TAF) y emtricitabina (FTC) en un solo comprimido (Symtuza®) ha permitido que, por primera vez, se disponga de un IP de elección como opción cómoda en pacientes con infección por el VIH.
En los ensayos clínicos en fase III de evaluación de esta nueva formulación, tanto en pacientes sin tratamiento previo5 como en pacientes pretratados6 se ha demostrado que este STR muestra tasas de supresión virológica similares a las observadas con otras coformula-ciones basadas en inhibidores de la integrasa (InI)7. En pacientes sin tratamiento previo, en el estudio AMBER, la eficacia alcanzó el 91,4% a las 48 semanas y el 2% de los pacientes suspendieron el tratamiento por efectos adversos, con mejoría de la función renal y de la densidad mineral ósea en comparación con pacientes que recibían el mismo IP junto con tenofovir disoproxil fumarato (TDF)5. En el estudio EMERALD no hubo diferencias en el mantenimiento de la supresión virológica en pacientes que recibían un IP previamente (el 1,8 frente al 2,1% de fracaso virológico) y de nuevo hubo mejoría renal y ósea, en una intensidad similar a la observada en otros estudios de simplificación6. Ambos estudios se comentan de forma ampliada en los artículos «Symtuza® (DRV/c/FTC/TAF) en el tratamiento de inicio» y «Symtuza® (DRV/c/FTC/TAF) en el abordaje de pacientes que han recibido tratamiento antirretroviral previamente», respectivamente.
Quizá la única pregunta pendiente ahora ya no es la diferencia en eficacia o toxicidad sino cuándo debería considerarse esta combinación de elección o ser una de las opciones que deberían considerarse en la práctica clínica. Esto es especialmente importante en una población que va a ir cambiando en edad y en comorbilidades. Se espera que en el año 2030 el 73% de los pacientes actuales sean mayores de 50 años, según una estimación de la cohorte ATHENA8 y, quizá más importante, el 84% de los pacientes tendrán alguna enfermedad no asociada con el sida.
En los próximos apartados se tratan diferentes aspectos sobre esta situación.
Objetivos del tratamiento antirretroviral a largo plazo: la eficacia exige adherenciaActualmente, el principal motivo de fracaso del TAR es la falta de adherencia. Este hecho ha motivado, como se ha mencionado, el desarrollo de nuevas coformulaciones para conseguir administrar el tratamiento más sencillo posible. Sin embargo, la adherencia continúa siendo un problema9.
En pacientes en quienes se sospecha o está confirmada una menor adherencia, los IP continúan siendo el fármaco de elección. Su alta barrera genética y el desarrollo de resistencias, conocida desde la introducción de DRV en la práctica clínica y uno de los motivos de su predominio dentro de esta familia, ahora está acompañada por su administración en un STR, que facilita el seguimiento del régimen. Como dato reciente, no se han observado resistencias a DRV en pacientes con fracaso virológico en los 2 estudios en fase III mencionados anteriormente. Este hecho es importante dado que los criterios de entrada en el estudio EMERALD fueron menos restrictivos que en otros estudios de simplificación y así el 58% de los pacientes habían recibido varias líneas de TAR y el 15% presentaba fracaso virológico previo. De hecho, muchos de ellos habían fracasado frente a otros IP y el único criterio de exclusión fue fracaso virológico a un régimen con DRV o existencia de mutaciones asociadas con resistencia a este fármaco, las 11 ya previamente conocidas (V11I, V32I, L33F, I47V, I50V, I54M, I54L, T74P, L76V, I84V y L89V)10.
Como comparación, en estudios de simplificación con el InI bicte-gravir se evitaban mutaciones a análogos y en los estudios SWORD o Striiving, en que se evaluaban terapias basadas en dolutegravir, la existencia de cualquier mutación mayor a análogos, no análogos o IP fue un criterio de exclusión11. Esta diferencia en el diseño de los estudios está basada en la experiencia acumulada y datos recién comunicados. Estudios de revisión han hallado que la aparición de mutaciones durante el tratamiento con DRV (QD 800 mg) es muy rara, < 0,1%12,13. En cambio, estudios recientes han encontrado una alta tasa de fracaso virológico y aparición de mutaciones de resistencia en el caso de dolutegravir, el InI con mejor barrera genética, como mono-terapia14,15, lo que acentúa la superior barrera genética de DRV.
Objetivos del TAR: beneficio adicionalEl uso de un fármaco de alta barrera genética, que evita la aparición de mutaciones en caso de fracaso virológico, no sería motivo de uso por sí solo en muchos pacientes si se asociara con tasas altas de intolerancia digestiva o toxicidad metabólica, renal y ósea. En los estudios de desarrollo de la combinación de DRV/cobicistat o en los estudios en fase III de Symtuza® mencionados anteriormente, la tasa de efectos adversos y la suspensión del tratamiento por estos efectos fueron raras. De hecho, la diarrea, un efecto secundario asociado de forma clásica con la familia de los IP, se detalló en menos del 9%, en su mayoría de grado 1 o 2. De hecho, en el estudio AMBER, la tasa de efectos adversos de grado 3 o 4 fue similar en los brazos, con suspensiones del tratamiento menores del 2% (el 1,9 frente al 4,4%). En el estudio EMERALD, en que se consideraba que el diseño abierto favorecía más efectos adversos en el grupo que cambia a un régimen estable, solo el 1,3% de los pacientes suspendió el tratamiento por efectos adversos. Cabe destacar que no se objetivaron efectos adversos psiquiátricos o neuropsiquiátricos, un hecho que permite su uso en este caso.
La seguridad renal y ósea de Symtuza® se ha demostrado en línea con la observada en otros estudios donde TDF es reemplazado por TAF16. De forma importante, no se ha descrito y se esperan pocos casos de toxicidad tubular con TAF a pesar del uso concomitante de cobicistat dado que este fármaco alcanza niveles en plasma de teno-fovir el 90% menores de los observados con TDF y, además, en el caso de usar un potenciador como cobicistat, la dosis de TAF es 10 mg y no 25 mg, y de este modo se consigue menor acumulación de tenofovir en las células del túbulo proximal renal y menor repercusión ósea. En ambos estudios en fase III se objetivó de forma importante un aumento menor (AMBER) o un descenso mayor (EMERALD) de la pro-teinuria tubular basada en β2-microglobulina (B2M) y proteína de fijación del retinol (RBP, retinol-bindingprotein), como muestra de la menor toxicidad tubular de este STR. De forma importante, este descenso fue mayor en pacientes mayores de 50 años, hipertensos o diabéticos, lo que demostraba, a la vez, el mayor riesgo asociado con TDF y el beneficio observado con TAF.
Desde el punto de vista renal, hay que conocer que cobicistat se excreta a través de filtración glomerular y secreción tubular renal proximal. En la célula tubular, cobicistat inhibe la secreción de creatinina a través del transportador MATE-1 (multidrug and toxin extrusion-1), que no interfiere con la secreción tubular de tenofovir17. De esta forma, pacientes que inician un régimen basado en cobicistat experimentan un incremento inicial de la concentración sérica de creatinina de alrededor de 0,05-0,1mg/dl. Este efecto parece que es máximo a las 4 semanas tras su inicio, permanece constante durante el seguimiento y desaparece tras la interrupción. Su falta de significado estructural se ha demostrado al comparar el descenso de alrededor de 10 ml/min en la tasa de filtración glomerular estimada (TFGe) por la ecuación de Cockroft-Gault mientras que no se afecta al medir la TFG real por aclaramiento de iohexol, una sustancia inerte que no sufre secreción tubular. En ambos estudios en fase III se observa este descenso de la TFGe, medida por la ecuación CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), y es importante resaltar que, mientras que en el estudio AMBER de pacientes que no han recibido tratamiento previo el descenso de la TFGe fue menor en el grupo de Symtuza® (efecto cobicistat) que en el grupo de TDF (efecto cobicistat + influencia de TDF), en el estudio EMERALD hubo mayor descenso en el grupo de Symtuza® (efecto cobicistat) dado que la mayoría de los pacientes en el brazo control continuaban recibiendo ritonavir y no cobicistat, y naturalmente se habían incluido por una función renal dentro de lo normal. En cualquier caso, al estimar la TFG con el uso de cistatinaC en vez de creatinina, una proteína de las células multinucleadas que no depende de la secreción tubular, se observan mejorías en los brazos de Symtuza® en ambos estudios.
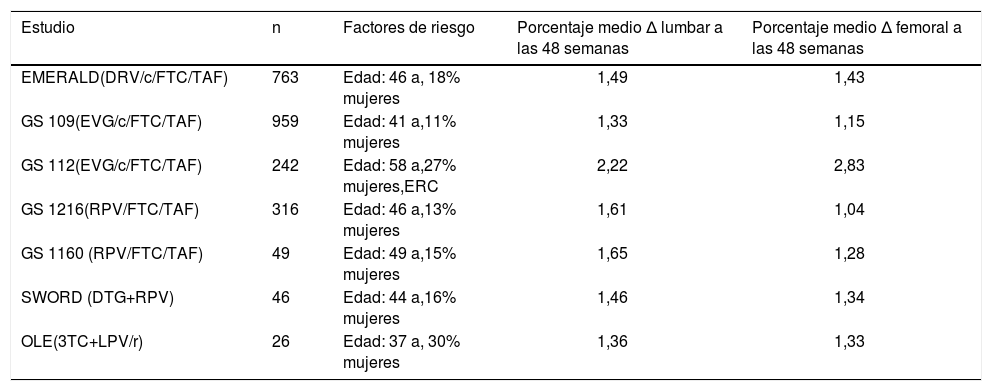
La potencial toxicidad ósea de los IP ha permanecido como parte importante de la discusión clínica. En distintas cohortes y ensayos clínicos se ha objetivado mayor descenso de la densidad mineral ósea (DMO) en caso de utilizar esta familia de fármacos18. Aunque distintos estudios in vitro han encontrado mayor resorción osteoclás-tica en presencia de IP, no se ha definido de forma clara el mecanismo de lesión ósea en presencia de IP e, incluso, se ha vinculado con mayor reconstitución inmunitaria19. Además, el descenso observado en las distintas cohortes no se ha interpretado en función de la presencia o no de TDF, un fármaco que podría aumentar sus niveles plasmáticos y renales, y producir mayor toxicidad en caso de uso de IP de forma concomitante20. Por ello, estos 2 estudios basados en el uso de TAF eran una oportunidad de oro para evaluar su riesgo de toxicidad ósea. En el estudio AMBER, no se objetivan cambios en la DMO en cuello femoral y mínimos en columna lumbar, en el brazo de Symtu-za® en comparación con el brazo control, similar a lo observado en el brazo sin análogos del estudio NEAT001 con DRV+raltegravir21, lo que refuerza que el peso de la toxicidad ósea se debe a TDF. En el estudio EMERALD, como comprobación indirecta, hubo una mejoría en el brazo de cambio a Symtuza® similar a la observada tras el paso de TDF a TAF en otros estudios de simplificación con otras familias y combinaciones, o incluso con terapia dual (tabla 2). Estos 2 hechos sirven para rechazar la posible toxicidad ósea de DRV.
Mejora porcentual de la densidad mineral ósea tras el cambio de tenofovir disoproxil fumarato (TDF) a tenofovir alafenamida (TAF) en diferentes estudios de simplificación y en estudios de biterapia con el uso de inhibidores de la proteasa o sin este
| Estudio | n | Factores de riesgo | Porcentaje medio Δ lumbar a las 48 semanas | Porcentaje medio Δ femoral a las 48 semanas |
|---|---|---|---|---|
| EMERALD(DRV/c/FTC/TAF) | 763 | Edad: 46 a, 18% mujeres | 1,49 | 1,43 |
| GS 109(EVG/c/FTC/TAF) | 959 | Edad: 41 a,11% mujeres | 1,33 | 1,15 |
| GS 112(EVG/c/FTC/TAF) | 242 | Edad: 58 a,27% mujeres,ERC | 2,22 | 2,83 |
| GS 1216(RPV/FTC/TAF) | 316 | Edad: 46 a,13% mujeres | 1,61 | 1,04 |
| GS 1160 (RPV/FTC/TAF) | 49 | Edad: 49 a,15% mujeres | 1,65 | 1,28 |
| SWORD (DTG+RPV) | 46 | Edad: 44 a,16% mujeres | 1,46 | 1,34 |
| OLE(3TC+LPV/r) | 26 | Edad: 37 a, 30% mujeres | 1,36 | 1,33 |
Desde un punto de vista metabólico, en los 2 estudios se observa que el uso de TAF en vez de TDF se asocia con aumentos considerables del colesterol total, colesterol de las lipoproteínas de baja densidad (LDL) y de triglicéridos, pero pocos pacientes tuvieron que iniciar tratamientos hipolipemiantes sin diferencias entre ambos grupos en el estudio AMBER (el 1,7 frente al 0,6%) o no fueron clínicamente importantes para el cociente colesterol total/colesterol de las lipo-proteínas de alta densidad (HDL) o índice aterogénico en el estudio EMERALD.
Objetivos del TAR: individualizar el tratamiento en situaciones especialesUna de las ventajas de disponer de una coformulación basada en IP es ampliar nuestro arsenal para el tratamiento de situaciones especiales. Estas incluirían diferentes situaciones, como las basadas en pacientes coinfectados por el virus de la hepatitis C (VHC), en que los IP han demostrado ser escasamente hepatotóxicos, o en pacientes con enfermedad renal y ósea, en que el uso de TAF en dosis ajustada nos permitiría esperar mejoría o no progresión, y también pacientes en que el tratamiento requiere ser individualizado. Una aproximación práctica a la indicación de Symtuza®, desde un punto de vista de su uso en la práctica diaria, se puede encontrar en la tabla 3.
Valoración de Symtuza® como primera opción en la práctica clínica en diferentes situaciones
| Preferente | Preferente/ alternativa | |
|---|---|---|
| Sintratamiento previo | Falta de adherencia/sospecha de falta de adherenciaInicio «ultrarrápido» del tratamiento Falta de prueba de resistencias Inmunodepresión avanzada (< 200 cél./ml) Riesgo o imposibilidad de uso de otras coformulaciones (síntomas del SNC, factores de riesgo, etc.) | Resto de situaciones |
| Simplificación | Fracaso previo a no análogos u otros IPResistencias a otras familias, incluyendo IP* Viremia o fracaso de bajo gradoSospecha de no adherencia/falta de adherenciaToxicidad con otras coformulacionesImposibilidad de control/seguimientoadecuado | Resto de situaciones |
Aunque las distintas guías de expertos han elevado a los InI como opción de elección en la mayoría de los pacientes, un régimen basado en IP puede ser la opción preferida en pacientes con falta de adherencia o sospecha de baja adherencia, en los cuales se precise un régimen con una alta barrera genética. Esto incluiría pacientes con problemas de seguimiento del tratamiento clínico o del cumplimiento del tratamiento (problemas sociolaborales, adicciones, falta de apoyo social, depresión, etc.)22. Hay que considerar que la dificultad en el seguimiento, con visitas perdidas, es muchas veces un indicador de riesgo de pérdida del paciente a largo plazo, lo que permitiría una intervención más precoz9. Incluso, antes de Symtuza® muchos especialistas clínicos recomendaban un régimen con un IP en estos casos, con más comprimidos, pero con mejor barrera genética, un problema resuelto con la coformulación. De hecho, disponer de darunavir y cobicistat en el mismo comprimido elimina el riesgo de falta de adherencia selectiva, donde el paciente toma uno de los fármacos, pero no el otro, o los toma de forma separada y elimina el efecto del potenciador por niveles subterapéuticos. Además, la formulación en un solo comprimido reduce el riesgo de errores de prescripción.
Pacientes que precisan un inicio rápido del tratamiento antirretroviralEn algunos pacientes con situación inmunológica avanzada o con infección oportunista reciente es importante poder iniciar el régimen antirretroviral lo más rápido posible, sin retrasos debido a falta de la prueba de resistencia basal o la realización de la prueba de detección del gen HLA-B57. Incluso en los últimos meses se ha debatido la importancia del inicio «ultrarrápido» del TAR, en la primera consulta o en la primera semana del diagnóstico, lo que permitiría un rápido control de la replicación viral y que se ha asociado con mayor retención en cuidados y seguimiento en países en desarrollo23 aunque un reciente metaanálisis no ha encontrado diferencias en supresión virológica al año24. De hecho, muchos clínicos prefieren empezar un IP en pacientes presentadores tardíos (CD4 < 200 cél./ml) por la experiencia acumulada y para asegurar la eficacia del régimen.
Pacientes con fracasos previos o existencia de resistenciasLa alta barrera genética es un factor fundamental a la hora de decidir el establecimiento de un régimen eficaz en pacientes que han fracasado previamente a otras familias o han acumulado mutaciones a otras familias, como los no análogos y los IP. Como se ha mencionado anteriormente, DRV continúa siendo eficaz en presencia de mutaciones frente a otros IP y la aparición de mutaciones frente a este fármaco continúa siendo residual. Además, es capaz de «proteger» a los fármacos acompañantes y reducir la selección de resistencias frente a ellos, por lo que continúa siendo la base de todo tratamiento cuando existan resistencias a otras familias.
Este hecho sería fundamental en las elevaciones transitorias o blips repetidos, o en los casos de fracaso virológico de bajo grado, definido como la existencia de cargas virales detectables de forma mantenida por debajo de cifras de 500 cél./ml, generalmente incluso por debajo de 200cél./ml, donde muchas veces no disponemos de prueba de resistencias para optimizar el tratamiento, y en los cuales se ha descrito la progresión a fracaso virológico, acúmulo de resistencias, e incluso mayor mortalidad25. Esta situación se ha asociado con cargas virales altas al inicio, CD4+ bajos, tratamientos subópti-mos incluyendo IP previos a 2008 y, por supuesto, menor adheren-cia26. En estos casos, el uso de un IP en un solo comprimido puede mejorar la adherencia y ofrecer la alta barrera genética necesaria para evitar la pérdida de opciones.
Pacientes con limitaciones al uso de otras coformulacionesLa disponibilidad de una coformulación (STR) con buena tolerancia es una alternativa en la práctica clínica para pacientes que precisan un régimen sencillo y no pueden recibir otras coformulaciones disponibles. Este apartado incluiría a pacientes con limitaciones evidentes a otras opciones de STR, como serían los pacientes con HLA-B5701 positivo, pero especialmente incluiría a pacientes con riesgo de toxicidad neuropsiquiátrica a los InI, o que han desarrollado dicha toxicidad. Distintos estudios han referido una incidencia del 2-14% de suspensiones de tratamiento asociadas con la aparición de efectos sobre el sistema nervioso central, especialmente insomnio, con el uso de dolutegravir, que al parecer es más frecuente en pacientes mayores de 50 años, mujeres y personas con antecedentes de enfermedad neuropsiquiátrica27. Aunque se discute si puede ser un efecto secundario común a todos los InI, se observa que es más frecuente en los pacientes que reciben dolu-tegravir y se iguala con el resto de la familia en porcentaje de suspensiones del tratamiento, de nuevo asociadas con la edad28. Por todo lo anterior, parece prudente considerar pacientes en riesgo de efectos del sistema nervioso central con coformulaciones basadas en dolutegravir a aquellos con edad elevada y antecedentes de enfermedad neuropsi quiátrica o insomnio intenso. En todo caso, Symtuza® podría ser una opción como simplificación en pacientes que desarrollan toxicidad con otras coformulaciones y se desea continuar un tratamiento sencillo al no presentar toxicidad cruzada a este nivel.
Limitaciones: interaccionesAdemás de no poder utilizarse en pacientes embarazadas durante el tercer trimestre, la principal limitación del uso de Symtuza® radica en la posible aparición de interacciones. Cobicistat, como ritonavir, es un potenciador con un efecto inhibitorio similar sobre las isoenzi-mas CYP3A4, CYP2D6, P-gp y otros transportadores, por lo que se considera equivalente respecto al riesgo de interacciones29. Sin embargo, la inhibición de cobicistat parece que es más selectiva que con ritonavir y no tiene efecto inductor alguno30. Asimismo, cobicistat es un inhibidor más potente del transportador de la glucoproteína P intestinal, lo que explica, por ejemplo, mayores niveles de dabigatrán con el uso de cobicistat31. Estas pequeñas diferencias también se han observado en estudios pequeños, con la combinación con DTG, con aumento de niveles de este InI de forma marcada tras cambiar de ritonavir a cobicistat, un hecho que se ha intentado explicar por la pérdida de inhibición de la UGT1A1 tras retirar ritonavir. Como dato importante, los niveles de DRV en el sistema nervioso central son similares con el uso de ritonavir y cobicistat, con lo que así se evita la pérdida de control del virus a este nivel.
ConclusiónLa coformulación del mejor inhibidor de la proteasa, DRV, potenciado con cobicistat con sus características diferenciales con ritona-vir y asociado con el uso de TAF en vez de TDF ha permitido disponer de un comprimido altamente eficaz que combina la mejora en adherencia a corto y largo plazo con el uso de un único comprimido, la seguridad renal y ósea de TAF, y la potencia y barrera genética de DRV potenciado. En los 2 estudios en fase III en que se ha evaluado, ha demostrado altísima eficacia con tolerancia adecuada. Con los datos del estudio AMBER se demuestra que es una opción altamente recomendable en todos los pacientes sin tratamiento previo y que puede ser una opción de elección cuando exista o se sospeche mala adherencia, o en aquellos pacientes en que se desee un inicio rápido aunque no se posean datos de resistencia o resultados de la prueba de detección del gen HLA-B57, especialmente en casos de inmunode-presión avanzada o infección oportunista. Con los datos del estudio EMERALD se reafirma su uso en terapias de simplificación, con mejoría renal y ósea en caso de uso de TDF previo, pero con una eficacia mantenida, incluso en caso de fracaso a otros regímenes previos, dada su barrera genética. Por todo lo anterior, Symtuza® se ha recomendado en varias guías de expertos como terapia inicial o alternativa, y será una herramienta útil en el abordaje de los pacientes con infección por el VIH, permitiendo individualizar el tratamiento sin aumentar el número de comprimidos ni reducir la tolerancia.
Conflicto de interesesEl autor José Luis Casado ha recibido honorarios por asesoría científica de Janssen y ViiV, y por conferencias de Janssen, MSD y Gilead, así como becas de investigación de Janssen y MSD.
Las autoras María Fontecha, Marta Monsalvo y Pilar Vizcarra declaran no tener conflicto de intereses.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Darunavir, co-bicistat, emtricitabina y tenofovir alafenamida coformulados en el tratamiento de la infección por el VIH», que ha sido patrocinado por Janssen.