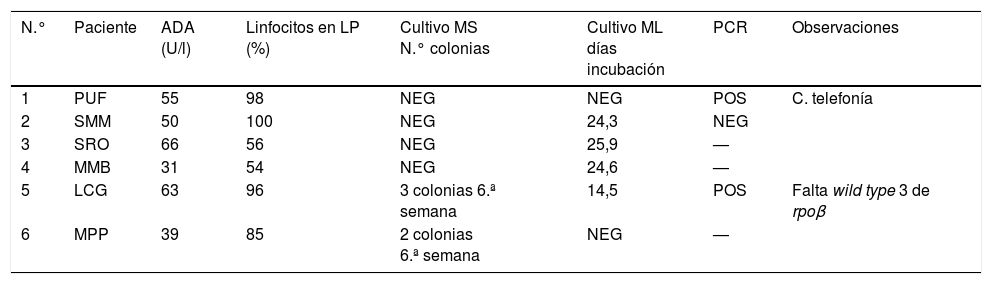
La tuberculosis pleural (TP) es una causa importante de tuberculosis (TB) en nuestra comunidad de Castilla y León y junto a la genitourinaria es la causa más frecuente de TB extrapulmonar. El porcentaje de cultivos positivos en líquidos pleurales (LP) con respecto al total de cultivos positivos para Mycobacterium tuberculosis (MT) ha oscilado entre un 5,18% en el año 2013 y un 6,54% en el año 2016. El número de casos de TP ha permanecido en torno a los 14 casos anuales confirmados por cultivo, mientras que al mismo tiempo se producía un descenso del número de casos de TB pulmonar. Un estudio previo de 17 años de duración realizado en nuestra área de salud del Bierzo1 reveló que tan solo un 2,5% de los LP son positivos para el cultivo de MT. Ante esta situación nos propusimos buscar un sistema de selección de muestras de LP para mejorar el rendimiento de los cultivos de micobacterias y optimizar el uso de técnicas moleculares sobre los mismos. Para ello se evaluaron un total de 200 muestras de LP recogidas entre los años 2015 y 2018. A todas ellas se les determinó el valor de adenosin deaminasa (ADA) estableciendo el punto de corte en mayor o igual a 30U/l, que es a partir del cual se considera que hay sospecha de TP en nuestra área de salud. Todas las muestras se sembraron en medios de cultivo sólidos (Coletsos y Middlebrook 7H11) y en medios líquidos automatizados (BacT/ALERT® MP) incubando al menos durante 6 semanas. Cuando el valor de ADA superaba el punto de corte, se realizaba además una resiembra del medio líquido automatizado al final de su incubación y se prolongaba la de todos los frascos al menos 3 semanas más. La identificación de MT se realizó mediante técnicas moleculares (GenoType® MTBC y GenoType® MTBDR, Hain) y la PCR sobre muestra directa se realizó empleando GeneXpert® MT-RIF (Izasa®). Cuando se prescinde del valor de ADA, en tan solo un 3% de las muestras de LP se obtiene crecimiento/PCR+ de MT. Cuando se utiliza un valor de ADA igual o superior a 30U/l (51 casos, el 25,5% de los LP) el porcentaje de crecimiento/detección por PCR se eleva hasta el 11,76% (6 casos). Como se indica en la tabla 1, en todos ellos el derrame pleural fue de claro predominio linfocitario con cifras que oscilaron del 54 al 100%. En solo 2 casos se obtuvo crecimiento de MT en medios sólidos y tan solo 2-3 colonias crecieron después de la sexta semana de incubación. El crecimiento de MT en medios líquidos fue en 4 casos con una media de 22 días, siendo negativo en 2 casos. En ninguna de las 149 muestras de LP con valores de ADA inferiores a 30U/l se obtuvo crecimiento de MT. Según una reciente revisión, la determinación de los valores de ADA estableciendo puntos de corte adaptados a regiones con alta tasa de TB sería un método con alto poder discriminativo. En cambio, en regiones de baja incidencia tendría un alto valor predictivo negativo2.
Casos de tuberculosis pleural en los que se obtiene crecimiento de micobacterias, y en los que se especifica el valor de la ADA, el porcentaje de linfocitos en el LP, el resultado del cultivo en medios sólidos y líquidos y de la detección por PCR en muestra directa
| N.° | Paciente | ADA (U/l) | Linfocitos en LP (%) | Cultivo MS N.° colonias | Cultivo ML días incubación | PCR | Observaciones |
|---|---|---|---|---|---|---|---|
| 1 | PUF | 55 | 98 | NEG | NEG | POS | C. telefonía |
| 2 | SMM | 50 | 100 | NEG | 24,3 | NEG | |
| 3 | SRO | 66 | 56 | NEG | 25,9 | — | |
| 4 | MMB | 31 | 54 | NEG | 24,6 | — | |
| 5 | LCG | 63 | 96 | 3 colonias 6.ª semana | 14,5 | POS | Falta wild type 3 de rpoβ |
| 6 | MPP | 39 | 85 | 2 colonias 6.ª semana | NEG | — |
ADA: adenosin deaminasa; LP: líquido pleural; ML: medio de cultivo líquido automatizado para micobacterias (BacT/ALERT® MP, BioMérieux); MS: medios de cultivo sólidos para micobacterias (Coletsos, Middlebroock 7H11); NEG: negativo; PCR: detección de Mycobacterium tuberculosis complex mediante amplificación genómica (GeneXpert®, Hain Lifescience); POS: positivo.
El principal factor de controversia es la determinación del punto de corte que permita diferenciar TB de otros procesos, y varía ampliamente según los siguientes parámetros: 1) la prevalencia de la TB en el área geográfica estudiada; 2) la edad de los pacientes, ya que en pacientes mayores de 55 años el punto de corte bajaría a 26UI/l, mientras que en menores de 55 años se elevaría hasta 72UI/l3, y 3) el número de casos estudiados. Así, en un estudio sobre 2.413 casos de derrame pleural debidamente clasificados según etiología y con una media de edad de 65 años, el punto de corte medio se estableció en 28,26UI. Además, valores superiores a 100UI/l se relacionaron con procesos linfoproliferativos, carcinomas, derrames paramalignos y empiemas4. En 2015 la incidencia media de TB en Castilla y León fue de 9,93 casos por 100.000 habitantes siendo la incidencia media de TP de 0,77 casos por 100.000 habitantes5. La provincia de León y especialmente la comarca del Bierzo siguen siendo las zonas con mayor incidencia de TB de la comunidad. La selección de muestras de LP para detección de TB podría establecerse inicialmente mediante el uso del ADA, acompañado por otros marcadores, especialmente por el porcentaje de linfocitos y por otros parámetros bioquímicos. Para ello habría que empezar por determinar el punto de corte más oportuno en nuestra área de salud, estudiando un mayor número de muestras. En nuestro estudio, si hubiésemos utilizado 40UI/l como punto de corte habrían escapado 2 casos. Los líquidos pleurales suelen ser muestras paucibacilares, en las que una mayor sensibilidad elevaría el límite de detección microbiológico y molecular. Dado que en la mayoría de las muestras de LP estudiadas (74,5%) el valor de ADA ha sido inferior a 30UI/l, tan solo este dato ya nos permitiría seleccionar el 25,5% restante (con un ADA>30UI/l) para aplicar las técnicas microbiológicas y/o moleculares, consiguiendo una mayor rentabilidad diagnóstica y ahorro de costes. Partiendo de estos resultados preliminares y a falta de un estudio más exhaustivo, parece deducirse que el empleo de técnicas moleculares para la detección de MT en LP con valores de ADA inferiores a las 30UI/l no parece razonable en nuestro entorno.