Raltegravir (RAL) es el primer inhibidor de la integrasa disponible para el tratamiento de la infección por VIH-1. Este fármaco ha demostrado excelentes resultados en el control de la replicación viral en pacientes naïve y pretratados. Es categoríaC de la Food and Drug Administration de Estados Unidos en embarazo, debiendo usarse solo si el beneficio justifica el riesgo potencial1–3. A pesar de que la experiencia en el embarazo es limitada, reportes preliminares han mostrado un buen perfil farmacocinético y transferencia placentaria4,5.
El objetivo de la presente comunicación es describir nuestra experiencia con el uso de RAL en gestantes en diferentes escenarios clínicos. Desarrollamos un estudio descriptivo retrospectivo realizado en el Hospital General de Agudos Cosme Argerich (Ciudad Autónoma de Buenos Aires, Argentina), durante el período enero de 2009 a mayo de 2013. Las características y la metodología de trabajo de nuestro equipo han sido previamente descritas6.
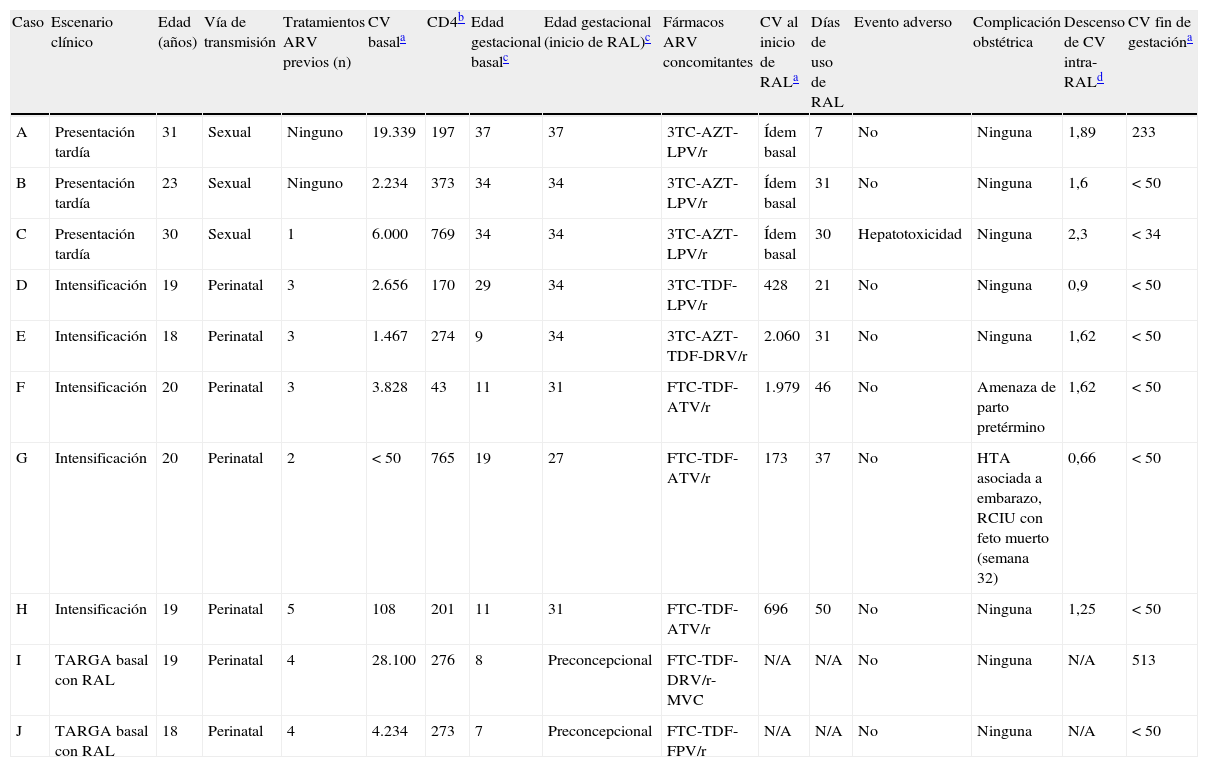
Durante el período estudiado se asistieron 179gestantes, indicándose RAL en 10 (5,5%). En los 10casos las pacientes fueron hispánicas, sin antecedente de tabaquismo, adicción intravenosa o coinfecciones relevantes. El RAL se indicó en los siguientes escenarios clínicos: 1)presentación tardía a la consulta (edad gestacional >33semanas): 3pacientes, incluyendo una seroconversión; 2)intensificación (agregado transitorio del fármaco) por insuficiente supresión viral en tercer trimestre: 5pacientes; 3)tratamiento antirretroviral de gran eficacia (TARGA basal) de VIH-1 previo al embarazo, donde el RAL forma parte estable del tratamiento seleccionado: 2pacientes. Los escenarios2 y 3 corresponden a gestantes adolescentes con VIH-1 adquirido por transmisión vertical; en las pacientes del escenario1 la infección fue por vía sexual (tabla 1).
Escenarios clínicos de uso de raltegravir en embarazadas VIH+. Características basales, evolución y respuesta virológica
| Caso | Escenario clínico | Edad (años) | Vía de transmisión | Tratamientos ARV previos (n) | CV basala | CD4b | Edad gestacional basalc | Edad gestacional (inicio de RAL)c | Fármacos ARV concomitantes | CV al inicio de RALa | Días de uso de RAL | Evento adverso | Complicación obstétrica | Descenso de CV intra-RALd | CV fin de gestacióna |
| A | Presentación tardía | 31 | Sexual | Ninguno | 19.339 | 197 | 37 | 37 | 3TC-AZT-LPV/r | Ídem basal | 7 | No | Ninguna | 1,89 | 233 |
| B | Presentación tardía | 23 | Sexual | Ninguno | 2.234 | 373 | 34 | 34 | 3TC-AZT-LPV/r | Ídem basal | 31 | No | Ninguna | 1,6 | < 50 |
| C | Presentación tardía | 30 | Sexual | 1 | 6.000 | 769 | 34 | 34 | 3TC-AZT-LPV/r | Ídem basal | 30 | Hepatotoxicidad | Ninguna | 2,3 | < 34 |
| D | Intensificación | 19 | Perinatal | 3 | 2.656 | 170 | 29 | 34 | 3TC-TDF-LPV/r | 428 | 21 | No | Ninguna | 0,9 | < 50 |
| E | Intensificación | 18 | Perinatal | 3 | 1.467 | 274 | 9 | 34 | 3TC-AZT-TDF-DRV/r | 2.060 | 31 | No | Ninguna | 1,62 | < 50 |
| F | Intensificación | 20 | Perinatal | 3 | 3.828 | 43 | 11 | 31 | FTC-TDF-ATV/r | 1.979 | 46 | No | Amenaza de parto pretérmino | 1,62 | < 50 |
| G | Intensificación | 20 | Perinatal | 2 | < 50 | 765 | 19 | 27 | FTC-TDF-ATV/r | 173 | 37 | No | HTA asociada a embarazo, RCIU con feto muerto (semana 32) | 0,66 | < 50 |
| H | Intensificación | 19 | Perinatal | 5 | 108 | 201 | 11 | 31 | FTC-TDF-ATV/r | 696 | 50 | No | Ninguna | 1,25 | < 50 |
| I | TARGA basal con RAL | 19 | Perinatal | 4 | 28.100 | 276 | 8 | Preconcepcional | FTC-TDF-DRV/r-MVC | N/A | N/A | No | Ninguna | N/A | 513 |
| J | TARGA basal con RAL | 18 | Perinatal | 4 | 4.234 | 273 | 7 | Preconcepcional | FTC-TDF-FPV/r | N/A | N/A | No | Ninguna | N/A | < 50 |
ARV: antirretrovirales; ATV/r: atazanavir/ritonavir; AZT: zidovudina; CD4: recuento de linfocitos T-CD4+ en sangre periférica; CV: carga viral plasmática; DRV/r: darunavir/ritonavir; FPV/r: fosamprenavir/ritonavir; FTC: emtricitabina; HTA: hipertensión arterial; LPV/r: lopinavir/ritonavir; MVC: maraviroc; N/A: no aplica; RAL: raltegravir; RCIU: retardo de crecimiento intrauterino; TARGA basal: tratamiento antirretroviral de gran eficacia; TDF: tenofovir; 3TC: lamivudina.
La mediana (rango) de edad fue 19años (18-31); número de gestaciones: 1 (1-5); carga viral basal: 2.445copias/ml (<50-28.100) y de recuento de linfocitosT CD4+: 273/μl (43-769). Cinco tenían antecedentes de eventos categoríaC de los CDC. En los escenarios de presentación tardía e intensificación la mediana de exposición a RAL fue 31días (7-46), con el fin de lograr la supresión viral en el momento del parto. Todas las pacientes del escenario de intensificación y TARGA basal presentaron antecedente de adherencia irregular a su tratamiento durante la gestación. La tolerancia digestiva al RAL fue óptima. Una paciente del grupo de presentación tardía presentó hepatotoxicidad moderada (con una dosificación de transaminasa glutámico-pirúvica de 123UI/l) sin expresión clínica, que se resolvió tras suspender el fármaco. En cuanto a la supresión viral, se logró en 8 de 10pacientes una carga viral <50/ml en fin de gestación. En el escenario de presentación tardía se observó un descenso de la carga viral superior a 1,5log10. En un caso se obtuvo un descenso de 1,89log10 con solo 7días de exposición a TARGA estándar+RAL. En cuanto al escenario de intensificación, el RAL fue adicionado al TARGA de base en tercer trimestre, lográndose la supresión viral (con descensos de carga viral plasmática >0,6 log10), lo cual también podría atribuirse a una mejor adherencia global de las gestantes al tratamiento, dado que se efectuaron intervenciones para mejorar la misma. En cuanto a las complicaciones obstétricas, una paciente presentó amenaza de parto pretérmino que se resolvió con uteroinhibición (en este contexto se intensifica con RAL [caso F]) y otra hipertensión arterial que llevó a retraso de crecimiento intrauterino y cuadro de feto muerto (caso G).
Dado que en la mayoría de los casos la carga viral de fin de gestación fue extraída el mismo día del parto (o muy cercano al mismo), los nacimientos fueron por cesárea programada excepto en un caso, que fue de urgencia. Todas las gestantes recibieron infusión de AZT intraparto. No hubo nacidos vivos pretérmino. La mediana (rango) de peso neonatal fue de 2.895g (2.200-3.450). Se realizó profilaxis posnatal en todos los casos: con AZT en 7 y con 3fármacos (AZT, 3TC y nevirapina) en 2. A la fecha, todos los recién nacidos presentan al menos 2determinaciones de PCR en ADN proviral obtenidas por encima de las 8semanas de vida ya sin profilaxis antirretroviral, presentando alguna de estas con más de 4meses de seguimiento.
El uso de RAL en gestantes se limita a «circunstancias especiales» en diferentes guías de tratamiento. Nuestra casuística permite identificar algunas de dichas circunstancias. Observamos, como otros autores, un rápido descenso de la carga viral con perfil de seguridad similar a reportes previos7–9. Presentamos lo que, a la fecha, es una de las mayores experiencias en el uso de RAL en embarazadas y la mayor casuística en uso de este fármaco en gestantes con infección perinatal, población de difícil manejo infectológico10. Si bien el carácter retrospectivo de nuestros datos puede limitar su extrapolación, el RAL ofrece un rol prometedor en estos escenarios clínicos complejos.
A la Unidad de Virología del Hospital Francisco J. Muñiz por el procesamiento de las cargas virales; al Dr. Rafael Giesolauro y al Departamento de Obstetricia del Hospital Cosme Argerich, Buenos Aires, Argentina