La povidona yodada y el peróxido de hidrógeno podrían ser eficaces contra el SARS-CoV-2.
MétodosEstudio observacional de seguimiento prospectivo (EPA-AS) en 88 pacientes (43±17 años, 55% varones) con SARS-CoV-2 en muestras nasofaríngeas (RT-PCR). Treinta y uno recibieron enjuagues/gargarismos con povidona yodada cada 8h 2 días consecutivos, 17 con la misma pauta de peróxido de hidrógeno y 40 controles sin enjuagues. Se repitió PCR a los 3, 11 y 17 días.
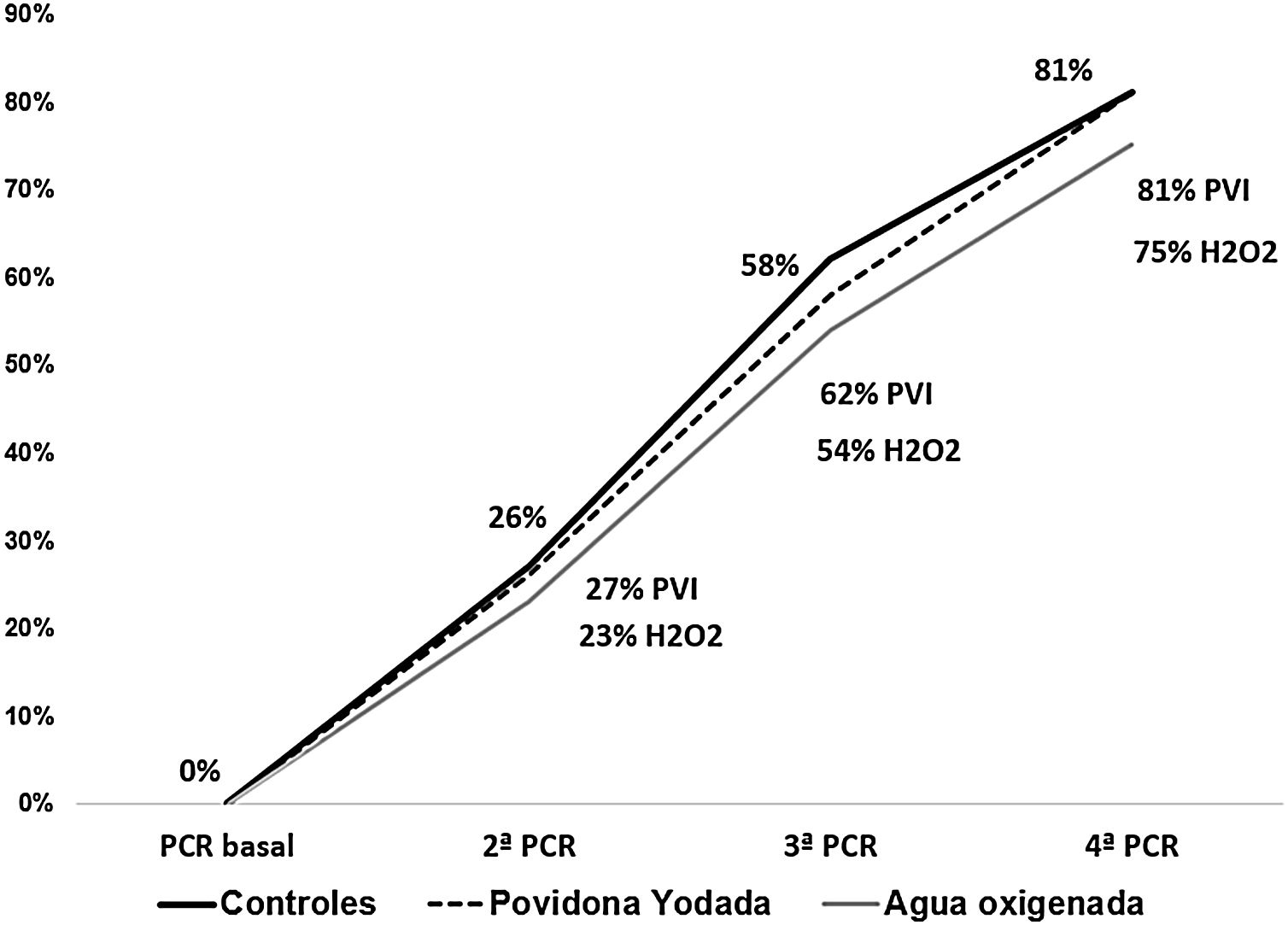
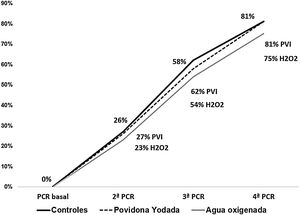
ResultadosTras la intervención no hubo diferencias en la carga viral: povidona yodada (4,3±2,7 copias/ml), peróxido de hidrógeno (4,6±2,9 copias/ml), controles (4,4±3,0 copias/ml). El porcentaje de pacientes con una 2.ª PCR negativa fue 27% povidona yodada, 23% peróxido de hidrógeno y 32% controles; en la 3.ª PCR 62%, 54% y 58% respectivamente y en la 4.ª PCR, 81%, 75% y 81%.
ConclusiónNuestros resultados no apoyan la utilidad de los enjuagues de estos 2 antisépticos en pacientes con COVID-19.
Povidone-iodine and hydrogen peroxide could be effective in against SARS-CoV-2.
MethodsA “non-interventional trial” in 88 patients (43±17 yrs, 55% men) with SARS-CoV-2 in nasopharyngeal swabs (RT-PCR). 31 received mouth rinses/gargling with povidone-iodine (every 8h, two consecutive days), 17 with mouth rinses/gargling of hydrogen peroxide, and 40 controls. PCR were repeated at 3, 11 and 17 days.
ResultsAfter intervention the viral load (Log10copies/ml) remained similar in povidone-iodine (4.3±2.7copies/ml), hydrogen peroxide (4.6±2.9copies/ml; p=0.40) and controls (4.4±3.0copies/ml). The percentage of patients with a negative result in the second PCR was 27% in povidone-iodine group, 23% in hydrogen peroxide and 32% in controls; in the third PCR, 62%, 54% and 58% respectively; and in the fourth PCR, 81%, 75% and 81%.
ConclusionOur results do not support the clinical usefulness of mouth rinses/gargling with povidone-iodine or hydrogen peroxide in patients with COVID-19.
La cavidad oral tiene un papel importante en la transmisión del SARS-CoV-21,2. Las células del epitelio de la mucosa oral expresan receptores ACE-2 y las glándulas salivares son reservorio del virus3. Por ello, diferentes sociedades científicas han propuesto el uso de soluciones orales antisépticas para reducir la transmisión4,5. La povidona yodada (PVI) ya demostró gran actividad antiviral in vitro frente a MERS y SARS-CoV6,7, y más recientemente frente a SARS-CoV-28. El peróxido de hidrógeno (H2O2) también es eficaz frente a SARS-CoV-2 en superficies inanimadas9 y en cultivos celulares10. Sin embargo, la eficacia in vivo, de ambos antisépticos orales no ha sido aclarada en esta pandemia11,12. Por ello, queremos determinar la utilidad de los enjuagues y gargarismos con PVI y H2O2 en la reducción de la carga viral orofaríngea de SARS-CoV-2 en pacientes con COVID-19.
Material y métodosEstudio observacional de seguimiento prospectivo (EPA-AS), clasificado por la Agencia Española del Medicamento y Productos Sanitarios, en 88 pacientes (ingresados o ambulatorios) con COVID-19 confirmado por RT-PCR en muestras nasofaríngeas (Ct<35 gen N o R; VIASURE SARS-CoV-2 Real Time PCR Detection Kit, Certest, Zaragoza, España). Los pacientes fueron diagnosticados en nuestro hospital entre mayo-noviembre del 2020. Se excluyeron menores de 18 años, pacientes con disminución del nivel de conciencia, presencia de aftas o heridas bucales, enfermedades del tiroides, hipersensibilidad a la PVI o al peróxido de hidrógeno, embarazo o lactancia y en tratamiento con litio. La inclusión en el estudio se produjo con menos de 24h tras la primera determinación de PCR positiva. De los 88 pacientes (media de edad 43±17 años, rango de 19-86 años, 55% varones), 31 realizaron enjuagues y gargarismos de PVI (1%) en solución oral cada 8h (100mg/ml; 30segundos) durante 2 días consecutivos; 17 recibieron enjuagues y gargarismos con H2O2 (1,5%) con la misma pauta y 40 fueron grupo control sin ningún enjuague. Tras la intervención se realizó PCR a los 3 (2-4), 11 (9-13) y 17 (14-19) días en todos los pacientes.
Se midió la carga viral de SARS-CoV-2 mediante PCR cuantitativa en todas las determinaciones (qRT-PCR; EDX SARS-CoV-2 Standard; Exact Diagnostics, Bio-Rad; genes E, N, ORF1a, RdRP y S). La carga viral se expresó como Log10 de la media de las cargas virales de ambos genes (N y R) y valores de Ct. El procesamiento de las muestras y la interpretación de resultados fue un estudio ciego. Se realizaron estudios serológicos (IgG) mediante inmunoanálisis de quimioluminiscencia (Virclia, Monotest, Vircell, S.L., Granada, España).
Se solicitó el consentimiento informado y el estudio fue aprobado por el Comité de Ética de la investigación con medicamentos de Cantabria.
Los resultados se expresaron con la media y desviación estándar (DE) para las variables cuantitativas y n (%) para las cualitativas. Se usó el test de Kolmogorov-Smirnov para determinar la distribución de la variable. Para la comparación de variables cuantitativas se utilizó «t» de Student o Mann-Whitney, y para las variables cualitativas Chi cuadrado o Fisher. Se empleó el programa estadístico SPSS 23.0 software (Chicago, IL, EE. UU.). Se consideró significación con una p<0,05.
ResultadosDos tercios de los pacientes fueron atendidos de forma ambulatoria (76%). Los 3 grupos partieron de la misma carga viral en la primera PCR positiva (6,4±2,0 copias/ml PVI, 7,5±2,1 copias/ml H2O2 y 6,8±2,2 copias/ml controles). No hubo diferencias en la carga viral tras los enjuagues en la 2.ª determinación (PVI 4,3±2,7 copias/ml, H2O2 4,6±2,9 copias/ml y 4,4±3,0 copias/ml controles). Tampoco en las sucesivas determinaciones 3.ª y 4.ª PCR (tabla 1). Los valores de Ct (gen N y R) fueron similares en los 3 grupos en todos los tiempos (tabla 1).
Carga viral en los 3 grupos
| Controles n=40 | PVI n=31 | H2O2 n=17 | |
|---|---|---|---|
| Log10 copias/ml | |||
| PCR basal | 6,8 (2,2) | 6,4 (2,0); p=0,38 | 7,5 (2,1); p*=0,24 |
| 2.ª PCR | 4,4 (3,0) | 4,3 (2,7); p=0,93 | 4,6 (2,9); p*=0,84 |
| 3.ª PCR | 2,4 (2,4) | 1,7 (1,8); p=0,40 | 2,1 (2,5); p*=0,16 |
| 4.ª PCR | 1,1 (1,6) | 1,0 (1,7); p=0,91 | 1,8 (2,5); p*=0,40 |
| Ct gen N | |||
| PCR basal | 26,8 (6,5) | 27,7 (6,3); p=0,62 | 26,4 (6,2); p*=0,72 |
| 2.ª PCR | 32,7 (7,4) | 32,7 (7,0); p=0,99 | 33,1 (7,0); p*=0,70 |
| 3.ª PCR | 37,6 (5,4) | 39,7 (3,7); p=0,27 | 39,5 (5,4); p*=0,10 |
| 4.ª PCR | 40,3 (3,4) | 40,3 (3,8); p=0,96 | 39,8 (5,6); p*=0,40 |
| Ct gen R | |||
| PCR basal | 26,3 (7,9) | 27,0 (7,8); p=0,68 | 24,9 (7,8); p*=0,53 |
| 2.ª PCR | 32,4 (8,4) | 32,2 (7,6); p=0,91 | 33,5 (8,6); p*=0,45 |
| 3.ª PCR | 38,0 (6,1) | 39,6 (3,8); p=0,88 | 40,4 (5,5); p*=0,06 |
| 4.ª PCR | 41,3 (2,9) | 40,5 (3,9); p=0,33 | 40,0 (5,8); p*=0,36 |
Media (DE) o n (%).
Ct: ciclo umbral (cycle threshold); RT-PCR: reacción en cadena de la polimerasa a tiempo real.
Mann–Whitney: p (PVI y controles); p* (H2O2 y controles).
El porcentaje de pacientes que negativizaron la PCR en la 2.ª determinación fue del 27% en PVI, 23% en H2O2 y 26% en controles. Estos porcentajes fueron similares en la 3.ª PCR (62%, 54% y 58%) y 4.ª PCR (81%, 75% y 81% respectivamente) (fig. 1).
No hubo diferencias en la respuesta inmune. El 87% de los pacientes con enjuagues de PVI desarrollaron inmunoglobulina G, frente al 82% en H2O2 y 95% en los controles (media de tiempo de 74±31, 78±33 y 81±48 días respectivamente).
DiscusiónLos enjuagues y gargarismos de PVI y H2O2 no modificaron la carga viral orofaríngea de los pacientes con COVID-19. Estos antisépticos orales no aceleraron la negativización de la PCR para SARS-CoV-2. La PVI es un yodóforo que debe su acción antiviral al iodo libre, alterando membranas celulares y la síntesis de proteínas13. Sin embargo, su reconocida actividad in vitro frente a SARS-CoV-28 no parece evidenciarse in vivo, aunque solo encontramos un ensayo clínico al respecto, realizado en 12 pacientes con COVID-19 que tras recibir enjuagues y gargarismos con PVI (1%) no modifican su carga viral orofaríngea de SARS-CoV-2 respecto al grupo no tratado11. Por otra parte, el H2O2 también ha demostrado eficacia in vitro inactivando SARS-CoV-2, aunque con menos eficacia que PVI10. Su poder antiviral parece deberse a la oxidación14. Hasta el momento el empleo de este antiséptico en pacientes COVID-19ha sido muy debatido15,16. Nuestro trabajo es el primer estudio observacional, con grupo control, que evalúa la utilidad de los enjuagues de H2O2 en pacientes COVID-19, y no vemos una clara reducción de la carga viral, ni a corto, ni a medio plazo.
Solo encontramos otro estudio, sin grupo control, en 12 pacientes hospitalizados con COVID-19 que recibieron enjuagues de H2O2 (1%) sin modificar su carga viral orofaríngea a los 30minutos13.
Nuestro estudio tiene limitaciones al no ser aleatorizado. Sin embargo, incluimos un amplio número de pacientes con un grupo control y evaluamos la utilidad de 2 antisépticos orales de uso común.
Concluimos que los enjuagues y gargarismos de PVI y H2O2 no parecen tener una clara utilidad en la reducción de la carga viral orofaríngea de SARS-CoV-2. Consideramos que la recomendación del uso de estos y otros antisépticos orales debe de basarse en la evidencia científica, por lo que son necesarios más estudios que valoren su eficacia en esta pandemia.
FinanciaciónEste trabajo ha sido financiado con una Beca de Investigación otorgada por el Consejo Superior de Investigaciones Científicas (CSIC. 202050E106). España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Consejo Superior de Investigaciones Científicas y a Javier Xercavins, del Ministerio de Ciencia e Innovación. A los profesores Jesús Agüero y J.A. Riancho (Universidad de Cantabria), España.