La neutropenia es un signo frecuente en los pacientes que van a ser sometidos a trasplante de progenitores hematopoyéticos (TPH). Una complicación importante es la infección favorecida por la inmunodepresión y el grado de neutropenia. El objetivo del estudio es evaluar la utilidad diagnóstica de la procalcitonina (PCT) y de la proteína C reactiva (PCR) en pacientes onco-hematológicos sometidos a quimioterapia y TPH para discriminar la etiología de la fiebre.
Pacientes y métodosSe midieron los valores de PCT y PCR en 30 episodios de neutropenia febril antes del inicio de la quimioterapia, el día de la neutropenia, el día del inicio de la fiebre y los días 1, 2, 3 y 6 postinicio de la fiebre y al fin del episodio. Los episodios fueron clasificados como 5 bacteriemias, 3 infecciones documentadas microbiológicamente, 10 infecciones clínicas y 12 fiebres de origen desconocido.
ResultadosLos valores medios de PCT más elevados correspondieron al grupo de pacientes con bacteriemia. Hubo diferencias estadísticamente significativas (p=0,04) el segundo día tras el inicio de la fiebre. El punto de corte de 0,5ng/ml mostró una sensibilidad del 66% y una especificidad del 75%. La PCR mostró diferencias estadísticamente significativas los días 1, 2 y 3 postinicio de la fiebre (p=0,01; p=0,003 y p=0,002). El punto de corte de 7,5mg/dl mostró una sensibilidad del 88% y una especificidad del 58%.
ConclusionesLa combinación de PCT y PCR es un método insuficiente para la detección de infección bacteriana y no puede sustituir el correcto diagnóstico clínico y microbiológico.
Neutropenia is a frequent sign in patients who are going to have a haematopoietic stem cell transplant (HSCT). Infection is an important complication in these patients, which is favoured by immunosuppression and the degree of neutropenia. This study aims to evaluate the diagnostic usefulness of procalcitonin (PCT) and C-reactive protein (CRP) in onco-haematological patients undergoing chemotherapy and HSCT to determine the origin of the fever.
Patients and methodsPCT and CRP values were measured in 30 episodes of febrile neutropenia: before starting chemotherapy, appearance of neutropenia, onset of fever, days 1, 2, 3 and 6 after the onset of fever, and when the febrile episode ended. The episodes were classified as 5 bacteraemia, 3 microbiologically documented infections, 10 clinical infections, and 12 fevers of unknown origin.
ResultsThe highest PCT mean values corresponded to the group of patients with bacteraemia. Statistically significant differences (P=.04) were found on the second day after the onset of fever. The cut-off point of 0.5ng/ml showed a sensitivity of 66% and a specificity of 75%. PCR results showed statistically significant differences on days 1, 2 and 3 after the onset of fever (P=.01, P=.003, and P=.002, respectively). The cut-off point of 7.5mg/L had a sensitivity of 88% and a specificity of 58%.
ConclusionsThe combination of PCT and CRP is an insufficient method to detect bacterial infections and may not replace the proper clinical and microbiological diagnosis.
La neutropenia es uno de los signos más comunes en los pacientes onco-hematológicos tras el tratamiento con quimioterapia. Además, el grado de la neutropenia, la duración de la misma y la rapidez en la disminución del número de leucocitos polimorfonucleares (PMN) también forman parte de los factores de riesgo más importantes en la incidencia de infecciones1,2.
Tienen especial mención los pacientes sometidos a trasplante de progenitores hematopoyéticos (TPH), que precisan tratamientos de acondicionamiento previos mediante agentes citotóxicos e inmunodepresores, que serán los responsables de la aparición de diferentes efectos adversos. Una de las complicaciones más destacables son las infecciones, favorecidas por la inmunodepresión, y la prolongada y profunda neutropenia. Se ha descrito que alrededor del 80% de los pacientes sometidos a algún tipo de TPH presentan al menos un episodio de neutropenia febril; de estos, entre el 30 y el 50% presentan fiebre de origen desconocido (FOD), del 25 al 50%, bacteriemia, y del 15 al 20%, infecciones bacterianas localizadas3. A pesar de que las infecciones presentan una elevada morbimortalidad, se sabe que la mortalidad es mayor en pacientes con neutropenia febril y bacteriemia que en los que no presentan bacteriemia4. En esta situación, en la mayoría de ocasiones el único signo clínico que hace sospechar la existencia de infección es la presencia de fiebre5–7. Por ello, en los últimos años se han realizado múltiples esfuerzos para encontrar marcadores de laboratorio que puedan ayudar a su diagnóstico, puesto que es esencial en este tipo de enfermos evitar las posibles complicaciones infecciosas comenzando una terapia antiinfecciosa rápida y eficaz.
Entre los marcadores de infección más utilizados destacan la proteína C reactiva (PCR) y la procalcitonina (PCT). La PCR es un reactante de fase aguda que se sintetiza en los hepatocitos en respuesta a procesos inflamatorios, infecciones, traumatismos, quemaduras, infartos tisulares y neoplasias8. La PCT deriva de la preprocalcitonina, que por acción de la prohormona convertasa se fragmenta dando lugar a la calcitonina. Fisiológicamente es sintetizada principalmente en las célulasC del tiroides y en el pulmón, de manera que en individuos sanos las concentraciones séricas de PCT suelen ser muy bajas9. La síntesis de PCT puede ser inducida por una gran variedad de estímulos, pero principalmente es inducida por las endotoxinas bacterianas, sobre todo los lipopolisacáridos de las bacterias gramnegativas10. La cinética de la PCT muestra una elevación muy rápida (2-3h tras el estímulo infeccioso), con un pico entre las 6-12h, y se mantiene hasta 24h, permaneciendo aumentada si no se resuelve el proceso infeccioso, o volviendo a la normalidad en caso de resolución11. A pesar de la existencia de ciertas controversias respecto a que los pacientes con neutropenia tienen concentraciones de PCT más bajas12, otros trabajos confirman el uso de la PCT como marcador de infección sistémica en pacientes neutropénicos13–16.
El objetivo del presente estudio es evaluar la utilidad diagnóstica de la PCT y de la PCR en pacientes onco-hematológicos sometidos a quimioterapia y TPH para discriminar la etiología de la fiebre.
Pacientes y métodosSe han recogido 34 episodios consecutivos de neutropenia tras quimioterapia agresiva por TPH. Las patologías que motivaron la realización de TPH fueron mieloma múltiple (10), linfoma no Hogdkin (8), linfoma de Hogdkin (6), neoplasia testicular (2), leucemia mieloide aguda (1) y otros (2), correspondientes a 29 pacientes pertenecientes a la Unidad de Hematología y Hemoterapia de un hospital monográfico oncológico. Todos los pacientes estudiados eran portadores de catéter venoso central de diferentes tipos: uno tipo Port-a-cath, 23 Hickman y 5 Arrow. Asimismo, todos los pacientes recibieron profilaxis antibacteriana con levofloxacino y sulfametoxazol/trimetroprima, profilaxis antifúngica con fluconazol y profilaxis antivírica con aciclovir.
De los iniciales 34 episodios, 30 de ellos presentaron fiebre (91%), es decir, fueron descritos como neutropenia febril.
Cada episodio fue monitorizado de forma previa al inicio del TPH (basal), el día que presentó la neutropenia, el día del inicio de la fiebre a cualquier hora del día, los días 1, 2, 3 y 6 posteriores al inicio de la fiebre, y el día que se dio por finalizado el episodio. Las tomas realizadas los días 1, 2, 3 y 6 se llevaron a cabo entre las 8 y las 9h de la mañana de los días siguientes al inicio de la fiebre, es decir, en los intervalos de 0 a 24h, de 24 a 48h y de 48 a 72h. En cada día de los mencionados se extrajeron por venopunción muestras de sangre total para determinar el número de leucocitos y de PMN, y muestras con gel separador que tras centrifugación se separó suero que se congeló a –20°C para la posterior determinación de PCT y PCR.
En el momento en el que se presentó la fiebre se realizó exploración física completa, se obtuvieron tomas para hemocultivos de vía central y periférica, urinocultivo, cultivo de muestras obtenidas de orofaringe y otros tipos de muestras procedentes del foco clínico sospechoso, además de todas aquellas pruebas que pudieran indicar la sospecha infecciosa.
Asimismo se inició tratamiento antibiótico empírico según esquema hospitalario de neutropenia febril.
La PCT se realizó en un Vidas® BRAHMS PCT, con un límite de detección analítico <0,05ng/ml. La PCR se realizó en un Cobas® c501 Roche, con un límite de detección analítico 0,1mg/dl. El recuento de leucocitos y PMN se realizó con un Cell-Dyn Sapphire® Abbott.
La neutropenia fue definida como la presencia de una cifra de PMN inferior a 0,5×109/l (neutropenia grave), inferior a 1,0×109/l (neutropenia moderada) e inferior a 1,5×109/l (neutropenia leve). La fiebre fue definida como la presencia de una temperatura corporal superior a 38,5°C en una sola ocasión o superior a 38°C al menos en 2 ocasiones durante 12h.
Los episodios se clasificaron en 2 grupos. El primero fue considerado grupo infeccioso, e incluía: bacteriemia, definida como la presencia de bacterias en sangre en uno o más hemocultivos, con excepción de los microorganismos considerados como contaminantes: estafilococos coagulasa negativa, estreptococos del grupo viridans, Propionibacterium acnes, Corynebacterium spp. y Bacillus spp., a excepción de si los aislamientos se encontraban en 2 hemocultivos separados en el tiempo obtenidos de punciones distintas de vena periférica o de vena periférica y catéter en un paciente con un cuadro clínico compatible17; infección documentada microbiológicamente (IDM), definida como infección por un microorganismo patógeno aislado en una muestra estéril a excepción de sangre, e infección documentada clínicamente (IDC), definida como episodio febril con foco clínico de infección y cultivos negativos. El segundo grupo, considerado no infeccioso, estaba formado por los episodios que presentaron FOD, definido como el episodio febril que no puede ser clasificado en ninguno de los grupos anteriores18.
El análisis estadístico de los datos fue realizado con el programa Med Calc® V12.3.0, expresando los resultados como media±desviación estándar y/o mediana y rango. Las variables fueron comparadas mediante el test de Kruskall-Wallis y la U de Mann Whitney. Se consideraron diferencias estadísticamente significativas cuando p<0,05. El valor diagnóstico de la PCT y de la PCR se expresó mediante la sensibilidad, la especificidad y el área bajo la curva característica operativa del receptor (COR). También se calculó la razón de probabilidad (RP) positiva y negativa, la probabilidad post-test y la odds-ratio diagnóstica (ORD) con objeto de evaluar la eficacia diagnóstica como marcadores de infección.
El protocolo del estudio ha sido revisado y aprobado por el comité ético del hospital, según los criterios de la Declaración de Helsinki de la asociación médica mundial (octubre 2008), y todos los pacientes firmaron el consentimiento informado para participar en el estudio.
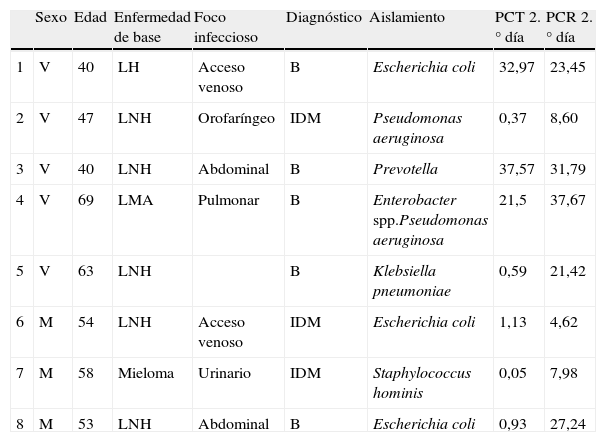
ResultadosLos datos demográficos y las características clínicas y microbiológicas de los pacientes fueron los siguientes: de los 29 pacientes estudiados, 17 fueron hombres y 12 mujeres, con una edad media de 48,47 (20-69) y de 43,27 (19-65) años, respectivamente. Se registraron 30 episodios de neutropenia febril, que fueron clasificados en el grupo infeccioso como: 5 bacteriemias; 3 IDM y 10 IDC. Y en el grupo no infeccioso, 12 episodios de FOD. Los aislamientos microbiológicos en la bacteriemia fueron Escherichia coli en 2 casos, Prevotella, Enterobacter spp, Pseudomonas aeruginosa y Klebsiella pneumoniae. Para la IDM los aislamientos mostraron Pseudomonas aeruginosa, Escherichia coli y Staphylococcus hominis. Las IDC procedían de 2 accesos venosos, 2 pulmonares, 3 orofaríngeas y 3 abdominales.
Todos los episodios de neutropenia febril recibieron tratamiento antibiótico. Once fueron tratados con piperacilina/tazobactam, seis con piperacilina/tazobactam más vancomicina y siete con piperacilina/tazobactam más otro antibiótico diferente. En 6 episodios se administraron esquemas distintos sin incluir piperacilina/tazobactam. De todos ellos, solo diez episodios recibieron una segunda pauta de tratamiento antibiótico modificada tras la no mejoría clínica o la obtención de los antibiogramas correspondientes. Tres de estos últimos fueron episodios con aislamientos microbiológicos, 2 bacteriemias y una IDC.
Respecto al recuento de leucocitos PMN, solo un episodio fue una neutropenia leve, 5 episodios fueron neutropenias moderadas y 24 episodios fueron neutropenias severas. Los valores de PMN para cada grupo el día de la neutropenia expresados como media y desviación típica fueron: bacteriemia 0,11±0,11; IDM 0,39±0,34; infección clínica 0,21±0,27, y FOD 0,52±0,32 (expresados ×109/l).
Al comparar los niveles de PCT entre el grupo no infeccioso y el grupo infeccioso, se obtuvieron diferencias estadísticamente significativas en los días 1, 2 y 3 postinicio de la fiebre, con valores de p iguales a 0,048, 0,043 y 0,029, respectivamente. Y en estos casos el rango promedio de la PCT del grupo infeccioso fue mayor que en el grupo no infeccioso.
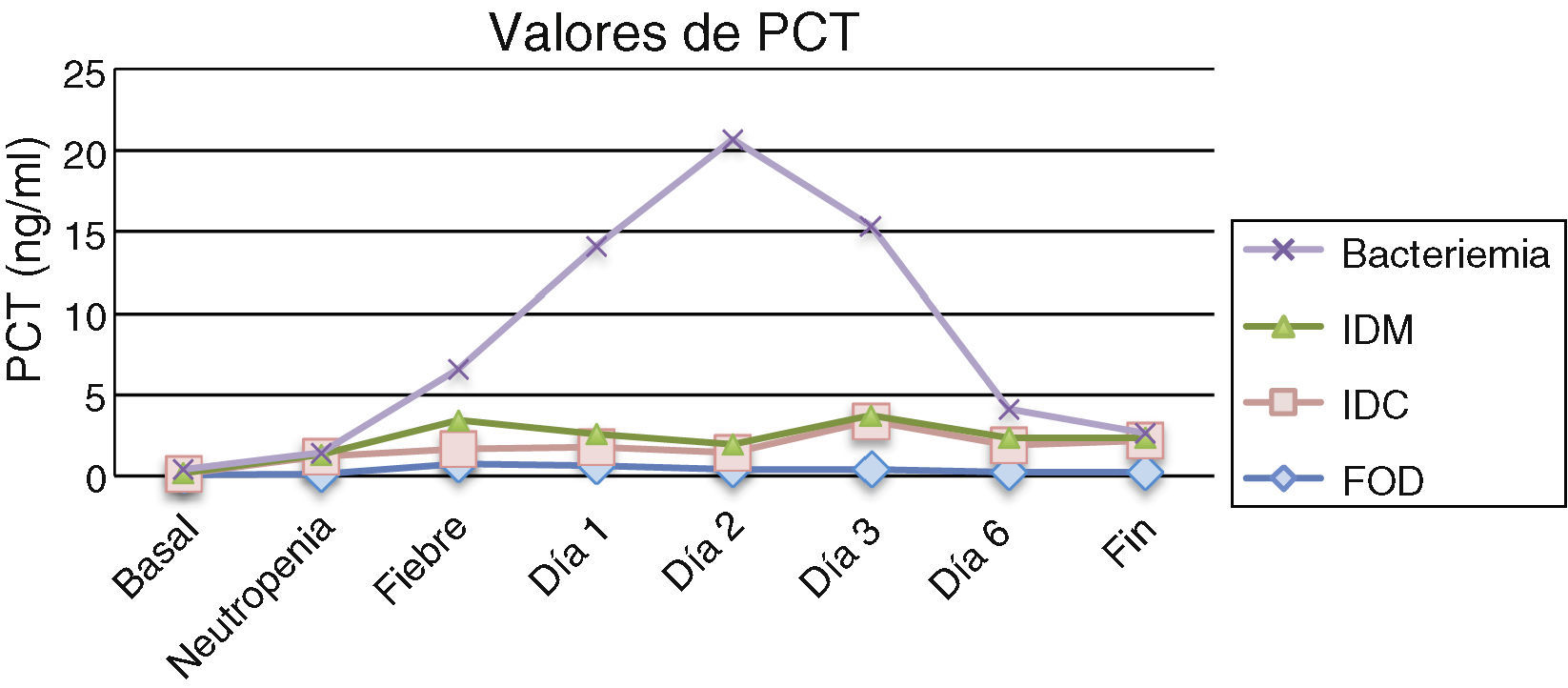
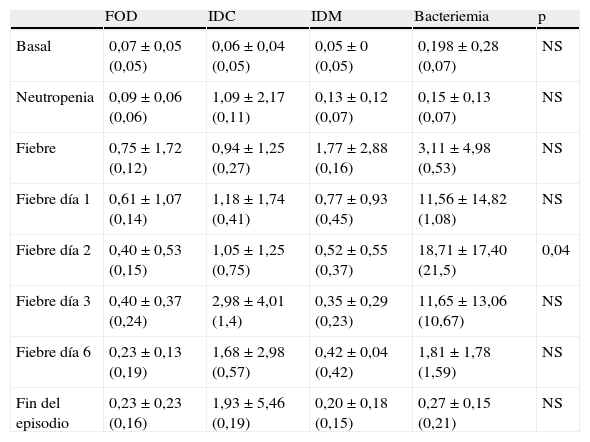
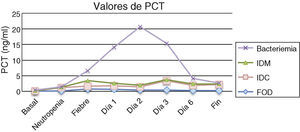
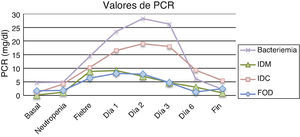
Los resultados obtenidos en los episodios de todos los subgrupos estudiados mostraron que los valores medios de PCT el día basal se encontraron por debajo de los valores de normalidad (<0,5ng/ml), ocurriendo prácticamente lo mismo el día de la neutropenia, excepto para el grupo de pacientes con infección clínica en el que 2 pacientes presentaron cifras por encima de 2ng/ml. No se encontraron diferencias estadísticamente significativas entre los subgrupos durante estos días. En cuanto al día del inicio de la fiebre y los días posteriores, los valores medios de PCT más elevados correspondieron al grupo de pacientes con bacteriemia, que además coincide con uno de los grupos con cifras de leucocitos más bajos (0,03×109/l). Al comparar los resultados de la PCT en estos 4 subgrupos se observaron diferencias estadísticamente significativas (p=0,04) el segundo día tras el inicio de la fiebre para los pacientes con bacteriemia, que mostraron una media de 18,71mg/dl, una mediana de 21,5 y un rango de 0,59 a 37,57. Por tanto, el pico de PCT fue observado el segundo día tras el inicio de la fiebre. La tabla 1 y la figura 1 muestran los resultados de los valores de PCT según sus diferentes clasificaciones y días. En la tabla 2 se muestran las características clínicas y los valores de PCT y PCR en los episodios en los que se obtuvieron aislamientos microbiológicos.
Valores de procalcitonina en ng/ml expresados como media±desviación estándar (mediana)
| FOD | IDC | IDM | Bacteriemia | p | |
| Basal | 0,07±0,05 (0,05) | 0,06±0,04 (0,05) | 0,05±0 (0,05) | 0,198±0,28 (0,07) | NS |
| Neutropenia | 0,09±0,06 (0,06) | 1,09±2,17 (0,11) | 0,13±0,12 (0,07) | 0,15±0,13 (0,07) | NS |
| Fiebre | 0,75±1,72 (0,12) | 0,94±1,25 (0,27) | 1,77±2,88 (0,16) | 3,11±4,98 (0,53) | NS |
| Fiebre día 1 | 0,61±1,07 (0,14) | 1,18±1,74 (0,41) | 0,77±0,93 (0,45) | 11,56±14,82 (1,08) | NS |
| Fiebre día 2 | 0,40±0,53 (0,15) | 1,05±1,25 (0,75) | 0,52±0,55 (0,37) | 18,71±17,40 (21,5) | 0,04 |
| Fiebre día 3 | 0,40±0,37 (0,24) | 2,98±4,01 (1,4) | 0,35±0,29 (0,23) | 11,65±13,06 (10,67) | NS |
| Fiebre día 6 | 0,23±0,13 (0,19) | 1,68±2,98 (0,57) | 0,42±0,04 (0,42) | 1,81±1,78 (1,59) | NS |
| Fin del episodio | 0,23±0,23 (0,16) | 1,93±5,46 (0,19) | 0,20±0,18 (0,15) | 0,27±0,15 (0,21) | NS |
FOD: fiebre de origen desconocido; IDC: infección documentada clínicamente; IDM: infección documentada microbiológicamente; NS: no significativo.
Episodios de neutropenia febril con aislamientos microbiológicos
| Sexo | Edad | Enfermedad de base | Foco infeccioso | Diagnóstico | Aislamiento | PCT 2.° día | PCR 2.° día | |
| 1 | V | 40 | LH | Acceso venoso | B | Escherichia coli | 32,97 | 23,45 |
| 2 | V | 47 | LNH | Orofaríngeo | IDM | Pseudomonas aeruginosa | 0,37 | 8,60 |
| 3 | V | 40 | LNH | Abdominal | B | Prevotella | 37,57 | 31,79 |
| 4 | V | 69 | LMA | Pulmonar | B | Enterobacter spp.Pseudomonas aeruginosa | 21,5 | 37,67 |
| 5 | V | 63 | LNH | B | Klebsiella pneumoniae | 0,59 | 21,42 | |
| 6 | M | 54 | LNH | Acceso venoso | IDM | Escherichia coli | 1,13 | 4,62 |
| 7 | M | 58 | Mieloma | Urinario | IDM | Staphylococcus hominis | 0,05 | 7,98 |
| 8 | M | 53 | LNH | Abdominal | B | Escherichia coli | 0,93 | 27,24 |
B: bacteriemia; IDM: infección documentada microbiológicamente; LH: linfoma de Hodgkin; LMA: leucemia mieloide aguda; LNH: linfoma no Hodgkin; M: mujer; PCR: proteína C reactiva; PCT: procalcitonina; V: varón.
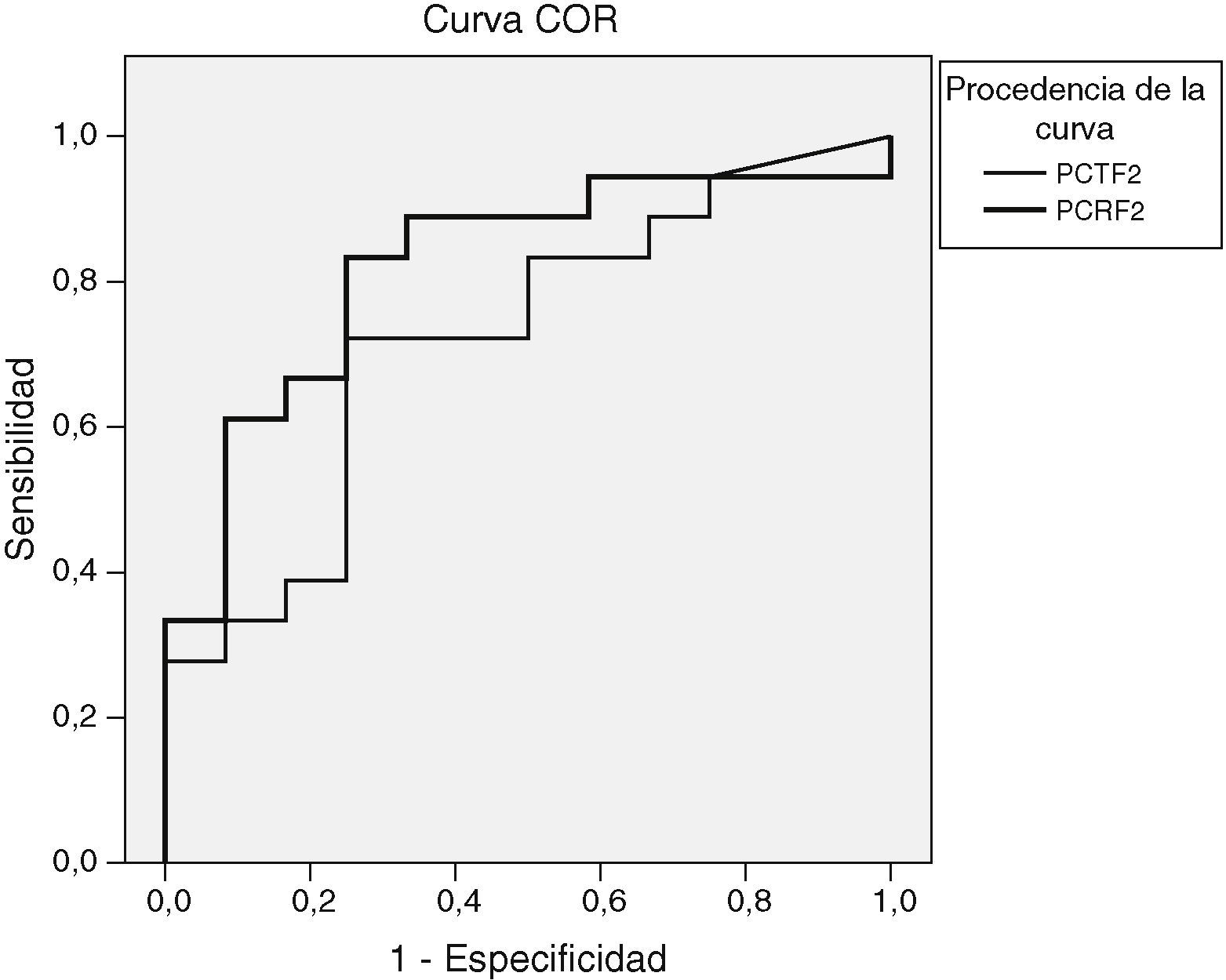
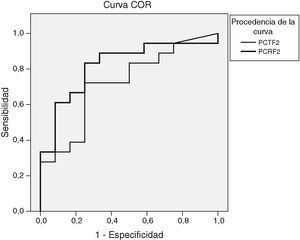
Al determinar el área bajo la curva COR en los resultados del segundo día postinicio de la fiebre entre el grupo no infeccioso y el infeccioso, el área bajo la curva fue de 0,72 (fig. 3). En ese día el punto de corte óptimo con el que encontramos mejor sensibilidad y especificidad fue 0,5ng/ml, con el que se obtiene una sensibilidad del 66% y una especificidad del 75%, un valor predictivo positivo (VPP) de 80% y un valor predictivo negativo (VPN) de 60%.
Al calcular la RP para la determinación de PCT el segundo día de la fiebre se obtuvo una RP positiva de 2,64 y una RP negativa de 0,45. La ORD fue de 5,86, y la probabilidad postest para un resultado positivo fue del 80%, y para un resultado negativo fue del 40%.
Los resultados de la PCR, cuando se compara el grupo no infeccioso frente al grupo infeccioso, mostraron diferencias estadísticamente significativas para el día de inicio de la fiebre, y los días 1, 2, 3 y 6 postinicio de la fiebre, con valores de p iguales a 0,028, 0,004, 0,003, 0,001 y 0,014, respectivamente. En estos casos el rango promedio de la PCR del grupo infeccioso fue mayor que para el grupo no infeccioso.
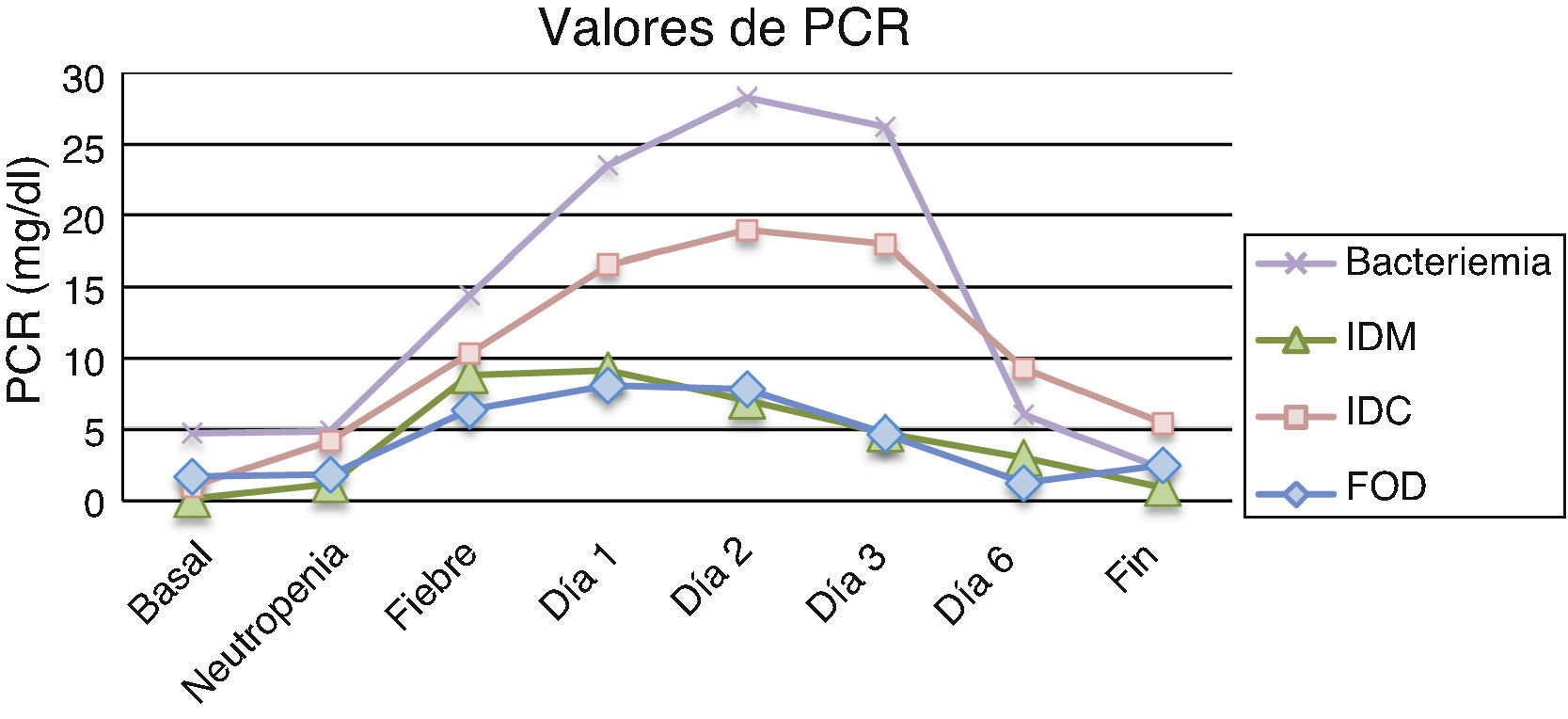
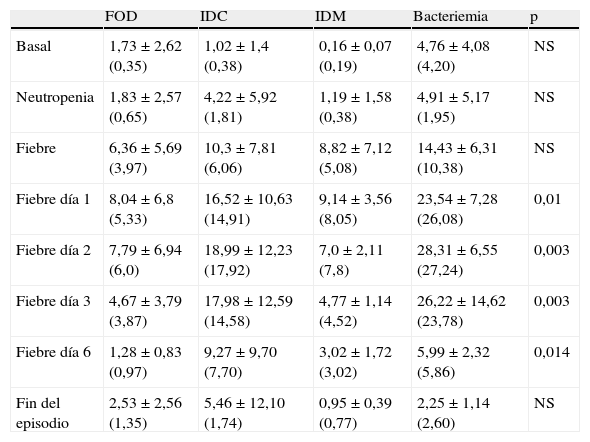
Los resultados de la PCR basal, neutropenia e inicio de la fiebre mostraron que las medias de todos los subgrupos se encontraban por encima de los valores de normalidad (0,5mg/dl), excepto en la PCR basal de IDM, aunque sin presentar diferencias estadísticamente significativas. Por el contrario, los resultados de la PCR en los días 1, 2 y 3 postinicio de la fiebre sí obtuvieron diferencias estadísticamente significativas entre los diferentes subgrupos, con valores de p iguales a 0,01, 0,003 y 0,002, respectivamente. La tabla 3 y la figura 2 muestran los resultados de los valores de PCR según sus diferentes clasificaciones y días.
Valores de proteína C reactiva en mg/dl expresados como media±desviación estándar (mediana)
| FOD | IDC | IDM | Bacteriemia | p | |
| Basal | 1,73±2,62 (0,35) | 1,02±1,4 (0,38) | 0,16±0,07 (0,19) | 4,76±4,08 (4,20) | NS |
| Neutropenia | 1,83±2,57 (0,65) | 4,22±5,92 (1,81) | 1,19±1,58 (0,38) | 4,91±5,17 (1,95) | NS |
| Fiebre | 6,36±5,69 (3,97) | 10,3±7,81 (6,06) | 8,82±7,12 (5,08) | 14,43±6,31 (10,38) | NS |
| Fiebre día 1 | 8,04±6,8 (5,33) | 16,52±10,63 (14,91) | 9,14±3,56 (8,05) | 23,54±7,28 (26,08) | 0,01 |
| Fiebre día 2 | 7,79±6,94 (6,0) | 18,99±12,23 (17,92) | 7,0±2,11 (7,8) | 28,31±6,55 (27,24) | 0,003 |
| Fiebre día 3 | 4,67±3,79 (3,87) | 17,98±12,59 (14,58) | 4,77±1,14 (4,52) | 26,22±14,62 (23,78) | 0,003 |
| Fiebre día 6 | 1,28±0,83 (0,97) | 9,27±9,70 (7,70) | 3,02±1,72 (3,02) | 5,99±2,32 (5,86) | 0,014 |
| Fin del episodio | 2,53±2,56 (1,35) | 5,46±12,10 (1,74) | 0,95±0,39 (0,77) | 2,25±1,14 (2,60) | NS |
FOD: fiebre de origen desconocido; IDC: infección documentada clínicamente; IDM: infección documentada microbiológicamente; NS: no significativo.
El área bajo la curva COR para la PCR en el segundo día postinicio de la fiebre entre el grupo no infeccioso y el infeccioso fue de 0,82 (fig. 3). En ese día, con un punto de corte de 7,5mg/dl se obtuvo la mejor sensibilidad (88%) y la mejor especificidad (58%), un VPP del 76% y un VPN del 77%.
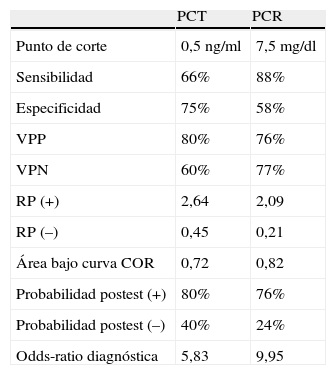
Al calcular la RP para la determinación de PCR el segundo día de la fiebre se obtuvo una RP positiva de 2,09 y una RP negativa de 0,21, y la ORD fue de 9,95. La probabilidad post-test el mismo día para un resultado positivo fue del 76% y para un resultado negativo del 24%. La tabla 4 muestra los resultados obtenidos al estudiar la eficacia del uso de estos marcadores.
Resultados del estudio de eficacia
| PCT | PCR | |
| Punto de corte | 0,5ng/ml | 7,5mg/dl |
| Sensibilidad | 66% | 88% |
| Especificidad | 75% | 58% |
| VPP | 80% | 76% |
| VPN | 60% | 77% |
| RP (+) | 2,64 | 2,09 |
| RP (–) | 0,45 | 0,21 |
| Área bajo curva COR | 0,72 | 0,82 |
| Probabilidad postest (+) | 80% | 76% |
| Probabilidad postest (–) | 40% | 24% |
| Odds-ratio diagnóstica | 5,83 | 9,95 |
PCR: proteína C reactiva; PCT: procalcitonina; RP: razón de probabilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La PCT está considerada un marcador precoz de infección en diferentes tipos de cuadros clínicos, a pesar de la existencia de muchas controversias. En el estudio se describe la concentración de PCT y PCR previa a la neutropenia, durante la fiebre y en los días posteriores a su inicio, en un intento de diferenciar la presencia de una infección de otro tipo de patologías que también provoquen, como único signo clínico de alarma, la presencia de fiebre. Es decir, que se etiquete como FOD a pacientes sin infección y que el origen pueda ser una quimioterapia agresiva por un TPH u otra causa no infecciosa.
Ya es conocido que la PCT aumenta rápidamente en las infecciones bacterianas y desciende al rango normal más rápidamente que la PCR19. En el estudio, el 91% de los episodios desarrollaron fiebre durante el periodo de neutropenia. La mayoría de los pacientes presentaron valores de PCT por encima del rango de normalidad tanto el día del inicio de la fiebre como el día 1 postinicio de la fiebre. Es de destacar que en el grupo de bacteriemia se presentaron los niveles más elevados de PCT, con un pico en el segundo día. Estos resultados coinciden con los obtenidos por otros autores, como Von Lilienfeld-Toal et al.20 y Robinson et al.21, en los que los valores de PCT son significativamente mayores para los pacientes con bacteriemia frente a los de FOD con un pico el segundo día de la fiebre. Por otro lado, otros autores encuentran que la elevación de la PCT presenta el pico un día diferente, como Sandri et al.22, donde los niveles más elevados se encuentran en el día 1 para la bacteriemia y en el día 3 para las infecciones clínicas y las IDM. Así, con el mismo punto de corte obtiene una sensibilidad del 62,3% y una especificidad del 80,7% en la diferenciación de pacientes con infección frente a las de FOD, valores similares a los encontrados en nuestro estudio. También para Hambach et al.23 y Bernard et al.15 los niveles de PCT aumentan con una media de 1 día tras el inicio de la fiebre. O como para Engel et al.14, que encuentran diferencias entre infección documentada y FOD a las 32h del inicio de la fiebre.
Todos estos resultados muestran una elevación de la PCT ante la presencia de infección, lo que consideramos importante para el diagnóstico etiológico, independientemente del día en que se presente el pico de máxima elevación de la PCT. Además, los valores de PCT en pacientes neutropénicos con bacteriemia son mayores si se comparan con los pacientes que padecen infecciones clínicas o FOD. De esta manera, el rendimiento diagnóstico de la PCT en nuestro estudio es semejante al observado por Aznar-Oroval et al.24 para la bacteriemia al inicio de la fiebre y con Robinson et al.21 en el segundo día de la fiebre, encontrando también la mejor eficacia diagnóstica con un punto de corte de 0,5ng/ml. Y lo mismo ocurre con los resultados obtenidos por Reitman et al.25 en pacientes oncológicos pediátricos con neutropenia febril en la predicción de bacteriemia, donde en la determinación seriada de PCT obtiene una sensibilidad del 78% y una especificidad del 76%.
En nuestra serie no podemos establecer diferencias entre los microorganismos aislados, ya que todos excepto un paciente tuvieron aislamientos por microorganismos gramnegativos. Y aunque existen estudios que ponen de manifiesto valores de PCT más elevados en infecciones por bacilos gramnegativos12,13,26, también existen otros en los que los resultados de la PCT son similares para infecciones por gramnegativos y grampositivos14,20; de la misma manera que otros estudios ponen de manifiesto que los niveles normales o bajos de PCT no excluyen bacteriemia por estafilococos coagulasa negativos clínicamente significativos27.
Se ha propuesto el VPN de la PCT con un punto de corte de 0,4ng/ml como marcador para la exclusión de bacteriemia28. Sin embargo, el VPN que obtenemos en nuestro estudio con el punto de corte de 0,5ng/ml no ayuda a excluir la presencia de infección en nuestros pacientes, al igual que si hacemos el mismo cálculo con un punto de corte de 0,4ng/ml, e incluso si se disminuye más el punto de corte29.
La PCR parece no tener tanta repercusión clínica respecto a la sospecha de infección, puesto que este marcador a menudo se encuentra elevado en pacientes con cáncer22. En el estudio los resultados de la PCR se encuentran ya aumentados de forma basal, incluso de forma previa al inicio de la quimioterapia antes de realizar el TPH, hecho ya publicado por otros autores, como von Lilienfeld-Toal et al.20, Hambach et al.23 y Sandri et al.22. Después de la neutropenia el valor de la PCR aumenta en todos los grupos, aunque en nuestro estudio los resultados más elevados se observan en el grupo de la bacteriemia el segundo día de la fiebre. Estos datos coinciden con otros grupos, aunque el día de máximo valor para los que presentan bacteriemia es el primer día22. En otros casos el pico máximo de la PCR también coincide con el segundo día, como es el caso de Vänskä et al.30, en el que utilizan la PCR junto con otros marcadores para la predicción de complicaciones infecciosas en pacientes con patologías hematológicas y que presenten neutropenia febril. En nuestro grupo de estudio sí existen diferencias significativas entre los grupos infeccioso y no infeccioso, al igual que encuentran diferencias otros autores, como Hambach et al.23 y Sauer et al.31. Estos resultados sugieren que la PCR es un marcador temprano de la presencia de un proceso inflamatorio. Hay que tener en cuenta que la presencia de resultados de la PCR aumentados de forma basal no ayuda a establecer una etiología infecciosa al inicio de la fiebre. Sin embargo, es posible que el aumento de los valores de PCR por encima del punto de corte establecido para la mejor sensibilidad, especificidad y área bajo la curva COR, durante los días posteriores al inicio de la fiebre, sugieran la sospecha de complicaciones infecciosas, y que la determinación de PCT confirme el diagnóstico de las mismas.
Nuestro estudio no está exento de limitaciones. Una de ellas sería el pequeño número de episodios de neutropenia febril estudiados, y la otra, la baja frecuencia de bacteriemia observada.
La PCR muestra una gran utilidad como marcador de inflamación sistémica, pero no discrimina la existencia de infección respecto a otros procesos, ni tampoco diferencia entre infección vírica o bacteriana. En el momento del diagnóstico su cinética más lenta hace que el aumento de sus valores sea más tardío respecto al proceso infeccioso, tal como indican Tudela et al.28, pero puede apoyar el diagnóstico infeccioso ya establecido con la PCT.
La sensibilidad de la PCT en cuanto a detección de infección fue inferior a la de la PCR, pero con mejor especificidad. Teniendo en cuenta los resultados de la RP de la PCT, la eficacia diagnóstica de la misma es moderada. En esta situación la obtención de un test positivo apoyaría la sospecha infecciosa, pero la presencia de un test negativo deja un margen de probabilidad postest de presentar una infección considerable. La eficacia diagnóstica de la PCR muestra resultados semejantes, aunque la probabilidad postest de padecer la enfermedad ante un resultado negativo es mejor. De esta manera la PCT muestra mejor capacidad para diagnosticar la presencia de infección y la PCR mejor capacidad para diagnosticar la ausencia de infección. Es por ello que la combinación de ambos marcadores puede ayudar al diagnóstico de infección ante la presencia de una neutropenia febril.
Creemos, al igual que Lacoma et al.32, que el uso de marcadores de inflamación puede aportar una adecuada información diagnóstica pero no puede sustituir el correcto diagnóstico clínico y microbiológico
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.