Las infecciones neumocócicas son una importante causa de morbimortalidad y constituyen una de las 10 principales causas de muerte en el mundo. Los niños menores de 2 años son los que tienen una tasa de incidencia más elevada, seguidos de los adultos mayores de 64 años. El principal grupo de riesgo son los individuos con inmunodeficiencias de cualquier tipo y aquellos con asplenia anatómica o funcional, aunque también afecta a personas inmunocompetentes con ciertas enfermedades crónicas. En la última década se ha realizado un importante progreso en la prevención de estas infecciones. Hasta hace pocos años solo se disponía de la vacuna antineumocócica no conjugada 23-valente, con resultados controvertidos en cuanto a su eficacia y efectividad, y con limitaciones importantes por el tipo de respuesta inmune inducida. La posibilidad actual de utilizar la vacuna conjugada 13-valente en el adulto abre expectativas importantes en la mejora de la prevención de la enfermedad neumocócica en estos grupos de edad.
Pneumococcal infections are a significant cause of morbidity and mortality, and are one of the 10 leading causes of death worldwide. Children under 2 years have a higher incidence rate, followed by adults over 64 years. The main risk group are individuals with immunodeficiency, and those with anatomical or functional asplenia, but can also affect immunocompetent persons with certain chronic diseases. Significant progress has been made in the last 10 years in the prevention of these infections. Until a few years ago, only the 23-valent non-conjugate pneumococcal vaccine was available. Its results were controversial in terms of efficacy and effectiveness, and with serious limitations on the type of immune response induced. The current possibility of using the 13-valent conjugate vaccine in adults has led to greater expectations in improving the prevention of pneumococcal disease in these age groups.
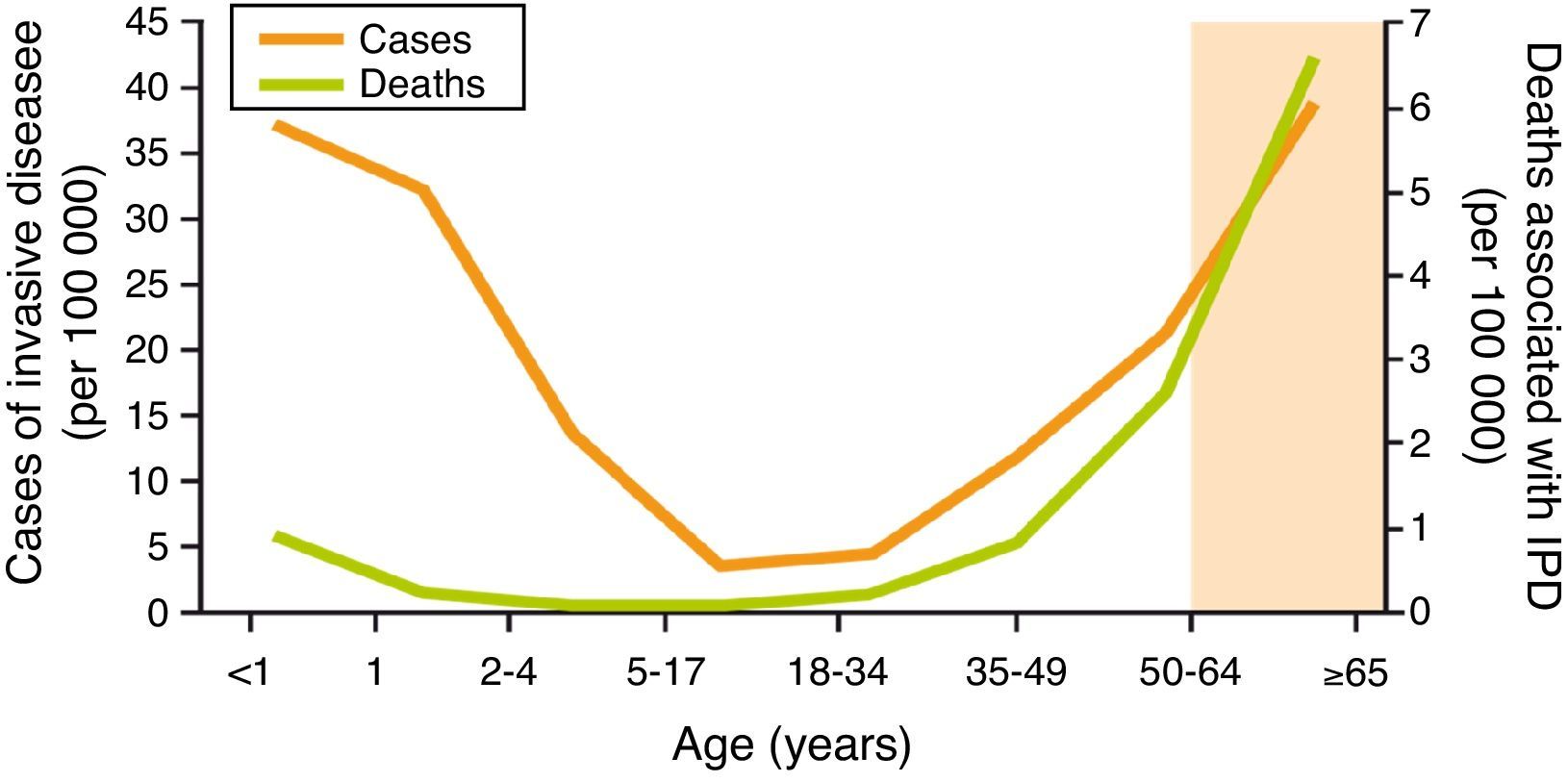
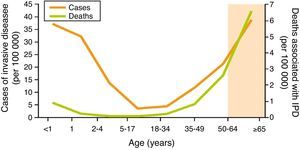
Las infecciones neumocócicas son una importante causa de morbimortalidad en el mundo. Según la Organización Mundial de la Salud, la enfermedad neumocócica constituye una de las 10 principales causas de muerte y representa, particularmente en los países de baja renta, el 40% de los 2,6 millones de muertes anuales por infección respiratoria aguda en niños menores de 5 años, con una cifra de más de un millón de fallecimientos1. Los niños menores de 2 años son los que tienen una tasa de incidencia más elevada de enfermedad neumocócica invasiva (ENI), seguidos de los adultos mayores de 64 años. Aunque la enfermedad neumocócica es más frecuente en niños, su letalidad en ancianos es superior, entre el 20-40%, a pesar del tratamiento antibiótico adecuado2,3 (fig. 1).
Incidencia y letalidad de la enfermedad neumocócica invasiva en Estados Unidos (ABC, 2009).
Fuente: CDC, 2010. Active Bacterial Core Surveillance Report, Emerging Infections Program Network, Streptococcus pneumoniae, 200960.
La infección neumocócica continúa siendo la primera causa de neumonía comunitaria que requiere hospitalización. Se considera, además, que una buena proporción de las neumonías comunitarias de causa desconocida se deben a Streptococcus pneumoniae (S. pneumoniae)4. Entre el 70-90% de los casos de bacteriemia neumocócica se asocian a neumonía, y un 5 a 10% a meningitis5; con menos frecuencia se asocian a sinusitis, artritis, peritonitis o endocarditis6.
Las personas con ciertas enfermedades de base tienen un mayor riesgo de desarrollar infecciones neumocócicas, padecer formas más graves o complicaciones. El principal grupo de riesgo son los individuos con inmunodeficiencias de cualquier tipo y aquellos con asplenia anatómica o funcional, aunque también afecta a personas inmunocompetentes con ciertas enfermedades que requieren cuidados médicos continuados7. En este último grupo se incluyen los sujetos con afecciones crónicas cardiovasculares, respiratorias, hepáticas, renales y metabólicas.
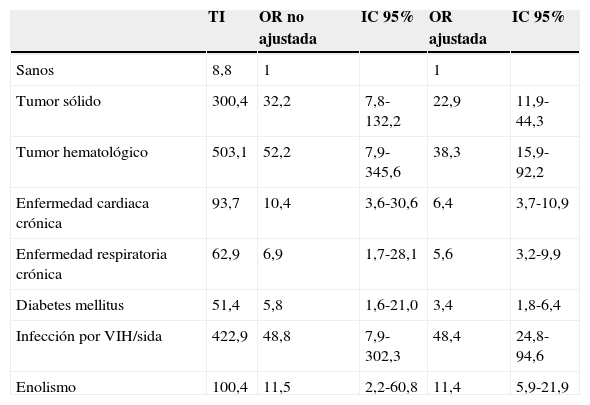
La incidencia de ENI en adultos sanos es de 8,8 casos por 100.000 personas-año8. Esta cifra aumenta hasta tasas de 51 por 100.000 en adultos con diabetes, 63 por 100.000 en pacientes con enfermedad pulmonar crónica, 94 por 100.000 en los afectos de enfermedad cardiaca crónica y 100 por 100.000 en pacientes con enolismo (tabla 1). Los pacientes inmunodeprimidos son los de mayor riesgo, con tasas de 300 casos por 100.000 en los afectos de tumores sólidos, 423 por 100.000 en los infectados por el VIH y 503 por 100.000 en los que padecen neoplasias hematológicas8.
Incidencia y riesgo de enfermedad neumocócica invasiva en adultos con enfermedad de base en Estados Unidos
| TI | OR no ajustada | IC 95% | OR ajustada | IC 95% | |
|---|---|---|---|---|---|
| Sanos | 8,8 | 1 | 1 | ||
| Tumor sólido | 300,4 | 32,2 | 7,8-132,2 | 22,9 | 11,9-44,3 |
| Tumor hematológico | 503,1 | 52,2 | 7,9-345,6 | 38,3 | 15,9-92,2 |
| Enfermedad cardiaca crónica | 93,7 | 10,4 | 3,6-30,6 | 6,4 | 3,7-10,9 |
| Enfermedad respiratoria crónica | 62,9 | 6,9 | 1,7-28,1 | 5,6 | 3,2-9,9 |
| Diabetes mellitus | 51,4 | 5,8 | 1,6-21,0 | 3,4 | 1,8-6,4 |
| Infección por VIH/sida | 422,9 | 48,8 | 7,9-302,3 | 48,4 | 24,8-94,6 |
| Enolismo | 100,4 | 11,5 | 2,2-60,8 | 11,4 | 5,9-21,9 |
IC: intervalo de confianza; OR: odds ratio; TI: tasa de incidencia (por 100.000 habitantes); VIH: virus de la inmunodeficiencia humana.
Adaptada de Kyaw et al.8.
El tabaquismo es también un factor de riesgo importante de ENI. Según un estudio realizado por Nuorti et al., la ENI se asoció de forma significativa con el consumo de tabaco, con una OR de 4,1 (IC 95% 2,4-7,3) y un riesgo atribuible del 51%9. En un estudio realizado en nuestro país por Almirall et al.10, el tabaquismo como factor de riesgo de neumonía adquirida en la comunidad mostró una OR de 1,48 (IC 95% 1,14-1,86) en fumadores de más de 180 paquetes/año.
En la última década se ha realizado un importante progreso en la prevención de estas infecciones. Hasta hace pocos años solo se disponía de una vacuna antineumocócica no conjugada 23-valente (VPNC23), eficaz únicamente a partir de los 2 años de edad y sin capacidad de inducir memoria inmunitaria. Desde el año 2000 se dispone además de vacunas conjugadas, que pueden administrarse desde los 2 meses de edad, con un excelente perfil de eficacia y seguridad.
El impacto de la vacuna conjugada en EE. UU., donde se incluyó en el calendario vacunal en enero de 2001, ha sido muy importante, con una marcada disminución de la incidencia de la ENI en los niños menores de 2 años, pero también en los mayores de esa edad y en los adultos, a consecuencia de la inmunidad de grupo que induce y por la reducción del número de portadores nasofaríngeos de los serotipos vacunales11–13.
En este artículo se revisan las características de ambas vacunas, sus indicaciones y la evidencia científica disponible sobre su eficacia, efectividad y seguridad.
Vacunas antineumocócicasLa primera vacuna neumocócica de células enteras fue elaborada en 1911 por Wright et al.14 para la inmunización de los trabajadores de las minas de oro de Sudáfrica, un colectivo con una elevada incidencia de ENI y neumonía neumocócica. Posteriormente, otros investigadores llevaron a cabo ensayos clínicos para evaluar la eficacia y seguridad de vacunas basadas en polisacáridos capsulares de diferente número de serotipos (6, 14 y 23 serotipos)15.
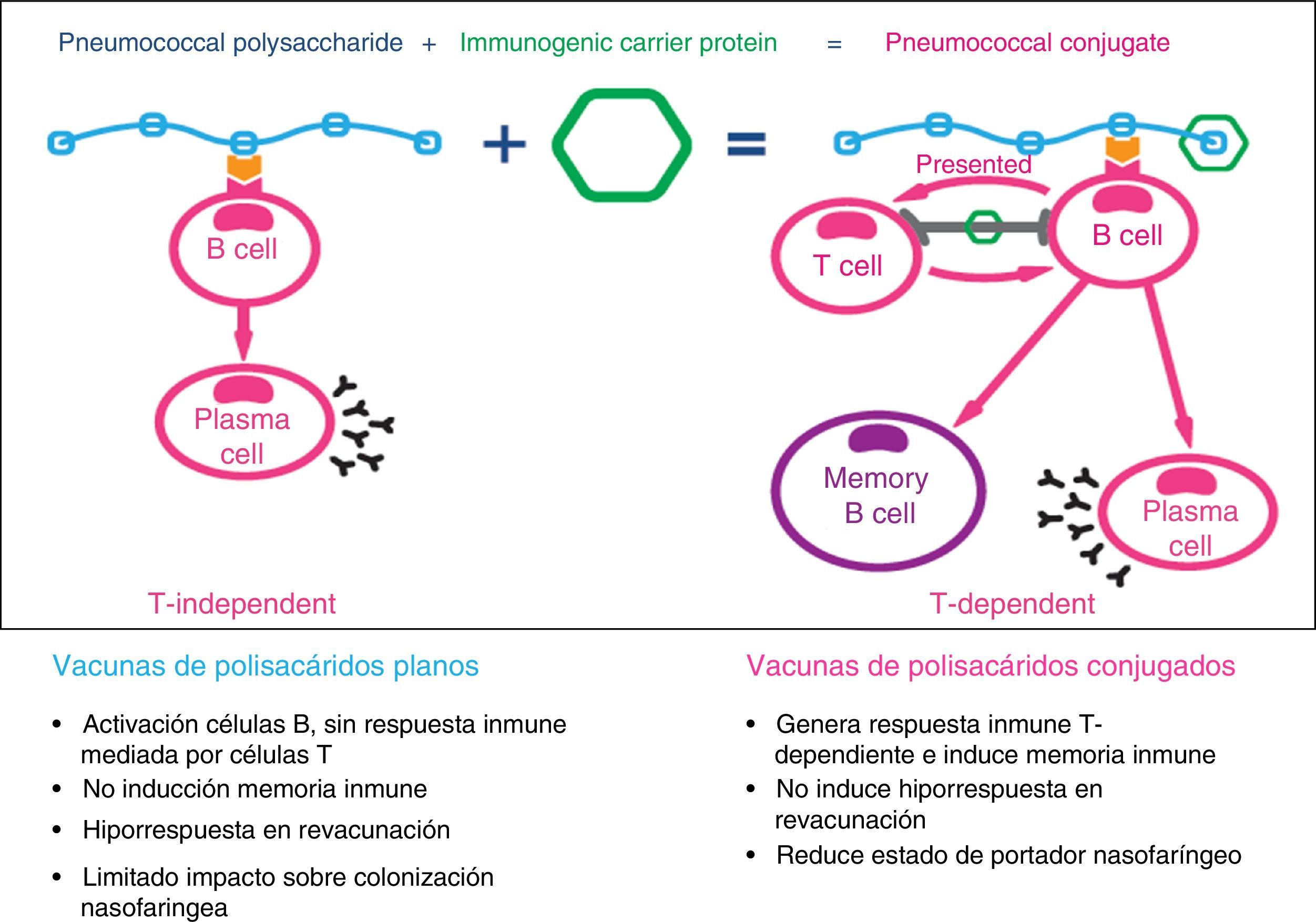
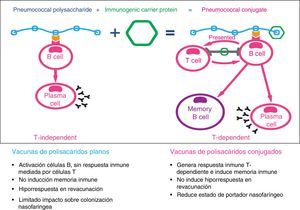
A finales del siglo pasado se empezaron a desarrollar las vacunas de polisacáridos conjugados con proteínas para convertir el tipo de respuesta inmune inducido por estas vacunas de T-independiente a T-dependiente16 (fig. 2). El objetivo era solventar las limitaciones de las vacunas de polisacáridos planos: no inmunógenas en los niños menores de 2 años, duración de la inmunidad vacunal de corta duración (5-10 años), inducción del fenómeno de tolerancia inmune o hiporrespuesta con las revacunaciones, ausencia de memoria inmunológica y no influencia sobre la colonización nasofaríngea17,18. Las vacunas antineumocócicas conjugadas generan respuestas de anticuerpos en las mucosas (IgA) y con ello disminuyen la colonización nasofaríngea por los serotipos presentes en la vacuna, con lo cual se consigue una disminución de la circulación de neumococos y, por tanto, de nuevos portadores, produciendo inmunidad de grupo.
La VPNC23 contiene antígenos polisacáridos capsulares purificados no conjugados de 23 serotipos de S. pneumoniae (25μg de antígeno de cada serotipo). La selección de serotipos a incluir en la vacuna se realizó con base en los que causan enfermedad con mayor frecuencia. Aunque hay variaciones según el área geográfica, en general, la vacuna contiene entre el 70 y el 80% de los serotipos asociados a ENI en los adultos en nuestro medio19. Desde 1980 está disponible para la vacunación de niños y adultos a partir de los 2 años de edad. En España, hay 2 preparados autorizados: Pneumo23® (Sanofi Pasteur MSD) y Pneumovax23® (Sanofi Pasteur MSD).
InmunogenicidadLa respuesta a la vacunación es específica de serotipo, con un incremento de la actividad opsonizante y fagocítica de los leucocitos y otras células fagocíticas. A las 2-3 semanas de la vacunación, más del 80% de los adultos jóvenes sanos desarrollan anticuerpos. La respuesta a los polisacáridos capsulares es T-independiente, por los que los niños menores de 2 años responden mal a la vacunación16. La vacuna no induce la formación de células B de memoria, por lo que la administración posterior de nuevas dosis genera una respuesta similar a la de la primovacunación (fenómeno de hiporrespuesta o tolerancia inmunológica)20.
Las personas mayores de 65 años y aquellas con asplenia y con enfermedades crónicas no inmunodepresoras responden aceptablemente a la vacunación. La respuesta empeora al aumentar el grado de inmunosupresión (hemopatías, tratamientos inmunosupresores, infección por VIH, etc.). Los adultos con enfermedades cardiovasculares responden de forma similar a los sujetos sanos21, al igual que en los pacientes con alcoholismo crónico y cirrosis22.
Eficacia y efectividad. Impacto de la vacunación de las personas mayores de 64 añosLa efectividad de la VPNC23 es motivo de controversia desde hace años. Los resultados de los ensayos clínicos y de los estudios observacionales para evaluar la eficacia/efectividad de la vacuna frente a ENI, publicados en los últimos 30 años, muestran resultados discordantes23–36. Una revisión Cochrane reciente37, publicada en 2013, que incluye 18 ensayos clínicos aleatorizados y 7 estudios observacionales, estima una eficacia global en el adulto del 74% (IC 95% 54-86), aunque no se observó protección en los grupos de alto riesgo, posiblemente por falta de potencia de dichos estudios. En cuanto a la efectividad frente a ENI, se ha estimado en un 52% (IC 95% 39-63).
En España, según un estudio caso-control realizado en Cataluña por Domínguez et al.36, que evalúa la efectividad de la vacuna para la prevención de la ENI en personas mayores de 65 años, se observó que en un 88% de los casos, la enfermedad fue producida por un serotipo incluido o relacionado con los serotipos de la VPNC23, y que la efectividad vacunal frente a cualquier serotipo fue del 70% (IC 95%48-82) (del 76% en los sujetos inmunocompetentes con o sin enfermedad de base y del 50% en los inmunodeprimidos). Al considerar únicamente los serotipos vacunales o relacionados, la efectividad global fue del 72% (del 78% en inmunocompetentes y del 46% en inmunodeprimidos).
Algunos programas de vacunación, como el llevado a cabo en Australia, han obtenido resultados sobre el impacto de la VPNC23 en la reducción de la ENI en la población mayor de 64 años38. Al comparar las tasas específicas por edad en el periodo prevacunal y después de la implantación del programa, se observó una reducción del 36% en la incidencia de ENI en este grupo de edad. A partir de estos datos, se estima que la efectividad de la vacuna oscila entre el 71% (IC 95% 54-82) y el 79% (IC 95% 14-96). Un reciente estudio realizado en Reino Unido con el objetivo de evaluar el impacto del programa de vacunación sistemática de las personas mayores de 64 años ha mostrado una efectividad global del 24% (IC 95% 10-36), que llega hasta el 48% (IC 95% 32-60) en los 2 primeros años tras la vacunación, pero que disminuye progresivamente a partir de entonces39. El estudio no muestra ningún impacto de la vacunación en personas con enfermedad de base ni en los mayores de 75 años.
En relación con la prevención de las neumonías, la mayoría de los estudios han utilizado como endpoint la neumonía por todas las causas debido a la dificultad del diagnóstico etiológico de las neumonías no bacteriémicas. La revisión Cochrane37 mostró una efectividad vacunal del 46% (IC 95% 33-57) en países de baja renta, pero fue no concluyente en adultos sanos y con enfermedades crónicas de países de renta alta. Un metaanálisis realizado en 2009 tampoco permitió demostrar protección en personas mayores o en adultos con enfermedades crónicas para la prevención de la neumonía de probable etiología neumocócica (RR 1,04; IC 95% 0,78-1,38) o de la neumonía de cualquier causa (RR 0,89; IC 95% 0,69-1,14)40. No obstante, en un amplio estudio poblacional prospectivo de cohortes41, llevado a cabo en España entre 2008 y 2011, la efectividad frente a neumonías no bacteriémicas en mayores de 60 años fue del 48% (hazard ratio 0,52; IC 95% 0,29-0,92) en los primeros 5 años tras la vacunación.
SeguridadLa vacuna es segura y bien tolerada. En menos del 50% de los casos puede presentarse alguna reacción local en forma de eritema o induración en el lugar de la inyección, y menos del 1% presentan reacciones locales importantes. Algunos estudios indican un incremento de la frecuencia de reacciones locales tras la revacunación, en especial si esta se realiza en los 5 años siguientes a la primovacunación42.
Pauta vacunalLa posología incluye una única dosis de 0,5ml (adultos y niños mayores de 2 años de edad) por vía intramuscular.
La revacunación está indicada a los 5 años de la primovacunación y una única vez en los pacientes de alto riesgo y en las personas de más de 64 años si cuando recibieron la primera dosis tenían menos de 65.
Indicaciones vacunalesNumerosos organismos y sociedades científicas de diferentes países recomiendan la vacunación antineumocócica con VPNC23 a partir de los 2 años de edad en personas con afecciones crónicas con riesgo incrementado de sufrir enfermedad neumocócica o sus complicaciones, así como en la población mayor de 64 años1,7,43.
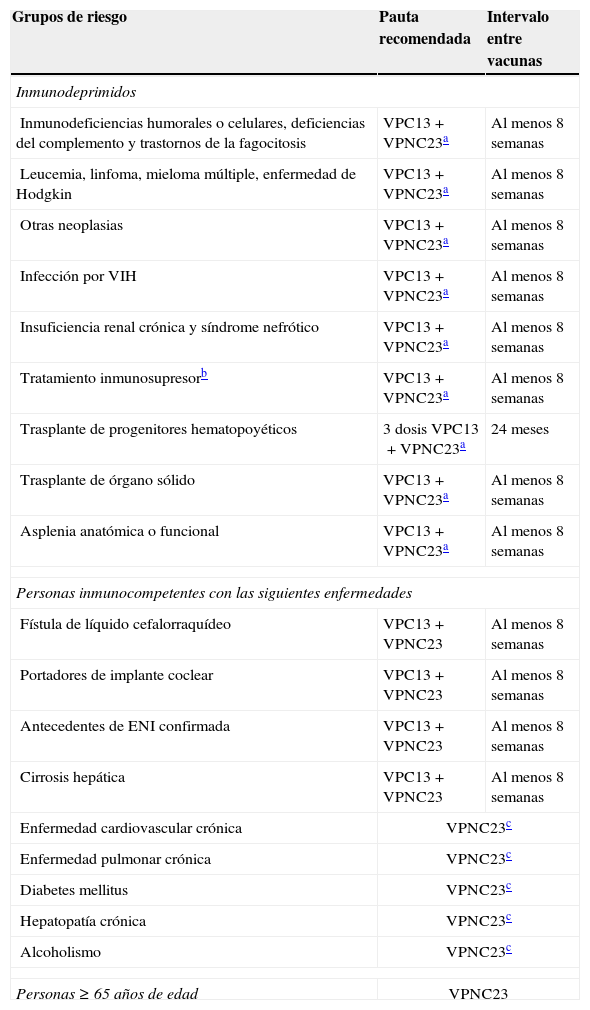
Las indicaciones actuales de esta vacuna en España, según el último documento del Ministerio de Sanidad, Servicios Sociales e Igualdad de 2015, se muestran en la tabla 244.
Recomendaciones de vacunación antineumocócica (VPNC23/VPC13) según grupos de riesgo
| Grupos de riesgo | Pauta recomendada | Intervalo entre vacunas |
|---|---|---|
| Inmunodeprimidos | ||
| Inmunodeficiencias humorales o celulares, deficiencias del complemento y trastornos de la fagocitosis | VPC13+VPNC23a | Al menos 8 semanas |
| Leucemia, linfoma, mieloma múltiple, enfermedad de Hodgkin | VPC13+VPNC23a | Al menos 8 semanas |
| Otras neoplasias | VPC13+VPNC23a | Al menos 8 semanas |
| Infección por VIH | VPC13+VPNC23a | Al menos 8 semanas |
| Insuficiencia renal crónica y síndrome nefrótico | VPC13+VPNC23a | Al menos 8 semanas |
| Tratamiento inmunosupresorb | VPC13+VPNC23a | Al menos 8 semanas |
| Trasplante de progenitores hematopoyéticos | 3 dosis VPC13+VPNC23a | 24 meses |
| Trasplante de órgano sólido | VPC13+VPNC23a | Al menos 8 semanas |
| Asplenia anatómica o funcional | VPC13+VPNC23a | Al menos 8 semanas |
| Personas inmunocompetentes con las siguientes enfermedades | ||
| Fístula de líquido cefalorraquídeo | VPC13+VPNC23 | Al menos 8 semanas |
| Portadores de implante coclear | VPC13+VPNC23 | Al menos 8 semanas |
| Antecedentes de ENI confirmada | VPC13+VPNC23 | Al menos 8 semanas |
| Cirrosis hepática | VPC13+VPNC23 | Al menos 8 semanas |
| Enfermedad cardiovascular crónica | VPNC23c | |
| Enfermedad pulmonar crónica | VPNC23c | |
| Diabetes mellitus | VPNC23c | |
| Hepatopatía crónica | VPNC23c | |
| Alcoholismo | VPNC23c | |
| Personas≥65 años de edad | VPNC23 | |
ENI: enfermedad neumocócica invasiva; VIH: virus de la inmunodeficiencia humana; VPC13: vacuna antineumocócica conjugada 13-valente; VPNC23: vacuna antineumocócica no conjugada 23-valente.
Revacunación con VPNC23 a partir de los 65 años, siembre que hayan transcurrido más de 5 años desde la dosis anterior.
Fuente: Ministerio de Sanidad, Servicios Sociales e Igualdad44.
La vacuna antineumocócica conjugada 13-valente (VPC13) contiene polisacáridos capsulares de 13 serotipos de S. pneumoniae: 4, 6A (no incluido en la VPNC23), 6B, 9V, 14, 18C, 19F, 23F, 1, 3, 5, 7F y 19A. Contiene 2,2μg de cada uno de ellos, excepto del 6B, que tiene 4,4μg. Es una vacuna conjugada con proteína diftérica CRM197, adsorbida en fosfato de aluminio (0,125mg de aluminio).
En octubre de 2011, la European Medicines Agency y la Food and Drug Administration de los EE. UU. autorizaron la VPC13 para la inmunización activa de adultos de edad igual o superior a 50 años45,46. En mayo de 2013 se ha autorizado su uso también para adultos menores de 50 años.
InmunogenicidadLa autorización de la VPC13 en adultos se ha basado en la comparación de las concentraciones geométricas medias de anticuerpos con actividad opsofagocítica (OPA) (mejor medida de la capacidad funcional de los anticuerpos protectores) inducidos por la VPC13 y la VPNC23.
Los ensayos clínicos han incluido más de 5.000 adultos mayores de 50 años sanos o con enfermedades crónicas no inmunosupresoras (cardiovascular, EPOC, diabetes, IRC, hepatopatía crónica)18,47–50. Estos estudios, diseñados de acuerdo con los organismos reguladores de las agencias evaluadoras de medicamentos, han demostrado que la VPC13 induce una respuesta inmune funcional superior a la de la VPNC23 para 8-10 de los serotipos comunes incluidos y para el 6A. Los niveles de anticuerpos tras la vacunación se correlacionan inversamente con la edad del vacunado.
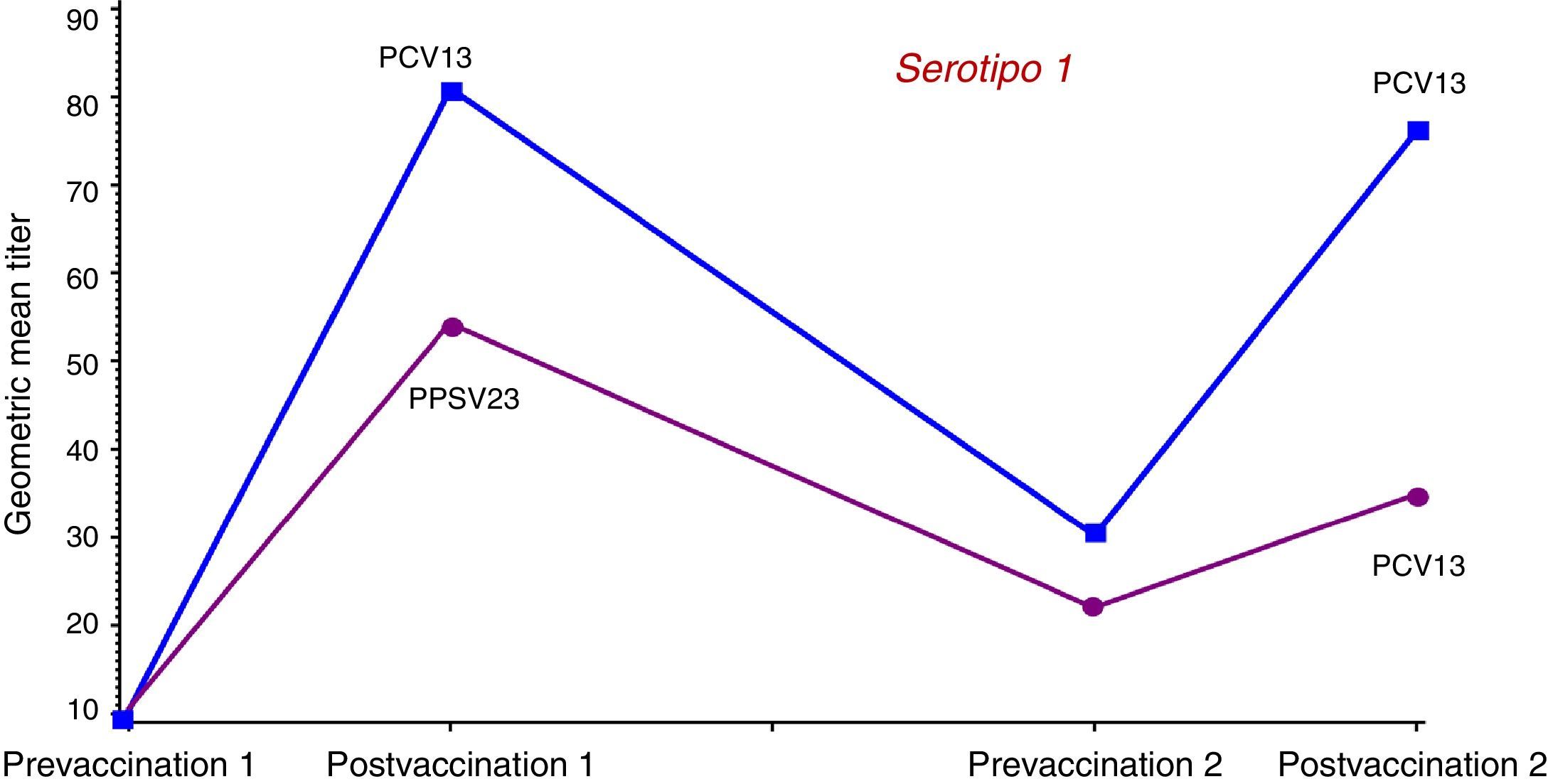
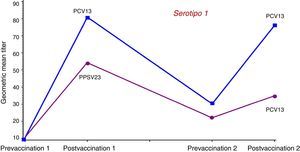
Para analizar la posible influencia de la vacunación previa con VPNC23 se compararon las respuestas inmunes inducidas por la VPC13 y por la VPNC23 en un ensayo realizado con adultos mayores de 70 años que habían recibido previamente una dosis única de VPNC23 al menos 5 años antes48. Se asignó a los sujetos a recibir una dosis única de VPC13 o de VPNC23. Las concentraciones geométricas medias OPA inducidas por la VPC13 fueron superiores, de forma estadísticamente significativa, para 10 de los 12 serotipos comunes y para el 6A. La administración de otra dosis de VPC13 un año después a los sujetos del estudio anterior permitió observar que no se producía tolerancia inmune en aquellos que habían recibido primero la vacuna conjugada. Los sujetos que el año anterior habían recibido la VPNC23 presentaron concentraciones geométricas medias OPA inferiores tras la revacunación con VPC13. En la figura 3 se muestran los resultados de la cinética de anticuerpos OPA para el serotipo 1; los resultados son similares para 12 de los 13 serotipos comunes. Los resultados de este estudio confirman el efecto negativo de la VPNC23 sobre la respuesta posterior a la vacuna conjugada, lo que permite concluir que en caso de estar indicada la administración secuencial de ambas vacunas, siempre se deberá administrar en primer lugar la conjugada.
Cinética de anticuerpos con actividad opsofagocítica para el serotipo 1 tras la administración de una dosis de recuerdo de VPC13 o de VPNC23 un año después de la vacunación en sujetos mayores de 70 años primovacunados con VPNC23.
Fuente: Jackson et al.48.
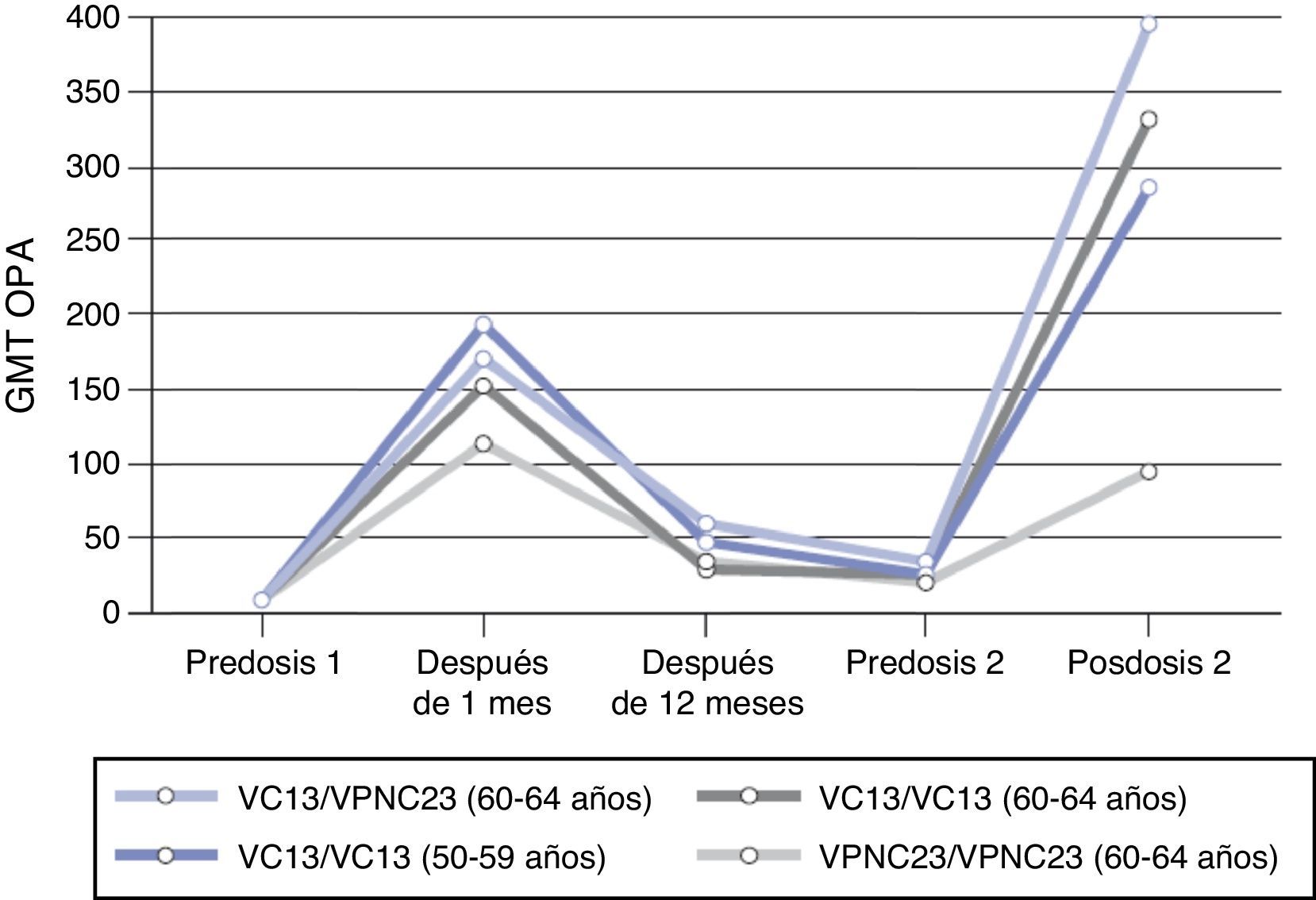
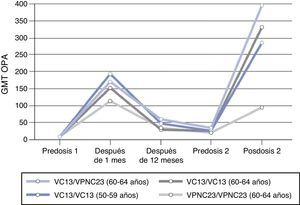
Otro estudio realizado para evaluar la respuesta inmune a una segunda dosis de VPC13 o de VPNC23, 3 o 4 años después de la primera dosis, mostró que la administración previa de VPC13 incrementa la respuesta inmune a dosis subsiguientes de VPC13 o de VPNC23 para 7 de los 13 serotipos comunes en comparación con aquellos primovacunados con VPNC23 y no es inferior para los 6 restantes18,49. Por el contrario, la administración previa de VPNC23 se asocia a una respuesta disminuida a las dosis subsiguientes de vacuna. Los resultados son similares para el resto de los serotipos (fig. 4). Estas observaciones permiten concluir que la administración inicial de VPC13 genera memoria inmune que potencia la respuesta a una segunda dosis de vacuna (VPC13 o VPNC23), es decir, induce un efecto booster, hecho que no se observa con la vacunación inicial con vacuna no conjugada.
Cinética de anticuerpos con actividad opsofagocítica prevacunación y posvacunación (un mes, 3-4 años) para el serotipo 1 según diferentes pautas vacunales.
Fuente: Paradiso18.
Existen datos disponibles de inmunogenicidad y seguridad de VPC13 en sujetos infectados por el VIH que habían sido vacunados previamente con al menos una dosis de VPNC2351.
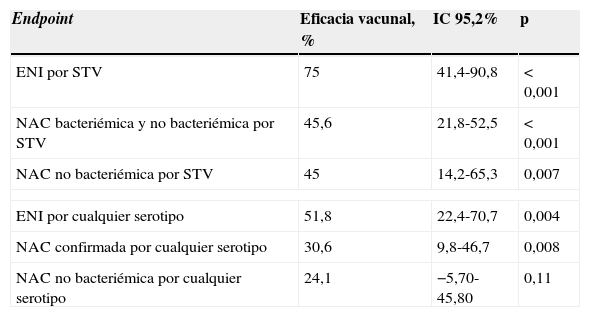
Eficacia y efectividadSe han publicado recientemente los resultados de un ensayo clínico en fase iii con VPC13 (Estudio CAPITA)52 realizado en Holanda en adultos mayores de 65 años que incluye más de 85.000 sujetos. El objetivo primario fue analizar la eficacia de la vacuna para la prevención de la neumonía, y el objetivo secundario, su eficacia frente a ENI. La eficacia vacunal por protocolo para el primer episodio de neumonía comunitaria por serotipos vacunales fue del 45,56% (IC 95% 21,8-62,4), del 45,0% (IC 95% 14,2-65,3) para la neumonía no bacteriémica por serotipos incluidos en la vacuna, del 30,56% (IC 95% 9,75-46,74) para la neumonía neumocócica por serotipos vacunales, no vacunales y no tipables, y del 75% (IC 95% 41,4-90,7) para el primer episodio de ENI por serotipos incluidos en la vacuna. La eficacia, especialmente en la prevención de la ENI, fue mayor en los sujetos de menor edad (84,2% en menores de 75 años vs. 50,0% en los de edades comprendidas entre los 75 y los 85 años) (tabla 3).
Eficacia de la vacuna antineumocócica conjugada 13-valente (Estudio CAPITA)
| Endpoint | Eficacia vacunal, % | IC 95,2% | p |
|---|---|---|---|
| ENI por STV | 75 | 41,4-90,8 | <0,001 |
| NAC bacteriémica y no bacteriémica por STV | 45,6 | 21,8-52,5 | <0,001 |
| NAC no bacteriémica por STV | 45 | 14,2-65,3 | 0,007 |
| ENI por cualquier serotipo | 51,8 | 22,4-70,7 | 0,004 |
| NAC confirmada por cualquier serotipo | 30,6 | 9,8-46,7 | 0,008 |
| NAC no bacteriémica por cualquier serotipo | 24,1 | −5,70-45,80 | 0,11 |
ENI: enfermedad neumocócica invasiva; IC: intervalo de confianza; NAC: neumonía adquirida en la comunidad; STV: serotipos incluidos en la vacuna 13-valente.
Fuente: Bonten et al.52.
Se están realizando ensayos clínicos con VPC13 en pacientes trasplantados de progenitores hematopoyéticos y en enfermos con drepanocitosis.
Al igual que ocurre con otras vacunas conjugadas, la VPC13 genera protección comunitaria. Según datos de los EE. UU., de vigilancia poblacional del Active Bacterial Core Surveillance, la vacunación sistemática infantil con VPC13 ha generado reducciones significativas de ENI en todos los grupos de edad (a los 3 años de la introducción y para 5 serotipos exclusivos de VPC13, la reducción ha sido del 93% en los niños menores de 5 años y del 58% en las personas mayores de 65 años)53. Así mismo, se ha estimado que en los 3 primeros años tras la introducción de VPC13, probablemente se han evitado 20.000 casos de ENI en adultos y alrededor de 2.900 fallecimientos.
SeguridadLos ensayos clínicos precomercialización de la VPC13 en adultos han mostrado un buen perfil de seguridad. Las reacciones adversas más frecuentes, tanto locales como sistémicas, son similares a las observadas con la VPNC23 y el resto de las vacunas de uso habitual en los calendarios de vacunación sistemática del adulto45.
Pauta vacunalLa pauta de administración en adultos es de una única dosis por vía intramuscular. Únicamente los pacientes sometidos a trasplante de progenitores hematopoyéticos54,55 deberán recibir 3 dosis de VPC13 con un intervalo mínimo de un mes entre dosis y una dosis de VPNC23 a los 12 meses de la última dosis de VPC13. En pacientes con EICH crónica debe considerarse la administración de una cuarta dosis de VPC13.
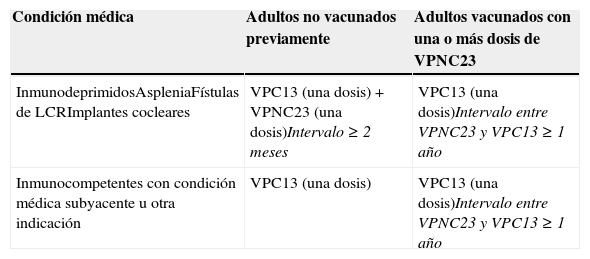
Los pacientes no vacunados previamente con VPNC23 deberán recibir una dosis de VPC13 seguida de una dosis de VPNC23 8 semanas después. Las personas incluidas en los grupos de mayor riesgo (inmunodeprimidos y personas con asplenia anatómica o funcional) deberán revacunarse con una segunda dosis de VPNC23 5 años más tarde. Las personas con implantes cocleares o fístulas de líquido cefalorraquídeo no necesitan recibir ninguna dosis adicional de VPNC23 hasta los 65 años de edad56.
Los adultos previamente vacunados con VPNC23 deberán recibir una dosis de VPC13 con un intervalo mínimo de un año desde la vacunación con VPNC2356.
En la tabla 4 se muestran las pautas e intervalos de administración de ambas vacunas.
Recomendaciones de utilización de la vacuna antineumocócica conjugada 13-valente en adultos, según indicación médica
| Condición médica | Adultos no vacunados previamente | Adultos vacunados con una o más dosis de VPNC23 |
|---|---|---|
| InmunodeprimidosAspleniaFístulas de LCRImplantes cocleares | VPC13 (una dosis)+VPNC23 (una dosis)Intervalo≥2 meses | VPC13 (una dosis)Intervalo entre VPNC23 y VPC13≥1 año |
| Inmunocompetentes con condición médica subyacente u otra indicación | VPC13 (una dosis) | VPC13 (una dosis)Intervalo entre VPNC23 y VPC13≥1 año |
LCR: líquido cefalorraquídeo; VPC13: vacuna antineumocócica conjugada 13-valente; VPNC23: vacuna antineumocócica no conjugada 23-valente.
Fuente: Sociedad Española de Medicina Preventiva, Salud Pública e Higiene58.
La vacuna puede administrarse simultáneamente con la vacuna antigripal inactivada.
Indicaciones vacunalesEn junio de 2012, el Advisory Committee on Immunization Practices de los Centers for Disease Control and Prevention de los EE. UU. publicó las primeras recomendaciones para la utilización de VPC13 en adultos56, que incluyen los siguientes grupos de pacientes: inmunodeprimidos de cualquier causa, asplenia congénita o adquirida, drepanocitosis y otros tipos de hemoglobinopatías, fístulas de líquido cefalorraquídeo y portadores de implantes cocleares. Recientemente se ha incluido también la indicación sistemática de esta vacuna a todas las personas mayores de 64 años57.
En España, según el último documento del Ministerio de Sanidad, Servicios Sociales e Igualdad44, las indicaciones de la vacuna VPC13 en adultos financiadas por el Sistema Nacional de Salud se muestran en la tabla 2.
Diversas sociedades científicas y grupos de trabajo en nuestro país han elaborado documentos de consenso sobre las indicaciones de esta vacuna, que amplían la recomendación a todos los pacientes con afecciones crónicas de riesgo de enfermedad neumocócica (tabla 4)58,59.
Conclusiones- •
Las infecciones por S. pneumoniae constituyen un importante problema de salud pública en las personas mayores de los países desarrollados y en los adultos de cualquier edad con factores de riesgo.
- •
Se dispone de 2 vacunas frente a neumococo para su utilización en adultos y grupos de riesgo: la VPNC23 y la VPC13.
- •
Existe evidencia de la efectividad de VPNC23 en la prevención de la ENI. Sin embargo, hay controversia en relación con su efectividad frente a neumonía neumocócica y neumonía por todas las causas.
- •
La eficacia y efectividad de la VPC13 está bien demostrada en niños, así como el impacto comunitario de los programas de vacunación sistemática infantil.
- •
Recientemente se han publicado también resultados concluyentes sobre la eficacia de la VPC13 para la prevención de la ENI y la neumonía adquirida en la comunidad en adultos mayores de 64 años.
- •
Si está indicada la revacunación con VPNC23, independientemente del estado vacunal previo, la VPC13 debe administrarse siempre en primer lugar.
- •
La VPC13 puede coadministrarse con la vacuna antigripal.
- •
La amplia experiencia y los buenos resultados de las vacunas conjugadas en la población pediátrica evidencian que su beneficio será también importante en el adulto.
La autora ha participado como investigadora en ensayos clínicos y en comités de expertos de Pfizzer, GSK, Novartis y Sanofi Pasteur MSD.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.