Los últimos avances en el microbioma vaginal y el diagnóstico molecular de la vaginosis bacteriana han permitido un mayor conocimiento de esta entidad caracterizando aspectos de su patogenia y el establecimiento de la biocapa vaginal, los modelos y nuevas teorías de la etiología de la misma, cómo se transmite al considerarse hoy como una probable infección de transmisión sexual, la separación de otras entidades como la vaginitis aerobia, el diagnóstico molecular de la misma y el tratamiento y nuevas moléculas que eviten las recaídas frecuentes. Esta entidad y el estudio del microbioma vaginal han permitido considerar estas infecciones como un síndrome polimicrobiano acabando con el dogma: un microorganismo, una enfermedad. Además, se actualiza una entidad menos conocida como es la vaginitis aerobia y los métodos para su detección.
The latest advances in the vaginal microbiome and molecular diagnosis of bacterial vaginosis have allowed for a better knowledge of this entity, characterising aspects of its pathogenesis and the establishment of the vaginal biolayer, the models and new theories of its aetiology, how it is transmitted, with it being considered nowadays as a probable sexually transmitted infection, the separation of other entities such as aerobic vaginosis, its molecular diagnosis and treatment with new molecules to prevent frequent relapses. This entity and the study of the vaginal microbiome have made it possible to consider these infections as a polymicrobial syndrome, putting an end to the dogma: one microorganism, one disease. In addition, a lesser-known entity such as aerobic vaginosis and the methods for its detection are updated.
La vagina humana es un ecosistema balanceado y dinámico, con una población compleja de bacterias aerobias y anaerobias que alcanzan hasta 109ufc/ml de líquido vaginal1-3. Clásicamente la presencia de Lactobacillus spp. se considera que tiene un efecto protector en este ecosistema por 3 mecanismos complementarios: a) exclusión mediante la formación de una biocapa que cubre los receptores de la célula epitelial y bloquea la unión de microorganismos patógenos; b) inhibición del crecimiento por generación de distintos compuestos antimicrobianos: b1) ácido láctico del catabolismo fermentativo de azúcares, especialmente de glucosa, que excreta glucógeno e hidrólisis que hace que el pH de la vagina sea de 3,5-4,5, b2) producción de peróxido de hidrógeno (H2O2), fundamentalmente de Lactobacillus crispatus y Lactobacillus jensenii, b3) bacteriocinas cuyo efecto solo se ha demostrado in vitro; y c) coagregación con patógenos. Estos efectos incrementan la función de barrera en las células epiteliales y estimulan la inmunidad innata.
La aparición de molestias genitales (exudado, prurito, dispareunia y mal olor) es común en las mujeres y son de etiología variada: vulvodinia, dermatitis de contacto, vaginitis atrófica o liquen escleroso. Dentro de las infecciones están las producidas por levaduras, tricomonas y la vaginosis bacteriana (VB), que representan el 19% de los diagnósticos en estas mujeres4. Estas infecciones producen una disbiosis en la que interviene también otra entidad clínica reconocida más recientemente: la vaginitis aerobia (VA), que se puede confundir a veces con la VB5.
El enfoque de esta revisión es actualizar aspectos de la entidad clínica conocida como VB, y se incluyen las características que permiten el diagnóstico y tratamiento de la VA en relación con el papel de la microbiota vaginal.
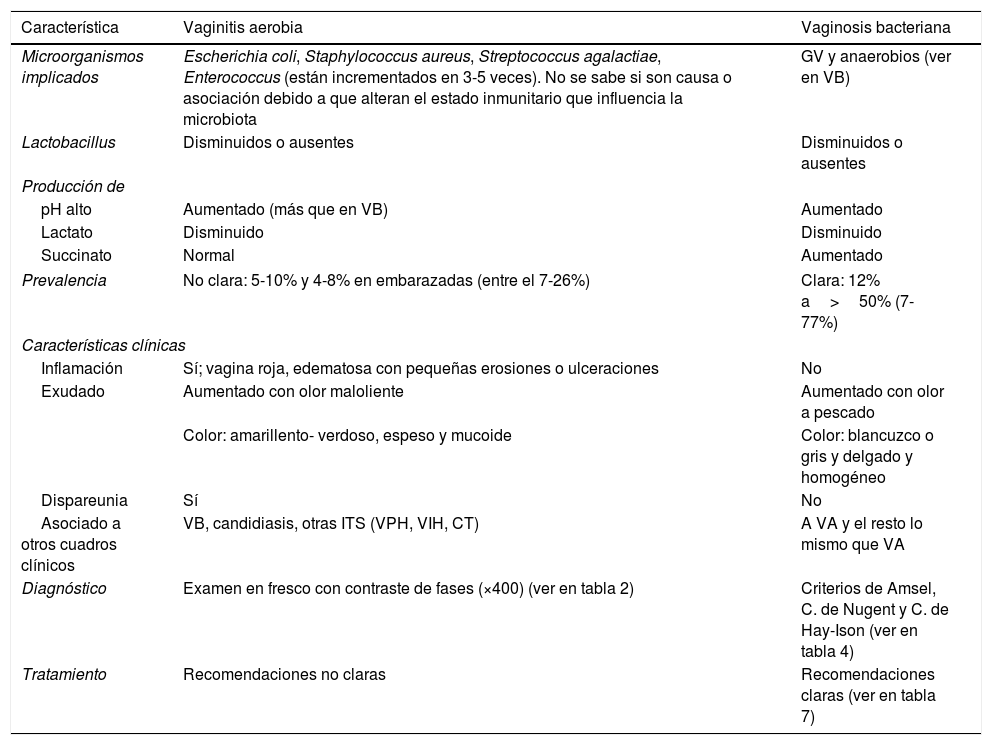
Vaginitis aerobiaDefiniciónEl nombre de esta entidad fue dado en el año 2002 y se puede definir como una alteración de la microbiota (menos Lactobacillus y mayores cantidades de bacterias aerobias entéricas) con niveles variables de inflamación, deficiencia de maduración epitelial, y de respuesta inmune con elevación local de IL-1, IL-6 e IL-8. En mujeres embarazadas se asocia a riesgo de parto prematuro, corioamnionitis y funisitis del feto, o también en general a displasia cervical5,6. Es importante diferenciar la VA de la VB (tabla 1), aunque a veces no es fácil. La mayoría de clínicos están de acuerdo con la puntuación de Nugent de 7 o más para VB y de 3 o menos para microbiota normal, pero no está claro el significado de la microbiota intermedia con puntuación de 4-65. En este grupo intermedio, la VA puede explicar aspectos no claros de la VB: a) el concepto mismo de esta microbiota intermedia; b) la variabilidad de los síntomas con la puntuación de Nugent; c) la llamada VB inflamatoria, y d) el fallo de tratamiento con metronidazol para prevenir parto prematuro en muchas mujeres con VB5. Por lo tanto, este grupo intermedio se cree que puede ser un grupo mixto que puede incluir mujeres con VA asociadas a VB.
Características diferenciales entre vaginitis aerobia y vaginosis bacteriana
| Característica | Vaginitis aerobia | Vaginosis bacteriana |
|---|---|---|
| Microorganismos implicados | Escherichia coli, Staphylococcus aureus, Streptococcus agalactiae, Enterococcus (están incrementados en 3-5 veces). No se sabe si son causa o asociación debido a que alteran el estado inmunitario que influencia la microbiota | GV y anaerobios (ver en VB) |
| Lactobacillus | Disminuidos o ausentes | Disminuidos o ausentes |
| Producción de | ||
| pH alto | Aumentado (más que en VB) | Aumentado |
| Lactato | Disminuido | Disminuido |
| Succinato | Normal | Aumentado |
| Prevalencia | No clara: 5-10% y 4-8% en embarazadas (entre el 7-26%) | Clara: 12% a>50% (7-77%) |
| Características clínicas | ||
| Inflamación | Sí; vagina roja, edematosa con pequeñas erosiones o ulceraciones | No |
| Exudado | Aumentado con olor maloliente | Aumentado con olor a pescado |
| Color: amarillento- verdoso, espeso y mucoide | Color: blancuzco o gris y delgado y homogéneo | |
| Dispareunia | Sí | No |
| Asociado a otros cuadros clínicos | VB, candidiasis, otras ITS (VPH, VIH, CT) | A VA y el resto lo mismo que VA |
| Diagnóstico | Examen en fresco con contraste de fases (×400) (ver en tabla 2) | Criterios de Amsel, C. de Nugent y C. de Hay-Ison (ver en tabla 4) |
| Tratamiento | Recomendaciones no claras | Recomendaciones claras (ver en tabla 7) |
No hay datos muy fiables por la escasez de trabajos realizados, pero se calcula en entre un 5-10% en mujeres no embarazadas y un 4-8% en embarazadas7, aunque puede variar entre el 7 y 26%6. Los factores de riesgo son similares a los de la VB.
ClínicaSe produce un exudado purulento amarillo-verdoso con inflamación y alteración epitelial. Los signos son una vagina enrojecida, inflamatoria, con flujo maloliente, quemazón con sangrado equimótico, erosiones y dispareunia. La sintomatología puede prolongarse hasta 12 meses o más y a veces es indistinguible de la vaginitis inflamatoria descamativa5.
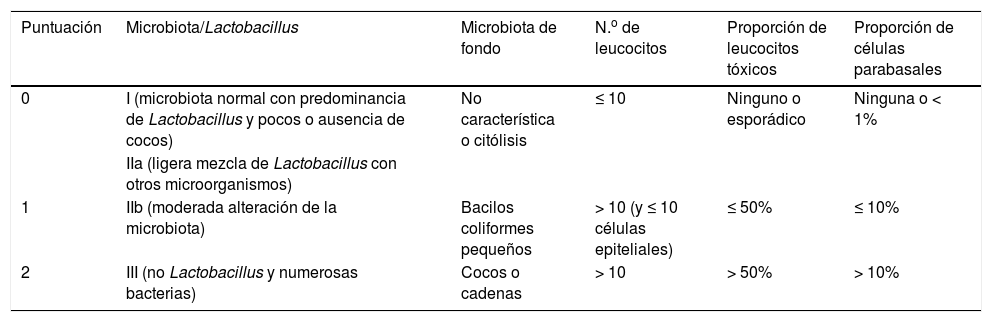
DiagnósticoEl método más preciso y preferido es el examen en fresco con microscopio de contraste de fases (×400) (tabla 2)6, aplicando una puntuación como en los criterios de Nugent: de 0 a 2 significa ausencia de VA; entre 3 y 4, ligera VA; entre 5 y 6, moderada VA; y de 7 a 10, severa. Algunos estudios consideran patológica una puntuación de entre 5 y 10 puntos.
Diagnóstico de la vaginitis aerobia mediante examen en fresco con microscopio de contraste de fases (×400)
| Puntuación | Microbiota/Lactobacillus | Microbiota de fondo | N.o de leucocitos | Proporción de leucocitos tóxicos | Proporción de células parabasales |
|---|---|---|---|---|---|
| 0 | I (microbiota normal con predominancia de Lactobacillus y pocos o ausencia de cocos) | No característica o citólisis | ≤ 10 | Ninguno o esporádico | Ninguna o < 1% |
| IIa (ligera mezcla de Lactobacillus con otros microorganismos) | |||||
| 1 | IIb (moderada alteración de la microbiota) | Bacilos coliformes pequeños | > 10 (y ≤ 10 células epiteliales) | ≤ 50% | ≤ 10% |
| 2 | III (no Lactobacillus y numerosas bacterias) | Cocos o cadenas | > 10 | > 50% | > 10% |
Células epiteliales parabasales: células epiteliales inmaduras, redondeadas, pequeñas, con una proporción alta de núcleo a citoplasma.
Leucocitos tóxicos: leucocitos con abundantes gránulos de secreción.
Este método no está muy extendido y se suelen emplear métodos alternativos, como PCR cuantitativa (se desconoce su sensibilidad [S] y su especificidad [E]), cultivos para detectar Streptococcus pyogenes y/o Trichomonas vaginalis (TV) o el análisis histológico. La observación de la microbiota cocoide al microscopio es una técnica rápida, pero solo recoge un subgrupo de pacientes con VA6.
También existe otra prueba para la medición de 5 indicadores enzimáticos6: a) actividad de peroxidasa de hidrógeno (indicador de Lactobacillus productores de H2O2); b) actividad de la leucocito estearasa (indica inflamación); c) actividad de la sialidasa (por alta producción en VA por Streptococcus agalactiae y en VB por Atapobium vaginae [AV], Gardnerella vaginalis [GV] y Prevotella bivia); d) actividad de la betaglucuronidasa (específica de Escherichia coli), y e) actividad de la coagulasa (de Staphylococcus aureus y Enterococcus faecalis); mediante estos 5 indicadores se consigue una S del 90%, pero su E no se ha estudiado.
Otros métodos menos comunes son: medir el contenido de estrógeno en sangre (en vagina un estrógeno bajo sugiere la presencia de células epiteliales inmaduras o parabasales, pero no es relevante al medirse en suero); la prueba de pH, por autotoma, para cribado (S del 90% pero baja E porque aumenta también el pH en TV, VB, levaduras, por esperma o por sangre menstrual) y la secuenciación NGS.
TratamientoNo está claro y no hay datos concluyentes con el uso de los antibióticos. Se pueden usar: a) antisépticos como el cloruro de decualinio o nifuratel 500mg intravaginal 10 días; y b) antibióticos como clindamicina, kanamicina en óvulos de 100mg 6 días, rifaximina vaginal 6 días o moxifloxacino oral 400mg durante 6 días en una dosis. El metronidazol no es adecuado al no cubrir los microorganismos implicados en VA. Las guías de tratamiento aconsejan: cuando hay atrofia, pautar estradiol con o sin probiotas; si hay inflamación, pautar corticoides locales; y cuando hay infección clara (grado IIb o III [tabla 2] y/o crecimiento abundante de E. coli, S. pyogenes, S. agalactiae o estafilococos en cultivo) incluir antibióticos. Durante el embarazo parece mejor usar clindamicina, que es activo para VA y VB además de reducir el parto prematuro, pero de nuevo esta pauta es controvertida6.
Vaginosis bacterianaIntroducciónHasta la aparición de las técnicas moleculares, el concepto de «un microorganismo, una enfermedad» fue un dogma, así como que los microorganismos estaban en forma planctónica y como una sola especie, cuando en realidad son comunidades complejas polimicrobianas formando biofilm o bicapas8. Desde 1892, año en que Albert Döderlein descubrió los bacilos que llevan su nombre o Lactobacillus, estos son considerados microbiota vaginal normal1. Este microbioma normal consiste en bacterias aerobias y anaerobias, con Lactobacillus representando > 95% de todos ellos. Así, mantienen un pH acídico asegurando que el H2O2 esté presente en el ambiente9.
El término vaginosis aparece en la literatura en 1964, pero hasta 1981 no se emplea el término VB, que actualmente se cuestiona por el de vaginosis polimicrobiana. En la tabla 3 se exponen los hitos históricos de la VB10,11.
Hitos históricos de la vaginosis bacteriana
| Año | Hito |
|---|---|
| Años 50 | Descripción de Gardnerella vaginalis |
| 1955 | Descubrimiento como agente causal de vaginosis no específica |
| 1964 | Introducción del término vaginosis |
| 1981 | Introducción del término vaginosis bacteriana |
| 2016 | Se sugiere el término vaginosis polimicrobiana |
Desde hace tiempo se considera a la VB un síndrome con distintas etiologías. Con métodos actuales como la hibridación in situ por fluorescencia (FISH) se ha comprobado las características de estas biocapas en el caso de la VB12. La VB representa una disbiosis de la microbiota vaginal13, y en este síndrome polimicrobiano disminuye la concentración de Lactobacillus y aumenta la de bacterias patógenas9. A pesar de que no hay un solo microorganismo cuya presencia confirme potencialmente el diagnóstico, GV y AV son fuertes indicadores de VB14.
Aunque es aceptado que la VB está producida por un conglomerado de microorganismos, se debate acerca del desencadenante o trigger que iniciaría las alteraciones: si el microorganismo fundador de esta microbiota alterada es GV, si se trata de un consorcio de microorganismos, o si es debido a otros factores como el uso de la ducha vaginal.
PrevalenciaAfecta al 12% de mujeres en Australia, 29% en los EE.UU. y > 50% en mujeres de la zona subsahariana15, aunque hay una gran variación entre el 7-70% de las mujeres16,17.
EpidemiologíaVB es la disbiosis vaginal más común en mujeres en edad reproductiva1 y la causa más común de vaginitis con exudado vaginal abundante y olor en embarazadas y no embarazadas9. Por otro lado, es más común en mujeres que tienen sexo con mujeres (MSM) o mixto que en mujeres que tienen sexo con hombres (MSH). El mecanismo podría ser por compartir objetos sexuales, pero no se sabe si el líquido vaginal compartido entre mujeres es más eficiente que la penetración masculina. Además, la transmisión de anaerobios es menos eficiente, por lo que iría a favor de la hipótesis de transmisión primaria de GV18.
Se debate si se puede definir como una verdadera infección de transmisión sexual (ITS). Ya se planteó históricamente en los años 50 cuando Gardner y Dukes vieron la transmisión de mujeres infectadas a no infectadas, pero se abandonó esta teoría ya que: a) no había la contrapartida en hombres; b) el tratamiento de los hombres no disminuía la VB en las parejas (aunque estos estudios fueron de baja calidad metodológica), y c) la presencia de varios patógenos iba en contra de esta posibilidad.
Actualmente se ha retomado la teoría a favor de una ITS por varios aspectos destacables y de mucho peso15:
- a)
Hay muchos estudios transversales y longitudinales ligados a la actividad sexual.
- b)
Se asocia a bajo uso del preservativo.
- c)
Las mujeres con VB tienen un número de parejas sexuales mayor que las mujeres sin VB.
- d)
Aparece más tempranamente en las mujeres activas sexualmente.
- e)
Hay un reservorio en el hombre, que alberga los microorganismos implicados en el surco subprepucial y uretra distal.
- f)
Solo el tabaco (y no las duchas vaginales, factores dietéticos y estrés) se ha asociado consistentemente.
- g)
Se ha asociado a transmisión sexual entre mujeres, a una pareja femenina con síntomas o historia de VB, y al sexo oral receptivo.
- h)
Hay concordancia de biotipos y oligotipos entre hombres y mujeres que son pareja.
- i)
La circuncisión disminuye la probabilidad en las mujeres que son pareja de estos hombres.
- j)
La uretritis no gonocócica (UNG) es más frecuente en hombres parejas de mujeres con VB, pero solo se ha encontrado Sneathia, bacterias asociadas a VB (BVAB) como BVAB2 y BVAB3 de forma no estadísticamente significativa.
- k)
Se asocia a balanopostitis por GV en los hombres.
El concepto de VB viene condicionado por el método diagnóstico que se realice:
a) Clínico, usando los criterios de Amsel17.
b) De investigación, usando los criterios de Nugent16 o su modificación de los criterios de Hay-Ison19.
En estudios clínicos se han utilizado los criterios de Amsel, mientras que en estudios de investigación se han empleado los criterios de Nugent basados en la tinción de Gram (tabla 4): 0-3 normal, 4-6 intermedios con morfotipos de GV/Bacteroides y de 7-10 con numerosos GV/Bacteroides y aparición de bacilos curvados anaerobios (Mobiluncus y posiblemente BVAB1) en 9-10.
Criterios de Amsel, criterios de Nugent y criterios de Hay-Ison
| Criterios de Amsel (clínicos)a | Características (%) |
|---|---|
| Flujo vaginal | Filante, homogéneo, blanco, adherido a las paredes y uniforme |
| pH vaginal | > 4,5 (90%) |
| KOH al 10% | Olor a pescado |
| Células clave o pista (×40) | > 20% (> 90%) |
| Criterios de Nugent (tinción de Gram)b | Recuento por campo inmersión (valor) |
|---|---|
| Bacilos grampositivos tipo Lactobacillus | > 30 (0) |
| 5-30 (1) | |
| 1-4 (2) | |
| < 1 (3) | |
| 0 (4) | |
| Bacilos gramnegativos tipo GV y Bacteroides | > 30 (4) |
| 5-30 (3) | |
| 1-4 (2) | |
| < 1 (1) | |
| 0 (0) | |
| Bacilos gram variables curvos | > 5 (2) |
| < 1-4 (1) | |
| 0 (0) |
| Criterios de Hay-Ison (tinción de Gram) | Grado |
|---|---|
| Predominio de bacilos grampositivos tipo Lactobacillus | 1. Normal |
| Microbiota mixta de algún Lactobacillus y bacilos gramnegativos tipo GV y Mobiluncus | 2. Intermedio |
| Predominio de GV y/o Mobiluncus con pocos/ningún Lactobacillus | 3. VB |
National Institute of Healthcare (NIH): Diagnóstico de VB con los criterios de Nugent (al menos una puntuación de 7) y un criterio de Amsel positivo, independientemente de los síntomas.
La presencia de leucocitos polimorfonucleares sugiere la coexistencia de otro proceso como cervicitis.
Los criterios de Amsel generan problemas de sobrediagnóstico, ya que habría muchas mujeres asintomáticas diagnosticadas de VB. En un estudio en el cual un 29% de mujeres presentaban VB según los criterios de Amsel, solo el 15,7% eran sintomáticas20. Sin embargo, este grupo de mujeres presentaron más complicaciones asociadas con VB, independientemente de si tenían o no sintomatología.
Los criterios de Nugent tienen alta precisión y fiabilidad diagnósticas, con alta reproducibilidad tanto inter- e intracentro como interobservador. Sin embargo, la identificación de microorganismos en las células pista o clave en la tinción de Gram no siempre es precisa. Se ha demostrado mediante PCR cuantitativa y FISH que los bacilos gramnegativos curvos que se creía que representaban Mobiluncus spp., es más probable que sean (en un factor de 100 a 1) BVAB121. Además, no se ha observado una correlación entre una mayor puntuación según los criterios de Nugent y la presencia de más síntomas en mujeres, aunque hay pocos estudios realizados al respecto18.
Debido a esto, el grupo de trabajo del National Institute of Healthcare (NIH) recomienda para la definición de VB emplear una combinación de los criterios de Nugent con al menos una puntuación de 7 y un criterio de Amsel positivo, independientemente de los síntomas22.
c) Otra alternativa es la visualización con FISH de la biocapa en células descamativas en el sedimento urinario con precisión diagnóstica del 0,94, una S del 83%, una E del 97%, un valor predictivo positivo del 83% y un valor predictivo negativo del 97%21. Este método resulta adecuado para estudios clínicos y epidemiológicos, ya que la muestra es fácil de obtener.
d) No se recomienda el cultivo de GV ni el empleo de sondas específicas para GV actualmente. La tinción de Gram ha demostrado mayor E que el cultivo en ensayos recientes basados en el estudio de microbioma. El cultivo de GV no sugiere ni prueba VB o la necesidad de su tratamiento, ya que el 50% de mujeres asintomáticas presentan un cultivo positivo. La FDA recientemente ha aprobado el Max Vaginal panel (Becton-Dickinson, New Jersey, EE.UU.) para el estudio del microbioma, el cual permite realizar de 2 a 24 pruebas simultáneamente. Permite la detección de L. crispatus, L. jensenii, GV, AV, BVAB2, Megasphaera 1, Candida grupo (C. albicans, C. parapsilosis, C. dubliniensis, C. glabrata y C. krusei) y TV23.
Microorganismos en la vaginosis bacterianaEl concepto de VB como síndrome fue establecido hace muchos años, pero por técnicas de FISH se han visto biocapas donde GV es el microorganismo predominante, seguido por AV y en menor frecuencia por Bacteroides, Veillonella, Ruminococcus y el género Streptococcus12.
Aunque clásicamente se ha asociado a la presencia de GV, la VB hoy se asocia a un conglomerado de bacterias, como se expone en la tabla 51. Mediante métodos moleculares en la microbiota de vagina, vulva/labios, cérvix y útero se han detectado más de 250 especies bacterianas, levaduras, Chlamydia, Archaea, virus y protozoos24. En un estudio, se observaron hasta 6 clusters o tipos de estados comunitarios de la microbiota vaginal empleando la secuenciación genómica por Illumina (NGS): 2 asociados a una microbiota vaginal normal (una dominada por Lactobacillus iners y otra por L. crispatus) y 4 asociados a VB (dominados por P. bivia, GV, Lachnospiraceae o una mezcla de especies diferentes)24. Del mismo modo, otros autores han descrito un cluster con presencia de Lactobacillus asociado con microbiota normal, y otros 3 grupos con disbiosis con el orden Lachnospiraceae y géneros Sneathia y Prevotella como microorganismos dominantes25. Finalmente, se han realizado estudios en embarazadas y no embarazadas VIH negativas, describiéndose 5 grupos: 1) L. crispatus; 2) Lactobacillus gasseri; 3) L. iners; 4) Peptoniphilus, Prevotella y Anaerococcus spp., y elevada cantidad de GV o Ureplasma; y 5) L. jensenii. Mediante transcriptómica se ha visto que L. iners se adapta a ambientes de VB muy diferentes24,26.
Microorganismos asociados y/o encontrados en la vaginosis bacteriana
| Microorganismo | Característica y especies | Comentario |
|---|---|---|
| Gardnerella vaginalis | Bacilo grampositivo pequeño pleomórfico, en tinción de Gram se ve como bacilo gramnegativo o gram variable | Tolera pH 4-5 |
| Anaerobio facultativo | Tiene factores de virulencia | |
| No motil | Cultivable | |
| Atapobium vaginae | Coco grampositivo pequeño en pares o cadenas cortas | Es el mejor marcador de VB (> 80% de casos) |
| Anaerobio facultativo | 2,6 veces mejor que los criterios de Amsel | |
| Inmóvil | 19 veces mejor que los criterios de Nugent | |
| Raro que aparezca sin GV | ||
| Puede ser microbiota normal | ||
| Puede ser responsable de resistencia a metronidazol y explica porque reaparece en recurrencias | ||
| Bacterias asociadas a VB (BVAB)Relacionadas con el phylum Clostridium | Mediante FISH se han visto 3 especies: | En células clave BVAB1 predomina más que Mobiluncus spp. (suele ser el que se ve en la tinción de Gram) |
| -BVAB1: bacterias curvas, delgadas | Da el mal olor a pescado por poliaminas (putresceína, cadaverina y trimetilamina) | |
| -BVAB2: bacilos rectos | BVAB3 el único caracterizado y cultivado | |
| -BVAB3 (Mageeibacillus indolicus): bacilos rectos, anchos y largos | El papel de estas bacterias en la etiología de la VB no está bien estudiado | |
| Otros | ||
| Actinomyces, Eggerthella, Mobiluncus, Prevotella | Producen ácidos grasos no volátiles (AGNV) | Ácido succínico produce fermentación del ácido. Mobiluncus, ácido málico que da irritación de membranas y mucosas vaginales |
| Y ácidos grasos volátiles (AGV) | Ácido fórmico y ácidos acéticos | |
| Megasphaera, Propionibacterium | Ácidos propiónicos | |
| Mobiluncus, Prevotella | Prevotella (P. amnii, P. bivia, P. buccalis, P. corporis, P. disiens) | Ácidos isobutílico, valérico e isovalérico |
| Anaerococcus spp., Bacteroides spp. (B. levii, B. ureolyticus), Dialister spp., Finegoldia spp., Fusobacterium nucleate, Leptotrichia spp., Peptococcus, Peptostreptococcus, Sneathia spp., Streptoccocus grupo viridiansMycoplasma hominisUreaplasma urealyticum | Peptostreptococcus (P. anaerobius, P. prevotii, P. tetradius) | |
| Streptoccocus grupo viridans (S. acidominimus, S. constellatus, S. morbillorum, S. mutans, S. sanguis II) |
Existe gran variabilidad entre estos estudios respecto al muestreo, el almacenaje de muestras, el procesamiento de las mismas, el kit de extracción del ADN, las variaciones técnicas en la amplificación por PCR y el uso de diferentes primers, así como respecto a los métodos estadísticos empleados. Además, no se tuvieron en cuenta los cambios debidos a la menstruación, actividad sexual, espermicidas, duchas y antibióticos.
En resumen, los estudios moleculares han demostrado, al igual que lo hicieran previamente los estudios clásicos mediante el cultivo, que hay en la vagina sana una alta presencia de Lactobacillus y que no es posible asociarla a una sola composición de microbiota24. Así, se pueden definir distintos cluster de microbiota vaginal, cada uno correlacionado con el predominio de uno o más microorganismos9. Si se comparan los criterios de Nugent con el microbioma vaginal definido molecularmente, se observa una buena aunque no una total correlación27.
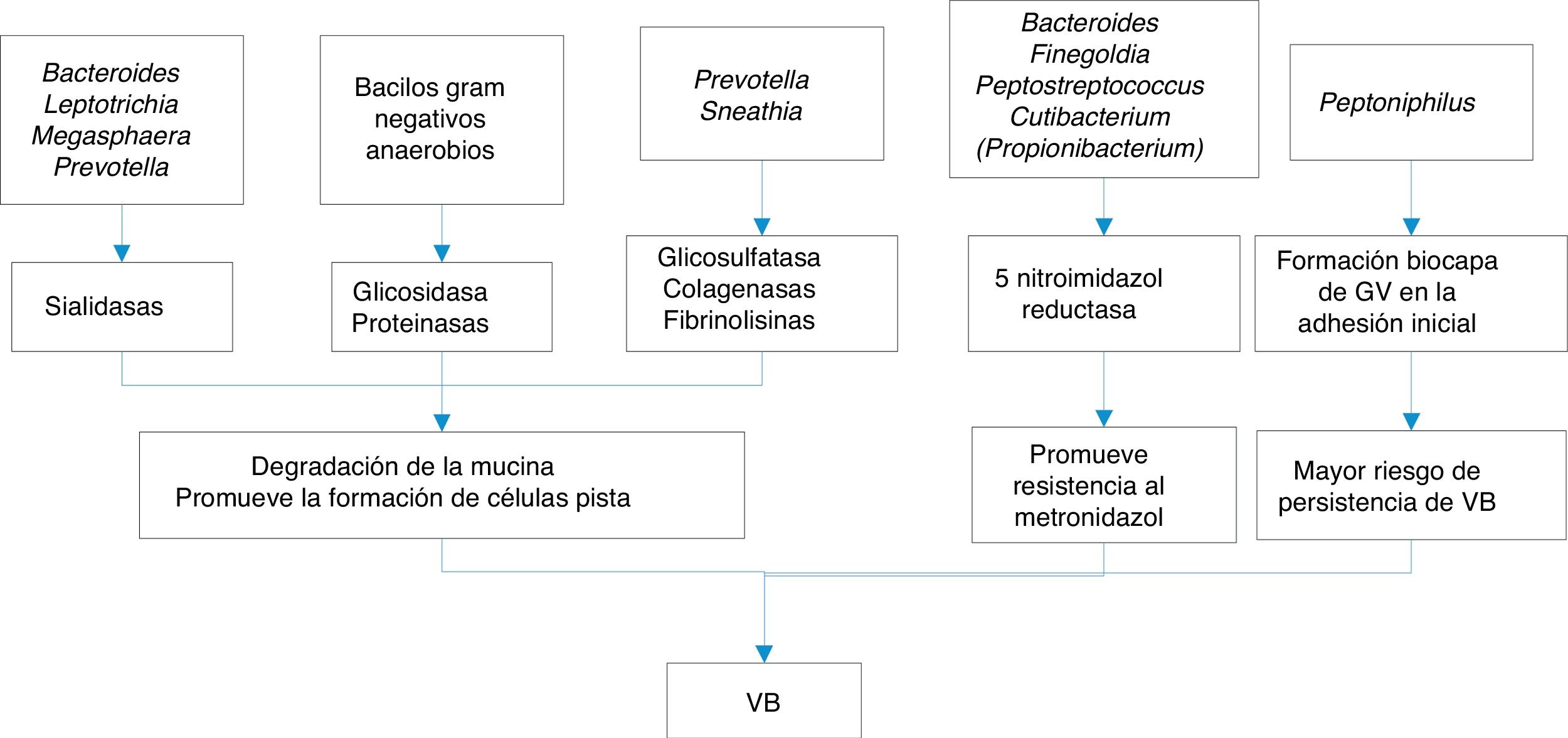
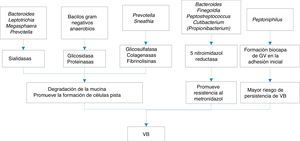
Las sustancias que liberan todo este conglomerado de bacterias que constituyen las biocapas y que pueden estar implicadas en la VB son variadas:
- a)
Inmunomoduladores como las hemolisinas, ácidos grasos volátiles (AGV) y ácidos grasos no volátiles (AGNV), proteasas y sialidasas. Las sialidasas inhiben la IgA sérica, aumentando el riesgo de parto prematuro por citoxinas, y además aumentan las IL-1b, IL-8 y TNF-alfa, que junto con la prolidasa confieren una mayor susceptibilidad a las infecciones por VIH y virus del herpes simple tipo 2 (VHS2).
- b)
Sustancias proinflamatorias, como el LPS, que actúa sobre citocinas, IL-1b, IL-6 y TNF-alfa, favoreciendo el parto prematuro.
En la figura 1 se exponen algunos de los mecanismos de la producción de VB.
Por análisis de proteómica, se ha detectado una alteración del contenido de proteínas del líquido cervicovaginal en la VB: elastasa de neutrófilos, kaliocina-1, defensina-1 de neutrófilos, regiones C de la cadena lambda 2 de Ig y proteína S100-A7. Esto parece indicar que la alteración de la microbiota es capaz de interferir en los mecanismos de la respuesta inmune28.
Respecto al papel de GV, se ha observado una heterogeneidad fenotípica y genotípica, además de una variabilidad en el potencial de virulencia. Se han descrito 4 clades para GV que se han intentado correlacionar con los clusters de microbiota vaginal. La hipótesis es que en la vagina hay una colonización por distintos clades de GV que expresan diferentes determinantes de virulencia27. El papel de algunos factores de virulencia como la hemolisina o vaginolisina (que es una citolisina dependiente de colesterol), sialidasa o prolidasa no está claro. Por otro lado, la clade A de GV es lipasa positiva y la clade B es sialidasa positiva, lo que podría indicar que diferentes clades están implicados o bien en la resolución de la VB restableciendo los Lactobacillus, o, por el contrario, en la transición a infección por levaduras o VA1.
GV aparece en la vagina de dos formas: una en forma dispersa (106-8 células por gramo en el líquido vaginal) y otra en la forma infectiva o transmisible en forma cohesiva de una biocapa (1010-11 células por gramo)29. Este patrón se ve en hombres también y en semen. No está claro si se trata de cepas diferentes de GV, aunque todas aquellas que forman parte de las biocapas presentan genes de síntesis de exopolisacárido14.
Tampoco existen datos concretos de los receptores celulares de superficie para GV, aunque diversos estudios demuestran diferencias significativas en la capacidad de unión y citotoxicidad entre las cepas patógenas y no patógenas de este microorganismo30,31. Diversos ecotipos de GV son capaces de alterar la adhesión de Lactobacillus, mediada por glicosaminoglicanos de superficie celular, gracias a la producción de glicosidasas que degradan dichos receptores31,32. Además, la producción de sialidasas y vaginolisina es capaz de alterar las células epiteliales, afectando, por tanto, a la microbiota unida33. Por otro lado, los Lactobacillus son capaces de afectar tanto a la unión como a la internalización de GV interfiriendo con su pili y con proteínas de unión a fibronectina30.
¿Cómo se produce la protección y la alteración del ecosistema de la vagina?Los lactobacilos juegan un papel clave en la protección de la mucosa vaginal y en la inhibición de la colonización por bacterias patógenas mediante una serie de mecanismos1:
- a)
Adhesión a receptores glicolipídicos en la superficie de las células del epitelio vaginal. La presencia de altos volúmenes de inóculo de Lactobacillus en el fluido vaginal de mujeres sanas premenopáusicas (107-108ufc/g) evita la unión de los patógenos genitourinarios a dichos receptores mediante un mecanismo de exclusión competitiva.
- b)
Coagregación de Lactobacillus con patógenos y autoagregación o quorum sensing.Ambos mecanismos contribuyen a la formación de la biocapa en la vagina sana y a la inhibición del crecimiento de los patógenos. En un estudio de 3 poblaciones vaginales de lactobacilos (Lactobacillus acidophilus, L. gasseri y L. jensenii), se demostró la capacidad de autoagregación mediada por proteínas de superficie o lipoproteínas. Además, las 3 cepas se adhirieron fuertemente a las células epiteliales vaginales mediante glicoproteínas (L. acidophilus y L. gasseri) e hidratos de carbono (L. jensenii), mientras que los lactobacilos recuperados de otras fuentes, como los productos lácteos, se adhirieron en números significativamente menores, lo que indica que la adherencia es una propiedad idiosincrásica de los lactobacilos vaginales34.
- c)
Acidificación vaginal con la producción de ácido láctico. Estudios metabolómicos24 han visto producción de ácido láctico, ácido acético, glicerol y otros en la vagina sana, mientras que en VB hay 2-hidroxivalerato, gammahidroxibutirato o succinato. Se podría desarrollar una prueba diagnóstica para detectar gammahidoxibutirato en torundas vaginales con un pH elevado.
- d)
La producción de H2O2, bacteriocinas y biosurfactantes contribuye a la inhibición del crecimiento de algunos patógenos.
Por otro lado, los factores que alteran el ecosistema serían:
- a)
Excesivas duchas vaginales. Las duchas vaginales35 se definen como el uso de una solución líquida en la vagina, y se calcula que son utilizadas por el 27-59% de las mujeres en función de diferencias étnicas, culturales y educacionales. La mayoría de estudios desaconsejan su uso, aunque algunos ven beneficios con el uso de ácido acético para eliminar el semen y la posible transmisión de patógenos, el mal olor vaginal y para aliviar la irritación vaginal. De todas maneras, se sabe que aumenta de media 2,1 veces el riesgo de desarrollar una VB (uso de duchas vaginales ≥ 1 vez por mes aumenta el riesgo en 1,6; ≥ 2 veces por mes, aumenta en 2,5; y duchas en los 2 últimos meses aumentan el riesgo en 2,9 veces).
- b)
Uso de espermicidas (nonoxinol-9).
- c)
Antibióticos.
- d)
Fagos (no probado). Se postula que hay transmisión sexual de fagos con capacidad de destruir la población de Lactobacillus. El tabaco se comporta como un factor favorecedor, mediante la producción de promotores de tipo epóxido diolbenzopirona.
Se han propuesto 3 modelos explicativos de la VB1, y todos ellos están de acuerdo en que hay: disminución de Lactobacillus spp., exposición y crecimiento de BVAB y otras bacterias relacionadas con la VB, y aumento del pH vaginal.
Los 3 modelos propuestos son: a) modelo de la depleción de Lactobacillus spp., b) modelo del patógeno primario y c) modelo del patógeno polimicrobiano:
- a)
En el primero, se establece que hay una disminución de Lactobacillus spp. productores de H2O2 previo al aumento del pH vaginal que dispara el sobrecrecimiento de anaerobios productores de VB. Sin embargo, en contra de esta teoría está el que hay mujeres sanas sin Lactobacillus y, por otro lado, hay mujeres en las que se aísla AV que producen ácido láctico. Según este modelo, una estrategia de tratamiento sería el uso de probióticos y agentes acidificantes.
- b)
En el modelo del patógeno primario, se introduciría un patógeno como GV por actividad sexual que crea las condiciones, debido a sus factores de virulencia y formación de la biocapa, para el crecimiento de una microbiota intermedia y, finalmente, el establecimiento de la microbiota asociada a VB. En contra de este modelo, está el hecho de que GV se detecta también en mujeres sanas sin actividad sexual, aunque podría tratarse de genotipos y biotipos diferentes (p. ej., el biotipo 5 se ve en mujeres sanas). Según este modelo se podrían usar agentes que alterasen la biocapa de GV como tratamiento.
- c)
En el modelo del patógeno polimicrobiano, sería un conjunto de bacterias de VB las desencadenantes de la colonización tras la actividad sexual, sin presencia de una microbiota intermedia, con sinergismos entre ellas que disminuirían la población de Lactobacillus. En este caso y en contra de este modelo, está la menor virulencia de estas otras bacterias de VB respecto a la que presenta GV. El tratamiento en este modelo debería incluir agentes que alterasen la biocapa polimicrobiana.
- d)
Existen otros modelos o teorías propuestas aparte de los 3 anteriores:
d1) Bacterias relacionadas con VB se internalizarían en las células epiteliales, de forma que microorganismos como GV, AV y P. bivia escaparían a las defensas y a la acción de antibióticos como clindamicina y metronidazol. No hay evidencias de este mecanismo.
d2) El semen alcalino disminuiría la acidez de la vagina al aumentar el pH después del coito, favoreciendo el crecimiento de GV. Se podría en este caso definir como una infección asociada sexualmente más que como una ITS stricto sensu.
d3) Polimorfismos genéticos favorecerían la VB. No hay datos.
Formación de la biocapa en la vaginosis bacterianaComo en otras localizaciones, por ejemplo en la biocapa oral, la formación de la biocapa en VB tiene ventajas para GV: aumenta su tolerancia al H2O2 en 5 veces y al ácido láctico en 4-8 veces1. Las etapas de la formación de la biocapa se detallan en la tabla 6.
Proceso y etapas cronológicas de la formación de la biocapa en la vaginosis bacteriana
| Fase de la formación | Esquema de los procesos |
|---|---|
| 1.o Adhesión | GV expresa los dominios «Rib» por el gen bapL codificado por la proteína BapL y forma la biocapa como especie precursora |
| Probablemente intervienen también Lactobacillus iners y Peptoniphilus spp. | |
| 2.o Formación de microcolonias y coagregación | A. Se forman microcolonias antes de producir la matriz polimérica no extracelular (ESP) |
| B. A continuación se produce la coagregación con la segunda especie colonizadora, de dos formas: | |
| a) por cascada en suspensión antes de unirse a la superficie (probable mecanismo de Mobiluncus spp. y quizás de Atapobium vaginae, Fusobacterium nucleatum, Escherichia coli o Enterococcus faecalis) | |
| b) Después de unirse a la especie primaria | |
| C. Posteriormente se unen otras especies | |
| 3.o Maduración de la biocapa | GV libera el ADN extracelular que estimula la producción de ESP controlada por moléculas quizás de quorum sensing y se forma la biocapa en forma de una especie de ladrillos |
| GV también puede codificar glicosiltransferasas de las familias I, II y IV envueltas en la producción de ESP | |
| 4.o Dispersión | La hipótesis es que se produce de forma: |
| A. Activa, proceso esencial en la VB durante la menstruación o cuando crecen las bacterias relacionadas con la VB por aumento del pH vaginal con la sangre menstrual y poliaminas | |
| B. Pasiva, por erosión del epitelio y desprendimiento debido a sialidasa, glicosulfatasa, glicosidasa, proteinasa, colagenasa y fibrinolisina |
Los síntomas que aparecen en la VB son: exudado homogéneo (90%) y olor vaginal a pescado, durante la menstruación, después de relación sexual y con mínimo picor o irritación. Hay irritación perivaginal y rara disuria o dispareunia, dolor abdominal ocasional, un exudado introitus, no hay eritema o edema de labios y vulva.
Como complicaciones están descritas la corioamnionitis, endometritis, salpingitis y EPI (el tratamiento de la VB reduce la EPI después de aborto inducido). En embarazadas puede desencadenar: aborto espontáneo, rotura prematura de membranas, parto prematuro, niño pretérmino, recién nacido de bajo peso, endometritis posparto e infecciones de la herida posquirúrgica9. También aumenta el riesgo de adquirir otras ITS (Chlamydia trachomatis, Neisseria gonorrhoeae, VHS2 y VIH) y de transmisión de VIH a las parejas masculinas. Además, tiene un impacto negativo en la autoestima, las relaciones sexuales y la calidad de vida.
TratamientoEl tratamiento estándar se realiza con metronidazol o clindamicina (tabla 7). A corto plazo se obtiene una curación del 80-90%, aunque el 50-70% de las mujeres recurren a los 3-6 meses. A largo plazo se logra una curación de hasta el 80%, por lo que conviene confirmar el diagnóstico en estos casos. La recurrencia no está claro si es debida a: a) resistencia (no parece probable ya que el metronidazol es activo frente a gramnegativos anaerobios, Mobiluncus mulieris y menos activo frente a GV, cocos anaerobios, y Mobiluncus curtisii) e inactivo frente a Mycoplasma hominis y AV; b) recurrencia o reinfección, que parece más probable, por varios factores posibles aunque ninguno demostrado fehacientemente: b1) una fuente exógena (pareja sexual hombre o mujer), b2) fuente endógena (reservorio en recto), b3) formación de biocapas, b4) factores de riesgo como duchas vaginales y el tabaco, b5) fallo de recolonización o b6) activación de fagos23. No hay evidencias de las complicaciones asociadas a VB, por lo que el tratamiento estándar solamente se recomienda en mujeres sintomáticas.
Tratamientos establecidos de la vaginosis bacteriana
| Antimicrobiano | Dosis | Duración en días | Porcentaje de curación (%) | Grado de recomendación |
|---|---|---|---|---|
| Metronidazol | 500mg/oral/2 veces día | 7 | 75-85 | A |
| Metronidazol | 0,75% gel (1 aplicación de 5g intravaginal una vez al día) | 5 | 75-85 | A |
| Alternativas: | ||||
| Tinidazol | 1g/día | 5-7 | 75-85 (disminuye efectos gastrointestinales y número de dosis) | B |
| 2g | Dosis única | B | ||
| Metronidazol | 2g/oral | Dosis única | A | |
| Clindamicina | 300mg/oral/2 veces día | 7 | A | |
| Recurrencias: | ||||
| Metronidazol | 500mg/2 veces al día | 10-14 | El uso de preservativo puede reducir las recurrencias en mujeres activas sexualmente | A |
| 0,75% gel (1 aplicación de 5g intravaginal una vez al día) | 10, después 3-6 meses 2 veces por semana | A | ||
| Embarazadas sintomáticas: | ||||
| Metronidazol | 500mg/oral/2 veces día | 7 | No se recomienda tratamiento tópico y hay alta recurrencia | A |
| Clindamicina | 300mg/oral/2 veces al día | 7 | A | |
En general, al mes hay un 58-92% de curación. Ningún nitroimidazol ha demostrado superioridad frente a otros de su misma familia. La combinación de uso oral más vaginal parece más eficaz (80-86% de curación frente al 75-86% sin combinación). El uso oral o local de clindamicina o metronidazol presenta los mismos porcentajes de curación36.
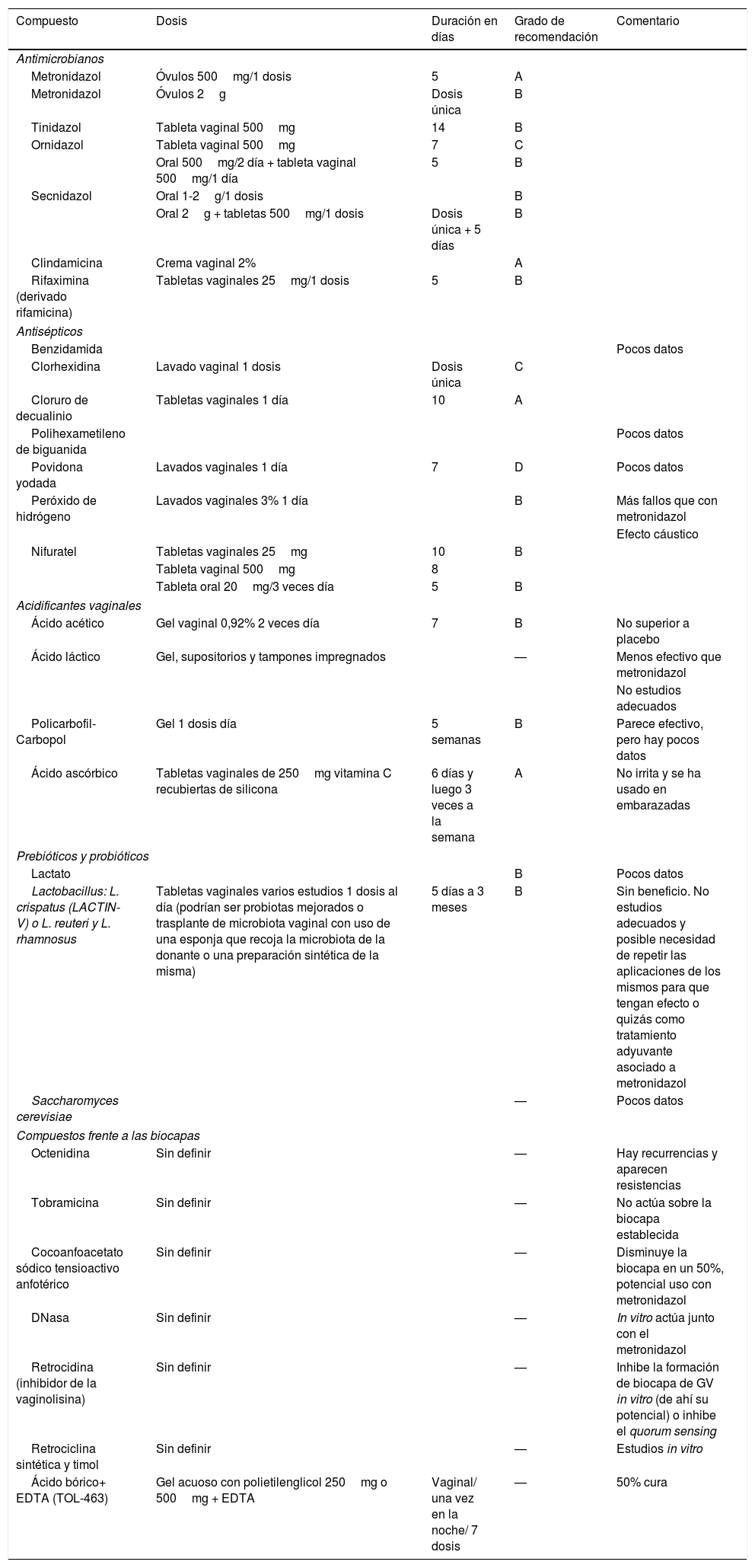
Debido a estas tasas de curación se han buscado distintas pautas de tratamiento o nuevas moléculas que actuarían a la luz de los nuevos conocimientos de cómo se produce la patogénesis en VB, como es el caso de la formación de biocapas (tabla 8)23,35-38.
Tratamientos alternativos ensayados en la vaginosis bacteriana
| Compuesto | Dosis | Duración en días | Grado de recomendación | Comentario |
|---|---|---|---|---|
| Antimicrobianos | ||||
| Metronidazol | Óvulos 500mg/1 dosis | 5 | A | |
| Metronidazol | Óvulos 2g | Dosis única | B | |
| Tinidazol | Tableta vaginal 500mg | 14 | B | |
| Ornidazol | Tableta vaginal 500mg | 7 | C | |
| Oral 500mg/2 día + tableta vaginal 500mg/1 día | 5 | B | ||
| Secnidazol | Oral 1-2g/1 dosis | B | ||
| Oral 2g + tabletas 500mg/1 dosis | Dosis única + 5 días | B | ||
| Clindamicina | Crema vaginal 2% | A | ||
| Rifaximina (derivado rifamicina) | Tabletas vaginales 25mg/1 dosis | 5 | B | |
| Antisépticos | ||||
| Benzidamida | Pocos datos | |||
| Clorhexidina | Lavado vaginal 1 dosis | Dosis única | C | |
| Cloruro de decualinio | Tabletas vaginales 1 día | 10 | A | |
| Polihexametileno de biguanida | Pocos datos | |||
| Povidona yodada | Lavados vaginales 1 día | 7 | D | Pocos datos |
| Peróxido de hidrógeno | Lavados vaginales 3% 1 día | B | Más fallos que con metronidazol | |
| Efecto cáustico | ||||
| Nifuratel | Tabletas vaginales 25mg | 10 | B | |
| Tableta vaginal 500mg | 8 | |||
| Tableta oral 20mg/3 veces día | 5 | B | ||
| Acidificantes vaginales | ||||
| Ácido acético | Gel vaginal 0,92% 2 veces día | 7 | B | No superior a placebo |
| Ácido láctico | Gel, supositorios y tampones impregnados | — | Menos efectivo que metronidazol | |
| No estudios adecuados | ||||
| Policarbofil-Carbopol | Gel 1 dosis día | 5 semanas | B | Parece efectivo, pero hay pocos datos |
| Ácido ascórbico | Tabletas vaginales de 250mg vitamina C recubiertas de silicona | 6 días y luego 3 veces a la semana | A | No irrita y se ha usado en embarazadas |
| Prebióticos y probióticos | ||||
| Lactato | B | Pocos datos | ||
| Lactobacillus: L. crispatus (LACTIN-V) o L. reuteri y L. rhamnosus | Tabletas vaginales varios estudios 1 dosis al día (podrían ser probiotas mejorados o trasplante de microbiota vaginal con uso de una esponja que recoja la microbiota de la donante o una preparación sintética de la misma) | 5 días a 3 meses | B | Sin beneficio. No estudios adecuados y posible necesidad de repetir las aplicaciones de los mismos para que tengan efecto o quizás como tratamiento adyuvante asociado a metronidazol |
| Saccharomyces cerevisiae | — | Pocos datos | ||
| Compuestos frente a las biocapas | ||||
| Octenidina | Sin definir | — | Hay recurrencias y aparecen resistencias | |
| Tobramicina | Sin definir | — | No actúa sobre la biocapa establecida | |
| Cocoanfoacetato sódico tensioactivo anfotérico | Sin definir | — | Disminuye la biocapa en un 50%, potencial uso con metronidazol | |
| DNasa | Sin definir | — | In vitro actúa junto con el metronidazol | |
| Retrocidina (inhibidor de la vaginolisina) | Sin definir | — | Inhibe la formación de biocapa de GV in vitro (de ahí su potencial) o inhibe el quorum sensing | |
| Retrociclina sintética y timol | Sin definir | — | Estudios in vitro | |
| Ácido bórico+ EDTA (TOL-463) | Gel acuoso con polietilenglicol 250mg o 500mg + EDTA | Vaginal/ una vez en la noche/ 7 dosis | — | 50% cura |
En el caso del uso de lactobacilos, las cepas ideales de lactobacilos con potencial probiótico serían aquellas que produjesen ácido láctico, H202, que formen biocapas y cuya concentración mínima inhibitoria (CMI) para metronidazol, clindamicina y nonoxilol-9 sea alta. Los lactobacilos endógenos de la vagina no han presentado potencial carcinogenético ni codifican determinantes de resistencia a los antibióticos transmisibles a la microbiota presente, a pesar de contener numerosos plásmidos. Además, no se han descrito lactobacilos que produzcan patología genital y muy raramente son causantes de infecciones en otras zonas anatómicas39-41.
En la tabla 9 se exponen las evidencias actuales del diagnóstico y tratamiento de la VB36.
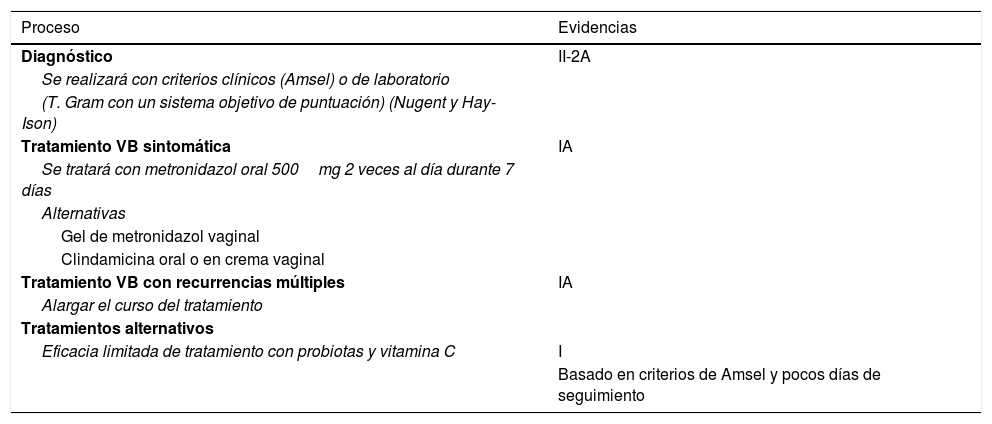
Evidencias en el diagnóstico y tratamiento de la vaginosis bacteriana
| Proceso | Evidencias |
|---|---|
| Diagnóstico | II-2A |
| Se realizará con criterios clínicos (Amsel) o de laboratorio | |
| (T. Gram con un sistema objetivo de puntuación) (Nugent y Hay-Ison) | |
| Tratamiento VB sintomática | IA |
| Se tratará con metronidazol oral 500mg 2 veces al día durante 7 días | |
| Alternativas | |
| Gel de metronidazol vaginal | |
| Clindamicina oral o en crema vaginal | |
| Tratamiento VB con recurrencias múltiples | IA |
| Alargar el curso del tratamiento | |
| Tratamientos alternativos | |
| Eficacia limitada de tratamiento con probiotas y vitamina C | I |
| Basado en criterios de Amsel y pocos días de seguimiento |
En conclusión, se ha producido un avance importante en el conocimiento de estas dos entidades clínicas que permite un mejor manejo y diagnóstico a la luz de los nuevos estudios del microbioma vaginal.
Conflicto de InteresesNinguno.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: https://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-formacion