La ribavirina es una molécula con actividad antiviral sobre diferentes virus. Ha encontrado su hueco en la práctica clínica de forma casi exclusiva para el tratamiento del virus de la hepatitisC, pero existen otras enfermedades que podrían beneficiarse de su empleo. Su disponibilidad para administración por vía oral, por vía intravenosa e inhalada es una característica beneficiosa. En este trabajo se realiza una revisión de las indicaciones en las principales agencias del medicamento (española, europea y americana), así como de otras posibles indicaciones, principalmente sobre fiebres hemorrágicas y coronavirus.
Ribavirin is a molecule with antiviral activity against different viruses. In clinical practice, it has made its niche almost exclusively for the treatment of the hepatitisC virus. However, there are other diseases in which it could be of benefit and it has the advantage of being suitable for oral, intravenous and inhaled administration. We conducted a review of the indications of the main drug agencies (Spanish, European and American) and other possible indications, mainly haemorrhagic fevers and coronavirus.
La ribavirina es una molécula que se sintetizó por vez primera en 1972. Es conocida también con el nombre de Virazole o de 1-f8-D-Ribofuranosil-1,2,4-triazol-3-carboxamida. Se trata de un nucleósido pirimidínico que fue diseñado como agente de amplio espectro in vitro, y la primera descripción se publicó en la revista Science1. En dicho trabajo se detallaba la acción tanto sobre virus DNA (virus herpes1 y2, citomegalovirus murino, virus vacunal, adenovirus tipo3) como RNA (virus similar a rabia, virus responsable del mixoma, virus parainfluenza tipos1 y3, gripeA yB, rhinovirus1A, 13 y 56, CoxsackieB, poliovirus tipo2, virus de la estomatitis vesicular y Semliki Forest). Posteriormente se conoció su actividad sobre otras enfermedades virales y ha encontrado su hueco en la práctica clínica de forma casi exclusiva para el tratamiento del virus de la hepatitisC (VHC).
En el presente trabajo se ha realizado una revisión de la bibliografía sobre la base de datos Pubmed (hasta el 31 de diciembre de 2017) cruzando (en inglés) la palabra clave «ribavirin» con las correspondientes a los virus o enfermedades siguientes: adenovirus, hantavirus, syncytial respiratory virus, Lassa fever, Crimean Congo hemorrhagic fever, Argentinian hemorrhagic fever y coronavirus. Se han revisado los artículos escritos en inglés o en castellano, seleccionándose de forma preferente para cada enfermedad los metaanálisis; en caso de que no existieran, se han revisado los ensayos clínicos faseI, II, III yIV. Finalmente, si no se encontraban en las búsquedas previas, se realizaba una revisión de los casos o series de casos publicadas. De los artículos revisados, se obtenían en algunos casos referencias a otros trabajos.
Mecanismo de acciónSe han propuesto diferentes mecanismos de acción para esta molécula, y lo más probable es que actúe de diversas formas en virus diferentes2. El primer mecanismo que se ha planteado es la interferencia en la síntesis de novo de los derivados de la guanosina (especialmente guanosín trifosfato [GTP]). La inosina monofosfato deshidrogenasa cataliza la formación de xantina monofosfato a partir de la inosina monofosfato, para posteriormente continuar la vía de síntesis de los derivados de la guanosina. La ribavirina monofosfato es capaz de inhibir de forma competitiva y potente dicha enzima, disminuyendo las reservas de estos nucleótidos (o nucleósidos) a la mitad en las células tratadas. La actividad antiviral paralela a la depleción de reservas de GTP se ha demostrado en estudios con el virus de la fiebre amarilla y paramyxovirus como el virus respiratorio sincitial (VRS). En segundo lugar, se ha sugerido una actividad inmunomoduladora, indicando que la ribavirina pudiera aumentar la actividad de los linfocitosT, y especialmente de los linfocitosTh. Esta hipótesis se basaba en la observación de que durante el tratamiento con ribavirina en pacientes infectados por VHC podía disminuir la citólisis sin modificar la carga viral circulante; por tanto, no tendría un efecto exclusivamente antiviral. Apoyaba esta hipótesis la observación de que un enantiómero de la ribavirina (levovirina) no presenta actividad antiviral directa, siendo capaz también de producir una inducción de la respuestaTh1 en el modelo murino. Sin embargo, el efecto inmunomodulador no se ha podido reconocer in vivo, e incluso en modelos matemáticos diseñados al respecto se concluye que el efecto se basa en actividad antiviral directa. Otro mecanismo que se ha propuesto es el de la inhibición directa de la polimerasa. El principal metabolito intracelular de la ribavirina es el ribavirín trifosfato (RTP). De esta forma, podría ser un inhibidor competitivo de otras bases nitrogenadas similares, como adenosín trifosfato (ATP) o GTP. Este efecto se ha observado en estudios realizados con virus gripal, reovirus y el virus de la estomatitis vesicular. Algunos virus RNA contienen una estructura con 7-metilguanosina, que es esencial para la estabilidad del RNA y que está sintetizada en tres procesos catalíticos diferentes. En otros virus, el proceso de traslación está mediado por una molécula conocida como eIF4E. La molécula de ribavirina podría interaccionar con las enzimas responsables del capping (síntesis de caperuza del RNA) o unirse a eIF4E impidiendo el inicio de la traslación. Este mecanismo podría ser el responsable de la actividad antiviral observada en algunos virus (Lassa, SARS). Por último, se ha propuesto un mecanismo de mutagénesis. Dada la similitud estructural, la incorporación de ribavirina en la cadena de RNA sería posible y produciría virus mutantes durante la replicación. Pero no solo alteraría la cadena «original» sustituyendo una GTP por RTP, sino que la unión a las bases complementarias citidina y timidina (o uracilo) tiene la misma eficacia. Esto se debe a la disposición espacial y a la flexibilidad en la rotación de un grupo carboxamida. El efecto mutagénico de la ribavirina se ha demostrado en estudios con poliovirus, virus boca-mano-pie, West Nile y hantavirus.
Indicaciones en ficha técnicaComo se ha comentado anteriormente, el empleo clínico de la ribavirina está casi exclusivamente limitado al tratamiento de la infección por el VHC. Sin embargo, cuando se realiza una revisión de las indicaciones en las principales agencias del medicamento (Agencia Española del Medicamento, Agencia Europea del Medicamento y Food and Drug Administration [FDA] estadounidense), pueden encontrarse otras indicaciones aprobadas menos conocidas.
En la página web de la Agencia Española del Medicamento3 se encuentra el fármaco Virazole, en forma de viales para inhalación respiratoria. No se hace mención a la indicación específica, indicándose que el fármaco no está comercializado actualmente en España y que existen problemas con el suministro. Se empleaba en aerosol en niños con infección grave del tracto respiratorio inferior causado por VRS. El tratamiento consistía en su nebulización durante 12-18h por un período de 3 a 7días.
En la Agencia Europea del Medicamento4 se encuentra también, aparte de la indicación para VHC, dos aplicaciones de la ribavirina que han sido investigadas: infecciones por adenovirus e infecciones por hantavirus. En ambos casos la decisión adoptada ha sido la retirada de su consideración en estas indicaciones.
Por último, en la FDA5 se indica la aprobación de Virazole para nebulización, aunque no especifica las enfermedades.
A continuación se revisa la evidencia clínica de la efectividad de ribavirina para tratar la infección por VRS, adenovirus y hantavirus.
Virus respiratorio sincitialExiste un metaanálisis realizado por la Cochrane Database System Review6 en relación con el uso de ribavirina en infecciones respiratorias bajas en niños y adolescentes, con dos actualizaciones posteriores y una retirada en 2010. La última revisión consiste, pues, en la publicada en 2007. En ella se llega a la conclusión de que, tras analizar 12 ensayos clínicos, la ribavirina no es eficaz en la reducción de la mortalidad ni en el desarrollo de deterioro respiratorio; no obstante, se observa una reducción de la estancia hospitalaria y de días de ventilación mecánica (aproximadamente 2días en ambos casos).
Otro aspecto diferente de la utilización de ribavirina en trasplantados era el tratamiento de infecciones respiratorias por VRS. Shah y Chemaly7 realizaron una revisión de la literatura acerca de los trabajos realizados en adultos trasplantados con infección por VRS y publicados entre 1980 y 2010. Evaluaron 26 estudios tanto prospectivos como retrospectivos (ensayos clínicos aleatorizados y observacionales) cuya variable principal fuera la mortalidad atribuida a VRS o progresión de la enfermedad. En estos trabajos aparecía el empleo de ribavirina en cualquier forma (aerosolizada, oral o intravenosa). La conclusión global es que el empleo de ribavirina (asociada o no a inmunoglobulinas) disminuía la progresión a enfermedad de vías bajas y disminuía la mortalidad. La ribavirina inhalada era útil, pero sobre todo era más efectiva asociada a inmunoglobulina, aunque su difusión en el parénquima consolidado podía estar disminuida. El coste era el principal inconveniente de esta terapia (aproximadamente 50.000$ por paciente).
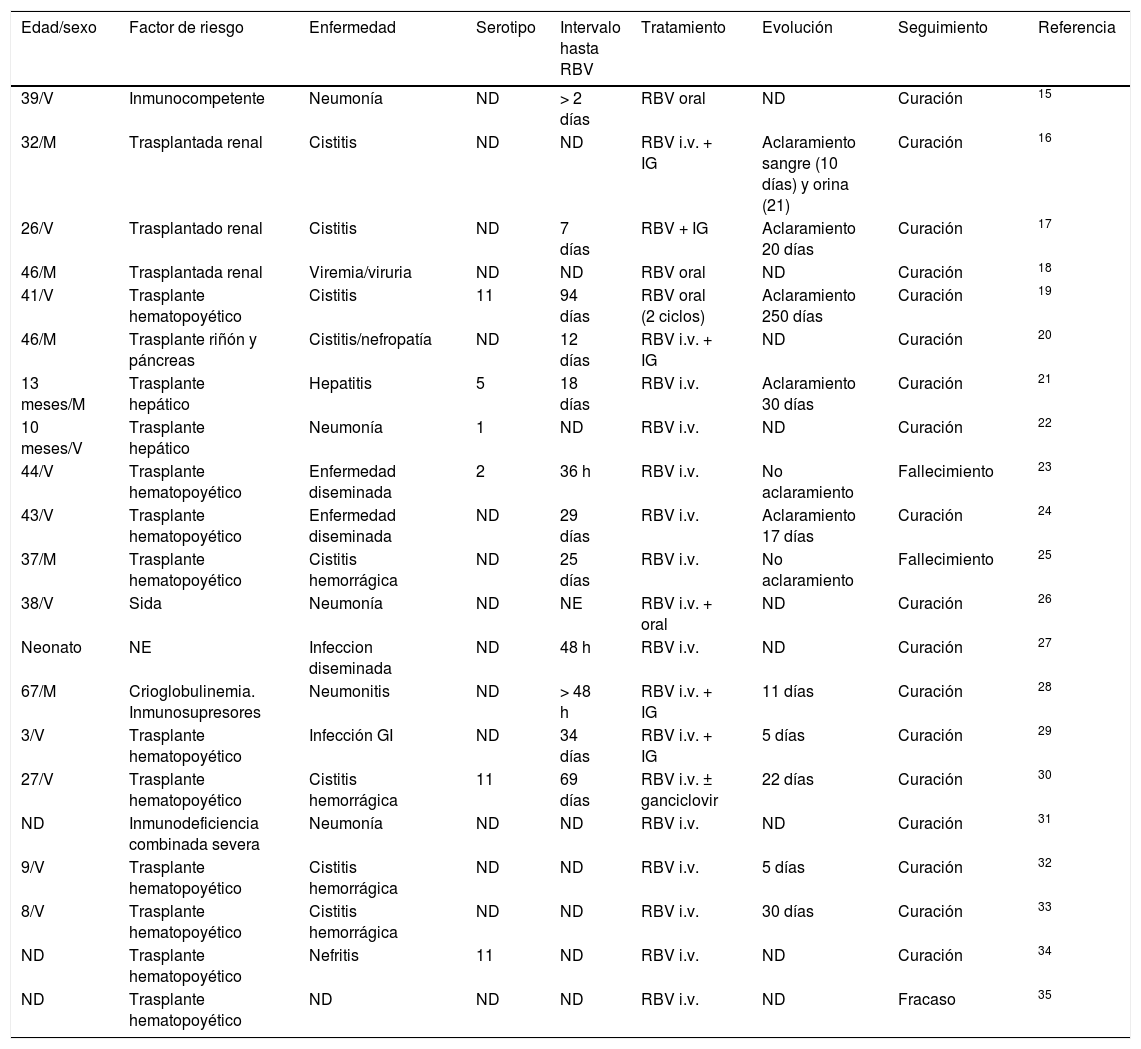
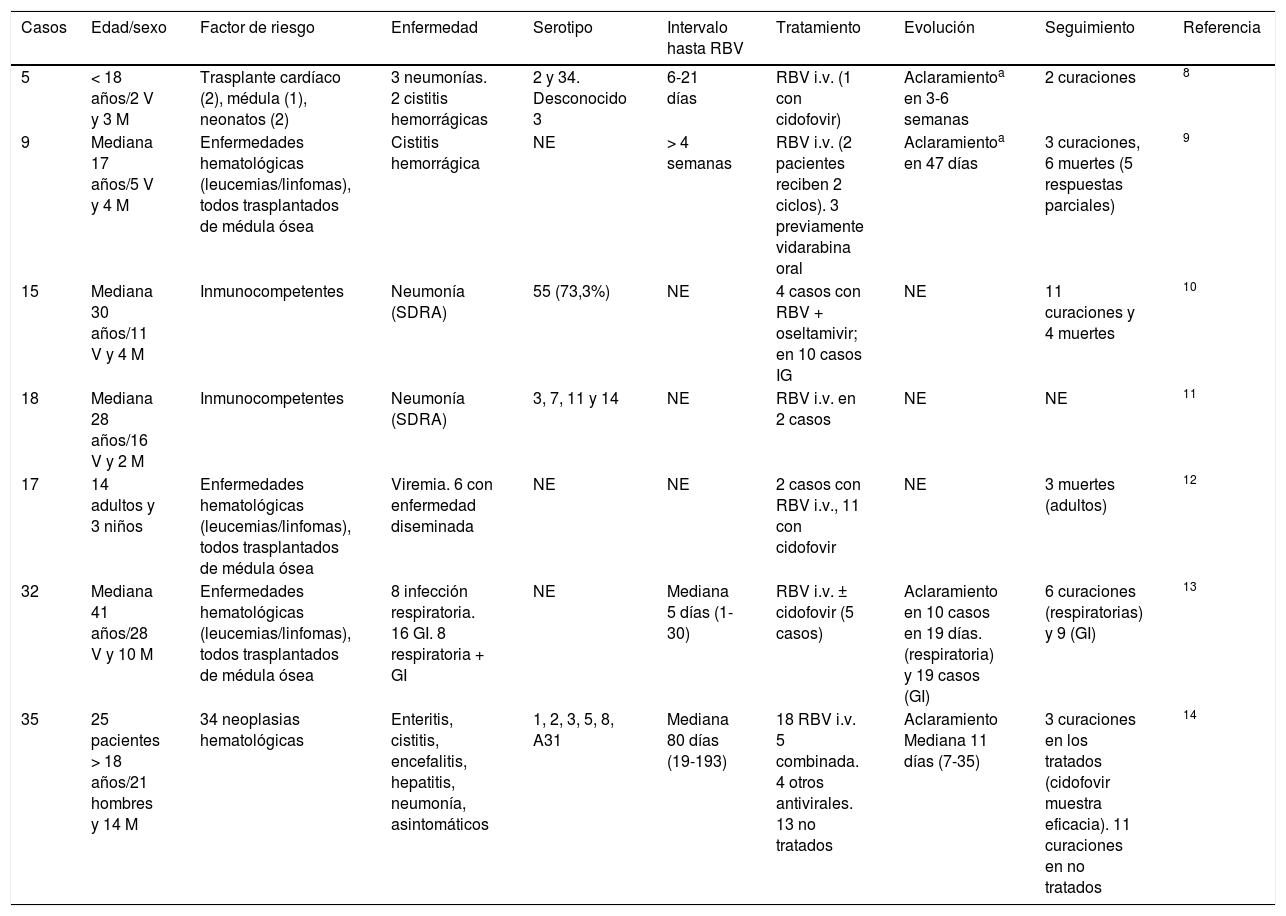
AdenovirusEn primer lugar hay que destacar que, cuando se revisa la literatura publicada (109 artículos en Pubmed), no existen metaanálisis ni ensayos clínicos. La evidencia científica está disponible a partir de series de casos y casos aislados. Existen 7 series de casos publicadas8-14 y 21 casos aislados15-35, lo que supone en total una experiencia publicada sobre menos de 150 casos (tablas 1 y 2). Como se puede observar, existe heterogeneidad tanto por parte del virus tratado (serotipos) como en las características de los pacientes (edad, sexo, factores de riesgo) como en los síndromes producidos (neumonía, cistitis, enfermedad digestiva, focal/diseminada), tiempo de evolución de enfermedad, combinación con otros fármacos… Por tanto, no se puede obtener ninguna conclusión, y por ello hasta la fecha su uso no ha sido aprobado.
Notificaciones de casos aislados de enfermedad por adenovirus tratada con ribavirina
| Edad/sexo | Factor de riesgo | Enfermedad | Serotipo | Intervalo hasta RBV | Tratamiento | Evolución | Seguimiento | Referencia |
|---|---|---|---|---|---|---|---|---|
| 39/V | Inmunocompetente | Neumonía | ND | > 2 días | RBV oral | ND | Curación | 15 |
| 32/M | Trasplantada renal | Cistitis | ND | ND | RBV i.v. + IG | Aclaramiento sangre (10 días) y orina (21) | Curación | 16 |
| 26/V | Trasplantado renal | Cistitis | ND | 7 días | RBV + IG | Aclaramiento 20 días | Curación | 17 |
| 46/M | Trasplantada renal | Viremia/viruria | ND | ND | RBV oral | ND | Curación | 18 |
| 41/V | Trasplante hematopoyético | Cistitis | 11 | 94 días | RBV oral (2 ciclos) | Aclaramiento 250 días | Curación | 19 |
| 46/M | Trasplante riñón y páncreas | Cistitis/nefropatía | ND | 12 días | RBV i.v. + IG | ND | Curación | 20 |
| 13 meses/M | Trasplante hepático | Hepatitis | 5 | 18 días | RBV i.v. | Aclaramiento 30 días | Curación | 21 |
| 10 meses/V | Trasplante hepático | Neumonía | 1 | ND | RBV i.v. | ND | Curación | 22 |
| 44/V | Trasplante hematopoyético | Enfermedad diseminada | 2 | 36 h | RBV i.v. | No aclaramiento | Fallecimiento | 23 |
| 43/V | Trasplante hematopoyético | Enfermedad diseminada | ND | 29 días | RBV i.v. | Aclaramiento 17 días | Curación | 24 |
| 37/M | Trasplante hematopoyético | Cistitis hemorrágica | ND | 25 días | RBV i.v. | No aclaramiento | Fallecimiento | 25 |
| 38/V | Sida | Neumonía | ND | NE | RBV i.v. + oral | ND | Curación | 26 |
| Neonato | NE | Infeccion diseminada | ND | 48 h | RBV i.v. | ND | Curación | 27 |
| 67/M | Crioglobulinemia. Inmunosupresores | Neumonitis | ND | > 48 h | RBV i.v. + IG | 11 días | Curación | 28 |
| 3/V | Trasplante hematopoyético | Infección GI | ND | 34 días | RBV i.v. + IG | 5 días | Curación | 29 |
| 27/V | Trasplante hematopoyético | Cistitis hemorrágica | 11 | 69 días | RBV i.v. ± ganciclovir | 22 días | Curación | 30 |
| ND | Inmunodeficiencia combinada severa | Neumonía | ND | ND | RBV i.v. | ND | Curación | 31 |
| 9/V | Trasplante hematopoyético | Cistitis hemorrágica | ND | ND | RBV i.v. | 5 días | Curación | 32 |
| 8/V | Trasplante hematopoyético | Cistitis hemorrágica | ND | ND | RBV i.v. | 30 días | Curación | 33 |
| ND | Trasplante hematopoyético | Nefritis | 11 | ND | RBV i.v. | ND | Curación | 34 |
| ND | Trasplante hematopoyético | ND | ND | ND | RBV i.v. | ND | Fracaso | 35 |
GI: gastrointestinal; IG: inmunoglobulina; i.v.: intravenosa; M: mujeres; ND: no disponible; NE: no especificado; RBV: ribavirina; V varones.
Series de casos de enfermedad por adenovirus tratada con ribavirina
| Casos | Edad/sexo | Factor de riesgo | Enfermedad | Serotipo | Intervalo hasta RBV | Tratamiento | Evolución | Seguimiento | Referencia |
|---|---|---|---|---|---|---|---|---|---|
| 5 | < 18 años/2 V y 3 M | Trasplante cardíaco (2), médula (1), neonatos (2) | 3 neumonías. 2 cistitis hemorrágicas | 2 y 34. Desconocido 3 | 6-21 días | RBV i.v. (1 con cidofovir) | Aclaramientoa en 3-6 semanas | 2 curaciones | 8 |
| 9 | Mediana 17 años/5 V y 4 M | Enfermedades hematológicas (leucemias/linfomas), todos trasplantados de médula ósea | Cistitis hemorrágica | NE | > 4 semanas | RBV i.v. (2 pacientes reciben 2 ciclos). 3 previamente vidarabina oral | Aclaramientoa en 47 días | 3 curaciones, 6 muertes (5 respuestas parciales) | 9 |
| 15 | Mediana 30 años/11 V y 4 M | Inmunocompetentes | Neumonía (SDRA) | 55 (73,3%) | NE | 4 casos con RBV + oseltamivir; en 10 casos IG | NE | 11 curaciones y 4 muertes | 10 |
| 18 | Mediana 28 años/16 V y 2 M | Inmunocompetentes | Neumonía (SDRA) | 3, 7, 11 y 14 | NE | RBV i.v. en 2 casos | NE | NE | 11 |
| 17 | 14 adultos y 3 niños | Enfermedades hematológicas (leucemias/linfomas), todos trasplantados de médula ósea | Viremia. 6 con enfermedad diseminada | NE | NE | 2 casos con RBV i.v., 11 con cidofovir | NE | 3 muertes (adultos) | 12 |
| 32 | Mediana 41 años/28 V y 10 M | Enfermedades hematológicas (leucemias/linfomas), todos trasplantados de médula ósea | 8 infección respiratoria. 16 GI. 8 respiratoria + GI | NE | Mediana 5 días (1-30) | RBV i.v. ± cidofovir (5 casos) | Aclaramiento en 10 casos en 19 días. (respiratoria) y 19 casos (GI) | 6 curaciones (respiratorias) y 9 (GI) | 13 |
| 35 | 25 pacientes > 18 años/21 hombres y 14 M | 34 neoplasias hematológicas | Enteritis, cistitis, encefalitis, hepatitis, neumonía, asintomáticos | 1, 2, 3, 5, 8, A31 | Mediana 80 días (19-193) | 18 RBV i.v. 5 combinada. 4 otros antivirales. 13 no tratados | Aclaramiento Mediana 11 días (7-35) | 3 curaciones en los tratados (cidofovir muestra eficacia). 11 curaciones en no tratados | 14 |
GI: gastrointestinal; IG: inmunoglobulina; i.v. intravenosa; M: mujeres; NE: no especificado; RBV: ribavirina; V: varones.
Series de casos de enfermedad por adenovirus tratada con ribavirina.
Respecto al empleo de ribavirina en las enfermedades producidas por hantavirus, existe un metaanálisis publicado en 2014 por Moreli et al.36 que merece una revisión profunda. Se trata de una revisión sistemática en la que se identifican 518 estudios; tras aplicar los criterios de exclusión solo se pueden analizar 7 estudios, lo que supone un total de 506 pacientes.
Se distinguen 2 grupos (fiebre hemorrágica con síndrome renal y síndrome pulmonar por hantavirus), además de dos subgrupos (estudios realizados en animales [4] o en humanos [3]). La mortalidad global era del 35%. En el grupo de síndrome pulmonar por hantavirus se identifican un estudio aleatorizado y 3 cohortes prospectivas. En los estudios animales se observó una reducción de la mortalidad en el grupo de tratamiento frente a placebo, pero no en los estudios en humanos, con una mortalidad en ambos grupos del 40%. En el grupo de fiebre hemorrágica con síndrome renal se incluyeron 3 estudios. Tanto en el subgrupo de animales como en el de humanos sí se observó una reducción en la mortalidad cuando se utilizaba ribavirina respecto a placebo (2,5% frente al 8,5% de mortalidad) con un riesgo relativo (RR) de 0,56 (0,42-0,76).
Con los datos existentes en este metaanálisis podría sugerirse que las infecciones por hantavirus del viejo mundo (fiebre hemorrágica con síndrome renal) podrían beneficiarse del empleo de ribavirina, mientras que en el síndrome pulmonar por hantavirus no sería útil. Los autores ya indican que no se ha podido considerar el tiempo desde el diagnóstico hasta la administración de la ribavirina: el síndrome pulmonar por hantavirus tiene una mortalidad del 50% y puede indicar una más rápida progresión de la enfermedad que en la fiebre hemorrágica con síndrome renal, cuya mortalidad es del 15%. Esto sería un factor clave, indicando la mayor necesidad de iniciar de forma temprana la terapia.
Otro sesgo puede haber sido la restricción de trabajos seleccionados según el idioma: solo se seleccionaron trabajos publicados en inglés, español o portugués. Dado que China es el país que más casos tiene de hantavirus con fiebre hemorrágica (en el periodo 1950-2007 se han notificado un total de 1.557.622 casos de fiebre hemorrágica con síndrome renal, con clara tendencia a disminuir la incidencia), es posible que se haya eliminado a priori información publicada en chino que modificase los resultados obtenidos.
Por último, hay que considerar que el listado de hantavirus es extenso (23, que incluyen entre otros el virus Hantaan, Seoul, Puumala y Dovabra para fiebre hemorrágica con síndrome renal, y Sinnombre y Andes en el síndrome pulmonar por hantavirus). La heterogeneidad entre virus (no solo entre síndromes) puede condicionar los resultados. Esto es lo que puede señalar un trabajo reciente realizado para evaluar la eficacia y la seguridad de la ribavirina en el tratamiento de la fiebre hemorrágica con síndrome renal producida por el virus Puumala37, que no encuentra beneficio del uso de ribavirina. Se trata de un estudio aleatorizado abierto, sobre 73 pacientes, de los que 36 reciben terapia estándar de soporte y 37 la misma terapia además de ribavirina intravenosa; el estudio no ha sido capaz de mostrar eficacia ni en aspectos clínicos ni de cinética viral en el tratamiento, con importantes efectos secundarios (principalmente anemia, hiperbilirrubinemia, bradicardia sinusal y rash cutáneo).
Otras indicaciones (fuera de ficha técnica)Fiebre de LassaCuando se realiza una revisión del tratamiento de la fiebre de Lassa con ribavirina se obtienen 108 publicaciones; sin embargo, cuando se evalúan los ensayos clínicos y metaanálisis se obtiene solo una referencia en relación con la efectividad del tratamiento38. Se trata de un estudio desarrollado en Sierra Leona en 1986 por parte del Ministerio de Salud en colaboración con el Centro de Control (CDC), que comenzó en 1977 y en el que se evaluó la administración de plasma de convaleciente, ribavirina oral y ribavirina intravenosa. El estudio es algo complejo pero, a pesar de ello, se puede concluir que se recomienda el tratamiento con ribavirina intravenosa u oral en cualquier momento de la enfermedad (siendo más efectivo en los primeros 6días de enfermedad). Inicialmente se diseñó un estudio faseI de casos y control de los aspectos clínicos y diagnósticos de la fiebre de Lassa en pacientes no tratados (se recogieron 30 variables clínicas y de laboratorio que fueron analizadas posteriormente), y una vez recogidas dichas variables se realizó un ensayo aleatorizado con 70 pacientes (39 con ribavirina oral y 31 con plasma; las mujeres embarazadas entraban sin aleatorizar en este último grupo), desconociéndose en ese momento los resultados del análisis de las variables recogidas. En todos los casos el tratamiento se inició en las primeras 24h. Como variables de mal pronóstico se identificaron, a posteriori, la elevación de transaminasas y la viremia mayor de 1.000copias/ml.
Posteriormente, conocidas las variables indicadoras de mal pronóstico, se desarrolló un estudio faseII, seleccionando los pacientes con una de las variables de mal pronóstico (elevación de transaminasas al diagnóstico; la viremia no estaba disponible). Se aleatorizaron dos grupos de pacientes (29 pacientes en grupo de ribavirina intravenosa y 33 en grupo de ribavirina intravenosa más plasma; las embarazadas recibieron solo 2 unidades de plasma). De forma global (análisis de los pacientes incluidos tanto en el estudio faseI como en el faseII), el tratamiento con ribavirina disminuía la mortalidad. En los pacientes con viremia >1.000copias/ml y tratados con ribavirina la mortalidad era menor que en los que estaban sin tratamiento (mortalidad con ribavirina intravenosa del 32% frente al 76% sin terapia (p=0,00015); mortalidad con ribavirina oral del 30% frente al 76% sin terapia (p=0,008). Lo mismo ocurría si la viremia era <1.000copias/ml (mortalidad con ribavirina intravenosa del 9% frente al 28% sin terapia (p=0,02); mortalidad con ribavirina oral del 7% frente al 28% sin terapia (p=0,01).
Existe un segundo trabajo, realizado por Fisher-Hoch et al.39, que aparece en Pubmed como ensayo clínico con relación al empleo de ribavirina en la fiebre de Lassa. Si bien es verdad que hace referencia a su empleo en un ensayo clínico, lo que describe es la aparición de un efecto adverso que se asociaba a curación («tiritona/escalofríos») y que parecía estar en relación con la velocidad de administración del fármaco (<1min). Tras corregir la velocidad de infusión desaparecieron estos efectos secundarios. Se ha realizado algún estudio para la evaluación de la ribavirina como profilaxis postexposición, pero no ha aportado resultados concluyentes40-41.
Fiebre hemorrágica Crimea-CongoExiste un solo ensayo clínico aleatorizado que evalúa la utilidad de la ribavirina para la fiebre hemorrágica Crimea-Congo, realizado entre 2004 y 2007 con 136 pacientes42. De forma basal, no existían diferencias en el sexo, edad, período de incubación (alrededor de 5días), características clínicas o analíticas. La administración de la ribavirina se hacía antes de confirmar el diagnóstico, por lo que el tiempo hasta la administración de la misma fue alrededor de 4días. No se encontraron diferencias en cuanto a mortalidad, recuperación analítica o tiempo de estancia hospitalaria. Posteriormente, 2metaanálisis evalúan la utilidad de la ribavirina para la fiebre hemorrágica Crimea-Congo. El primero es del año 201043 y revisa 21 trabajos. La conclusión que extraen los autores es que la ribavirina en el ensayo clínico no fue superior al no empleo de la misma, pero en la evaluación conjunta de todos los resultados sí redujo la mortalidad (RR: 0,56; IC95%: 0,35-0,90; 955 participantes). Lo que no se encontró fue diferencia en la duración del ingreso hospitalario. El segundo metaanálisis es del año 201144, e incluye también el único ensayo clínico aleatorizado, pero solo introduce 7 trabajos más que son observacionales con grupo control. Tampoco se encuentra beneficio de la ribavirina con los datos agregados. En ambos metaanálisis se insiste en el riesgo de sesgo en todos los trabajos, ya sea de selección, de validez externa o de atrición.
Fiebres hemorrágicas sudamericanasLa ribavirina no ha conseguido demostrar su utilidad en la reducción de la mortalidad por el virus Junin (fiebre hemorrágica argentina) en 2 ensayos clínicos muy reducidos45,46. No obstante, en el primer trabajo se observó bloqueo de la replicación viral y un retraso en el tiempo hasta el fallecimiento, comparado con controles históricos. El aclaramiento de la viremia se consiguió incluso en los pacientes que fallecieron (en esta fase de la enfermedad se detecta el virus hasta en el 80% de los casos). Dado que existe un tratamiento que ha mostrado ser eficaz si se administra en los primeros 7días de enfermedad (suero de convaleciente), los estudios que emplearon ribavirina se realizaron en fases avanzadas de la enfermedad, lo que justificaría los malos resultados. Probablemente no sea posible realizar nuevos estudios al respecto, dado que existe también una vacuna que ha resultado eficaz en la reducción de la incidencia de la enfermedad47.
Prácticamente no existen casos comunicados de virus Machupo tratados con ribavirina (fiebre hemorrágica boliviana): tan solo 2 casos aislados en los que se administró ribavirina intravenosa y se recuperaron48. Lo mismo ocurre con los casos de virus Sabia. En 1995, un caso de virus Sabia fue tratado con ribavirina intravenosa, consiguiendo la curación del paciente49.
Virus respiratorios: coronavirusSe ha realizado un estudio retrospectivo en 44 pacientes con coronavirus50 para comparar la combinación de interferón y ribavirina frente a placebo, observándose una mejoría en la supervivencia a los 14 (70% vs 29%) y 28días (30% vs 17%) a favor de la combinación de fármacos, aunque la diferencia a 28días no fue estadísticamente significativa (probablemente por el pequeño tamaño muestral). La media de inicio de tratamiento con ribavirina era de 3días. Además, se han comunicado casos aislados51-55 y series de casos56-60 que reflejan grados variables de éxito terapéutico (tablas 3 y 4).
Casos de enfermedad por MERS-CoV tratados con ribavirina
| Edad (años)/sexo | Factor de riesgo | Tiempo hasta RBV | Tratamiento | Evolución | País | Referencia |
|---|---|---|---|---|---|---|
| 68/varón | HTA, DL | ND | RBV pauta A en los días 8-16 + 2 días con IFN alfa | Curación | Corea del Sur | 51 |
| 43/varón | ND | ND | RBV (pauta no especificada) en los días 1-12 + IFN alfa 1.er día | Curacióna | China | 52 |
| 32/mujer | Embarazada | 7 días | RBV pauta B + IFN-α pegilado | Muerte | Emiratos Árabes | 53 |
| 64/varón | HTA, DMb | 15 días | RBV pauta C + LP/r + IFN-a2a pegilado | Curación | República de Corea | 54 |
| 69/varón | Ninguno | 13 días | RBV pauta C + LP/r + IFN pegilado | Muertec | Arabia Saudí | 55 |
DL: dislipemia; DM: diabetes mellitus; HTA: hipertensión arterial; IFN: interferón; LP/r: lopinavir/ritonavir; ND: no disponible o desconocido; RBV: ribavirina.
Además tenía otras comorbilidades, como esplenectomía y pancreatectomía, e infección por Mycobacterium avium intracelulare.
Fallecimiento por adenocarcinoma de colon.
Casos de enfermedad por MERS-CoV tratados con interferón y ribavirina.
Pauta A. 2.000mg como dosis de carga, 600mg/8h 3días, y 400mg/8h durante 4 días.
Pauta B. Dosis de carga (400mg-0-600mg) y posteriormente 1.200mg/12h.
Las dosis de lopinavir/ritonavir fueron 400/100 mg/12 h, administradas por vía oral.
Pauta C. Dosis de carga 2.000mg y luego 1.200mg/8h por vía oral.
Series de casos de enfermedad por MERS-CoV tratados con ribavirina (+ IFN)
| n | Características de sexo y edada | Factor de riesgo | Tiempoa hasta RBV | Tratamiento | Mortalidad | Referencia |
|---|---|---|---|---|---|---|
| 14 | 54 años (23-79). 9 V/5 M | 28,6% sanitarios; 42% con enfermedad renal | 6 días (1-13) | Combinación en 11 casos, pero no especificada | 64%b | 56 |
| 32 | 65 años (25-88). 14 V/18 M | 15,6% sanitarios; 18,75% en hemodiálisis | 1 día | Pauta A | 69%c | 57 |
| 6 | 58,8 años (17-84). 5 V/1 M | 50% Cardiopatía | 8,5 días (1-19) | Pauta B | 50% | 58 |
| 2 | 52 años V/42 años M | Sin factores de riesgo identificados | 0 y 1 día | Pauta C | 0% | 59 |
| 5 | 57,6 años (24-81). 3 V/2 M | 100% Enfermedad renal | 19 días (10-22) | Pauta D | 100% | 60 |
M: mujer; V: varón.
Pauta A. Ribavirina (2.000mg dosis de carga, seguido por 600mg/12h) + IFN-a2a (180μg/semana durante 2 semanas) o IFN-b1a (44mg 3v/semana).
Pauta B. Ribavirina (2.000mg dosis de carga, luego 1.200mg/8h durante 4días), seguido de 600mg/8h durante 4-6días (ajustado a función renal) + IFN-a2b (180μg/semana durante 2semanas).
Pauta C. Ribavirina (2.000mg dosis de carga, luego 1.200mg/8h durante 4días) + IFN-a2b pegilado 180μg/semana durante 2 semanas).
Pauta D. Ribavirina (2.000mg dosis de carga, luego 800mg/8h por sonda nasogástrica) + IFN-a2b 100mg/semana durante 2 semanas.
Actualmente se investigan nuevas aplicaciones de la ribavirina. Están registrados 4 estudios para investigar su utilidad en gripe, 3 sobre arbovirosis, 3 sobre hepatitisB, 3 sobre hantavirus, 2 sobre paramyxovirus, 2 en virus Coxsackie y uno en coronavirus.
ConclusiónLa ribavirina es un antiviral de amplio espectro que actualmente busca un nuevo papel en el tratamiento de diversas infecciones. Su disponibilidad para administración vía oral, por vía intravenosa e inhalada es una característica beneficiosa. Existe evidencia de beneficio en la infección por VRS y fiebre de Lassa, pudiendo plantearse su uso en determinadas situaciones en enfermedad por hantavirus, fiebre hemorrágica Crimea-Congo y coronavirus como MERS-CoV. Actualmente existe en España la disponibilidad de ribavirina en formulación oral, mientras que las formas inhalada e intravenosa se deben solicitar a través de la Agencia Española del Medicamento.