Varón de 51 años fumador de 15 cigarrillos/día con infección por VIH y VHC, conocida desde 1996 y adquiridas por vía parenteral. En 1996 realizó tratamiento de la infección latente por Mycobacterium tuberculosis con isoniacida, al observarse un derivado proteico purificado (PPD) positivo. En 2005 presentó candidiasis esofágica y en 2006 presentó bacteriemia por Salmonella grupo D y neumonía por Pneumocystis jirovecii. Previamente, había realizado múltiples líneas de tratamiento antirretroviral, de dudosa cumplimentación, con fracaso inmunovirológico; los CD4 fueron de 53/μl y la carga viral plasmática (CVP) fue de 490.225 copias/ml previas al ingreso actual. Estaba en tratamiento antirretroviral de alta eficacia con 300mg de tenofovir coformulado con 200mg de emtricitabina v.o. cada 24h, tipranavir 500mg/12h/v.o. potenciado con ritonavir 200mg/12h/v.o. y profilaxis con trimetoprima-sulfometoxazol (800/160mg), 3 veces por semana, que el paciente no realizaba. Seis semanas antes de ingresar presenta sensación de plenitud epigástrica junto con vómitos postingesta y dolor abdominal difuso de carácter cólico, que mejoraba con las deposiciones. Tres semanas después comienza con diarrea acuosa, sin productos patológicos, y marcados edemas en miembros inferiores. No había presentado fiebre. A su ingreso tenía PA de 90/60mmHg, ausencia de fiebre, índice de masa corporal (IMC) de 19,9, y destacaban tanto la caquexia extrema como los marcados edemas en miembros inferiores que dejaban fóvea. No se evidenciaron adenopatías periféricas ni visceromegalias, y presentaba discreto dolor a la palpación profunda en hipocondrio derecho. En el hemograma: Hb de 8,7g/dl, volumen corpuscular medio (VCM) de 86,7fl, banda de distribución de hematíes (RDW) de 18,9, leucocitos 2.600/mm3 (el 82% segmentados, el 8% linfocitos, el 5% cayados) y plaquetas 76.000/mm3. La bioquímica mostraba colestasis disociada con GGT 236U/l y fosfatasa alcalina de 265U/l; la gammaglutamil transpeptidasa y trasaminasa glutamicoxalacética así como la glucosa, urea, creatinina e iones fueron normales. El colesterol total fue de 39mg/dl (lipoproteínas de alta densidad [HDL]: 2mg/dl, lipoproteínas de baja densidad [LDL]: 13mg/dl), prealbúmina de 4,95mg/dl, albúmina de 819mg/dl y proteínas totales de 4,3g/dl. Los tiempos de protrombina y tromboplastina en ratio fueron de 1,41 y 1,49, respectivamente; ambos se corrigieron al añadir suero control. La proteína C reactiva fue de 6mg/dl y la velocidad de sedimentación globular (VSG) de 16mm/h. El sedimento urinario resultó normal y la proteinuria de 24h resultó negativa. Con la sospecha de síndrome de malabsorción con hipoproteinemia grave en relación con enteropatía pierdeproteínas, de causa neoplásica o infecciosa, se solicitaron endoscopia digestiva alta, colonoscopia, tránsito intestinal, TAC de abdomen, coprocultivo convencional y para micobacterias y toxina de Clostridium difficile.
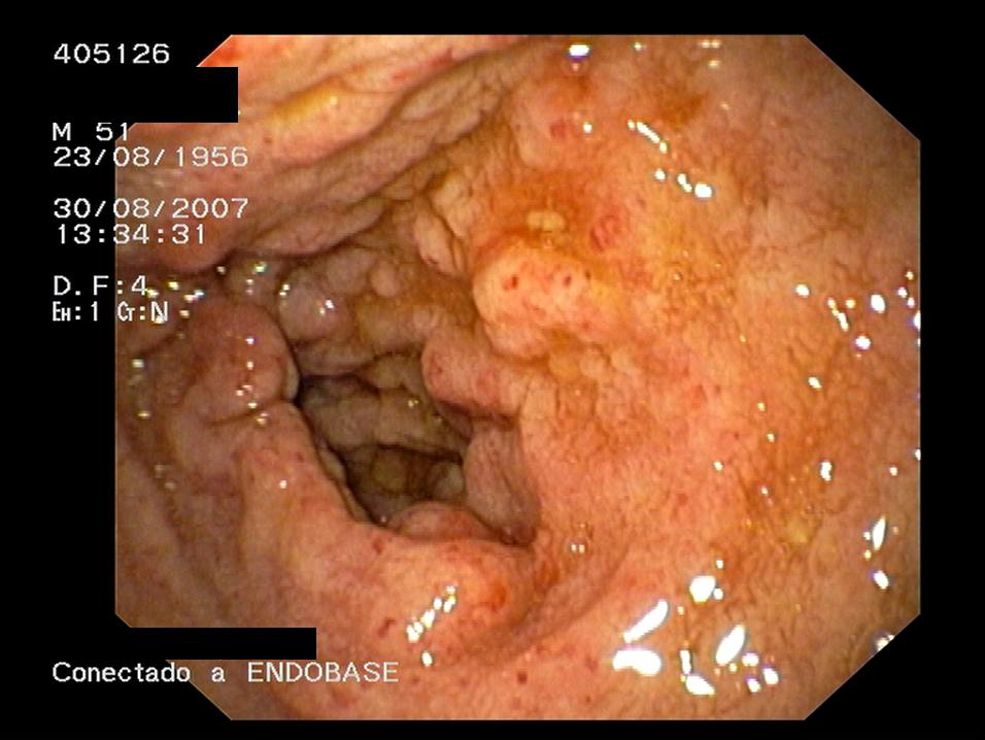
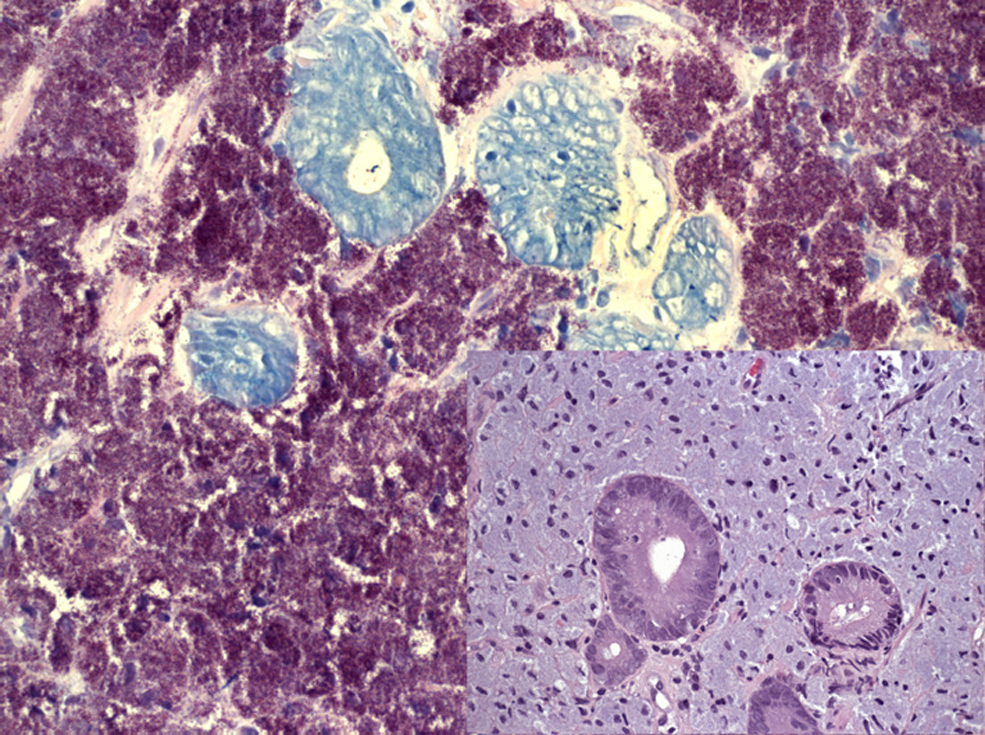
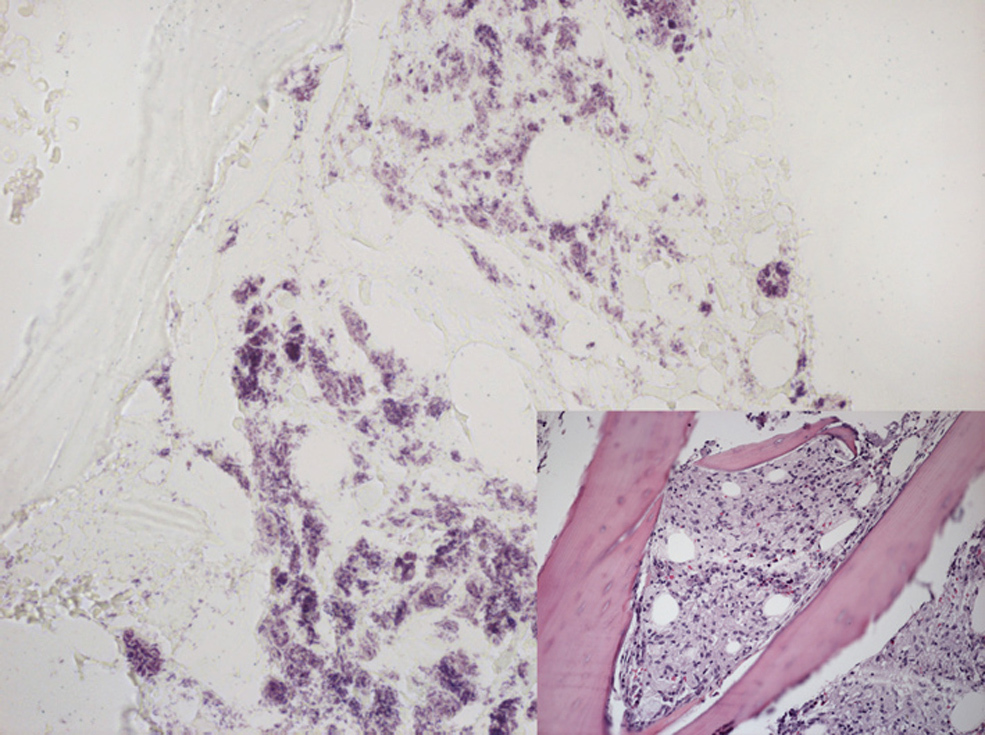
EvoluciónDurante los primeros días de hospitalización destacaba la hipotensión mantenida (presión arterial sistólica [PAS] 84/presión arterial diastólica [PAD] 50) y la intensa astenia en ausencia de fiebre u otros datos de sepsis. La endoscopia alta mostró candidiasis esofágica, estómago normal y un engrosamiento nodular difuso en el duodeno (figura 1). Se inició tratamiento con fluconazol 200mg/día/v.o. que se mantuvo durante 2 semanas. Ante la sospecha de enfermedad infiltrativa por Mycobacterium avium complex (MAC) con afectación intestinal, hepática y de médula ósea se inició tratamiento empírico con claritromicina (500mg/12h/v.o.), rifabutina (300mg/día/v.o.), etambutol (800mg/día/v.o.) y actocortina (50mg/8h/i.v.) con desaparición de la clínica digestiva que motivó el ingreso al quinto día de iniciado el tratamiento. El test de estimulación con hormona adenocorticotropa (ACTH) descartó insuficiencia suprarrenal, y se suspendió la actocortina. El tomografía axial computarizada de abdomen c/c mostró discreta hepatoesplenomegalia e importante edema difuso de los distintos segmentos del tubo digestivo con hipercaptación de la mucosa y engrosamiento de los pliegues, junto con adenopatías mesentéricas de hasta 1,3cm. La biopsia duodenal mostró una lámina propia cargada de macrófagos con una gran concentración de bacilos ácido-alcohol resistentes (BAAR) (figura 2). Se realizó biopsia de médula ósea que puso de manifiesto la presencia de BAAR (figura 3). El coprocultivo convencional, toxina de C. difficile y parásitos en heces que se observaron en la baciloscopia BAAR resultaron negativos, y se aisló M. avium en cultivo de heces, así como en cultivo de la biopsia duodenal. Con el diagnóstico de enfermedad por MAC diseminada con afectación demostrada intestinal y medular se mantuvo tratamiento con etambutol (800mg/día/v.o.), claritromicina (500mg/12h/v.o.), rifabutina (300mg/día/v.o.), y se mantuvo el mismo régimen de tratamiento antirretroviral, profilaxis con trimetoprima-sulfametoxazol, así como suplementación enteral. A los 3 meses de dársele el alta las proteínas totales plasmáticas fueron normales y se normalizó la bioquímica hepática a los 12 meses de iniciado el tratamiento. El paciente no presentó clínica compatible con reconstitución inmune. Tras 15 meses de seguimiento el paciente ha mantenido una respuesta serodiscordante con CD4 menores de 50 en todo momento y supresión virológica.
Figura 1. Endoscopia oral: afectación nodular y difusa de pliegues a partir de la primera porción duodenal que indican enfermedad infiltrativa.
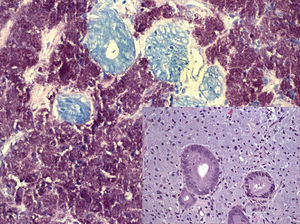
Figura 2. Biopsia de intestino delgado. Gran cantidad de microorganismos resistentes al ácido y al alcohol en el interior de histiocitos. In set abundantes macrófagos pletóricos en lámina propia (Ziehl-Neelsen, original ×520).
Figura 3. Biopsia de médula ósea. Gran cantidad de microorganismos resistentes al ácido y al alcohol en el interior de macrófagos. In set abundantes macrófagos con ocasionales eosinófilos y células plasmáticas (Ziehl-Neelsen, original ×260).
Comentario finalLa enfermedad diseminada por MAC ocurre en pacientes infectados por el VIH-1 e inmunosupresión grave1,2. En un estudio prospectivo de la cohorte EuroSIDA2, la incidencia global de infección por MAC es de 1,4 casos por 100 personas/año de seguimiento. Esta incidencia aumenta conforme disminuye la cifra de CD4, y es 50 veces mayor en pacientes con menos de 50CD4/μl que en aquéllos con más de 100CD4/μl y excepcional en pacientes que superan este recuento2. Por otra parte, y con independencia del recuento de CD4, aquellos pacientes con CVP mayores de 150.000 copias/ml presentan un riesgo relativo de 3,9 de desarrollar enfermedad por micobacterias no tuberculosas3. La infección se adquiere por ingestión o inhalación de bacterias ambientales, y la puerta de entrada es el intestino en más del 90% de los casos4. Una vez que los microorganismos atraviesan la mucosa intestinal penetran en la lámina propia, donde los macrófagos, en pacientes con sida avanzado, son incapaces de realizar una fagocitosis eficaz. La enfermedad puede afectar a cualquier tramo del tracto gastrointestinal y el duodeno es la porción afectada con más frecuencia5 (el 76% de los casos en los que se realiza endoscopia)6. La persistencia de la replicación de las micobacterias conlleva el engrosamiento masivo de la pared intestinal que puede verse macroscópicamente o mediante estudios radiológicos7. La diseminación se realiza a través de los ganglios linfáticos locales o por vía hematógena, donde son captadas por las células del sistema mononuclear fagocítico, principalmente en órganos como el hígado, el bazo y la médula ósea4. En las primeras series, más del 90% de los pacientes con infección diseminada por MAC presentaba fiebre alta, pérdida de peso, sudoración nocturna o anemia grave8,9, y estaban también asociados el dolor abdominal, diarrea, adenopatías intraabdominales, hepatoesplenomegalia y elevación sérica de fosfatasa alcalina. Está descrita la malabsorción en pacientes con MAC, si bien otros patógenos entéricos o el mismo VIH pueden contribuir a esta malabsorción4. En los inicios de la epidemia del sida, la diarrea crónica representaba un marcador de enfermedad avanzada por el VIH, y de forma típica, la etiología era infecciosa10. La probabilidad de desarrollar un episodio oportunista se relaciona con la gravedad de la inmunosupresión; de forma específica, los pacientes con menos de 100 CD4/μl están en riesgo de desarrollar enfermedad por Cryptosporidium, Microsporidium y enfermedad por CMV.
En cuanto al tratamiento, la enfermedad diseminada por Mycobacterium avium Complex (MAC) ha de tratarse con combinación de fármacos, ya que la monoterapia induce resistencias en pocas semanas. La pauta más eficaz y que se asocia a menor incidencia de resistencia a macrólidos es la asociación de claritromicina, etambutol y rifabutina11. La duración del tratamiento depende del estado inmunitario del paciente y debe mantenerse indefinidamente en pacientes con menos de 100 CD4. Los expertos indican que es razonable interrumpir el tratamiento en pacientes que han recibido tratamiento para MAC durante al menos 12 meses y que han permanecido con más de 100 CD4/μl durante al menos 6 meses12. En el caso que comunicamos, el tratamiento combinado específico para MAC ha podido contribuir no sólo a la mejoría clínica y analítica, sino también al aumento de la supervivencia estimada en 4–5 meses en pacientes no tratados13. Por otra parte, el control de la replicación viral mediante tratamiento antirretroviral de gran actividad sigue un curso paralelo tanto a nivel plasmático como en la mucosa intestinal, con disminución de la replicación viral en ambos compartimentos14. Determinados patógenos, como Cryptosporidium y Microsporidium, pueden erradicarse gracias a la restauración de la inmunidad de la mucosa intestinal, mediada por el tratamiento antirretroviral15. Es probable que en nuestro caso, la supresión de la CVP, aun en ausencia de respuesta inmunológica, tuviera un papel en la evolución favorable del síndrome de malabsorción.
Como conclusión, la enfermedad diseminada por MAC, actualmente excepcional, puede presentarse de manera inespecífica con afectación de múltiples órganos. Se trata de un caso interesante, si bien no novedoso, en el que las imágenes son ilustrativas e interesantes desde el punto de vista docente, dado los pocos casos que se diagnostican actualmente. La sospecha clínica junto con un tratamiento empírico precoz en pacientes con una situación clínica que no admite demora puede reducir la mortalidad.
Autor para correspondencia. med007369@telefonica.net