La detección y tratamiento de la infección tuberculosa latente (ITBL) constituye una medida esencial para el control de la tuberculosis (TB) en países de baja incidencia. Esta estrategia está limitada, sin embargo, por la falta de capacidad predictiva de las pruebas diagnósticas para el desarrollo de TB activa entre las personas infectadas y la larga duración y toxicidad de las pautas de tratamiento. Las técnicas in vitro de liberación de interferón-gamma son más específicas y sensibles que la prueba de la tuberculina, y permiten seleccionar mejor los casos que requieren tratamiento. Aun así, su capacidad para predecir el desarrollo de TB sigue siendo pobre. Además, las pautas de tratamiento de ITBL son largas, y las tasas de cumplimiento, bajas. Esta revisión discute el uso de las técnicas diagnósticas disponibles y las nuevas aproximaciones al diagnóstico de la ITBL y su abordaje terapéutico en diferentes escenarios clínicos.
Detection and treatment of latent tuberculosis infection (LTBI) is an essential measure for tuberculosis (TB) control in low-incidence countries. However, such strategy is limited by the low predictive ability of the diagnostic tests for the development of active TB among infected people and the long-term and toxic treatment regimens. The in vitro interferon-gamma release assays are more specific and sensitive than the tuberculin skin test (TST), and enable a better selection of cases requiring treatment. Nonetheless, their capacity to predict development of TB is still poor. In addition, treatment regimens for LTBI are long, and compliance rates are low. This review discusses the use of the available diagnostic tests and the new approaches to the diagnosis of LTBI, as well as its management in different clinical scenarios.
Además del tratamiento precoz de los pacientes con tuberculosis (TB) activa, la detección y tratamiento de la infección tuberculosa latente (ITBL) se ha convertido en una medida esencial de control de la TB en países de baja incidencia, en los que la reactivación endógena de una infección pasada constituye la principal fuente de los nuevos casos. Tras la primoinfección el sistema inmunitario es capaz de controlarla en la mayor parte de los casos, dando lugar a la persistencia de bacilos viables con capacidad para proliferar y desarrollar TB activa en el futuro. En la actualidad este modelo binario de latencia vs. enfermedad activa es considerado una simplificación de un espectro más amplio, el cual iría desde la eliminación de la infección hasta la enfermedad clínica, pasando por estadios de latencia y enfermedad clínicamente silente. En la práctica, sin embargo, se acepta una definición pragmática de ITBL como aquella infección por Mycobacterium tuberculosis complex, basada en la reactividad de la prueba de la tuberculina (PT) o de un interferon gamma release assay (IGRA), sin evidencia de enfermedad activa1. El riesgo de progresión a TB activa se estima en un 10% de los infectados. La infección reciente, la edad<5 años, la inmunosupresión celular de cualquier índole y la TB pulmonar con lesiones residuales nunca tratada incrementan notablemente el riego de progresión1. Ya en la década de 1950-1960 se demostró la utilidad de isoniazida (INH) para prevenir el desarrollo de TB en personas expuestas a pacientes con TB pulmonar. Desde entonces el mismo beneficio ha sido demostrado, con INH o pautas alternativas, en otros grupos de riesgo. En el presente artículo se discute el diagnóstico y abordaje terapéutico de la ITBL, de acuerdo a la evidencia existente en la actualidad.
Diagnóstico de la infección tuberculosa latenteEl diagnóstico de la ITBL se realiza mediante técnicas que estudian la sensibilización del individuo a diferentes antígenos de Mycobacterium tuberculosis. La técnica clásica de diagnóstico ha sido la PT. Esta técnica consiste en la inoculación intradérmica de un derivado purificado de proteínas (PPD), el cual contiene una mezcla de más de 200 antígenos presentes en M. tuberculosis, en la cepa vacunal, bacilo de Calmette-Guérin (BCG) y en micobacterias ambientales.
Técnicas disponibles para el diagnóstico de la infección tuberculosaLa PT, que se utiliza desde hace más de 100 años, y que representa una herramienta útil en el manejo de la infección tuberculosa, tiene, sin embargo, limitaciones importantes. La principal deficiencia radica en su baja especificidad en individuos vacunados con BCG y en infectados por micobacterias ambientales. Por lo tanto, en individuos vacunados o sensibilizados con micobacterias ambientales es virtualmente imposible distinguir una respuesta positiva por una reacción verdadera frente a M. tuberculosis de una reacción de otra causa. Además, la PT presenta una menor sensibilidad en individuos immunodeprimidos y niños pequeños con inmunidad no completamente madura, ya que no pueden responder adecuadamente a la estimulación antigénica. En estos casos también resulta difícil discernir entre anergia y un resultado verdadero negativo.
Hace ya más de una década se introdujo en la práctica clínica la utilización de técnicas de immunodiagnóstico in vitro, las cuales permiten diagnosticar la infección tuberculosa mediante pruebas de laboratorio. Básicamente, estas técnicas consisten en la estimulación in vitro de las células T circulantes en la sangre, mediante antígenos específicos del complejo M. tuberculosis. En el caso de que el individuo esté infectado, sus células T responderán liberando una amplia variedad de citoquinas que pueden ser detectables mediante técnicas inmunológicas. La citoquina detectada en las técnicas disponibles comercialmente es el interferón-gamma (IFN-γ). La principal virtud de los IGRA radica en los antígenos que utiliza para la estimulación de las células T: la proteína 6-kD M. tuberculosis early-secreted antigenic target (ESAT-6) y la 10-kD culture filtrate protein (CFP-10), codificados en la región de diferencia 1 (RD1)2. Estos antígenos específicos de M. tuberculosis no están presentes ni en el bacilo vacunal BCG ni en la mayoría de micobacterias ambientales. Las 2 técnicas disponibles comercialmente son el QuantiFERON®-TB Gold (QFT-G) (Qiagen, Düsseldorf, Alemania) y el T-SPOT®-TB (Oxford Immunotec, Oxford, Reino Unido). Ambas técnicas han sido aprobadas por la U.S. Food and Drug Administration (FDA) y la European Comission (para su uso en Europa). Hasta recientemente la versión de QFT-G utilizada era QuantiFERON-TB Gold In-Tube (QFT-GIT), el cual incluía además un tercer Ag (TB7.7) y detectaba la respuesta de células T-CD4. Actualmente ya se está utilizando una la nueva versión, el QuantiFERON®-TB Gold Plus (QFT-Plus), el cual permitiría identificar la respuesta por células T-CD4 y células T-CD8. La otra novedad es que se ha eliminado el Ag TB7.7. La principal diferencia entre las técnicas IGRA reside en que mientras el QFT-G estimula sangre total y cuantifica la cantidad de IFN-γ liberado mediante ELISA, el T-SPOT.TB cuantifica el número de células T que producen IFN-γ en respuesta a la estimulación mediante ELISPOT. Los IGRA también presentan otra potencial ventaja, como es incluir controles negativos y positivos para identificar posibles reacciones inespecíficas y falsos resultados negativos3. Los IGRA también se pueden ver afectados por la inmunosupresión, y su dificultad para responder a los antígenos de M. tuberculosis, si bien los estudios realizados parecen indicar que el impacto sería menor que sobre la PT4.
El principal objetivo del cribado de infección tuberculosa sería poder identificar y tratar a aquellos individuos que están infectados y que van a progresar a enfermedad activa. Sin embargo, tanto la PT como los IGRA en mayor o menor medida únicamente detectan sensibilización a los antígenos, pudiendo ser tanto individuos con infección reciente y mayor riesgo de progresar, como individuos con infección remota con muy bajo riesgo, o en los que el riesgo de progresar es nulo, pero que aún mantienen una respuesta inmune frente a la micobacteria. Es decir, que la capacidad de la PT y de los IGRA de predecir el desarrollo de TB es muy pobre, ya que un gran número de individuos con resultado positivo de la PT o los IGRA no progresarán hacia enfermedad tuberculosa5. Sin embargo, aun con esta limitación, los IGRA han mejorado significativamente el diagnóstico de la infección tuberculosa. A pesar de presentar valores predictivos similares su mayor especificidad ha permitido reducir el número de tratamientos preventivos innecesarios sin aumentar el riesgo de desarrollo de TB activa ulterior, como se ha demostrado en un estudio observacional6 y un ensayo clínico7 recientes. Además, los IGRA han mejorado la detección de infección tuberculosa en pacientes inmunodeprimidos.
La potencial capacidad de QFT-Plus, la nueva versión del QFT-GIT, de detectar la respuesta específica de las células T-CD4 y T-CD8 podría aumentar la capacidad de detectar individuos infectados, especialmente inmunodeprimidos, ya que muchas inmunodeficiencias están asociadas con una linfopenia general o una depleción específica de células T-CD4. Además, las células T-CD8, que responden a péptidos cortos de antígenos RD1, son más frecuentemente detectadas en pacientes con TB activa que en infectados sin enfermedad activa, y por lo tanto esta respuesta podría estar asociada con una exposición reciente a M. tuberculosis y con una mayor carga bacteriana8. Hasta el momento se ha confirmado que QFT-Plus presenta una sensibilidad y especificidad similares al QFT-GIT, y se ha sugerido que permitiría identificar mejor aquellos individuos infectados con mayor riesgo de progresión a enfermedad activa9,10. No obstante, es necesario confirmar estos datos y evidenciar su utilidad en el manejo del diagnóstico de la infección tuberculosa en población inmunodeprimida. En la tabla 1 se ilustran las diferencias generales entre la PT y los IGRA.
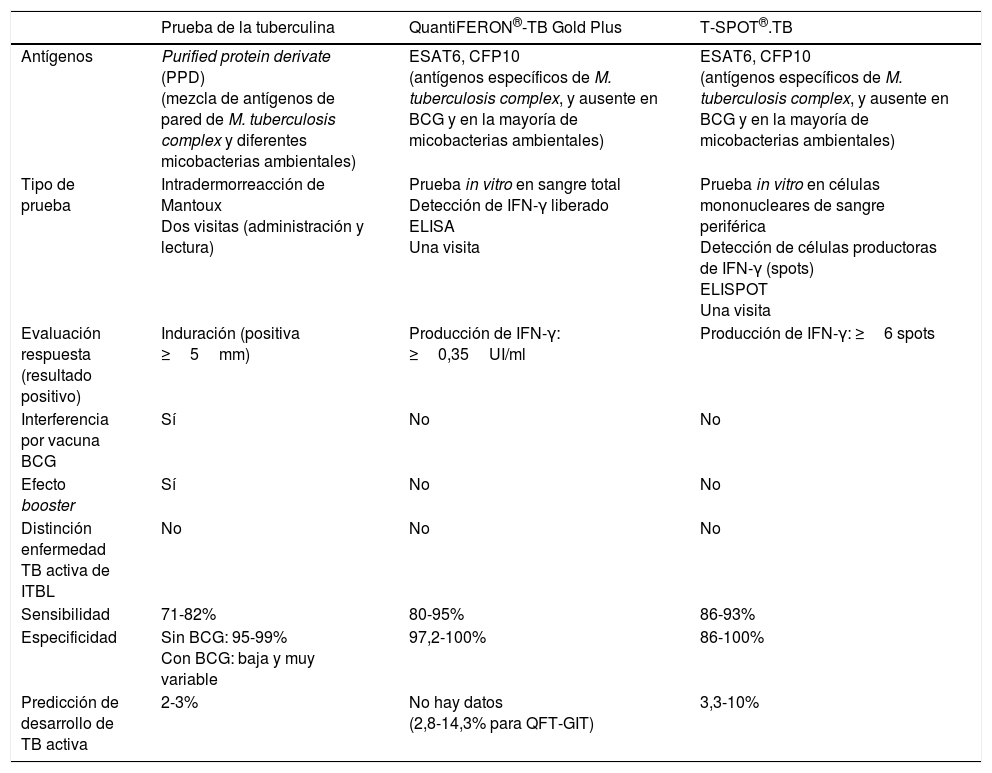
Comparación entre las pruebas disponibles para infección tuberculosa latente
| Prueba de la tuberculina | QuantiFERON®-TB Gold Plus | T-SPOT®.TB | |
|---|---|---|---|
| Antígenos | Purified protein derivate (PPD) (mezcla de antígenos de pared de M. tuberculosis complex y diferentes micobacterias ambientales) | ESAT6, CFP10 (antígenos específicos de M. tuberculosis complex, y ausente en BCG y en la mayoría de micobacterias ambientales) | ESAT6, CFP10 (antígenos específicos de M. tuberculosis complex, y ausente en BCG y en la mayoría de micobacterias ambientales) |
| Tipo de prueba | Intradermorreacción de Mantoux Dos visitas (administración y lectura) | Prueba in vitro en sangre total Detección de IFN-γ liberado ELISA Una visita | Prueba in vitro en células mononucleares de sangre periférica Detección de células productoras de IFN-γ (spots) ELISPOT Una visita |
| Evaluación respuesta (resultado positivo) | Induración (positiva ≥5mm) | Producción de IFN-γ: ≥0,35UI/ml | Producción de IFN-γ: ≥6 spots |
| Interferencia por vacuna BCG | Sí | No | No |
| Efecto booster | Sí | No | No |
| Distinción enfermedad TB activa de ITBL | No | No | No |
| Sensibilidad | 71-82% | 80-95% | 86-93% |
| Especificidad | Sin BCG: 95-99% Con BCG: baja y muy variable | 97,2-100% | 86-100% |
| Predicción de desarrollo de TB activa | 2-3% | No hay datos (2,8-14,3% para QFT-GIT) | 3,3-10% |
BCG: bacillus Calmette-Guérin; CFP10: culture filtrate protein 10; ESAT6: early-secreted antigenic target 6; IFN-γ: interferón gamma; ITBL: infección tuberculosa latente; PT: prueba de la tuberculina; QFT-GIT: QuantiFERON®-TB gold in-tube; TB: tuberculosis.
El pasado año se publicó un documento de consenso basado en la evidencia, elaborado por un panel de expertos del Grupo de Estudio de Micobacterias (GEIM) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) para el uso de las técnicas diagnósticas de infección tuberculosa11. Las recomendaciones se realizaron en función de distintos grupos poblaciones y su riesgo de progresar a enfermedad activa en caso de estar infectados (tabla 2). Cuando se elaboró dicho documento la evidencia existente con QFT-G correspondía únicamente a la versión QFT-GIT, pues QFT-Plus aún no había sido introducido. Sin embargo, a tenor de los datos disponibles, las recomendaciones que más adelante se hacen pueden ser aplicables también a QFT-Plus. Las principales recomendaciones de uso serían las siguientes:
Recomendaciones del uso de la prueba de la tuberculina y los IGRA en la práctica clínica11
| Grupo de riesgo | Recomendación |
|---|---|
| Estudio de contactos | |
| Adultos | Inicio de estudio con la PT Confirmación de los positivos con un IGRA en vacunados con BCGa |
| Niños ≥5 años | Inicio de estudio con la PT Confirmación de los positivos con un IGRA en vacunados con BCG |
| Niños<5 años | PT y un IGRA, independientemente de la BCG |
| Cribado en personal sanitario | PT en el cribado inicial Confirmación de los positivos con un IGRA. Si el IGRA fuese negativo, continuar con estudio periódico mediante IGRA solo si no hay sospecha de TB activa o inmunosupresión |
| VIH | |
| CD4 ≥200 | PT y un IGRA |
| CD4<200 | IGRA |
| Enfermedades inflamatorias crónicas | PT y un IGRA |
| Pacientes trasplantados | PT y un IGRA |
BCG: bacillus Calmette-Guérin; IGRA: interferon gamma release assay; PT: prueba de la tuberculina; TB: tuberculosis.
Recientemente se ha demostrado el beneficio de confirmar la positividad de la PT con QFT-G incluso en contactos sin vacuna BCG7.
Dado que la PT continúa estando mucho más disponible que los IGRA en los centros sanitarios, y que el porcentaje de pacientes con un resultado negativo que no desarrolla TB es muy alto, se recomienda iniciar el estudio de contactos con la PT, pero siendo necesario confirmar los resultados positivos mediante un IGRA en individuos vacunados con BCG.
Cribado en personal sanitarioSe recomienda utilizar la PT para el cribado inicial y también para el estudio periódico de infección tuberculosa del personal sanitario. Sin embargo, se sugiere reconfirmar los resultados positivos con un IGRA. En el supuesto de que la PT fuera positiva, pero el IGRA negativo, se sugiere continuar con el estudio periódico mediante IGRA solo si no hay sospecha de TB activa o inmunosupresión.
Estudio de contactos en niñosAl igual que en adultos, se recomienda iniciar el estudio de contactos con la PT, pero en caso de niños vacunados con BCG los resultados positivos deben ser confirmados mediante un IGRA. Debido a la reconocida baja sensibilidad de las técnicas en niños menores de 5 años, se sugiere realizar tanto la PT como los IGRA, independientemente de la vacunación con BCG, con el objetivo de maximizar la posibilidad de detectar aquellos niños infectados que están en un mayor riesgo de progresar a enfermedad.
Pacientes infectados por el virus de la inmunodeficiencia humanaSe recomienda utilizar la PT y los IGRA en individuos infectados por el VIH. Además, en aquellos individuos infectados por el VIH y un recuento de CD4 inferior a los 200/ml, el panel sugiere utilizar únicamente IGRA, ya que la PT raramente detecta la infección en pacientes con avanzado grado de inmunosupresión.
Pacientes con enfermedades inflamatorias crónicasLa recomendación está dirigida al cribado de infección tuberculosa antes de que los pacientes inicien terapias biológicas. Estos pacientes ya reciben otras terapias inmunomoduladoras que pueden reducir la sensibilidad de las técnicas. Por lo tanto, se recomienda utilizar la PT y los IGRA para maximizar la posibilidad de detectar la infección tuberculosa.
Pacientes trasplantadosLa recomendación en esta población susceptible también es la de realizar cribado previo al trasplante utilizando la PT y un IGRA.
Consideraciones adicionales sobre el uso de los interferon-gamma release assaysLa utilización de los IGRA requiere de una cierta infraestructura para poder llevarlos a cabo, como puede ser el transporte relativamente rápido de las muestras a los laboratorios (particularmente importante en el caso del T-SPOT.TB), y la necesidad de realizar venopunción, la cual dificulta la logística para llevar a cabo estudios de contactos en colectivos muy numerosos.
La elección de una u otra técnica de IGRA dependerá de diversos factores, más allá de la prestancia de ambas, que a tenor de la evidencia de la literatura se puede considerar equiparable, y queda a decisión del usuario. A continuación se hacen algunas consideraciones que deben tenerse en cuenta para la elección de uno u otro. Por un lado, T-SPOT.TB tendría la desventaja de requerir más manipulación técnica en el laboratorio que el QFT. Pero por otro lado, hay la percepción de que T-SPOT.TB ofrecería una mayor sensibilidad en población inmunodeprimida y en niños pequeños; percepción por otra parte no sólidamente documentada. Un hecho interesante a señalar es que el resultado de los IGRA puede verse afectado por el tabaquismo12. Recientemente se ha demostrado cómo existe una relación significativa entre la cantidad de cigarrillos que fuma un paciente y la posibilidad de que el resultado de los IGRA sea negativo o indeterminado13.
Existen otras consideraciones de orden logístico, como puede ser el hecho de que al no necesitar una segunda visita de los pacientes para poder obtener los resultados, como sucede con la PT, los IGRA pueden ser preferibles en aquellos pacientes en que se sospeche que no vayan a acudir de nuevo a la consulta.
Aproximaciones futuras al diagnóstico de la infección tuberculosaCon el objetivo de superar las principales limitaciones de las técnicas disponibles, como por ejemplo mejorar el valor predictivo positivo, la capacidad de distinguir entre infección y enfermedad, y entre infección reciente y remota, se está trabajando en el desarrollo de nuevas aproximaciones que permitan mejorar globalmente el diagnóstico de la infección tuberculosa.
Técnicas que mantienen el formato interferon-gamma release assaysPor una parte, nuevas técnicas que mantienen el formato IGRA, pero que buscan la detección de otras citoquinas, como puede ser la IP-10, han demostrado que pueden ser una buena alternativa a la utilización del IFN-γ14. La IP-10 ha presentado resultados equiparables en diferentes grupos de estudio15-17, y además se ha mostrado muy estable al ser desecada en papel de filtro, lo cual puede facilitar el envío de las muestras a los laboratorios de referencia17. Por otra parte, también se está explorando otros antígenos para estimular las células T, como antígenos dosR-regulon encoded proteins y los IVE-TB antigens, que se expresan cuando la bacteria está en condiciones de latencia. A pesar de disponer de resultados que pueden ser considerados prometedores, estos aún no son en absoluto definitivos18. Por otro lado, se ha ideado un test similar a la PT inoculando de forma intradérmica los antígenos específicos ESAT-6 y CFP-10 (C-Tb, Statens Serum Institut). Esta técnica in vivo no presenta reacción cruzada en individuos vacunados con el BCG y podría ser una alternativa real a la PT convencional19.
El significado del valor cuantitativo de la respuesta de IFN-γ en el QFT-GIT como herramienta de predicción de progresión a enfermedad ha sido un tema controvertido desde los inicios de los IGRA. Recientemente un estudio ha evidenciado que las conversiones de QFT-GIT con valores elevados de IFN-γ poseen un fuerte valor pronóstico de desarrollo de TB en niños, pudiendo ayudar a tomar mejores decisiones en la prescripción de tratamiento preventivo20,21. Por lo tanto, un conocimiento más riguroso de la variabilidad de estas técnicas in vitro, así como de las conversiones/reversiones podría ayudar a identificar aquellas personas con más riesgo de desarrollar TB activa22. Por último, el estudio del transcriptoma podría representar una herramienta muy útil para detectar perfiles de ARN del huésped que pudieran estar asociados al desarrollo de TB23.
Detección del patrón de glucosilación de anticuerposAunque durante años se ha intentado desarrollar técnicas diagnósticas basadas en la detección de anticuerpos, estos métodos, hasta el momento, se han mostrado poco útiles para el diagnóstico de la TB. Recientemente, un estudio publicado en la revista Cell por Lu et al.24 ha demostrado que los pacientes con TB activa presentan anticuerpos IgG con diferentes patrones de glucosilación respecto a los individuos infectados. Concretamente, se han observado diferencias en la presencia de galactosa y ácido siálico en los anticuerpos de tipo IgG, de forma que los individuos infectados presentaron niveles mucho más elevados que los enfermos. Se sabe que la presencia de determinadas estructuras de galactosa o ácido siálico está asociada a una mayor actividad antiinflamatoria. Por lo tanto, estos resultados sugieren que distintos perfiles de glucosilación podrían inducir diferentes tipos de respuesta efectora25.
Marcadores celularesFinalmente, la búsqueda de nuevos marcadores celulares mediante citometría también es una aproximación prometedora. Se ha observado que la disminución de la expresión del marcador celular CD27 en las células T-CD4 específicas de M. tuberculosis podría representar un marcador de TB activa, ya que durante la infección por M. tuberculosis se produce un cúmulo de células T-CD4 con una baja expresión de CD27 en sangre y un incremento de este tipo celular en el lugar de infección26,27. Este proceso es conocido como homing, el cual hace referencia a la acción migratoria de las células que expresan receptores específicos de alojamiento para que sean dirigidas hacia el tejido infectado.
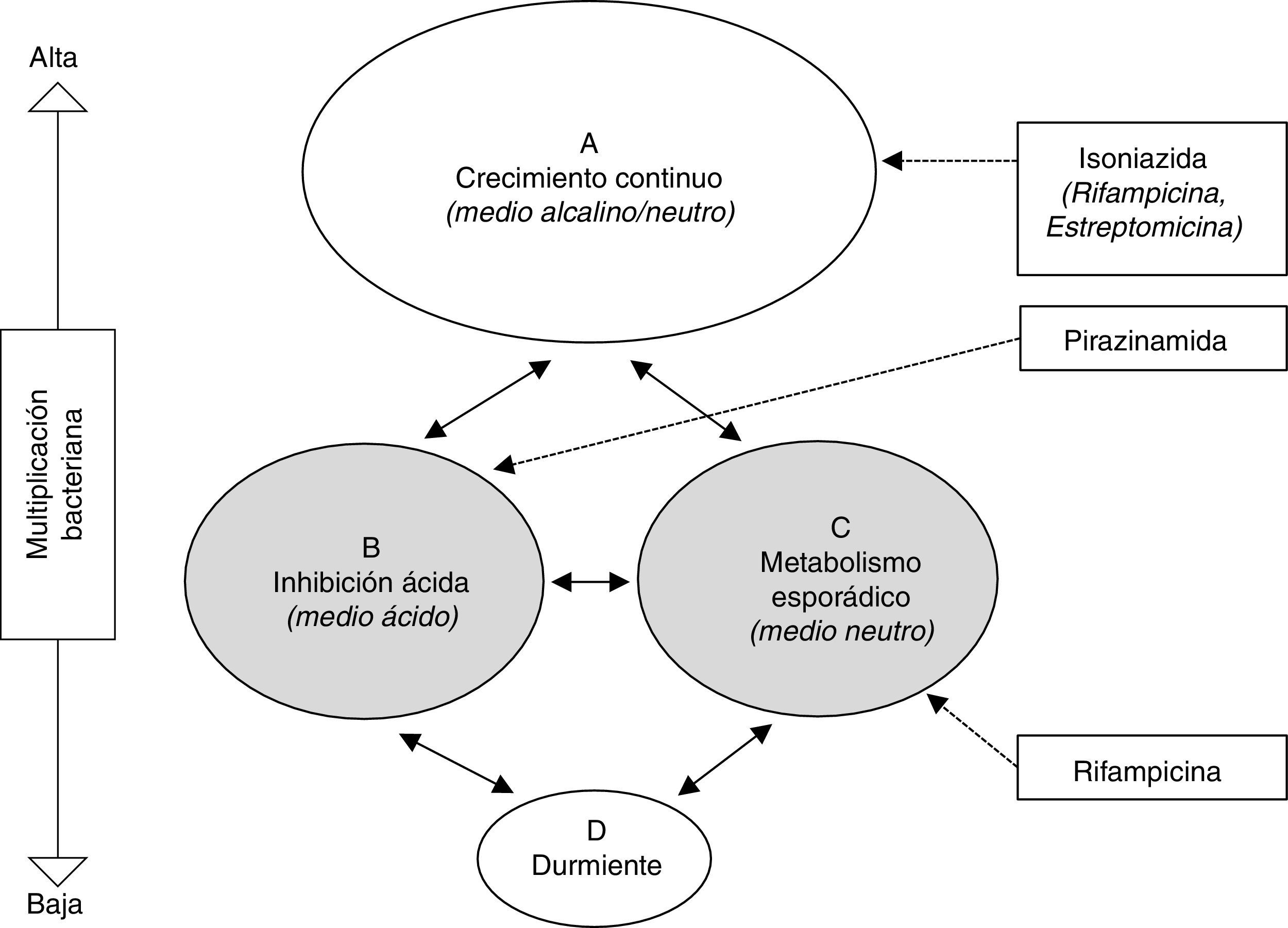
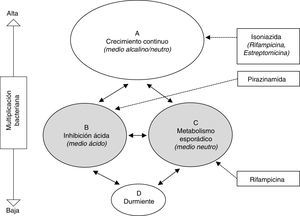
Tratamiento de la infección tuberculosa latenteEl fundamento del tratamiento antibiótico para la prevención de TB activa es la eliminación de la población bacteriana latente, constituida por bacilos metabólicamente poco activos, con el fin de evitar su reactivación ulterior. Esta población engloba la intracelular (macrófagos) y la extracelular del caseum, descritas por Mitchinson et al.28 (fig. 1). Paradójicamente, mientras que INH es muy activa frente a la población bacilar en constante multiplicación, su actividad frente a los bacilos metabólicamente menos activos es marginal. El amplio uso de INH con este objetivo vino motivado por la excelente actividad bactericida demostrada en el tratamiento de la TB activa antes de estos conocimientos. Precisamente, la actividad esterilizante de rifampicina (RMP) y pirazinamida (PZA), por su actividad frente a esta población latente, estimuló los estudios en modelo animal y clínicos para el tratamiento de la ITBL.
Representación esquemática de las hipotéticas poblaciones bacterianas en la tuberculosis activa y actividad de los antituberculosos28. Las poblaciones B y C (sombreadas) representan las metabólicamente menos activas, sobre las cuales actuan fundamentalmente pirazinamida y rifampicina, respectivamente.
La eficacia de INH se estableció mediante ensayos clínicos iniciados en la década de 1950 y finalizados en la de 1960 por el Servicio de Salud Pública de los Estados Unidos con más de 100.000 personas, incluyendo niños, contactos de TB, pacientes institucionalizados y personas con PT positiva29,30. En ellos se comparaba INH durante 12 meses con placebo. La eficacia de INH osciló entre el 25% y el 92% (90% en los sujetos adherentes al tratamiento). La eficacia se correlacionó con la duración del tratamiento, aumentando progresivamente hasta 9-10 meses y estabilizándose a partir de ahí, observación que motivó la recomendación mayoritaria de 9 meses de duración. Sin embargo, en un metaanálisis posterior que incluyó 73.375 sujetos, la INH durante 6-12 meses redujo el riesgo de TB en un 60%, sin diferencias significativas entre 6 meses (riesgo relativo: 0,44; IC 95%: 0,27-0,73) y 12 meses (riesgo relativo: 0,44; IC 95%: 0,27-0,73) de duración31. Por otra parte, un estudio con 28.000 personas con lesiones fibróticas pulmonares compatibles con TB pasada mostró una mayor eficacia de INH durante 12 meses (75%) con respecto a 6 meses (65%), la cual aumentaba cuando se consideraban únicamente los adherentes al tratamiento (69% para 6 meses y 93% para 12 meses). Globalmente, el efecto protector del tratamiento preventivo con INH en dichos estudios persistió por varias décadas30. Isoniazida también fue eficaz para el tratamiento de ITBL en pacientes con infección por el VIH32. El efecto protector parece ser prolongado, tal como se demuestra en un estudio reciente en Brasil33, pero disminuye progresivamente con el tiempo en países de alta incidencia.
La toxicidad hepática es el efecto adverso potencialmente más grave de la INH. En sus inicios, cuando no se conocía en gran medida este efecto, ocurrieron casos de hepatitis grave, e incluso muertes29,30. Las tasas de hepatitis clínica oscilaron entre 0,0% y 2,9%, en un metaanálisis sobre 38.257 sujetos. Estos casos ocurrieron sobre todo en los 3 primeros meses de tratamiento, y la edad fue un factor de riesgo importante, oscilando entre el 0% en<20 años, hasta el 2,3% en adultos de entre 50 y 64 años. Estudios contemporáneos, sin embargo, arrojan tasas mucho menores de hepatitis sintomática, oscilando entre uno y 3 por 1.00034. Probablemente ello se deba a un seguimiento más estrecho de los pacientes y suspensión temprana del tratamiento, evitando así la progresión a formas más graves de hepatitis.
Alternativas a la isoniazidaA pesar de la eficacia demostrada, las pautas de 6-9 meses con INH continúan siendo largas y de cumplimiento subóptimo. Como alternativas a la INH la atención se centró sobre RMP y PZA, fármacos que ya habían permitido acortar el tratamiento de TB activa a 6 meses. Un metaanálisis reciente concluyó que las pautas que incluían RMP durante 3 o más meses eran igualmente efectivas, si no más que INH por 6-9 meses35.
Combinación de rifampicina y pirazinamidaLa pauta de RMP y PZA durante 2 meses fue eficaz para la prevención de TB en pacientes con infección por el VIH y fue recomendada por la ATS/CDC en 2000. Sin embargo, tras extenderse su uso, se reportaron casos de hepatotoxicidad grave, incluso muerte, en personas sin infección VIH, por lo que su uso está desaconsejado29,30,34.
Combinación de rifampicina e isoniazidaLa combinación de RMP e INH es una alternativa válida a la INH, y está siendo ampliamente usada. Su eficacia ha sido probada sobre todo en pacientes con infección por el VIH en África29. En personas inmunocompetentes fue evaluada en un ensayo clínico en pacientes con silicosis, el cual incluía INH durante 6 meses, RMP durante 3 meses y la combinación de RMP e INH durante 3 meses frente a placebo36. Las 3 pautas redujeron el riesgo de TB con respecto a placebo, pero no hubo diferencias significativas entre ellas. Considerando únicamente los sujetos adherentes al tratamiento, la eficacia estimada fue del 48% para INH y 41% para la combinación RMP con INH.
Rifampicina en monoterapiaEl tratamiento con RMP en monoterapia para ITBL fue estudiada en el ensayo clínico citado previamente, en el cual se estimó una efectividad del 63% frente al 48% para INH36. RMP en monoterapia se ha asociado a menos efectos adversos graves y mejores tasas de cumplimiento que INH. La duración del tratamiento con RMP habitualmente recomendada es entre 3-4 meses.
Combinación de rifapentina e isoniazidaLa rifapentina (RPT), una rifamicina de vida media larga, demostró buena actividad frente a ITBL en modelo murino al administrase conjuntamente con INH, y su eficacia clínica quedó demostrada en un ensayo clínico comparativo entre RPT 600mg e INH 900mg, administrados semanalmente por 3 meses bajo terapia directamente observada, con 9 meses de INH 600mg/día, autoadministrada37. La pauta de RPT con INH fue tan efectiva como INH sola (0,19% y 0,43% casos para RPT/INH e INH respectivamente), tuvo una tasa de cumplimiento superior (82,1% vs 69%) y produjo menos hepatotoxicidad (0,4% vs 2,7%), si bien motivó la suspensión del tratamiento por efectos adversos en más casos (4,9% vs 3,7%). En niños y en pacientes con infección por el VIH se obtuvieron resultados similares38,39. A raíz de esos resultados esta pauta recibió la aprobación por parte de la FDA para el tratamiento de ITBL bajo terapia directamente observada en personas de ≥2 años de edad, y en 2014 los Centers for Disease Control and Prevention y la Organización Mundial de la Salud la incluyeron como alternativa a la INH. La rifapentina, sin embargo, no tiene la aprobación en Europa.
Tratamiento de infección tuberculosa latente en diferentes escenarios clínicosHoy en día está ampliamente aceptada la necesidad de una mejora en el control de la ITBL para el objetivo global de control y eliminación de la TB. La disminución significativa del pool de personas portadoras de ITBL supondría un impacto real en el control de la epidemia a nivel poblacional. Sin embargo, tal estrategia está limitada por 2 factores: en primer lugar, la falta de pruebas diagnósticas con capacidad de predecir adecuadamente el desarrollo de TB activa o biomarcadores de reactivación de ITBL, lo que obliga a administrar muchos tratamientos innecesarios para prevenir un número reducido de casos de TB, y en segundo lugar, la larga duración de las pautas de tratamiento, con bajas tasas de cumplimiento. Nos hallamos, por tanto, ante la disyuntiva de la necesidad de tratar más ITBL para que tenga impacto real en el control de la TB, y por otra parte, la necesidad de centrar nuestros esfuerzos en los grupos de mayor riesgo, en los cuales esta estrategia ha demostrado su coste-efectividad. Las estrategias y otros aspectos programáticos para el control de la TB se escapan del objetivo de este artículo y pueden ser consultados en otras fuentes. A continuación se discuten aspectos relevantes del tratamiento en escenarios clínicos en los que es práctica habitual según las recomendaciones de las guías de práctica clínica.
Infección tuberculosa recienteEl fundamento del tratamiento de la infección TB reciente es el mayor riesgo de progresión a enfermedad activa en los primeros años tras la primoinfección. A cualquier persona con viraje reciente de una PT o IGRA, o contacto con un paciente afecto de TB pulmonar y/o laríngea y una PT ≥5mm o un IGRA positivo, y una vez descartada enfermedad activa, se le debe ofrecer tratamiento de infección tuberculosa (tabla 3).
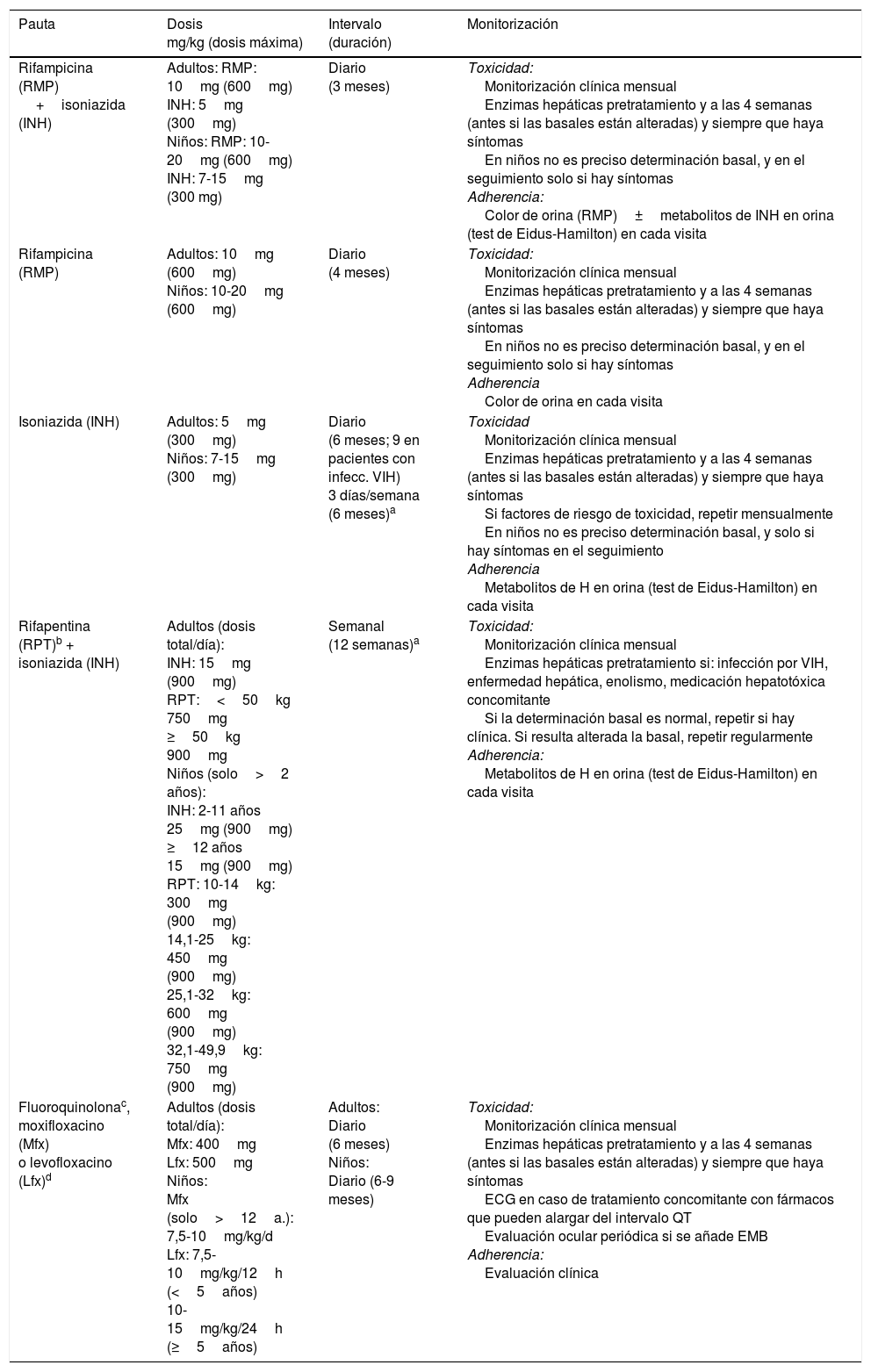
Pautas de tratamiento recomendadas para el tratamiento de la infección tuberculosa latente
| Pauta | Dosis mg/kg (dosis máxima) | Intervalo (duración) | Monitorización |
|---|---|---|---|
| Rifampicina (RMP) +isoniazida (INH) | Adultos: RMP: 10mg (600mg) INH: 5mg (300mg) Niños: RMP: 10-20mg (600mg) INH: 7-15mg (300 mg) | Diario (3 meses) | Toxicidad: Monitorización clínica mensual Enzimas hepáticas pretratamiento y a las 4 semanas (antes si las basales están alteradas) y siempre que haya síntomas En niños no es preciso determinación basal, y en el seguimiento solo si hay síntomas Adherencia: Color de orina (RMP)±metabolitos de INH en orina (test de Eidus-Hamilton) en cada visita |
| Rifampicina (RMP) | Adultos: 10mg (600mg) Niños: 10-20mg (600mg) | Diario (4 meses) | Toxicidad: Monitorización clínica mensual Enzimas hepáticas pretratamiento y a las 4 semanas (antes si las basales están alteradas) y siempre que haya síntomas En niños no es preciso determinación basal, y en el seguimiento solo si hay síntomas Adherencia Color de orina en cada visita |
| Isoniazida (INH) | Adultos: 5mg (300mg) Niños: 7-15mg (300mg) | Diario (6 meses; 9 en pacientes con infecc. VIH) 3 días/semana (6 meses)a | Toxicidad Monitorización clínica mensual Enzimas hepáticas pretratamiento y a las 4 semanas (antes si las basales están alteradas) y siempre que haya síntomas Si factores de riesgo de toxicidad, repetir mensualmente En niños no es preciso determinación basal, y solo si hay síntomas en el seguimiento Adherencia Metabolitos de H en orina (test de Eidus-Hamilton) en cada visita |
| Rifapentina (RPT)b + isoniazida (INH) | Adultos (dosis total/día): INH: 15mg (900mg) RPT:<50kg 750mg ≥50kg 900mg Niños (solo>2 años): INH: 2-11 años 25mg (900mg) ≥12 años 15mg (900mg) RPT: 10-14kg: 300mg (900mg) 14,1-25kg: 450mg (900mg) 25,1-32kg: 600mg (900mg) 32,1-49,9kg: 750mg (900mg) | Semanal (12 semanas)a | Toxicidad: Monitorización clínica mensual Enzimas hepáticas pretratamiento si: infección por VIH, enfermedad hepática, enolismo, medicación hepatotóxica concomitante Si la determinación basal es normal, repetir si hay clínica. Si resulta alterada la basal, repetir regularmente Adherencia: Metabolitos de H en orina (test de Eidus-Hamilton) en cada visita |
| Fluoroquinolonac, moxifloxacino (Mfx) o levofloxacino (Lfx)d | Adultos (dosis total/día): Mfx: 400mg Lfx: 500mg Niños: Mfx (solo>12a.): 7,5-10mg/kg/d Lfx: 7,5-10mg/kg/12h (<5años) 10-15mg/kg/24h (≥5años) | Adultos: Diario (6 meses) Niños: Diario (6-9 meses) | Toxicidad: Monitorización clínica mensual Enzimas hepáticas pretratamiento y a las 4 semanas (antes si las basales están alteradas) y siempre que haya síntomas ECG en caso de tratamiento concomitante con fármacos que pueden alargar del intervalo QT Evaluación ocular periódica si se añade EMB Adherencia: Evaluación clínica |
ECG: electrocardiograma; EMB: etambutol; VIH: virus de la inmunodeficiencia humana.
La historia natural de la MDR-TB, en ausencia de tratamiento, es esencialmente la misma que la de la infección por M. tuberculosis sensible, y el riesgo de infección y enfermedad tras exposición a MDR-TB está bien demostrado. De ahí que el diagnóstico y tratamiento de infección en contactos de MDR-TB sea un elemento importante para evitar la transmisión de la infección. Hasta la fecha, únicamente disponemos de datos de estudios observacionales40. Entre ellos destaca uno llevado a cabo en 104 contactos que recibieron levofloxacino (en ≤12 años) o moxifloxacino (en>12 años) durante 12 meses, asociado a etambutol o etionamida41. Ninguno de los contactos tratados desarrolló TB activa, mientras que 3 de los 15 que rechazaron el tratamiento enfermaron. Otra combinación atractiva es la de levofloxacino (u ofloxacino) con PZA. Sin embargo, estas combinaciones han sido mal toleradas, llevando a la interrupción del tratamiento en una alta proporción de casos40.
La Organización Mundial de la Salud, ante la falta de ensayos clínicos, recomienda el control periódico de los contactos de MDR-TB durante los 2 primeros años, sin tratamiento antimicrobiano. Sin embargo, un consenso de expertos recomienda la administración de una fluoroquinolona en contactos de alto riesgo42. Actualmente hay en marcha 2 ensayos clínicos comparando levofloxacino con placebo (VQUIN y TB CHAMP) y otro comparando delamanid con INH (PHOENIx), cuyos resultados se esperan para 2020.
Pacientes con infección por el virus de la inmunodeficiencia humanaLa infección por el VIH aumenta el riesgo de TB activa en personas con ITBL, y dicho riesgo se incrementa a medida que la inmunosupresión progresa. La efectividad del tratamiento de la ITBL en las personas infectadas por el VIH ha sido ampliamente demostrada32. A todo paciente infectado por el VIH, con ITBL demostrada, una vez descartada TB activa se debería ofrecer tratamiento de ITBL (tabla 3). Las pautas cortas con rifamicinas tienen el inconveniente de las frecuentes interacciones con muchos de los fármacos antirretrovirales, lo cual puede suponer una limitación importante para su uso en estos pacientes.
Pacientes receptores de trasplanteLa incidencia de TB en receptores de trasplante de órganos es superior a la población general43. El riesgo depende del tipo de trasplante (prevalencia de 1,3-6,5% en trasplante de pulmón frente a 0,05-0,26% en trasplante autógeno de progenitores hematopoyéticos), y de la situación endémica del área (prevalencia entre 0,48% en países de baja incidencia y 15,2% en países de alta incidencia)43. Aunque la evidencia del beneficio del tratamiento de la ITBL en los receptores de trasplante de órgano es limitada, el cribado de infección y tratamiento es práctica habitual y forma parte de las guías de práctica clínica. Se recomienda el tratamiento de cualquier paciente receptor de un trasplante con una PT o un IGRA positivos. La experiencia se limita casi exclusivamente a INH en trasplante renal y hepático, de ahí que INH durante 6 a 9 meses sea el tratamiento comúnmente recomendado43 (tabla 3). El tratamiento es especialmente difícil en pacientes con hepatopatía avanzada, por la potencial hepatotoxicidad de los fármacos. Por ello algunos grupos abogan por realizar el tratamiento una vez realizado el trasplante, estrategia que mejora las tasas de compleción del tratamiento. Las rifamicinas parecen ser mejor toleradas, si bien tendrían la limitación de las interacciones con los inmunosupresores. Un ensayo clínico evaluó la eficacia y seguridad de levofloxacino, comparándolo con INH en candidatos a trasplante hepático44. El estudio se tuvo que parar prematuramente por una inesperada alta incidencia de tenosinovitis grave asociada a levofloxacino (18%). Aun así, un 55% de los sujetos tratados con levofloxacino completaron 9 meses de tratamiento, frente a un 44% de los tratados con INH, y no hubo casos de TB tras una media de seguimiento de 9 meses. En un estudio retrospectivo posterior los resultados fueron más favorables en cuanto a la toxicidad de levofloxacino45.
Pacientes con enfermedades inflamatorias crónicas con terapias biológicasParalelamente a la mejora de la calidad de vida y pronóstico de las enfermedades inflamatorias inmunomediadas con las terapias biológicas se hizo evidente el riesgo de TB en estos pacientes, particularmente en relación con los agentes anti-factor de necrosis tumoral (TNF)-alfa (α). Pronto, también, se demostró la efectividad del cribado sistemático y tratamiento de la ITBL en esta población46,47. Los resultados reportados son básicamente con INH durante 6-9 meses, si bien las pautas cortas con RMP con/sin INH parecen igualmente efectivas48 (tabla 3).
Población pediátricaEl tratamiento de los niños con exposición a TB pulmonar bacilífera, cuando se considere indicado, o evidencia de ITBL, se lleva a cabo con INH durante 6-9 meses, RH durante 3 meses o en niños>12 años, RPT e INH durante 12 semanas bajo terapia directamente observada (tabla 3). La RMP durante 4 meses estaría indicada en pacientes con toxicidad o contraindicaciones a INH o en casos de exposición a casos con cepas resistentes a INH. En cuanto a la exposición e infección (presunta) por MDR-TB, al igual que en adultos, no existe consenso, pero un régimen de 6-9 meses de una fluoroquinolona (moxifloxacino solo en>12 años) en combinación con EMB o etionamida, según el test de sensibilidad, es la pauta más recomendada.
El régimen más aceptado es FQ 6-9 meses (moxifloxacino solo en>12 años), en combinación con otro fármaco (E o Eto), valorando asociar H a altas dosis. Para un conocimiento más pormenorizado del abordaje de la exposición a TB en niños, indicaciones de las pruebas diagnósticas de infección TB e indicaciones y monitorización del tratamiento, referimos al lector a una actualización sobre el tratamiento de la TB en niños de la Sociedad Española de Infectología Pediátrica49.
Otras situaciones de riesgoEn la práctica clínica existen otras situaciones en las cuales la inmunosupresión generada por fármacos y otras condiciones crónicas debilitantes —enfermedad renal y hepática avanzadas, diabetes mellitus, cáncer, desnutrición, alcoholismo y drogadicción— condicionan un mayor riesgo de TB. Dada la falta de evidencia del coste-beneficio del tratamiento en estas situaciones, en general no hay recomendaciones explícitas en dicho sentido. Sin embargo, se debería contemplar esta posibilidad sopesando los pros y los contras en cada caso. En particular, pero no exclusivamente, se debería tener en cuenta el tipo y la duración de la inmunosupresión (por ejemplo dosis y duración de una terapia esteroidea), riesgo de toxicidad del tratamiento (edad, comorbilidades, medicación concomitante) y la existencia de factores, a priori, de mala adherencia al tratamiento. A falta de mejor evidencia, cuando se estime un balance favorable entre riesgo y beneficio, debería realizarse cribado para infección TB e indicar tratamiento en caso de demostrarse.
Medidas para control adherencia y monitorización de efectos adversosEl control de la adherencia es una medida esencial para el éxito del tratamiento de la ITBL. No hay consenso sobre un método a utilizar. La mala adherencia se relaciona con factores como distocia social, falta de apoyo familiar, inmigración y, en general, la falta de percepción de la ITBL como un problema de salud y de riesgo de enfermar. En estas circunstancias cobra especial importancia la educación sanitaria y el refuerzo del tratamiento a lo largo del mismo. En la experiencia de la Unidad de TB del Hospital Universitario de Bellvitge, medidas como la educación sanitaria inicial por parte de enfermería especializada (explicación del concepto de infección/enfermedad tuberculosa, fundamento del tratamiento y efectos secundarios), el acceso fácil al equipo terapéutico (teléfono directo), la recaptación en caso de no presentación a las visitas y el control de metabolitos de INH en orina o color de la misma en caso de tratamiento con RMP en cada visita nos ha permitido completar el tratamiento de ITBL en>80% casos50.
Se ha de monitorizar la tolerancia al tratamiento a lo largo del mismo. Aparte de detectar problemas potencialmente graves, la evaluación clínica de síntomas leves atribuibles al tratamiento por parte del paciente sirve como refuerzo para continuar el tratamiento. Aunque no está bien definido cómo y con qué periodicidad se ha de llevar a cabo, una buena práctica consistiría en la determinación de enzimas hepáticas pretratamiento, y al menos, al mes de iniciado. Una excepción a esto podrían ser los niños, en los cuales la toxicidad hepática es excepcional, aceptándose iniciarlo sin analítica previa y realizarla únicamente ante la presencia de síntomas. Por el contrario, en pacientes con enfermedad de base como candidatos a trasplante, la monitorización podría requerir un control más estrecho (tablas 3 y 4).
Fármacos antituberculosos utilizados para el tratamiento de la infección tuberculosa latente y sus reacciones adversas
| Fármaco | Reacciones adversas | Seguridad en el uso de los fármacos |
|---|---|---|
| Isoniazida | Elevación de enzimas hepáticas Hepatitis Hipersensibilidad (reacción cutánea, prurito, fiebre) Neuropatía periférica Alteraciones del SNC (encefalopatía, convulsiones) Artralgias Lupus-like Anemia hemolítica | Factores de riesgo de hepatotoxicidad: enolismo, fármacos hepatotóxicos concomitantes y enfermedad hepática Se recomienda administración de vitamina B6 concomitante (algunos preparados ya la incorporan en su formulación) Es seguro su uso durante el embarazo y la lactancia Metabolismo hepático. No requiere ajuste por la función renal |
| Rifampicina | Elevación de enzimas hepáticas de colestasis Hepatitis (rara si no se asocia a H) Hipersensibilidad (reacción cutánea, prurito, fiebre) Intolerancia gastrointestinal Trombocitopenia Anemia hemolítica Síndrome pseudogripal Nefritis intersticial Coloración naranja de fluidos (sudor, orina, lágrimas) | Interacciones medicamentosas frecuentes. Antes de prescribirla, se debe consultar las interacciones con los fármacos que está tomando el paciente Es seguro su uso durante el embarazo y la lactancia Metabolismo hepático. No requiere ajuste por la función renal |
| Rifapentina | Elevación de enzimas hepáticas Hepatitis | -Interacciones medicamentosas frecuentes. Antes de prescribirla se debe consultar las interacciones con los fármacos que está tomando el paciente |
| Moxifloxacino | Intolerancia gastrointestinal Fotosensibilidad Insomnio, ansiedad Alteración de pruebas hepáticas, hepatitis Tendinitis y rotura tendinosa Prolongación QT | Factores de riesgo para tendinitis y rotura tendinosa: edad avanzada y tratamiento concomitantemente con corticosteroides Moxifloxacino debe emplearse con precaución en pacientes con medicación concomitante que pueda producir alargamiento del intervalo QT o hipocaliemia o hipomagnesemia Moxifloxacino está contraindicado en el embarazo y la lactancia Metabolismo hepático. No requiere ajuste por la función renal |
| Levofloxacino | Intolerancia gastrointestinal Insomnio, ansiedad Fotosensibilidad Artromialgias Tendinitis y rotura tendinosa Alteración de pruebas hepáticas, hepatitis Prolongación QT | Debe usarse con precaución en pacientes con factores de riesgo de prolongación del intervalo QT: síndrome congénito de intervalo QT largo, uso concomitante de medicamentos con capacidad de alargar el intervalo QT e hipocaliemia o hipomagnesemia Eliminación renal. Requiere ajuste en pacientes con alteración de la función renal Contraindicado en embarazo. En niños<12 años el beneficio de su uso en tuberculosis multirresistente supera el riesgo, y se recomienda su uso para esta indicación |
| Etambutol | Intolerancia gastrointestinal Hipersensibilidad (reacción cutánea, prurito, fiebre) Neuritis retrobulbar | Monitorizar agudeza visual y visión de los colores en tratamientos prolongados Es seguro su uso durante el embarazo y la lactancia Eliminación renal. Requiere ajuste en pacientes con alteración de la función renal |
QT: amplitud del complejo QRS; SNC: sistema nervioso central.
Proyectos financiados relacionados con el contenido de este artículo: Sociedad Española de Neumología y Cirugía Torácica (SEPAR), Fundació Catalana per la Pneumologia (FUCAP), Instituto de Salud Carlos III (PI13/1546, PI16/1912) integrados en el Plan Nacional de I+D+I y cofinanciados por el ISCIII-Subdirección General de Evaluación y el Fondo Europeo de Desarrollo Regional (FEDER); Ministerio de Sanidad, Política Social e Igualdad (ayudas para el fomento de la traslación de la aplicación terapéutica de medicamentos de uso humano, huérfanos y de terapias avanzadas, SAS/2481/2009), y por el Programa CERCA de la Generalitat de Catalunya. José Domínguez es investigador del programa Miguel Servet del Instituto de Salud Carlos III.
Conflicto de interesesMiguel Santin es el investigador principal de un ensayo clínico sobre QuantiFERON®-TB Gold In-tube (QFT-GIT) en el estudio de contactos, para el cual Cellestis, Inc. (Carnegie, Australia) proporcionó los tubos de QFT-GIT.