Streptococcus pneumoniae es una causa importante de morbilidad, y la vacuna es la medida más eficaz para prevenirla. El objetivo de este estudio es analizar la evolución de la enfermedad neumocócica invasora (ENI).
Material y métodosEstudio observacional de los casos de ENI residentes en la Comunidad de Madrid notificados a la Red de Vigilancia Epidemiológica entre los años 2008 y 2015. El caso de ENI se definió como la enfermedad producida por Streptococcus pneumoniae, con aislamiento, detección de ADN o detección de antígeno, en muestras procedentes de sitios normalmente estériles. Las cepas aisladas se enviaron al Laboratorio Regional de Salud Pública para la identificación del serotipo. Los serotipos se clasificaron según su inclusión en la vacuna heptavalente (VCN7), en la vacuna trecevalente pero no en la heptavalente (VCN13 adicional) y no incluidos en la VCN13 (no VCN). Se calcularon las razones de incidencia (RI) comparando los períodos 2011-2012 y 2013-2015 con el período 2008-2010.
ResultadosSe notificaron 4.307 casos. El 86,6% fueron serotipados. La RI de ENI para todos los serotipos fue de 0,67 y de 0,67; la RI para los serotipos VCN7 fue de 0,43 y de 0,45; la RI para los VCN13 adicional fue de 0,46 y de 0,25, y la RI para los no VCN fue de 1,01 y de 1,32 en los períodos 2011-2012 y 2013-2015. Los serotipos 8, 9N, 10A, 23B, 24F y el serogrupo 33 incrementaron su incidencia de manera significativa en el período 2013-2015. Los serotipos 15B y 24F supusieron el 24% de los casos no VCN13 en menores de 5años, los serotipos 8 y 9N el 51% en población de 5 a 59años y los serotipos 8 y 22F el 25% en mayores de 59años.
ConclusionesLa incidencia de serotipos no incluidos en vacunas conjugadas ha aumentado, especialmente en menores de 5años, pero la incidencia total de ENI ha disminuido. Es imprescindible continuar con los programas de vigilancia epidemiológica y microbiológica para valorar el efecto de la vacunación sobre la incidencia de la ENI.
Streptococcus pneumoniae is an important cause of morbidity. Vaccination is the most effective measure to prevent it. The aim of this study is to analyse the evolution of invasive pneumococcal disease (IPD).
Material and methodsObservational study of IPD cases notified to the Epidemiological Surveillance Network of the Autonomous Community of Madrid between 2008 and 2015. The IPD case was defined as the disease caused by Streptococcus pneumoniae, with isolation and DNA or antigen detection, in samples from normally sterile sites. The isolated strains were sent to the Regional Public Health Laboratory for identification of the serotype. Serotypes were classified according to their inclusion in the 7-valent conjugate vaccine (PCV7), in the 13-valent vaccine, but not in the 7-valent vaccine (PCV13-additional) and not included in the 13-valent vaccine (non-PCV). The Incidence Rate Ratios (IRRs) were calculated comparing the 2011-2012 and 2013-2015 periods with the 2008-2010 period.
Results4,307 cases were reported. 86.6% were serotyped. The IRR of IPD was 0.67 and 0.67 for all serotypes; 0.43 and 0.45 for PCV7 serotypes; 0.46 and 0.25 for PCV13-additional serotypes, and 1.01 and 1.32 for non-PCV13 serotypes in the 2011-2012 and 2013-2015 periods. The incidence of serotypes 8, 9N, 10A, 23B, 24F and serogroup 33 increased significantly in the 2013-2015 period. Serotypes 15B and 24F accounted for 24% of non-PCV13 cases in children under 5years, serotypes 8 and 9N for 51% in the population aged 5 to 59years and serotypes 8 and 22F for 25% in the population aged over 59years.
ConclusionsThe incidence of serotypes not included in conjugate vaccines has increased, especially in children under 5years, but the total incidence of IPD has decreased. It is important to continue with the epidemiological and microbiological surveillance programmes to assess the effect of vaccination on the incidence of IPD.
Streptococcus pneumoniae es una causa importante de morbimortalidad, tanto en países de renta alta como en países de renta media1. Produce un amplio espectro de enfermedades, siendo las formas invasoras las más graves.
La medida más eficaz para prevenir la enfermedad neumocócica invasora (ENI) es la vacunación. La Organización Mundial de la Salud recomienda, desde el año 2006, la inclusión de las vacunas conjugadas en los programas de inmunización infantil de todo el mundo2. La utilización de la vacuna conjugada heptavalente (VCN7) ha mostrado reducciones importantes en la incidencia de casos producidos por los serotipos contenidos en ella3,4. Sin embargo, la reducción en los casos producidos por serotipos cubiertos por las vacunas conjugadas podría acompañarse de un aumento en los casos producidos por otros serotipos, disminuyendo el impacto ocasionado por su inclusión en los programas de inmunización infantil3,5–8.
En noviembre del año 2006, la Comunidad de Madrid (CM) incluyó la vacuna conjugada neumocócica frente a 7 serotipos (VCN7 con los serotipos 4, 6B, 9V, 14, 18C, 19F y 23F)9 con una pauta 3+1 con dosis a los 2, 4, 6 y 18meses de edad. En junio de 2010 la VCN7 fue sustituida por la vacuna conjugada neumocócica frente a 13 serotipos (VCN13), que contiene 6 serotipos adicionales a los incluidos en la VCN7 (1, 3, 5, 6A, 7F y 19A), con una pauta 2+1 con dosis a los 2, 4 y 15meses de edad. En julio de 2012 se excluyó la VCN13 del programa de inmunización infantil10, manteniéndose para grupos de riesgo. A partir de entonces la vacuna siguió siendo recomendada por profesionales de pediatría de manera individual con una pauta 3+1 con dosis a los 2, 4, 6 y 15meses. En el año 2015, el Consejo Interterritorial del Sistema Nacional de Salud aprobó un nuevo programa de inmunización infantil en el que se incluía la vacuna del neumococo11, y en mayo de 2015 la CM adaptó su programa de vacunación de acuerdo a las recomendaciones nacionales12 con una pauta 2+1 con dosis a los 2, 4 y 12meses. Las coberturas de vacunación fueron superiores al 90% en menores de 5años13.
La ENI es una enfermedad de declaración obligatoria (EDO) en la CM desde el año 200714. El objetivo de este estudio es analizar la tendencia de la ENI en el período comprendido entre los años 2008 y 2015, así como la incidencia específica por serotipo.
Material y métodosDefinición de casoSe definió como caso de ENI la enfermedad producida por Streptococcus pneumoniae, con aislamiento, detección de ADN o detección de antígeno, en muestras procedentes de sitios normalmente estériles. La forma clínica de presentación de la enfermedad no fue determinante en la definición de caso.
Ámbito del estudioEl estudio incluyó todos los casos de ENI residentes en la CM notificados al Sistema de Vigilancia de EDO desde el año 2008 hasta el año 2015. La CM es una de las comunidades autónomas más pobladas de España. La Red de Vigilancia Epidemiológica cubre casi 6,5millones de personas.
Datos clínicos y de laboratorioLas cepas son obtenidas de muestras clínicas y aisladas en los laboratorios de microbiología de los hospitales públicos y privados de la CM. Una vez aislada la cepa, se envía al Laboratorio Regional de Salud Pública (LRSP) para la identificación del serotipo mediante el test de aglutinación por látex (Pneumo-látex) y la reacción de Quellung. El LRSP notifica los casos a los Servicios de Salud Pública de Área correspondientes, donde se graban en la base de datos del Sistema de EDO de la región.
Se recogieron datos individualizados mediante un formulario estandarizado de EDO que incluía variables sociodemográficas, datos clínicos y estado vacunal. Los datos clínicos se completaron consultando la información contenida en la historia clínica electrónica, y en caso de ser necesaria la ampliación de la información, se preguntó a los médicos que atendieron a los pacientes. Los datos de vacunación se extrajeron del Registro de Vacunas de la CM, que contiene información nominal del estado de vacunación de toda la población desde finales de 2004.
Análisis de los datosSe describió la incidencia acumulada anual de la ENI por 100.000 habitantes según el grupo de serotipos estuviese incluido en la VCN7 (VCN7: 4, 6B, 9V, 14, 18C, 19F y 23F), en los serotipos adicionales incluidos en la VCN13 (VCN13 adicional: 1, 3, 5, 6A, 7F y 19A) o no estuviesen incluidos en ninguna VCN (no VCN). Asimismo se describió la incidencia anual para cada uno de los serotipos VCN13 adicional. Para ello se tuvieron en cuenta los siguientes grupos de edad: 0 a 4años, 5 a 14años, 15 a 39años, 40 a 59años y >59años.
Se consideró el tiempo de seguimiento en tres períodos, atendiendo a las modificaciones en el programa de inmunización y a la epidemiología de la enfermedad: años 2008 a 2010, años 2011 a 2012 y años 2013 a 2015. Se analizó la evolución de la incidencia mediante el cálculo de razones de incidencia (RI) acumulada y su nivel de significación estadística mediante modelos de regresión de Poisson, comparando las incidencias acumuladas de los períodos 2011-2012 y 2013-2015 con la del período 2008-2010. Este análisis se realizó para los grupos de serotipos anteriormente descritos y para los serotipos individuales VCN13 adicional y no VCN más frecuentes. Para el análisis por serotipos individuales se tuvieron en cuenta grupos de edad más amplios (0 a 4años, 5 a 59años y >59años).
Las poblaciones utilizadas se obtuvieron del Padrón Continuo del Instituto de Estadística de la CM15.
ResultadosSe registraron 4.307 casos de ENI en la CM en el período estudiado. El 86,6% de los casos (n=3.730) fueron serotipados.
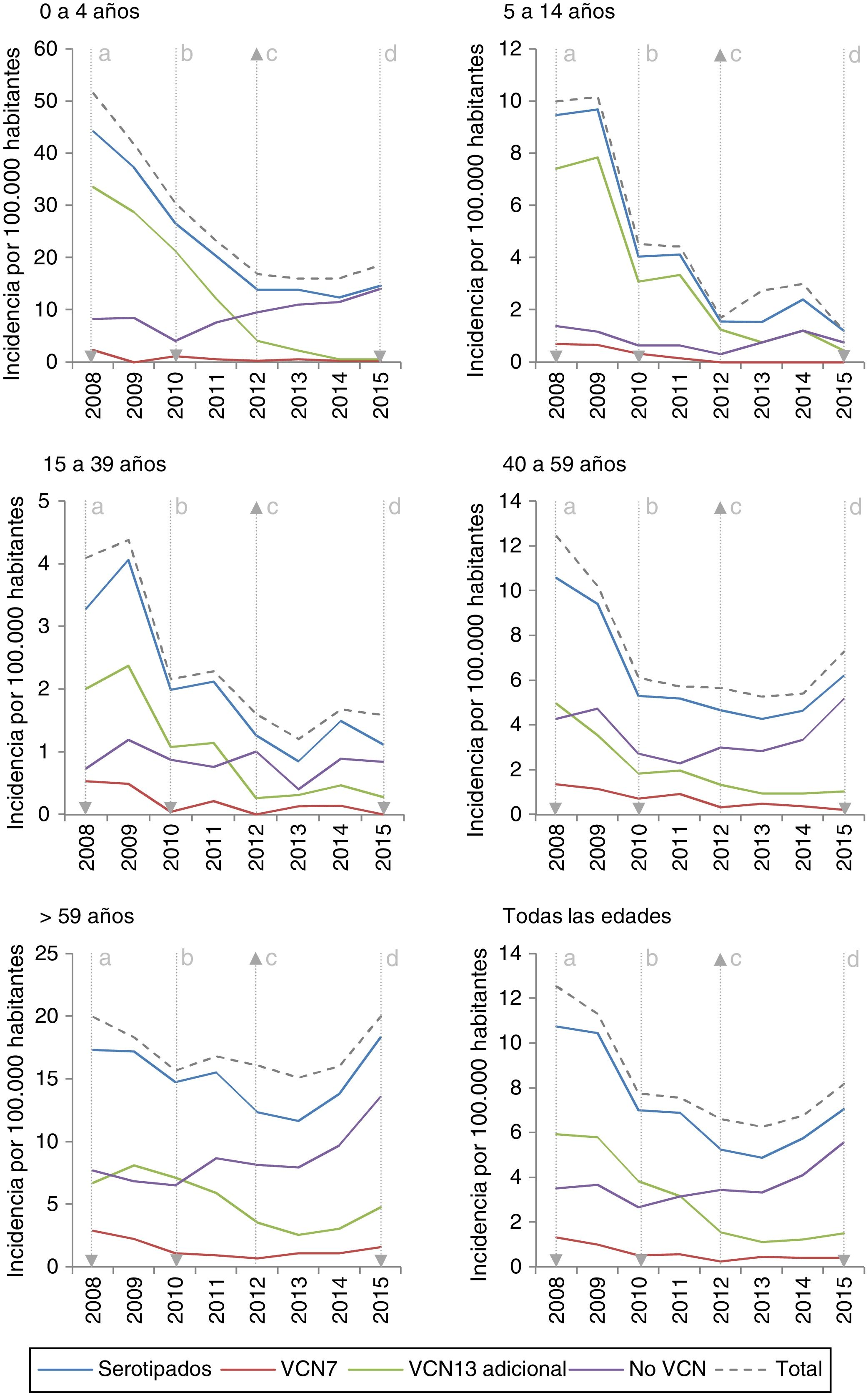
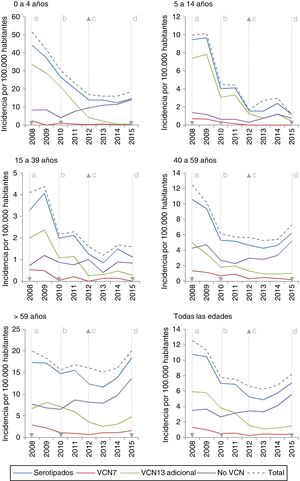
La incidencia de los serotipos VCN7 disminuye desde el inicio del período, pasando de 1,32 en 2008 a 0,42 en 2015, sobre todo en los grupos de edad de 0 a 4años y de 5 a 14años. La incidencia de los serotipos VCN13 adicional disminuye antes de la introducción de la VCN13, pasando de 5,93 en 2008 a 3,82 en 2010, mientras que la incidencia de los serotipos no VCN asciende tras la introducción de la VCN13, pasando de 2,66 en 2010 a 5,56 en 2015, especialmente en los grupos de edad de 0 a 4años y en mayores de 59años (fig. 1).
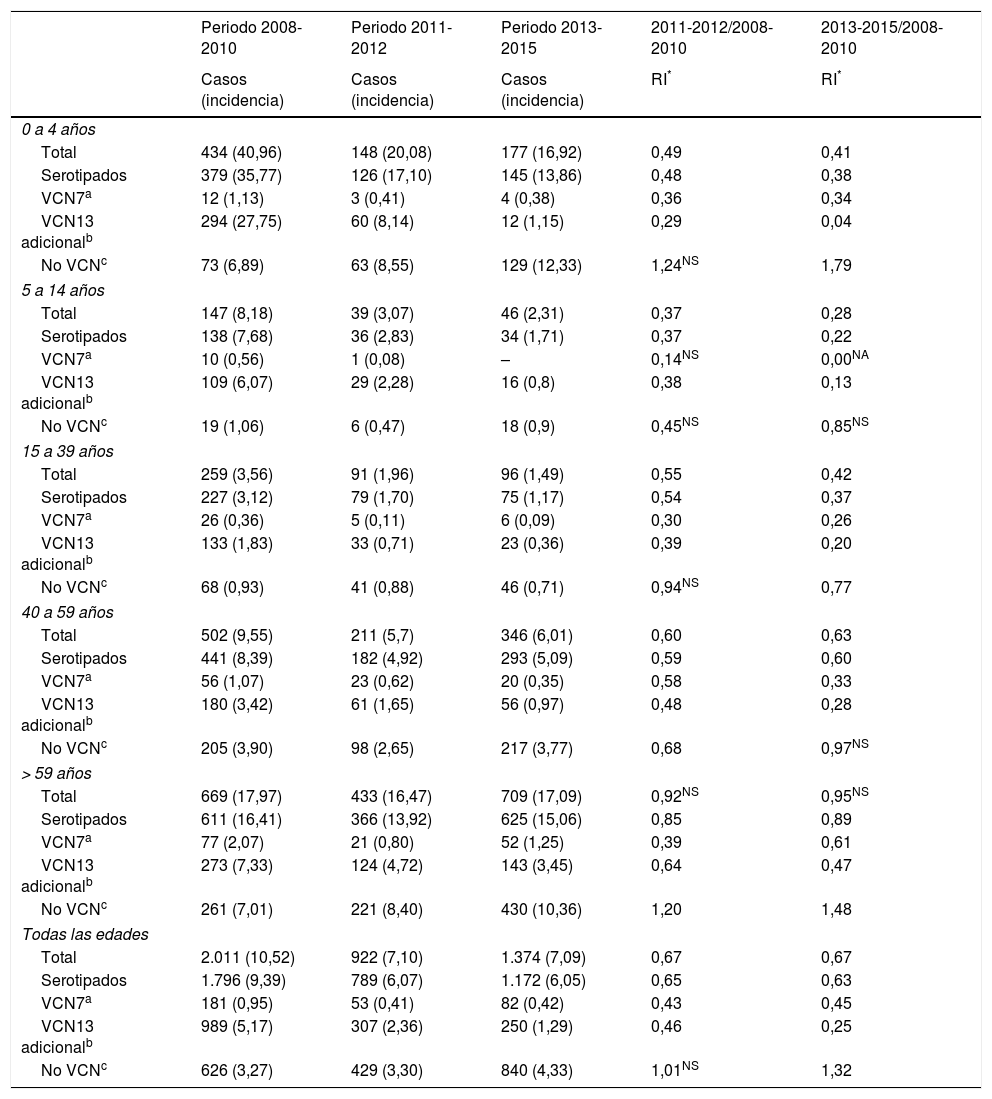
La incidencia de ENI es de 10,52 en el periodo 2008-2010. La RI muestra una reducción en la incidencia de los periodos posteriores, siendo de 0,67 en el periodo 2011-2012 (z=−9,89; p<0,01) y de la misma magnitud en el periodo 2013-2015 (z=−11,28; p<0,01) (tabla 1).
Evolución de la incidencia anual por 100.000 habitantes de enfermedad neumocócica invasora por serotipos según su inclusión en las vacunas conjugadas y grupo de edad. Comunidad de Madrid. Años 2008 a 2015
| Periodo 2008-2010 | Periodo 2011-2012 | Periodo 2013-2015 | 2011-2012/2008-2010 | 2013-2015/2008-2010 | |
|---|---|---|---|---|---|
| Casos (incidencia) | Casos (incidencia) | Casos (incidencia) | RI* | RI* | |
| 0 a 4 años | |||||
| Total | 434 (40,96) | 148 (20,08) | 177 (16,92) | 0,49 | 0,41 |
| Serotipados | 379 (35,77) | 126 (17,10) | 145 (13,86) | 0,48 | 0,38 |
| VCN7a | 12 (1,13) | 3 (0,41) | 4 (0,38) | 0,36 | 0,34 |
| VCN13 adicionalb | 294 (27,75) | 60 (8,14) | 12 (1,15) | 0,29 | 0,04 |
| No VCNc | 73 (6,89) | 63 (8,55) | 129 (12,33) | 1,24NS | 1,79 |
| 5 a 14 años | |||||
| Total | 147 (8,18) | 39 (3,07) | 46 (2,31) | 0,37 | 0,28 |
| Serotipados | 138 (7,68) | 36 (2,83) | 34 (1,71) | 0,37 | 0,22 |
| VCN7a | 10 (0,56) | 1 (0,08) | – | 0,14NS | 0,00NA |
| VCN13 adicionalb | 109 (6,07) | 29 (2,28) | 16 (0,8) | 0,38 | 0,13 |
| No VCNc | 19 (1,06) | 6 (0,47) | 18 (0,9) | 0,45NS | 0,85NS |
| 15 a 39 años | |||||
| Total | 259 (3,56) | 91 (1,96) | 96 (1,49) | 0,55 | 0,42 |
| Serotipados | 227 (3,12) | 79 (1,70) | 75 (1,17) | 0,54 | 0,37 |
| VCN7a | 26 (0,36) | 5 (0,11) | 6 (0,09) | 0,30 | 0,26 |
| VCN13 adicionalb | 133 (1,83) | 33 (0,71) | 23 (0,36) | 0,39 | 0,20 |
| No VCNc | 68 (0,93) | 41 (0,88) | 46 (0,71) | 0,94NS | 0,77 |
| 40 a 59 años | |||||
| Total | 502 (9,55) | 211 (5,7) | 346 (6,01) | 0,60 | 0,63 |
| Serotipados | 441 (8,39) | 182 (4,92) | 293 (5,09) | 0,59 | 0,60 |
| VCN7a | 56 (1,07) | 23 (0,62) | 20 (0,35) | 0,58 | 0,33 |
| VCN13 adicionalb | 180 (3,42) | 61 (1,65) | 56 (0,97) | 0,48 | 0,28 |
| No VCNc | 205 (3,90) | 98 (2,65) | 217 (3,77) | 0,68 | 0,97NS |
| > 59 años | |||||
| Total | 669 (17,97) | 433 (16,47) | 709 (17,09) | 0,92NS | 0,95NS |
| Serotipados | 611 (16,41) | 366 (13,92) | 625 (15,06) | 0,85 | 0,89 |
| VCN7a | 77 (2,07) | 21 (0,80) | 52 (1,25) | 0,39 | 0,61 |
| VCN13 adicionalb | 273 (7,33) | 124 (4,72) | 143 (3,45) | 0,64 | 0,47 |
| No VCNc | 261 (7,01) | 221 (8,40) | 430 (10,36) | 1,20 | 1,48 |
| Todas las edades | |||||
| Total | 2.011 (10,52) | 922 (7,10) | 1.374 (7,09) | 0,67 | 0,67 |
| Serotipados | 1.796 (9,39) | 789 (6,07) | 1.172 (6,05) | 0,65 | 0,63 |
| VCN7a | 181 (0,95) | 53 (0,41) | 82 (0,42) | 0,43 | 0,45 |
| VCN13 adicionalb | 989 (5,17) | 307 (2,36) | 250 (1,29) | 0,46 | 0,25 |
| No VCNc | 626 (3,27) | 429 (3,30) | 840 (4,33) | 1,01NS | 1,32 |
NA: valor p no calculable; NS: cambios estadísticamente no significativos (p≥0,05); RI: razón de tasas de incidencia; –: sin casos.
La incidencia de los serotipos VCN7 se reduce en el periodo 2011-2012 y se mantiene estable en el periodo 2013-2015, aunque en el grupo de >59años la incidencia aumenta en el periodo 2013-2015 sin llegar a los valores del 2008-2010. No obstante, las incidencias anuales para el grupo de >59años son similares en el año 2008 (19,99) y en el año 2015 (20,01) tras una reducción en los años intermedios (fig. 1).
La incidencia de los serotipos VCN13 adicional se reduce en ambos períodos, especialmente en el grupo de 0 a 4años. Los serotipos VCN7 y VCN13 adicional suponen el 28% (332 de 1.172) de los casos serotipados en 2013-2015 y su incidencia más baja en el grupo de 0 a 4años (1,53 casos por 100.000 habitantes) que en el de >59años (4,70 casos por 100.000 habitantes).
Se aprecia un aumento en la incidencia de los serotipos no VCN en el período 2013-2015 (RI=1,32; z=5,30; p<0,01). Este aumento es más marcado en el grupo de 0 a 4años (RI=1,79; z=3,97; p<0,01) y en el de >59años (RI=1,48; z=4,98; p<0,01).
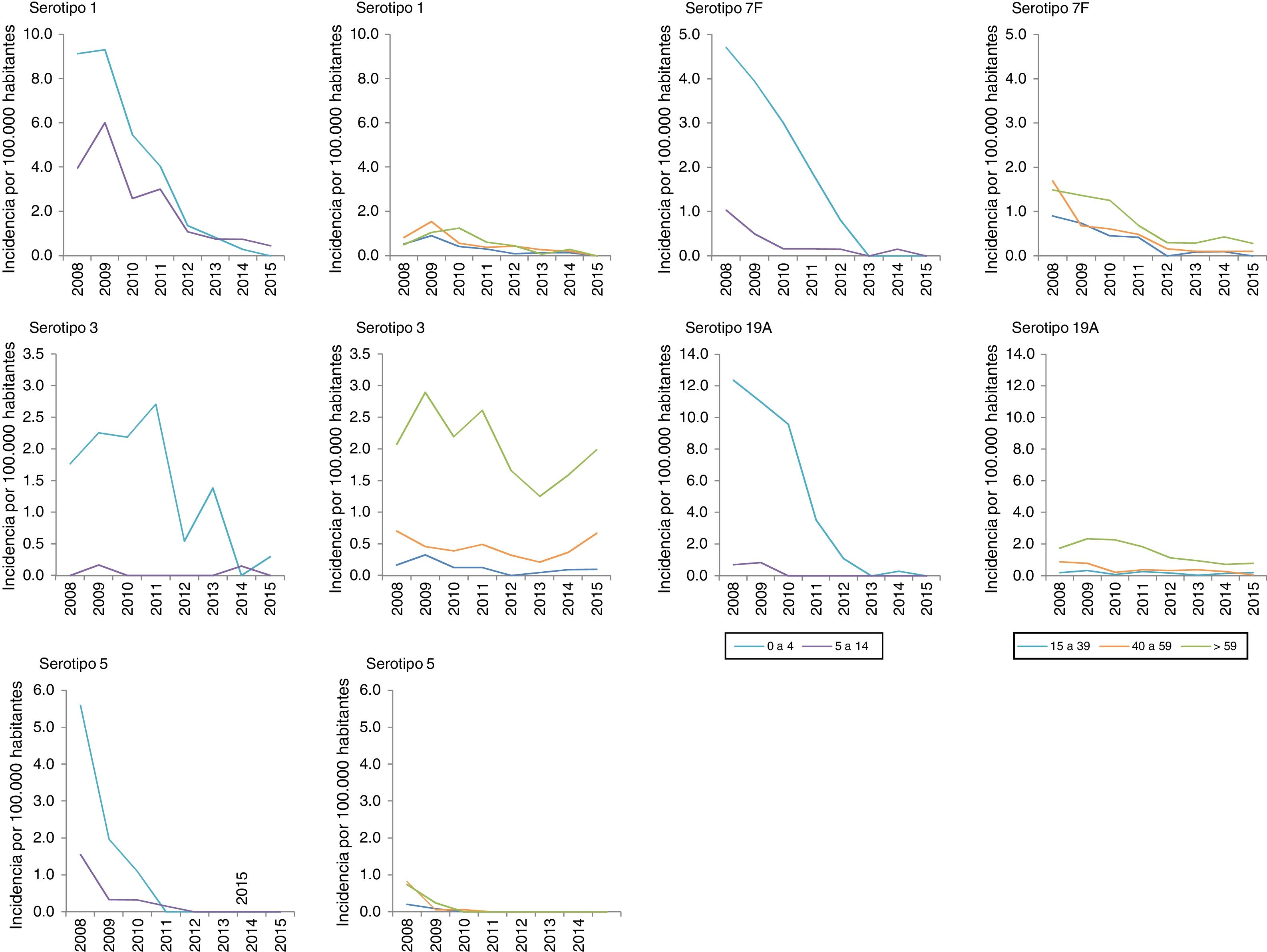
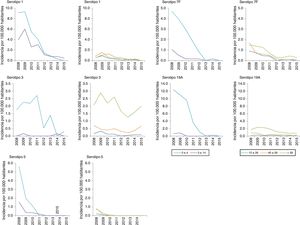
Entre los serotipos VCN13 adicional, el 1 es el de mayor incidencia en el período 2008-2010. La incidencia de los serotipos 1, 5, 6A, 7F y 19A se reduce en todos los grupos de edad. Este descenso comienza antes de la sustitución de la VCN7 por la VCN13 para los serotipos 5 y 7F. El serotipo 3 presenta una fluctuación anual (fig. 2), con una reducción de su incidencia del 33% (RI=0,67; z=−3,27; p<0,01) en el periodo 2013-2015 (tabla 2). Pese a ello, el serotipo3 es el segundo con mayor incidencia (1,61 casos por 100.000 habitantes) en el grupo de >59años en el período 2013-2015. Entre los serotipos no VCN, el 8 es el de mayor incidencia en el período 2013-2015, siendo más notable en el grupo de >59años (1,81 casos por 100.000habitantes).
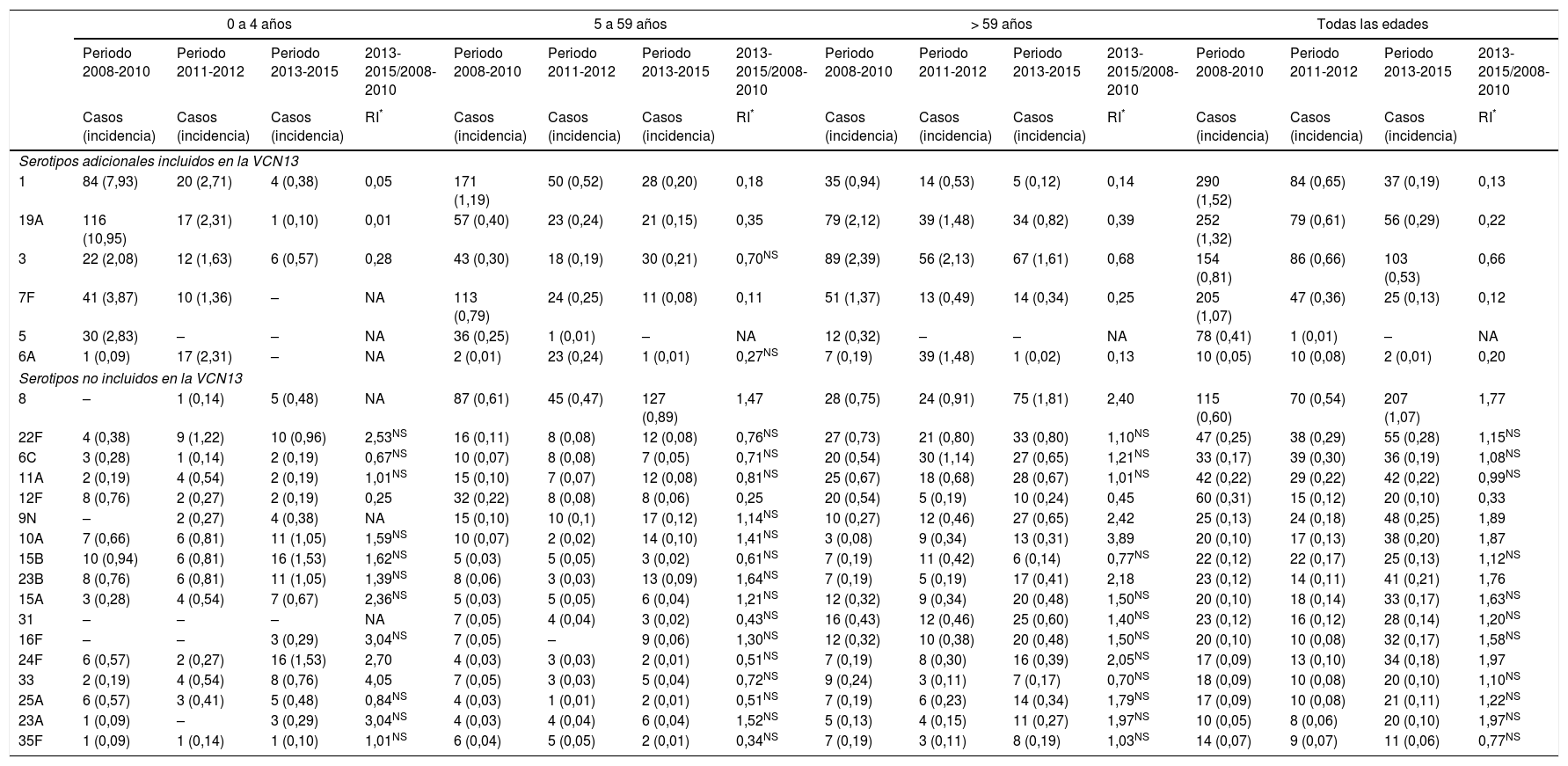
Evolución de enfermedad neumocócica invasora, según período, serotipo y grupo de edad. Comunidad de Madrid. Años 2008 a 2015
| 0 a 4 años | 5 a 59 años | > 59 años | Todas las edades | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Periodo 2008-2010 | Periodo 2011-2012 | Periodo 2013-2015 | 2013-2015/2008-2010 | Periodo 2008-2010 | Periodo 2011-2012 | Periodo 2013-2015 | 2013-2015/2008-2010 | Periodo 2008-2010 | Periodo 2011-2012 | Periodo 2013-2015 | 2013-2015/2008-2010 | Periodo 2008-2010 | Periodo 2011-2012 | Periodo 2013-2015 | 2013-2015/2008-2010 | |
| Casos (incidencia) | Casos (incidencia) | Casos (incidencia) | RI* | Casos (incidencia) | Casos (incidencia) | Casos (incidencia) | RI* | Casos (incidencia) | Casos (incidencia) | Casos (incidencia) | RI* | Casos (incidencia) | Casos (incidencia) | Casos (incidencia) | RI* | |
| Serotipos adicionales incluidos en la VCN13 | ||||||||||||||||
| 1 | 84 (7,93) | 20 (2,71) | 4 (0,38) | 0,05 | 171 (1,19) | 50 (0,52) | 28 (0,20) | 0,18 | 35 (0,94) | 14 (0,53) | 5 (0,12) | 0,14 | 290 (1,52) | 84 (0,65) | 37 (0,19) | 0,13 |
| 19A | 116 (10,95) | 17 (2,31) | 1 (0,10) | 0,01 | 57 (0,40) | 23 (0,24) | 21 (0,15) | 0,35 | 79 (2,12) | 39 (1,48) | 34 (0,82) | 0,39 | 252 (1,32) | 79 (0,61) | 56 (0,29) | 0,22 |
| 3 | 22 (2,08) | 12 (1,63) | 6 (0,57) | 0,28 | 43 (0,30) | 18 (0,19) | 30 (0,21) | 0,70NS | 89 (2,39) | 56 (2,13) | 67 (1,61) | 0,68 | 154 (0,81) | 86 (0,66) | 103 (0,53) | 0,66 |
| 7F | 41 (3,87) | 10 (1,36) | – | NA | 113 (0,79) | 24 (0,25) | 11 (0,08) | 0,11 | 51 (1,37) | 13 (0,49) | 14 (0,34) | 0,25 | 205 (1,07) | 47 (0,36) | 25 (0,13) | 0,12 |
| 5 | 30 (2,83) | – | – | NA | 36 (0,25) | 1 (0,01) | – | NA | 12 (0,32) | – | – | NA | 78 (0,41) | 1 (0,01) | – | NA |
| 6A | 1 (0,09) | 17 (2,31) | – | NA | 2 (0,01) | 23 (0,24) | 1 (0,01) | 0,27NS | 7 (0,19) | 39 (1,48) | 1 (0,02) | 0,13 | 10 (0,05) | 10 (0,08) | 2 (0,01) | 0,20 |
| Serotipos no incluidos en la VCN13 | ||||||||||||||||
| 8 | – | 1 (0,14) | 5 (0,48) | NA | 87 (0,61) | 45 (0,47) | 127 (0,89) | 1,47 | 28 (0,75) | 24 (0,91) | 75 (1,81) | 2,40 | 115 (0,60) | 70 (0,54) | 207 (1,07) | 1,77 |
| 22F | 4 (0,38) | 9 (1,22) | 10 (0,96) | 2,53NS | 16 (0,11) | 8 (0,08) | 12 (0,08) | 0,76NS | 27 (0,73) | 21 (0,80) | 33 (0,80) | 1,10NS | 47 (0,25) | 38 (0,29) | 55 (0,28) | 1,15NS |
| 6C | 3 (0,28) | 1 (0,14) | 2 (0,19) | 0,67NS | 10 (0,07) | 8 (0,08) | 7 (0,05) | 0,71NS | 20 (0,54) | 30 (1,14) | 27 (0,65) | 1,21NS | 33 (0,17) | 39 (0,30) | 36 (0,19) | 1,08NS |
| 11A | 2 (0,19) | 4 (0,54) | 2 (0,19) | 1,01NS | 15 (0,10) | 7 (0,07) | 12 (0,08) | 0,81NS | 25 (0,67) | 18 (0,68) | 28 (0,67) | 1,01NS | 42 (0,22) | 29 (0,22) | 42 (0,22) | 0,99NS |
| 12F | 8 (0,76) | 2 (0,27) | 2 (0,19) | 0,25 | 32 (0,22) | 8 (0,08) | 8 (0,06) | 0,25 | 20 (0,54) | 5 (0,19) | 10 (0,24) | 0,45 | 60 (0,31) | 15 (0,12) | 20 (0,10) | 0,33 |
| 9N | – | 2 (0,27) | 4 (0,38) | NA | 15 (0,10) | 10 (0,1) | 17 (0,12) | 1,14NS | 10 (0,27) | 12 (0,46) | 27 (0,65) | 2,42 | 25 (0,13) | 24 (0,18) | 48 (0,25) | 1,89 |
| 10A | 7 (0,66) | 6 (0,81) | 11 (1,05) | 1,59NS | 10 (0,07) | 2 (0,02) | 14 (0,10) | 1,41NS | 3 (0,08) | 9 (0,34) | 13 (0,31) | 3,89 | 20 (0,10) | 17 (0,13) | 38 (0,20) | 1,87 |
| 15B | 10 (0,94) | 6 (0,81) | 16 (1,53) | 1,62NS | 5 (0,03) | 5 (0,05) | 3 (0,02) | 0,61NS | 7 (0,19) | 11 (0,42) | 6 (0,14) | 0,77NS | 22 (0,12) | 22 (0,17) | 25 (0,13) | 1,12NS |
| 23B | 8 (0,76) | 6 (0,81) | 11 (1,05) | 1,39NS | 8 (0,06) | 3 (0,03) | 13 (0,09) | 1,64NS | 7 (0,19) | 5 (0,19) | 17 (0,41) | 2,18 | 23 (0,12) | 14 (0,11) | 41 (0,21) | 1,76 |
| 15A | 3 (0,28) | 4 (0,54) | 7 (0,67) | 2,36NS | 5 (0,03) | 5 (0,05) | 6 (0,04) | 1,21NS | 12 (0,32) | 9 (0,34) | 20 (0,48) | 1,50NS | 20 (0,10) | 18 (0,14) | 33 (0,17) | 1,63NS |
| 31 | – | – | – | NA | 7 (0,05) | 4 (0,04) | 3 (0,02) | 0,43NS | 16 (0,43) | 12 (0,46) | 25 (0,60) | 1,40NS | 23 (0,12) | 16 (0,12) | 28 (0,14) | 1,20NS |
| 16F | – | – | 3 (0,29) | 3,04NS | 7 (0,05) | – | 9 (0,06) | 1,30NS | 12 (0,32) | 10 (0,38) | 20 (0,48) | 1,50NS | 20 (0,10) | 10 (0,08) | 32 (0,17) | 1,58NS |
| 24F | 6 (0,57) | 2 (0,27) | 16 (1,53) | 2,70 | 4 (0,03) | 3 (0,03) | 2 (0,01) | 0,51NS | 7 (0,19) | 8 (0,30) | 16 (0,39) | 2,05NS | 17 (0,09) | 13 (0,10) | 34 (0,18) | 1,97 |
| 33 | 2 (0,19) | 4 (0,54) | 8 (0,76) | 4,05 | 7 (0,05) | 3 (0,03) | 5 (0,04) | 0,72NS | 9 (0,24) | 3 (0,11) | 7 (0,17) | 0,70NS | 18 (0,09) | 10 (0,08) | 20 (0,10) | 1,10NS |
| 25A | 6 (0,57) | 3 (0,41) | 5 (0,48) | 0,84NS | 4 (0,03) | 1 (0,01) | 2 (0,01) | 0,51NS | 7 (0,19) | 6 (0,23) | 14 (0,34) | 1,79NS | 17 (0,09) | 10 (0,08) | 21 (0,11) | 1,22NS |
| 23A | 1 (0,09) | – | 3 (0,29) | 3,04NS | 4 (0,03) | 4 (0,04) | 6 (0,04) | 1,52NS | 5 (0,13) | 4 (0,15) | 11 (0,27) | 1,97NS | 10 (0,05) | 8 (0,06) | 20 (0,10) | 1,97NS |
| 35F | 1 (0,09) | 1 (0,14) | 1 (0,10) | 1,01NS | 6 (0,04) | 5 (0,05) | 2 (0,01) | 0,34NS | 7 (0,19) | 3 (0,11) | 8 (0,19) | 1,03NS | 14 (0,07) | 9 (0,07) | 11 (0,06) | 0,77NS |
NA: valor p no calculable; NS: cambios estadísticamente no significativos (p≥0,05); RI: razón de tasas de incidencia (por 100.000 habitantes). –: sin casos;
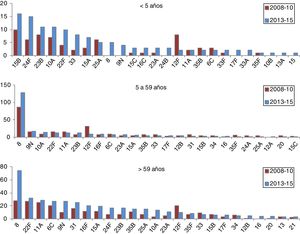
La incidencia de casos por serotipos 8, 9N, 10A, 23B, 24F y serogrupo 33 aumenta de manera estadísticamente significativa en el período 2013-2015 en alguno de los grupos de edad (tabla 2).
En el grupo de 0 a 4años la distribución de los serotipos no VCN es similar en los períodos 2011-2012 y 2013-2015 (fig. 3). Los serotipos de mayor incidencia durante el período 2013-2015 en este grupo de edad fueron: 15B (1,53 casos por 100.000 habitantes), 24F (1,53), 10A (1,05), 23B (1,05) y 22F (0,96). El serotipo 24F y el serogrupo 33 muestran un incremento significativo en este grupo.
Los serotipos no VCN que aumentan su incidencia de forma estadísticamente significativa son, en el grupo de 5 a 59años, el serotipo 8, y en el grupo de >59años, los serotipos 8, 9N, 10A y 23B.
DiscusiónLa introducción de vacunas conjugadas ha tenido un gran impacto en la epidemiología de la ENI. La incidencia de los serotipos vacunales ha descendido, mientras que el comportamiento de los serotipos no incluidos en vacunas conjugadas resulta complejo de interpretar.
En menores de 5años la incidencia de los serotipos incluidos en la VCN13 en el periodo 2013-2015 es similar a la de Inglaterra y Gales (1,43)16 e inferior a la Navarra6,8,17. Las diferencias con Navarra podrían deberse a que su estudio termina en 2013, sin que aún se haya observado el efecto completo de la VCN13.
El descenso en la incidencia de los serotipos VCN13 adicional comienza antes de la introducción de la vacuna. Esta tendencia podría deberse a la caída hasta su práctica desaparición del serotipo5 en el año 2009, descrito como serotipo epidémico18.
Pese al empleo de la VCN13 en niños, el serotipo3 continúa siendo frecuente entre pacientes adultos, por lo que la vacunación infantil no parece tener un impacto sobre la ENI causada por el serotipo3 en el adulto19. Este hecho cuestiona la capacidad para generar protección de grupo frente a este serotipo20.
Antes de la introducción de la VCN13, el serotipo 19A se convirtió en uno de los principales agentes etiológicos de ENI en menores de 5años, asociando altas tasas de resistencia antibiótica y gravedad clínica7. La introducción de la VCN13 redujo la incidencia de este serotipo hasta su práctica desaparición.
Los descensos en la incidencia de los serotipos cubiertos por las vacunas conjugadas se dan en todos los grupos de edad, incluyendo cohortes que no están inmunizadas, lo que apoya la existencia de protección de grupo21 para la mayoría de los serotipos.
La incidencia de los serotipos no VCN desciende antes de la introducción de la VCN13 y aumenta tras su introducción. Este incremento podría deberse a los cambios en la colonización nasofaríngea y la ocupación del nicho ecológico que han dejado libres los serotipos incluidos en las vacunas conjugadas22.
Cabe destacar el incremento de la ENI asociado al serotipo8. Este serotipo ha sido el más frecuente en los últimos años en la CM en población adulta. Recientemente se ha descrito un incremento similar en el Reino Unido23. En España24 y en el resto de Europa25 empieza a ser un serotipo emergente. Aunque no hay estudios de portadores nasales realizados a nivel nacional, los datos de Cataluña26 y Murcia27 muestran una baja prevalencia del serotipo8, lo que indicaría una alta invasividad.
Durante el periodo comprendido entre julio de 2012 y marzo de 2015 la vacuna estuvo fuera del calendario de vacunaciones sistemáticas de la infancia. La incidencia de ENI en ese periodo se mantuvo baja. Esto podría deberse a que se mantuvo financiada para los grupos de riesgo y siguió recomendándose por los pediatras con acceso a la misma por vía privada para el resto de la población infantil. Por otro lado, es posible que los efectos de las modificaciones del programa de inmunización requieran cierto periodo de latencia antes de repercutir en la epidemiología de la enfermedad.
A pesar de la reducción en la incidencia de ENI, se está produciendo un incremento de los casos ocasionados por serotipos no incluidos en las vacunas conjugadas, especialmente en mayores de 59años. Este reemplazo que se observó tras la introducción de la VCN728,29 se describe en otros trabajos con la VCN1316,22. No obstante, la incidencia de la ENI en el año 2015 está por debajo a la incidencia de 2008, por lo que el efecto de reemplazo aún no está establecido en nuestro medio.
Aunque la protección de grupo de la vacuna polisacárida esté en discusión, es posible que esta vacuna influya en la epidemiología de la ENI al inmunizar frente a serotipos contenidos en las vacunas conjugadas. No obstante, los serotipos incluidos en las vacunas conjugadas son más frecuentes en edades infantiles, salvo el serotipo3, que es más frecuente en mayores de 59años.
El sistema de vigilancia de ENI se inició en el año 2007 pero en los primeros meses no se recogieron datos y, al ser un año incompleto, se excluyó del estudio. De este modo, la principal fortaleza de este estudio es que el sistema de vigilancia de EDO de la CM recoge datos poblacionales de manera activa y consistente y no ha sufrido cambios relevantes durante el período 2008-2014. Otra fortaleza es la labor desempeñada por los laboratorios en la gestión de las muestras para su serotipado, dado que únicamente se desconocía el serotipo en el 13,4% de los casos. Nuestro estudio refleja la epidemiología de la ENI en una situación particular y poco común como es la retirada de la vacuna del programa de inmunización infantil con cargo a la administración pública.
Una de las debilidades de este estudio es la carencia de datos previos a la introducción de la VCN7. Con información de ese período se podría estudiar mejor la reducción en la incidencia. Las características de este estudio tampoco permiten conocer si los cambios detectados son debidos a la modificación del programa de inmunización infantil o a otros factores como la tendencia secular de la enfermedad, la presión antibiótica, los cambios en la notificación o cambios debidos al azar30. Es posible que alguno de estos factores esté presente en nuestro estudio, ya que la reducción en la incidencia de los casos producidos por serotipos adicionales incluidos en la VCN13 es previa a la introducción de la VCN13.
El lugar de aislamiento de las cepas puede condicionar el serotipado. Las muestras obtenidas de derrame pleural no son detectables por cultivo. En estas situaciones la identificación de serotipo mediante PCR podría constituir una alternativa al cultivo31 para conocer su serotipo. Muchos de estos casos de derrame pleural con cultivo negativo son causados por el serotipo132. Además, debido a las enzimas líticas del S.pneumoniae (autolisina y neumolisina), algunas cepas pueden perder su viabilidad en pases seriados por cultivo impidiendo llegar a realizar el serotipado33. Estas situaciones explican algunas diferencias entre la incidencia de los casos serotipados y los casos totales. No obstante estas discrepancias parecen deberse al azar, al ser su distribución homogénea a durante los años del estudio y entre los grupos de edad.
Como conclusión, el estudio muestra una reducción importante en la incidencia de la ENI producida por serotipos adicionales incluidos en la VCN13 en todos los grupos de edad, lo que apoya la existencia de protección de grupo. Si bien en conjunto la reducción de la incidencia ha sido del 43%, la incidencia de serotipos no incluidos en vacunas conjugadas ha aumentado de manera ininterrumpida, especialmente en menores de 5años, pero este aumento todavía no ha compensado la caída de los serotipos vacunales. Los serotipos 8 y 22F suponen el 28,5% de los no incluidos en las vacunas. En el futuro la investigación en vacunas con nuevos serotipos podría aportar un valor importante a las intervenciones en salud pública para controlar la ENI. En todo caso, es imprescindible continuar con los programas de vigilancia activa, epidemiológica y microbiológica para valorar el efecto de la vacunación sobre la incidencia de la enfermedad invasiva34,35.
FinanciaciónEste trabajo fue parcialmente financiado por SpIDnet (Evaluación del impacto de la vacunación con las vacunas conjugadas en la epidemiología de la enfermedad neumocócica invasiva en Europa), una red financiada por el Centro Europeo para la Prevención y el Control de Enfermedades.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.