Introducción
La mayoría de los pacientes que ingresa en las unidades de Cuidados Intensivos (UCI) y requiere soporte ventilatorio precisa de la administración de sedación y analgesia para aliviar la ansiedad, la agitación, el dolor, mejorar la adaptación del paciente a la ventilación mecánica y proporcionarle un estado lo más confortable posible. Conseguir adecuar el grado de sedoanalgesia al estado fisiopatológico del paciente y a las necesidades de soporte ventilatorio constituye un aspecto fundamental del correcto manejo terapéutico y evolución del enfermo crítico. Los niveles inadecuados de sedoanalgesia pueden provocar importantes efectos perjudiciales en el paciente, aumentando la morbimortalidad, el tiempo de ventilación mecánica, la estancia en UCI, la estancia hospitalaria, las secuelas físicas, las psicológicas y los costes1-6.
El continuo y frecuente manejo de la sedoanalgesia en el paciente crítico hace que la valoración del nivel de sedación constituya un factor de gran importancia para los profesionales que trabajan en la UCI. Las escalas de valoración de la sedación (EVS) son instrumentos subjetivos que, en general, miden la respuesta de los pacientes a la estimulación auditiva o física, a través de la observación7. En los últimos años se han realizado múltiples estudios que intentan identificar una EVS ideal, es decir, válida, fiable, fácil de recordar y utilizar con un entrenamiento mínimo, caracterizada por: determinar el grado de sedación y agitación, aplicarse en distintos tipos de pacientes, establecer un objetivo de sedación, poseer suficientes niveles que permita el ajuste de la medicación, indicar descriptores del comportamiento y desarrollarse de forma multidisciplinar7-9.
La enfermera de intensivos constituye una figura clave para conseguir un adecuado nivel de sedoanalgesia porque, en sus actividades diarias a pie de cama, realiza una valoración continua del paciente, detecta cualquier cambio en su estado, aplica técnicas y cuidados molestos y dolorosos, y administra medicación analgésica y sedante. Por ello debe conocer, dominar y utilizar las EVS en el día a día, para monitorizar el grado de sedoanalgesia que presentan los pacientes y favorecer que se alcance su nivel óptimo. Sin embargo, la realidad es que una importante proporción de las enfermeras que trabajan en las UCI no conocen, no saben qué evalúan y por tanto no aplican las EVS10. Está demostrado que es necesario el uso de EVS, pero estas están infrautilizadas8.
La evaluación del dolor, del nivel de sedación y de la agitación, realizada por las enfermeras mediante la utilización de escalas y la intervención médica precoz, se asocia a un descenso de la incidencia e intensidad del dolor y de la agitación2. El trabajo en equipo a este nivel mejora la calidad asistencial y la seguridad del paciente, y disminuye el tiempo de sedación, de ventilación mecánica y la incidencia de infecciones nosocomiales2,3,4,11.
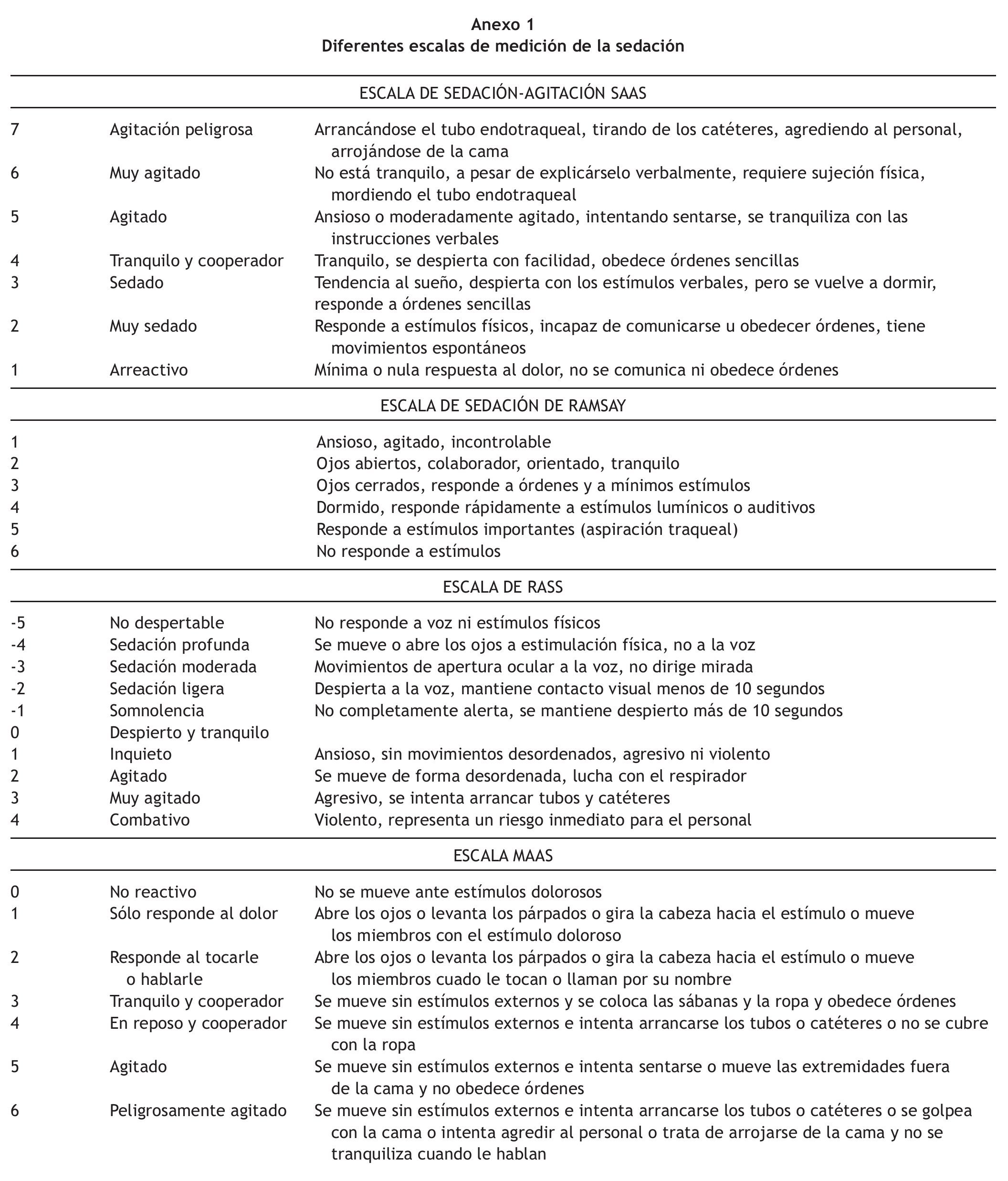
Existe una amplia variedad de EVS, aunque sólo una minoría son utilizadas y conocidas. Las EVS tratadas en este artículo incluyen: escala de Ramsay, escala de sedación-agitación (SAS), escala de evaluación de la actividad motora (MAAS) y escala de sedación-agitación de Richmond (RASS). Las categorías de todas estas EVS se reflejan en el Anexo 1.
La EVS que primero apareció fue diseñada por Ramsay en 197412. Es la EVS más conocida, se emplea rutinariamente en las UCI, es muy sencilla, pero no valora adecuadamente los estados de agitación y sobresedación13-15. En la actualidad todavía no se ha demostrado científicamente su fiabilidad y validez, aunque existe constancia de correlación entre el Ramsay, potenciales evocados16, la Glasgow Coma Scale (GCS) modificada por Cook y Palma y la escala de SAS para valorar la sedación17-19.
La escala de SAS fue planteada por Riker en 199420 y validada en 199921, en Portland y en investigaciónes posteriores14,17. Es la primera en ser diseñada para pacientes adultos y en aplicarse a pacientes ventilados y no ventilados artificialmente22; refleja mejor que el Ramsay la agitación23, es sencilla y puedeser utilizada por personal sin experiencia previa24.
La escala de MAAS fue desarrollada y validada por el grupo de Clement en Salt Lake City (Utah) en 199925 y actualmente ha sido validada científicamente frente a VAS (Visual Analog Scale) y signos vitales como presión sanguínea y frecuencia cardiaca14,17,25. Ésta deriva de la SAS, emplea una clara y concisa descripción de cada categoría25 y clasifica a los pacientes críticos a través de su actividad motora, como principal marcador de sedación23.
La escala de RASS fue desarrollada en 1999 por un equipo multidisciplinar del Hospital Universitario de Richmond, Virginia, y validada en 20028,26; posteriormente se ha comprobado su validez y fiabilidad en otros estudios14,27. Es útil en pacientes quirúrgicos y no quirúrgicos26 e incluye la valoración del delirio y la agitación8,23,28,29.
Durante el cuidado del paciente crítico se observa que los cambios en las dosis de sedoanalgesia provocan cambios en los datos clínicos y en las puntuaciones obtenidas en las EVS. Por ello los objetivos de nuestro estudio fueron:
1. Conocer si existe asociación entre las puntuaciones dadas por las EVS, los datos clínicos y las dosis de sedoanalgesia en perfusión (SAP).
2. Comprobar la correlación entre distintas EVS del paciente crítico con ventilación mecánica.
Material y métodos
En la UCI Polivalente (UCI-P) del Hospital Universitario 12 de Octubre, de 11 camas, se realizó un estudio analítico longitudinal prospectivo. La muestra incluyó a los pacientes adultos que ingresaron en la UCI-P desde octubre a diciembre de 2006, que precisaron SAP con midazolan asociado a cloruro mórfico, vía aérea artificial (tubo orotraqueal o cánula de traqueostomía) y ventilación mecánica más de 24 horas (técnicas de soporte ventilatorio total y/o parcial). Se excluyeron los pacientes con déficit audiovisuales, tetraplejia, dificultad para la comunicación por desconocimiento del idioma y alergia conocida o sospechada a midazolan o cloruro mórfico.
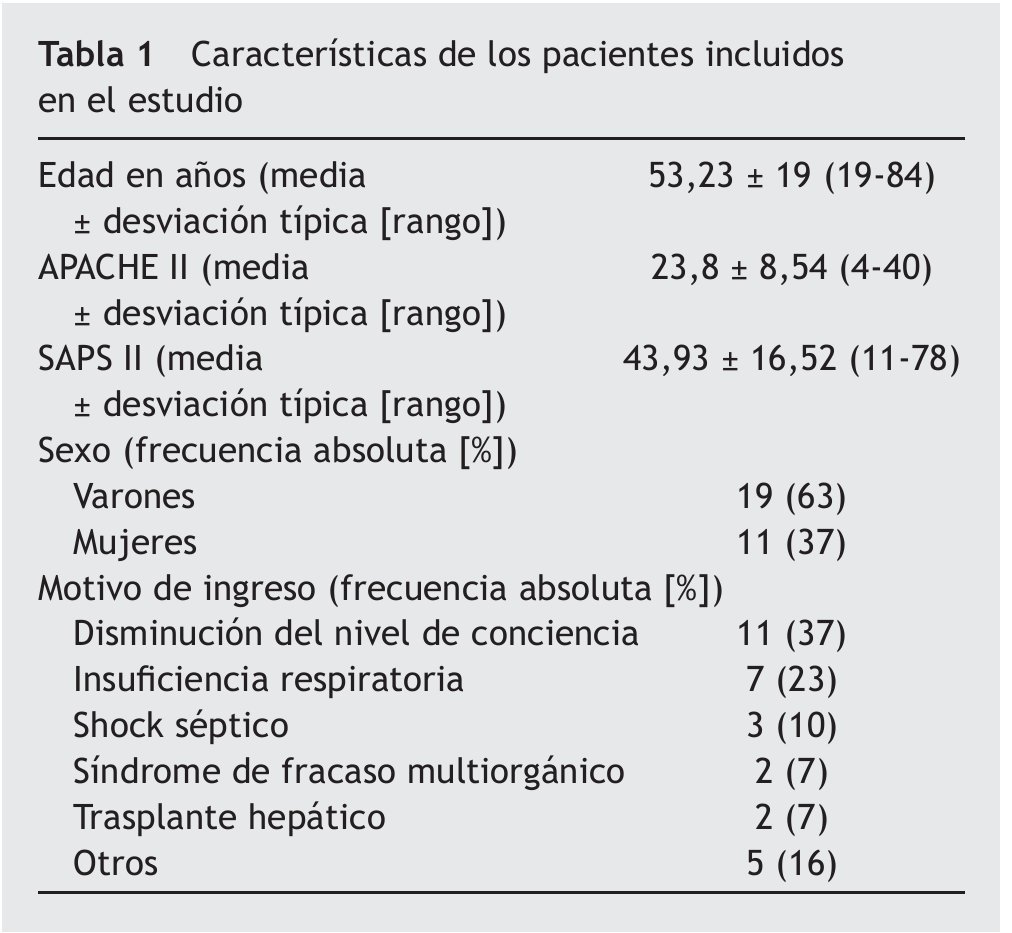
Las variables estudiadas fueron: edad, sexo, motivo de ingreso, APACHE II, SAPS II, estancia en UCI, mortalidad al alta de UCI, días de ventilación mecánica, de intubación orotraqueal (no incluyendo los días de traqueotomía), de SAP y de relajación en perfusión (RP). Además se registró la presencia de las siguientes complicaciones:
1. Necesidad de fármacos vasoactivos en infusión continua: noradrenalina, dopamina y dobutamina.
2. Arritmias: definidas como todos los ritmos cardiacos que no fueron ritmo sinusal normal, identificadas mediante monitorización y/o trazado electrocardiográfico.
3. Técnicas de reemplazo renal continuo: hemofiltración y hemodialfiltración venovenosa continua durante al menos 24 horas.
4. Síndrome de fracaso multiorgánico (SDMO): cuadro caracterizado por el deterioro progresivo de múltiples sistemas de órganos.
5. Accidente cerebrovascular agudo (ACVA).
6. Tratamiento antihipertensivo.
Se entrenaron 9 enfermeras en la evaluación de las EVS, que registraron el valor promedio de las siguientes variables: Ramsay, SAS, MAAS y RASS, dosis de SAP, tensión arterial media (TAM), frecuencia cardiaca (FC), frecuencia respiratoria (FR), tamaño pupilar y modalidad ventilatoria de todos los pacientes incluidos en el estudio. Estos registros se realizaron cada 3 horas durante el día y cada 9 horas por la noche, para respetar el descanso del paciente, a las 9, 12, 15, 18, 21 y 6 horas. Los valores registrados se obtenían del cálculo del promedio de las distintas variables, mediante entrevista con la enfermera responsable del paciente, revisión de la gráfica, del registro de tendencias del monitor y de la observación directa del paciente. Las mediciones se efectuaron durante un periodo máximo de 30 días o hasta el fallecimiento del paciente en la UCI o hasta 24 horas postextubación; si el paciente era reintubado antes de 24 horas y no se habían alcanzado los 30 días de registro se continuaron registrando las variables estudiadas.
Se calcularon, de todas las variables estudiadas, la media, la desviación típica, la mediana, el máximo, el mínimo y el rango intercuartílico. Se empleó el coeficiente de correlación de Spearman para conocer la relación existente entre las distintas EVS y la asociación entre las puntuaciones obtenidas en las EVS, dosis de SAP, TAM, FC, FR y tamaño pupilar, con el paquete informático SAS Enterprise Guide.
Resultados
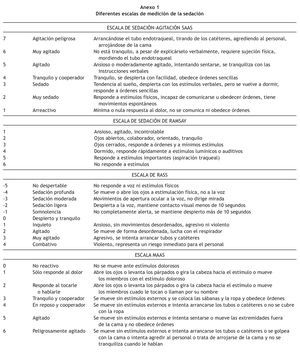
Durante el periodo estudiado ingresaron en la UCI-P un total de 128 pacientes, de los cuales 30 precisaron SAP con midazolan asociado a cloruro mórfico, vía aérea artificial y ventilación mecánica durante más de 24 horas. Los 98 pacientes restantes no se incluyeron en la muestra por presentar criterios de exclusión o no cumplir los criterios de inclusión. Las características de los pacientes incluidos en el estudio se muestran en la tabla 1. Entre los pacientes ingresados con disminución del nivel de conciencia, que fueron 11 (37%), diferenciamos: 6 (55%) por hemorragia cerebral, 1 (9%) por intoxicación medicamentosa, 2 (18%) por coma toxico-metabólico, 1 (9%) por estatus convulsivo y 1 (9%) por embolismo aéreo cerebral. La mediana y el rango intercuartílico de la estancia en UCI fue de 15,5 días y 20 días, respectivamente. La mortalidad al alta de la UCI, de los pacientes incluidos en el estudio, fue del 34%.
La mediana y el rango intercuartílico de la duración de la ventilación mecánica fue de 9 y 14 días, de SAP, 6 y 5,5 días, y de intubación orotraqueal, 10 y 11,75 días, respectivamente. Se realizó traqueotomía y se administró RP a un 40% de los pacientes, presentando esta última variable una mediana de 2 días, con un rango intercuartílico de 5 días.
Necesitaron fármacos vasoactivos 24 de los pacientes (80%), 13 (43%) sufrieron algún tipo de arritmias, técnicas de reemplazo renal 8 pacientes (27%), SDMO con sepsis 8 pacientes (27%), un solo paciente presentó ACVA (3%) y 2 pacientes precisaron tratamiento antihipertensivo (7%).
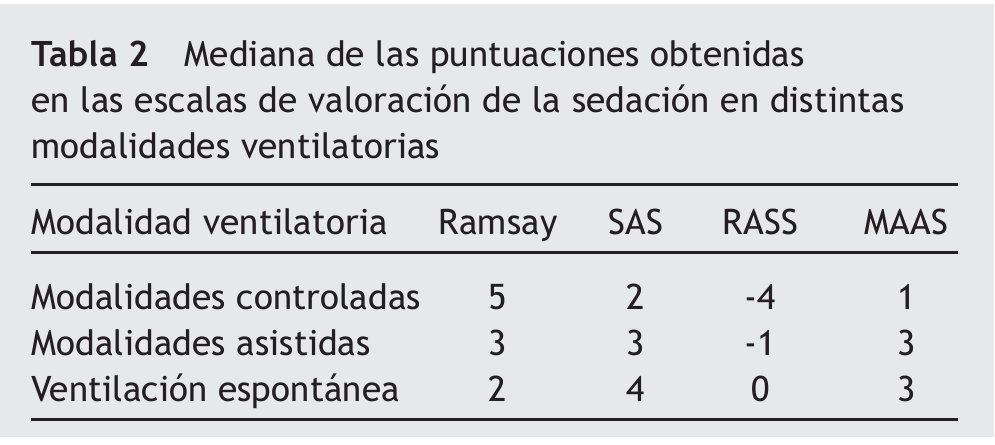
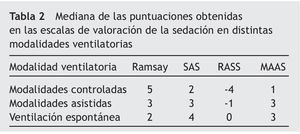
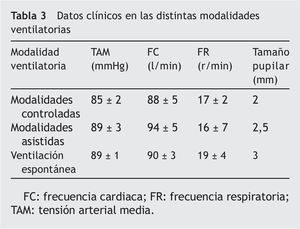
Se obtuvieron 2.412 mediciones de cada una de las variables evaluadas 6 veces al día: Ramsay, SAS, MAAS, RASS, TAM, FC, FR, tamaño pupilar y dosis de SAP. La mediana de la puntuación obtenida del Ramsay, SAS, MAAS y RASS en modalidades controladas (presión control, volumen control y volumen control regulado por presión) fue 5, 2, -4 y 1; en las modalidades asistidas (soporte inspiratorio y ventilación mandatoria intermitente sincronizada más soporte inspiratorio) fue 3, 3, -1 y 3, y en ventilación espontánea (a través de tubo en T con oxigenoterapia o tras extubación con mascarilla o gafas nasales) fue 2, 4, 0 y 3, respectivamente, como muestra la tabla 2. En las modalidades controladas la dosis media de midazolan en perfusión fue de 0,28 ± 0,04 mg/kg/h, y de cloruro mórfico de 0,026 ± 0,005 mg/kg/h, mientras que en modalidades asistidas y en ventilación espontánea no se empleó midazolan más mórfico en perfusión. Las medias de la TAM, FC, FR y el tamaño pupilar en las distintas modalidades de ventilación se reflejan en la tabla 3.
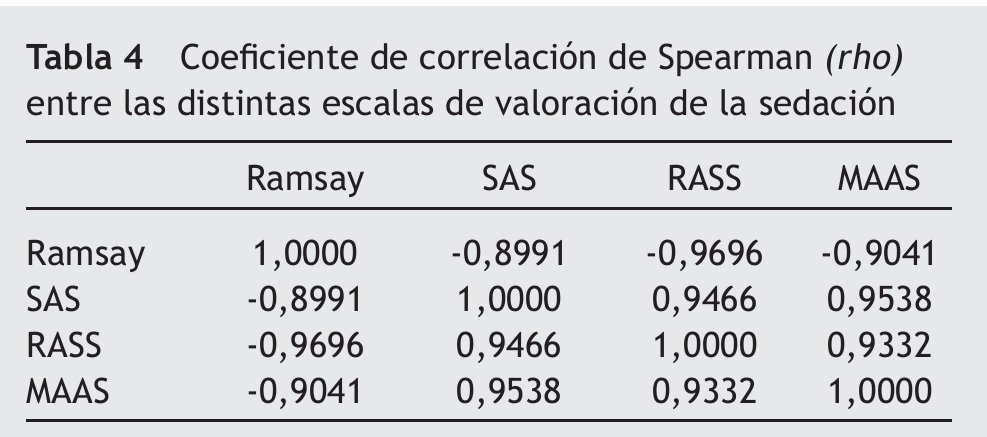
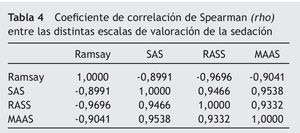
Se observó una buena correlación entre todas las EVS, con una p < 0,0001. La asociación entre SAS, RASS y MAAS fue directa, mientras que éstas se relacionaron inversamente con el Ramsay. La tabla 4 muestra el coeficiente de correlación de Spearman entre las distintas EVS.
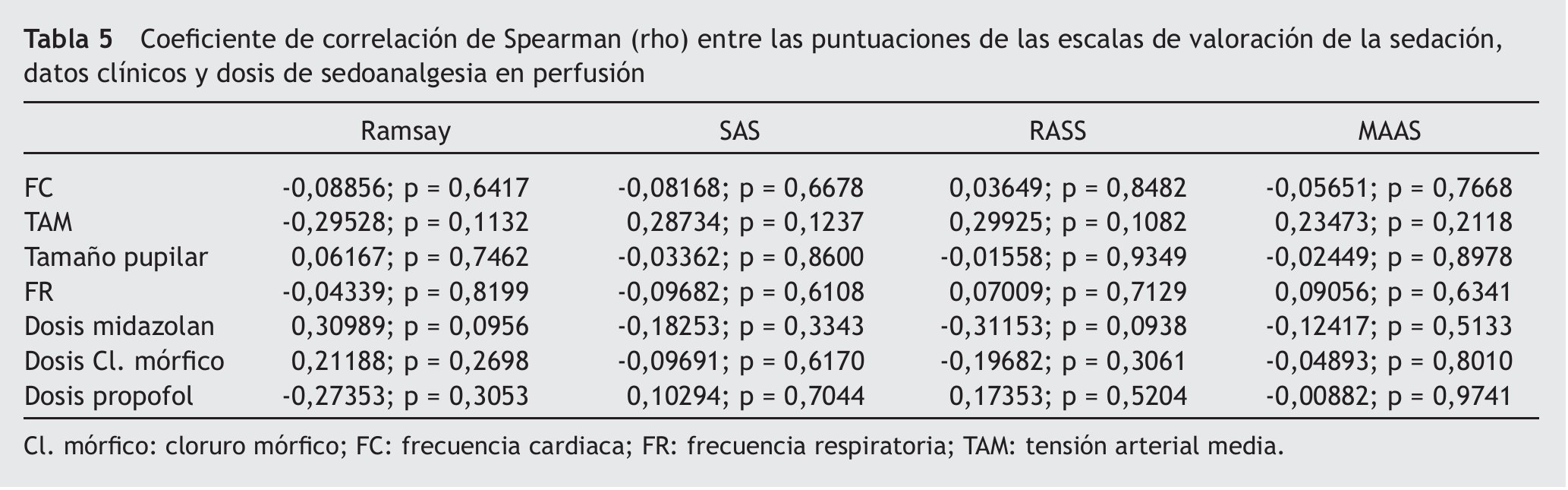
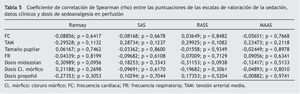
No se encontró relación estadísticamente significativa con p < 0,05 entre las puntuaciones de las EVS, los datos clínicos (TAM, FC, FR y tamaño pupilar) y las dosis de SAP, como se puede observar en la tabla 5.
Discusión
La muestra obtenida para este estudio fue muy heterogénea, porque se realizó en una UCI-P, que atiende a enfermos con gran variedad de patologías. Se incluyeron pacientes neurocríticos, a pesar de que algunos estudios sobre este tema los excluyen24,25,30, dado que constituyen un alto porcentaje de los ingresos de nuestra unidad y nos interesaba conocer las limitaciones y posibilidades de utilización de las EVS en este tipo de pacientes. En aquellos que no presentan importantes secuelas neurológicas que afecten a la movilidad, comunicación o nivel de conciencia, tras un accidente cerebrovascular, es factible la utilización de las EVS. También se incluyeron en el estudio los pacientes que recibieron relajación neuromuscular, a pesar de que investigaciones previas los excluyen8,21,24,25,30. En estos no se puede valorar el grado de sedación con las EVS, puesto que su respuesta a estímulos está limitada por la acción de los bloqueadores neuromusculares. Sin embargo, precisaron esta medicación una mediana de 2 días, un 40% de los pacientes. Un buen método para valorar la profundidad de la sedación, en enfermos que requieren relajantes neuromusculares y en los que presentan daño cerebral, es la monitorización y el análisis del electroencefalograma, mediante el índice biespectral (BIS)27,31.
Aunque el tamaño de la muestra no fue muy elevado, se realizaron numerosas mediciones de las variables estudiadas con respecto a otras investigaciones realizadas8,25,26,30, confirmando así la excelente relación existente entre SAS, MAAS y RASS (escalas validadas) y la escala de Ramsay. A pesar de que esta última es la más antigua, difundida y simple, no ha sido validada. Sin embargo, estudios recientes han intentado su validación frente a la GCS modificada por Cook y Palma (1993/1999), frente a potenciales evocados (1999) y frente a SAS (1999)16-19,21.
Existen múltiples investigaciones que han encontrado asociación estadísticamente significativa entre distintas EVS, como: Ramsay frente a Sedic Score30, SAS frente a Escala de Harris y Ramsay21, MAAS frente a VAS25 y RASS frente a VAS, Ramsay y SAS14.
El no haber encontrado correlación entre las dosis de SAP y las puntuaciones de las EVS puede explicarse porque el descenso de las dosis de SAP es más rápido que el cambio en la puntuación de las EVS. Además, en los estados reflejados en las EVS, que van desde tranquilo y despierto hasta peligrosamente agitado, el paciente habitualmente no recibe SAP. No obstante, en el estudio realizado por Ely et al26 se encontró asociación entre RASS y las dosis de sedoanalgesia.
Es evidente que los datos clínicos y las dosis de SAP cambian a medida que el paciente está más despierto y tiene mayor autonomía ventilatoria, como muestra la tabla 3. Quizá sea el método empleado en la recogida de datos, mediante el registro de promedios, una de las causas de no haber encontrado asociación entre las puntuaciones obtenidas en las EVS, los datos clínicos y las dosis de SAP, ya que otros estudios que han encontrado relación entre alguna de estas variables realizan mediciones puntuales25,26. Dada la dificultad de realizar una monitorización horaria de las EVS, se decidió registrar los promedios de las distintas variables 6 veces al día para intentar aproximarnos al conocimiento horario de las EVS. En 1992 se desarrolló un estudio que trataba de correlacionar la escala de Confort con la de Ramsay y ciertas variables, de las cuales las que menor relación guardaron con estas escalas fueron la TAM, la FC y el tono muscular22,32. Sin embargo, la investigación en la que se presentó y validó la escala MAAS, mediante mediciones puntuales de las variables analizadas, obtuvo una asociación positiva estadísticamente significativa entre esta y los cambios progresivos en la TAM y la FC25.
De todas formas, los datos clínicos del enfermo crítico se encuentran influidos por una gran cantidad de factores, no solo por las dosis de SAP y el grado de sedación. Los pacientes que ingresan en la UCI frecuentemente presentan un deterioro hemodinámico, arritmias, déficit neurológico, complicaciones respiratorias y precisan técnicas terapéuticas, que inciden directamente sobre los datos clínicos del paciente. Es probable que esto haya influido de forma determinante en el hecho de no haber encontrado correlación entre las EVS y los datos clínicos, puesto que en la muestra la mayoría de los pacientes precisó fármacos vasoactivos, casi un tercio requirió técnicas de reemplazo renal continuo, prácticamente la mitad presentó arritmias y en torno a un tercio SDMO con sepsis.
Desde que surgió la escala de Ramsay, con el paso de los años han aparecido multitud de EVS, con la finalidad de encontrar la escala de sedación ideal. En los últimos años ha aumentado la preocupación por mantener un nivel de sedación óptima, ya que se ha demostrado que mejora el pronóstico, la evolución y disminuye la estancia en UCI1-6. Este hecho hace que el estudio y la búsqueda de la escala ideal se encuentre en pleno apogeo y sea un tema de máxima actualidad.
Las EVS, en su aparición de forma cronológica, han ido incrementando el número de niveles y de descriptores de cada uno de estos, siendo así más específicas y completas. La escala que requiere de menor tiempo para su aplicación es Ramsay debido a su sencillez, porque presenta menos niveles de sedación que el resto de escalas estudiadas, y quizá por esto tiene mejor difusión y aceptación. Pero las escalas más útiles y eficaces son aquellas que nos permiten una mayor concreción del grado de sedación-agitación y para ello incluyen más descriptores y niveles de sedaciónagitación, como son MAAS y RASS, siendo estas las EVS recomendadas por la Society of Critical Care Medicine30.
Tras la realización de esta investigación apreciamos que el empleo de las EVS tiene ciertas dificultades en nuestra UCI, dado que un elevado porcentaje de los pacientes ingresa por disminución del nivel de conciencia y precisa relajación neuro-muscular. Por ello sería de gran utilidad disponer de algún método objetivo aplicable a todos los pacientes, como es el BIS.
Conclusiones
Este estudio demuestra que la escala de Ramsay, no validada actualmente, tiene una fuerte relación con las escalas SAS, RASS y MAAS, ya validadas en investigaciones previas.
Las EVS son subjetivas y en este estudio no se correlacionan con los datos clínicos y las dosis de SAP. Probablemente se deba a las múltiples complicaciones que presenta el paciente crítico, así como al reducido tamaño y heterogeneidad muestral.
Agradecimientos
Agradecemos la colaboración desinteresada de la Supervisora de Enfermería de la UCI-P Guadalupe Fontán Vinagre, las enfermeras de la UCI-P Alicia Ramiro Jiménez y Mónica del Pilar Martínez García, la doctora Mercedes Catalán González (médico adjunto del Servicio de Medicina Intensiva UCI Polivalente), Wigberta Martín Roncero (directora de la Biblioteca del Hospital 12 de Octubre), al departamento de estadística y a todo el equipo asistencial (enfermeros, médicos, auxiliares de enfermería y celadores) de la UCI-P del Hospital Universitario 12 de Octubre por la ayuda prestada.
* Autor para correspondencia.
Correo electrónico: mariajesusfrade@yahoo.es (M.J.Frade Mera).
Aceptado para su publicación el 6 de abril de 2009.