INTRODUCCIÓN
Desde la publicación de los estudios Van den Berghe et al1,2, donde se demuestra que mantener unos niveles de glucosa plasmática por debajo de 110 mg/ dl reduce la mortalidad y morbilidad de los enfermos quirúrgicos1 y de los enfermos médicos con una estancia superior de tres días2, el control estricto de la glucemia se ha convertido en una práctica rutinaria en las Unidades de Cuidados Intensivos (UCI).
Son varios los métodos utilizados para las determinaciones de glucemia en los pacientes críticos: determinación mediante glucómetro a pie de cama, en muestra de sangre capilar, arterial o venosa y determinación, en laboratorio, en plasma obtenido de sangre arterial o venosa. Todos estos métodos pueden coexistir y ser utilizados simultáneamente en el mismo paciente.
El método más utilizado en las UCI, por su rapidez y por minimizar las pérdidas de sangre, es la determinación a través de glucómetro a la cabecera del paciente. Aunque es un método aceptado para las determinaciones de pacientes ambulatorios y no críticos3, los estudios llevados a cabo en pacientes críticos4-7 no aportan datos concluyentes, al estar realizados con pocos pacientes y ponerse de manifiesto la existencia de variables, presentes en los pacientes críticos, que pueden dar medidas erróneas8-10.
El objetivo de este estudio es determinar la fiabilidad de tres métodos de determinación de la glucosa en el paciente crítico, a pie de cama, comparados con la determinación de glucemia en el laboratorio central (patrón oro).
MATERIAL Y MÉTODOS
Se llevó a cabo un estudio observacional prospectivo, desarrollado en el Servicio de Cuidados Intensivos del Hospital Universitario de Getafe, hospital de tercer nivel, que cuenta con 18 camas de pacientes polivalentes. El estudio se desarrolló entre octubre de 2005 y enero de 2006.
Pacientes
Se incluyeron todos los pacientes adultos con un ingreso mayor de 24 horas en la Unidad, portadores de catéter arterial Seldicath® (Plastimed, Saint-Leu-La-Forêt Cedex, Francia), conectado a un sistema de monitorización de presión Becton Dickinson® (Singapur). La permeabilidad del catéter se mantuvo con una perfusión de 500 ml de cloruro sódico 0,9%, en el que se añadieron 500 UI de heparina sódica, presurizado a 300 mmHg mediante un sistema de presurización Tycos®, que permite un ritmo de perfusión de 2-4 ml/ h. No se incluyeron en el estudio pacientes embarazadas ni quemados.
Recogida de datos
Se registraron datos demográficos (edad y sexo) y patología al ingreso, variables que se han relacionado con modificaciones en la determinación plasmática de glucosa: diabetes mellitus, hipertensión, tensión arterial, temperatura, administración de fármacos vasoactivos (noradrenalina, dopamina, nitroprusiato, nitroglicerina, labetalol y urapidilo) y dosis en las últimas 24 horas, administración de fármacos en las 24 horas previas a las determinaciones que pueden alterar la glucemia11,12 (ácido valproico, atenolol, captopril, clortalidona, cortisona, dexametasona, diltiazem, enalaprilo, esmolol, furosemida, glucosa intravenosa, hidroclorotiazida, hidrocortisona, insulina, isoniazida, levotiroxina, metilprednisolona, nifedipino, octreótido, paracetamol, prednisolona, prednisona, propacetamol y somastotatina), hemoglobina, hematocrito, recuento de leucocitos y gasometría arterial (pH, PaO2 y PaCO2), tiempo entre la primera y la última determinación de glucemia.
Protocolo
Tras limpiar el lateral de un dedo con alcohol 70º se pincha y se realizan tres determinaciones capilares consecutivas, tras desechar la primera gota (entre una y otra determinación, se limpia el dedo con una gasa seca). A continuación, se extraen 4 determinaciones arteriales, la primera tras la extracción de 1 ml de sangre (para eliminar el espacio muerto, determinado desde la punta distal del catéter hasta el extremo distal de la primera llave de tres pasos, por donde se realiza la extracción de 0,8 ml para los catéteres 3F y de 1 ml para los 5F), la segunda determinación fue realizada tras una extracción total de 2 ml de sangre, la tercera de 3 ml y la cuarta de 4 ml. A continuación se extrajeron muestras arteriales para la determinación, en el laboratorio central, de: hematocrito, hemoglobina, recuento de leucocitos, glucemia y gases arteriales. La última determinación a la cabecera del paciente fue realizada con la sangre procedente de la jeringa de gasometría. El volumen de sangre total utilizado para las 8 determinaciones y las muestras plasmáticas ha sido de 9,5 ml.
Las determinaciones a la cabecera fueron realizadas con tiras reactivas MediSense® Optium Plus (Abbott, Reino Unido) y glucómetro MediSense® Optium (Abbott, EE.UU.). Fueron utilizados dos glucómetros cuya correlación medida entre ellos fue de 0,98. La precisión de las tiras reactivas MediSense® Optium Plus presentan un coeficiente de variación de 3,8%-5,2%, según datos facilitados por Abbott. El valor de la glucosa plasmática determinado por el laboratorio central fue considerado el patrón oro.
Las muestras fueron extraídas por 7 enfermeras de la Unidad y remitidas al laboratorio siguiendo el procedimiento habitual, por lo que el laboratorio central era ciego al estudio. Los volúmenes de sangre que se desecharon fueron extraídos con jeringas y las muestras para determinaciones de bioquímica y hematología fueron con sistema Vacutainer® Luer Medisense Adapter (Becton Dickinson®, Reino Unido). Para las determinaciones de bioquímica se extrajeron 3 ml de sangre y fueron remitidas al laboratorio en un tubo Vacutainer® (Becton Dickinson®, Reino Unido) LH PST con gel separador, para las de hematología se extrajeron 2 ml de sangre y se introdujeron en un tubo Vacutainer® (Becton Dickinson®, Reino Unido) K2E 3,6 mg y para las de gasometría se extrajeron 0,5 ml en una jeringa de gasometría (Becton Dickinson®, Reino Unido) Preset con 30 IU Ca2+ LH.
Las muestras, remitidas al laboratorio central, fueron centrifugadas y procesadas en los analizadores SYNCHRON CX3 Delta (Izasa), ABX pentra DF120 (Horiba ABX) y GEM Premier 3000 (Izasa), utilizando plasma o sangre completa respectivamente.
Análisis estadístico
Los datos descriptivos son expresados como media y desviación estándar (DE) o como porcentaje, según proceda. En las muestras de la misma procedencia (capilares o arteriales) se realizó un análisis de fiabilidad denominado coeficiente de correlación intraclase (CCI), mediante una comparación de varianzas (ANOVA) con medidas repetidas13, donde la máxima concordancia posible corresponde a un valor de CCI = 1. En el caso de que el análisis de fiabilidad mostrase una correlación intraclase adecuada (CCI > 0,95) se realizará una comparación de medias entre la de la primera muestra capilar o arterial con el patrón oro (glucemia plasmática), mediante la prueba de la «t» de Student. En el caso de que el análisis de fiabilidad mostrase una correlación intraclase no adecuada (CCI < 0,95) se realizará una comparación de medias entre la de la muestra capilar o arterial que menos se desvíe de la media de la glucemia plasmática. Las diferencias entre las determinaciones capilares y arteriales y el patrón oro se expresan gráficamente utilizando el método de Bland y Altman14, método gráfico que mide la concordancia entre los resultados de dos sistemas de medida. En nuestro caso, el procedimiento utilizado por Bland y Altman representa la diferencia entre los resultados de las glucemias obtenidas con glucómetro (capilares o arteriales) y las plasmáticas. Se representa en un diagrama de dispersión con la diferencia de ambas extracciones (diferencia de las medias de las determinaciones con glucómetro diferencia de las medias de las determinaciones plasmáticas) en el eje de las ordenadas y el promedio de las extracciones (suma de las medias del glucómetro y de las plasmáticas dividido por 2) en el eje de las abscisas. En este gráfico el error sistemático se define como la media de las diferencias entre las determinaciones estudiadas (si la media se corresponde con la línea de «0», no existe error sistemático), la precisión es la DE de las diferencias entre las determinaciones y los intervalos de confianza del 95% superior e inferior, son ± 2 DE de la media de error. Para el análisis estadístico se utilizó el programa SPSS para Windows.
RESULTADOS
Obtuvimos 630 muestras (210 capilares, 350 arteriales y 70 plasmáticas) procedentes de 70 pacientes. Las características de los pacientes en el momento de la extracción de las muestras se observan en la tabla 1. El tiempo medio empleado en la extracción de las 9 determinaciones fue de 161 (52) segundos.
Fiabilidad de la determinación de la glucemia en muestras capilares
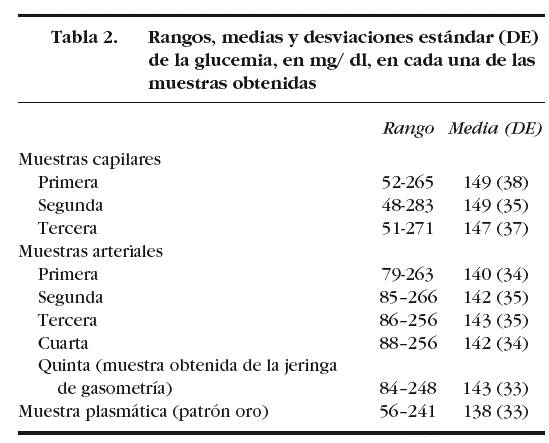
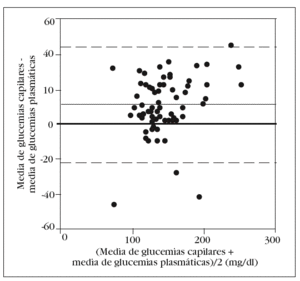
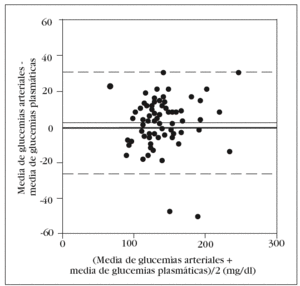
En la tabla 2 se muestran los rangos y la media de las glucemias medidas en las 210 muestras capilares. En el análisis de fiabilidad observamos un alto coeficiente de correlación intraclase entre las muestras ca pilares: 0,979 (intervalo de confianza para el 95%: 0,969-0,986). La comparación entre la primera muestra capilar y la glucemia plasmática muestra una diferencia estadísticamente significativa: 149 (38) mg/dl frente a 138 (33) mg/dl (p < 0,001). En el análisis de Bland y Altman se observa un error sistemático de 11 mg/dl y una dispersión desde 22 mg/dl a 44 mg/dl (fig. 1).
Figura 1. Error y dispersión de la determinación de glucemia en la primera muestra capilar comparada con la glucemia plasmática (patrón oro).
Fiabilidad de la determinación de la glucemia en muestras arteriales
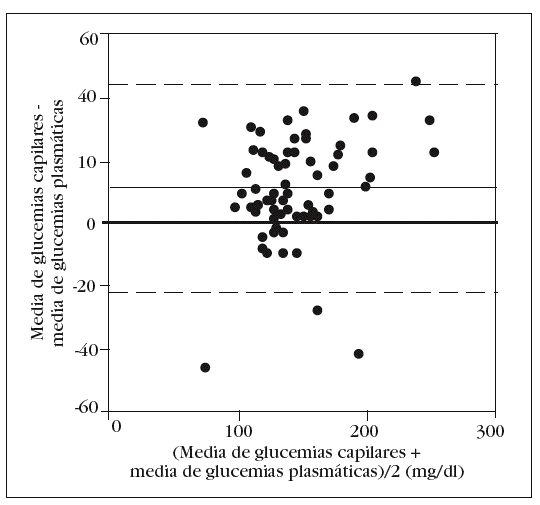
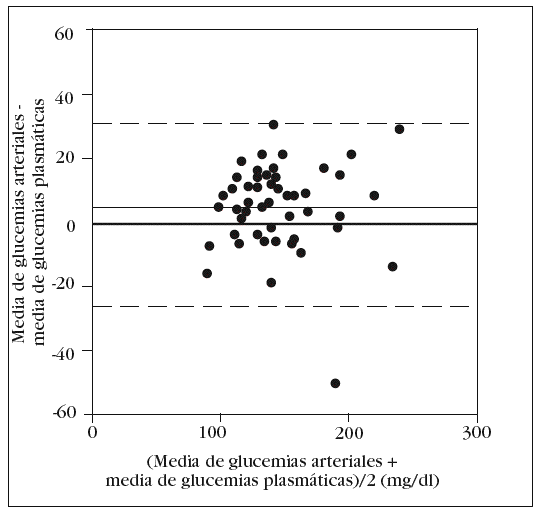
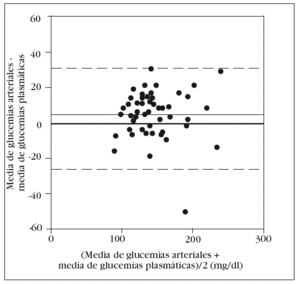
En la tabla 2 se muestran los rangos y la media de las glucemias medidas en las 350 muestras arteriales. Obtuvimos un coeficiente de correlación intraclase alto en la comparación de las 5 muestras arteriales: 0,993 (intervalo de confianza para el 95%: 0,990-0,996). No hallamos diferencias significativas en la comparación entre la primera muestra arterial y la glucemia plasmática: 140 (34) mg/dl frente a 138 (33) mg/dl (p = 0,2). El gráfico de Bland y Altman (fig. 2) nos muestra un error sistemático de 2 mg/dl y una dispersión entre 27 mg/dl a 31 mg/dl.
Figura 2. Error y dispersión de la determinación de glucemia en la primera muestra arterial comparada con la glucemia plasmática (patrón oro).
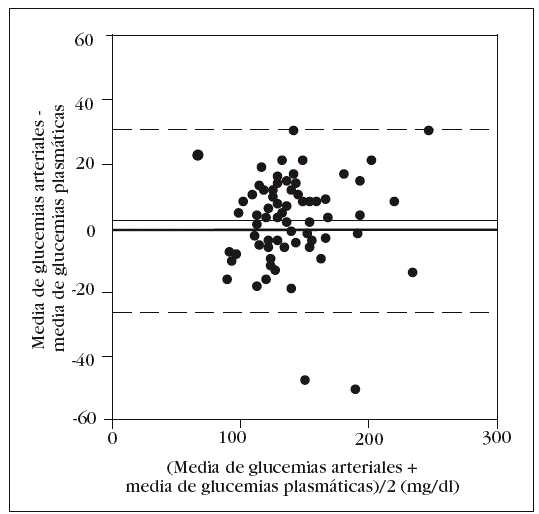
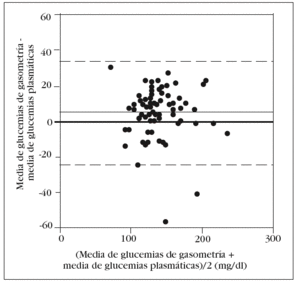
Como en la práctica clínica es habitual determinar la glucemia arterial con una muestra obtenida de la jeringa para la obtención de gases arteriales, decidimos comparar, por separado, la media de los valores obtenidos en esta muestra con el patrón oro. Aunque no observamos diferencias significativas con la glucemia determinada en las otras muestras arteriales, sí que las hubo con la glucemia plasmática: 143 (33) mg/dl frente a 138 (33) mg/dl (p = 0,006). El análisis de Bland y Altman nos muestra un error sistemático de 5 mg/dl y una dispersión entre 24 mg/dl y 34 mg/dl (fig. 3).
Figura 3. Error y dispersión de la determinación de glucemia en la muestra arterial obtenida con jeringa de gasometría comparada con la glucemia plasmática (patrón oro).
Variables que pueden influir en la fiabilidad de las muestras arteriales
Patología principal al ingreso en Cuidados Intensivos
De las 630 determinaciones, 495 muestras se obtuvieron en pacientes con patología médica, 99 en pacientes con patología quirúrgica y tan sólo 36 procedían de pacientes politraumatizados. No hemos hallado diferencias significativas en ninguno de los grupos al comparar la primera muestra arterial y la glucemia plasmática: 142 (33) mg/dl frente a 139 (32) mg/dl (p = 0,3) en pacientes con patología médica, 137 (47) mg/ dl frente a 136 (44) mg/dl (p = 0,8) en pacientes quirúrgicos y 134 (6) mg/dl frente a 127 (8) mg/dl (p = 0,3) en pacientes politraumatizados. El análisis de Bland y Altman muestra un error sistemático en pacientes médicos y quirúrgicos de 2 y 1 mg/dl respectivamente, con precisiones de 15 y 14 mg/dl y con dispersiones de 27 mg/dl a 31 mg/dl y 27 mg/dl a 29 mg/dl. En el caso de los pacientes politraumatizados el error sistemático fue de 7 mg/dl y la dispersión de 17 mg/dl a 31 mg/dl.
Antecedentes de hipertensión arterial
Trescientas quince muestras (50%) corresponden a pacientes con antecedentes de hipertensión arterial y el resto (50%) a pacientes sin dichos antecedentes. No encontramos diferencias significativas en la comparación de la primera muestra arterial y la glucemia plasmática en los enfermos con o sin hipertensión; pacientes hipertensos: 139 (34) mg/dl frente a 139 (33) mg/dl (p = 0,9) y 142 (34) mg/dl frente a 138 (35) mg/dl (p = 0,1) en pacientes no hipertensos. Los errores sistemáticos observados en los gráficos de Bland y Altman fueron de 0,4 mg/dl (dispersión de 27 mg/dl a 27 mg/dl) y de 4 mg/dl (dispersión de 25 mg/dl a 34 mg/dl), respectivamente.
Antecedentes de diabetes mellitus
De las 630 determinaciones 171 muestras procedían de enfermos con antecedentes de diabetes mellitus (27%) y 459 muestras (73%) fueron obtenidas en pacientes no diabéticos. No observamos diferencias significativas entre la primera muestra arterial y la glucemia plasmática: 147 (37) mg/dl frente a 142 (40) mg/dl (p = 0,2) en los pacientes diabéticos y 138 (33) mg/dl frente a 137 (31) mg/dl (p = 0,5) en pacientes no diabéticos. Los errores sistemáticos observados en los gráficos de Bland y Altman fueron de 5 mg/dl (dispersión de 27 mg/dl a 37 mg/dl) y de 1 mg/dl (dispersión de 26 mg/ dl a 29 mg/dl), respectivamente.
Fármacos recibidos en las 24 horas previas a la extracción
Se realizó un análisis de los fármacos recibidos por más del 25% de los pacientes. Los fármacos o soluciones intravenosas que influyeron en la fiabilidad de las muestras arteriales fueron: la noradrenalina 146 (35) mg/dl en la muestra arterial frente a 140 (38) mg/dl de glucemia plasmática (p = 0,001); la perfusión intravenosa de glucosa 141 (35) mg/dl frente a 136 (34) mg/dl (p = 0,01) y la perfusión de insulina intravenosa 148 (37) mg/dl frente a 143 (36) mg/dl (p = 0,01).
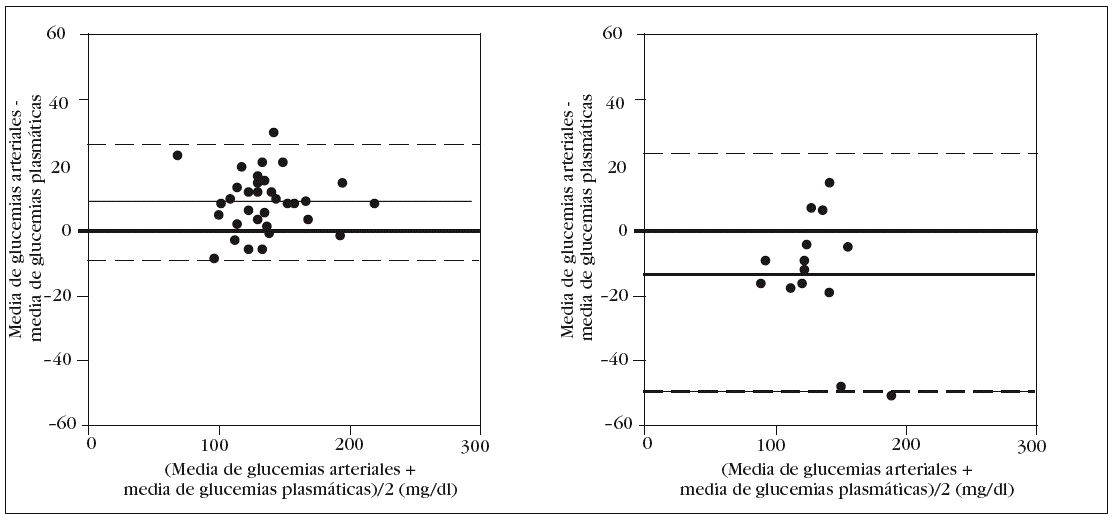
En los pacientes con perfusión de insulina observamos un error sistemático de 5 mg/dl con una dispersión de 23 mg/dl a 33 mg/dl (fig. 4).
Figura 4. Error y dispersión de la determinación de glucemia en la primera muestra arterial comparada con la glucemia plasmática (patrón oro) en pacientes que han recibido perfusión de insulina en las 24 horas previas a las determinaciones.
Datos clínicos
De las otras variables analíticas que hemos analizado hemos encontrado diferencias significativas al comparar las medias de la primera muestra arteriales con la glucemia plasmática, con una hemoglobina < 10 g/dl 138 (29) mg/dl frente a 130 (29) mg/dl (p < 0,0001) y con una hemoglobina > 12 g/dl 124 (23) mg/ dl frente a 137 (30) mg/ dl (p = 0,02).
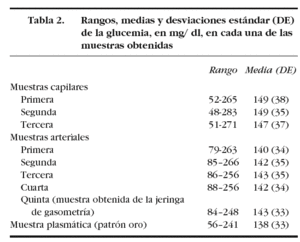
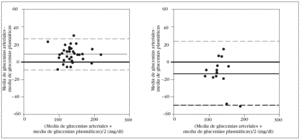
En los pacientes con una hemoglobina < 10 g/dl el error sistemático fue de 8 mg/dl, con una dispersión entre 9 mg/dl y 26 mg/dl. Por el contrario, en los enfermos con hemoglobina > 12 g/dl, el error fue 13 mg/dl, con una dispersión entre 50 mg/ dl y 24 mg/dl (fig. 5).
Figura 5. Error y dispersión de la determinación de glucemia en la primera muestra arterial comparada con la glucemia plasmática (patrón oro), en pacientes con hemoglobina inferior a 10 g/dl en el gráfico de la izquierda y en los pacientes con hemoglobina superior a 12 g/dl en el gráfico de la derecha.
DISCUSIÓN
Los principales hallazgos de nuestro estudio fueron:
1. La glucemia medida a pie de cama con los medidores de glucosa utilizados habitualmente en la práctica clínica de muestras obtenidas de un catéter arterial es similar a la glucemia plasmática considerada como patrón oro.
2. La glucemia medida de muestras capilares tiene un error y dispersión significativos.
3. Algunas variables noradrenalina, perfusión de glucosa, perfusión de insulina, pH y hemoglobina pueden aumentar el error y la dispersión de la medida de la glucemia en las muestras arteriales.
La hiperglucemia, debida a diferentes factores como resistencia a la insulina, alteración en el metabolismo de la glucosa o el uso de algunos fármacos, es una complicación frecuente en los enfermos críticos. Estudios recientes han evaluado que un control estricto de la glucemia se asocia con un mejor pronóstico de algunos enfermos críticos1,2. Como consecuencia, la monitorización rutinaria de la glucemia es uno de los procedimientos más habituales en las UCI. Para la determinación de la glucosa disponemos de diferentes métodos de obtención de muestra y de medición. La glucemia puede ser determinada en sangre total, obtenida de capilar, de vena o de un catéter arterial mediante tiras reactivas en un glucómetro, o en analizador de gases arteriales con multi-electrodo disponibles en las UCI, o en suero o plasma mediante analizadores situados en los laboratorios centrales.
El objetivo de nuestro estudio fue comprobar la fiabilidad de la determinación de la glucemia en las muestras que habitualmente se obtienen en una UCI (capilares y arteriales en los enfermos con catéter arterial) comparadas con la glucemia plasmática, que es lo que se considera el patrón oro. Realizamos la determinación de tres muestras capilares para estimar el efecto del alcohol de 70º, utilizado en la limpieza cutánea, en la variabilidad de los resultados y 4 muestras arteriales, para determinar el efecto de la heparina utilizada en los sueros de mantenimiento de los sistemas de monitorización de presión. Como no se han observado diferencias significativas entre las tres muestras capilares y entre las arteriales, asumimos que los factores del alcohol y de la heparina no interfieren en los resultados.
En nuestro estudio observamos que la glucemia determinada a partir de las muestras capilares tuvieron un error y una dispersión significativamente mayor que la determinada en muestras arteriales. Aunque un error de 11 mg/dl podría parecer clínicamente poco relevante, la dispersión observada, que puede llegar hasta 44 mg/ dl, puede ser causa de hipoglucemias no detectadas, sobre todo si se aplica la recomendación de mantener unos niveles de glucosa entre 80 y 110 mg/dl1,2. Una disminución en el hematocrito, la acidosis metabólica y la hipoxia son causas que pueden interferir con las medidas capilares de la glucosa8-10. Aunque nuestro estudio incluyó enfermos estables en el momento de la obtención de las muestras, un 39% de ellos estaban recibiendo perfusión de noradrenalina, lo cual puede producir vasoconstricción capilar y una hipoperfusión tisular en el punto de la punción, lo cual se ha reportado, y puede interferir la medida de la glucosa capilar15-17.
Hay evidencia de que la validez de la determinación de la glucosa mediante tiras reactivas puede modificarse tras la administración o en presencia de algunos fármacos. En nuestro estudio hemos encontrado que la fiabilidad de la glucemia medida en estas muestras se puede modificar en los enfermos que están recibiendo noradrenalina, probablemente por la misma razón que hemos comentado previamente. El motivo del aumento en el error y una mayor dispersión en los enfermos que están recibiendo soluciones glucosadas o perfusión continua de insulina podría estar relacionado con el hecho de que la glucemia con tiras reactivas se mide en sangre total, mientras que el patrón oro que hemos considerado es una determinación de la glucemia en el plasma. En cualquier caso, a pesar de la significación estadística observada, podemos considerar tanto el error como la dispersión dentro de los límites de tolerancia clínica.
Se ha descrito en varios estudios, in vitro8-10 e in vivo18, que las mediciones de la glucemia con tiras reactivas se modifican en función del pH, la PaO2 y el hematocrito. De estas variables, en la que nosotros hemos encontrado más relevancia clínica es la relación entre hemoglobina/ hematocrito y glucemia. En los enfermos con una hemoglobina baja (definida en nuestro estudio como inferior a 10 g/dl, que equivale a un hematocrito inferior al 30%) encontramos que las tiras reactivas sobrevaloran la glucemia, mientras que en enfermos con hemoglobina superior a 12 g/dl (equivalente a un hematocrito superior al 36%), la glucemia está infravalorada. El motivo para estas modificaciones de la glucemia, en presencia de una mayor o menor concentración de hemoglobina, se debe a la mayor concentración de glucosa en suero o plasma que en el hematíe, además de otros factores como cambios en la viscosidad de la sangre y modificaciones en la permeabilidad de las tiras reactivas. Para evitar este error se han empezado a comercializar glucómetros que determinan simultáneamente el hematocrito y la glucemia y realizan una corrección automática del efecto del hematocrito19. En relación con la acidosis y la hipoxia no hemos podido estimar su influencia sobre la glucemia debido a la baja incidencia de estas alteraciones en nuestra cohorte de enfermos.
Nuestro estudio puede tener algunas limitaciones. La población incluida fue una cohorte de enfermos estables, aunque algunos estuviesen con perfusión de fármacos vasoactivos, con una glucemia media cercana al límite de 150 mg/dl recomendado para los enfermos críticos en conferencias de consenso como la Surviving Campaign Sepsis20. Esto ha condicionado que hayamos tenido pocas determinaciones con hipoglucemia y, por lo tanto, aunque hemos observado diferencias estadísticamente significativas, en las muestras capilares y en algunas muestras arteriales en presencia de los factores que afectan la determinación de la glucemia, el error y la dispersión observados caen dentro de unos límites clínicamente aceptables.
En conclusión, en nuestro estudio hemos observado que la determinación de la glucemia a pie de cama en los enfermos críticos es más fiable cuando se mide en muestras de sangre arterial que en sangre capilar. Las mediciones pueden tener un mayor error y dispersión en pacientes que están recibiendo noradrenalina, soluciones glucosadas o perfusión de insulina y en relación con la concentración de hemoglobina.