Introducción
La ventilación mecánica no invasiva (VMNI) se refiere al empleo de soporte ventilatorio sin intubar la tráquea del paciente1,2. La principal razón para el ingreso de los pacientes en la Unidad de Cuidados Intensivos (UCI) es la de recibir soporte ventilatorio3, siendo la disminución del trabajo respiratorio la razón más frecuentemente argumentada para iniciar dicho soporte4. Hoy en día podemos considerar la VMNI como el estándar en el manejo y cuidado de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) exacerbada, habiendo demostrado disminuir la mortalidad, la estancia hospitalaria y la intubación traqueal1,2,5,6.
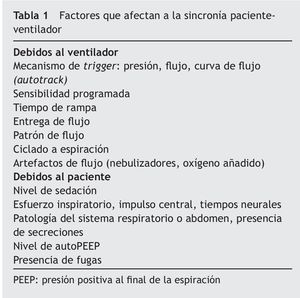
El esfuerzo inspiratorio del paciente en situación de fallo respiratorio agudo puede llegar a ser 6 veces el normal, lo que, de mantenerse en el tiempo, puede conducirle a una situación de fatiga muscular e, incluso, a daño estructural de los músculos respiratorios. Para reducir el trabajo respiratorio del paciente es necesario que enfermo y ventilador se adapten, es decir, que los tiempos mecánicos se ajusten a los tiempos neurales y la demanda de flujo del paciente sea cubierta por el ventilador3. Por tanto, la asincronía paciente-ventilador se puede definir como aquella situación en la que se produce un desajuste entre el tiempo neural (paciente) y mecánico (ventilador), o cuando el flujo entregado por el ventilador es inadecuado para cubrir la demanda de flujo del paciente6. Esta asincronía se puede observar en todos los modos ventilatorios y está determinada por factores relacionados con el paciente o por el ventilador (tabla 1)7,8. El fallo en conseguir una adecuada sincronización paciente-ventilador puede producir efectos deletéreos y complicaciones para el paciente (tabla 2)8.
Con fines didácticos, describiremos la asincronía en las tres fases del ciclo ventilatorio: fase de trigger, entrega de flujo y ciclado.
Asincronía durante la fase de trigger
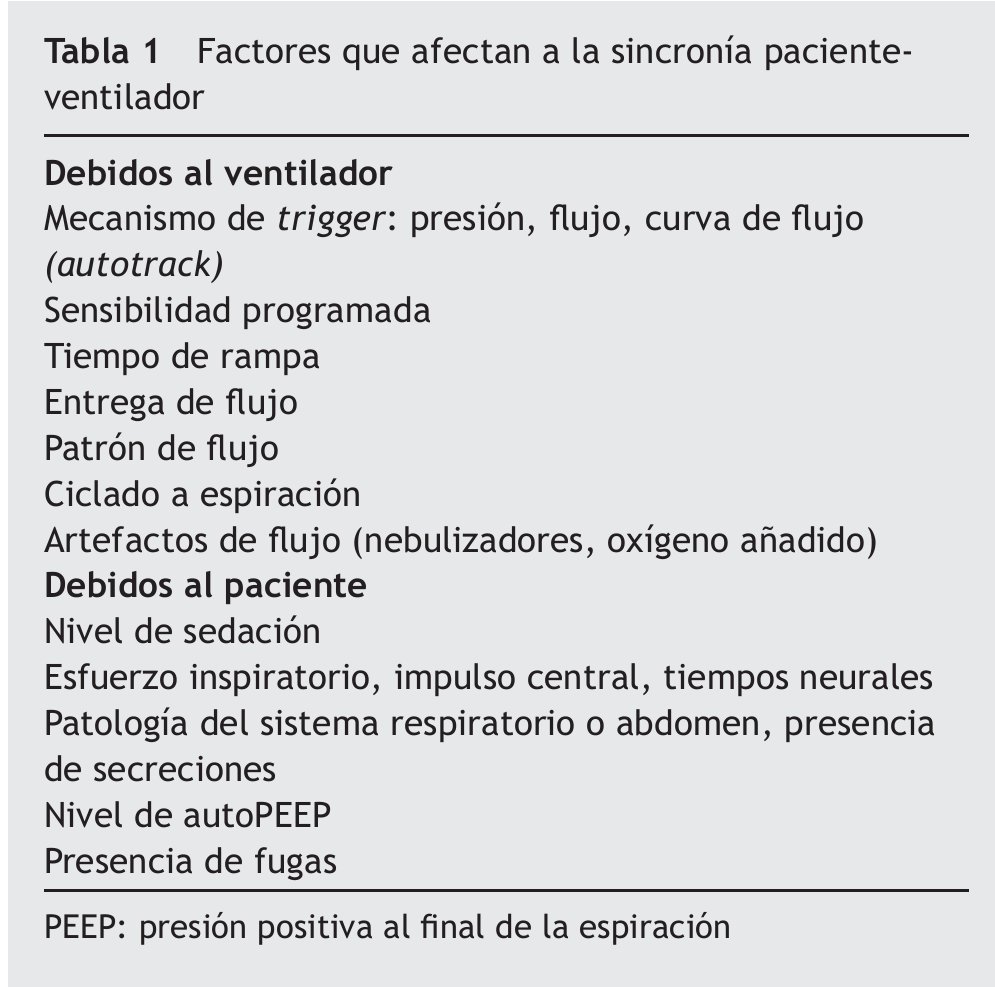
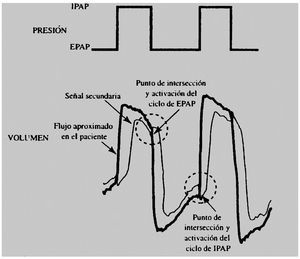
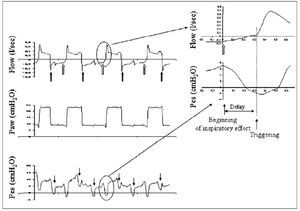
El esfuerzo inspiratorio del paciente inicia la entrega de gas por el ventilador al alcanzar un determinado umbral, trigger, programado por el operador9. El trigger puede ser programado para detectar un cambio de presión en la vía aérea, de flujo, volumen o curva de flujo (autotrack: señal de flujo dibujada por el propio software del ventilador sobre la curva de flujo del paciente, retrasándola 300 milisegundos sobre esta última y con una diferencia de flujo de 0,25 l/seg) (fig. 1). Recientemente se han diseñado dos nuevos modos de trigger que utilizan la presión diafragmática (servoventilación impulsada por presión diafragmática, o PdiDV) y la actividad eléctrica del diafragma (asistencia ventilatoria neuralmente ajustada, o NAVA) como señal de disparo. Con la PdiDV cada respiración es disparada por un cambio de presión diafragmática predeterminado o con un umbral de flujo alcanzado, dependiendo de cuál se alcance primero. Con NAVA el ventilador es disparado cuando la señal eléctrica del diafragma alcanza un determinado nivel preestablecido7,10.
Figura 1 Señal de flujo secundaria dibujada por el software del ventilador sobre la curva real de flujo del paciente. El flujo difiere en 0,25 l/seg y se retrasa 300 mseg. En los puntos de intersección se produce la activación del ciclo IPAP y EPAP.
La asincronía debida a la fase de trigger se puede expresar como autociclado (disparo del ventilador en ausencia de esfuerzo del paciente), retraso de trigger (tiempo de demora desde que se produce el esfuerzo del paciente hasta que el ventilador entrega el flujo de gas) y esfuerzos inefectivos (esfuerzos musculares del paciente que no disparan el ventilador)7.
El autociclado se puede producir como consecuencia de artefactos en el circuito del ventilador, presencia de agua en el circuito, fugas y oscilaciones cardiacas. Ocurre en pacientes con bajo impulso inspiratorio central, frecuencia respiratoria lenta, volumen sistólico elevado y ausencia de hiperinsuflación dinámica. El autociclado puede interferir considerablemente con el manejo del paciente, pudiendo disminuir la PaCO2 y afectar al esfuerzo inspiratorio. También puede interferir en la toma de decisiones; por ejemplo, en los pacientes con muerte cerebral puede retrasar la declaración de muerte, con las implicaciones que ello tiene en la donación de órganos.
Las curvas de presión y flujo ayudan a detectar este problema. La ausencia de una caída inicial de presión por debajo de la presión de fin de espiración es indicativa de autociclado.
Esta forma de asincronía se puede minimizar aumentando el umbral de presión o flujo para el disparo del ventilador, aumentando el impulso central del paciente (disminuyendo la sedación o aumentando la PaCO2) y eliminando las fugas7,10.
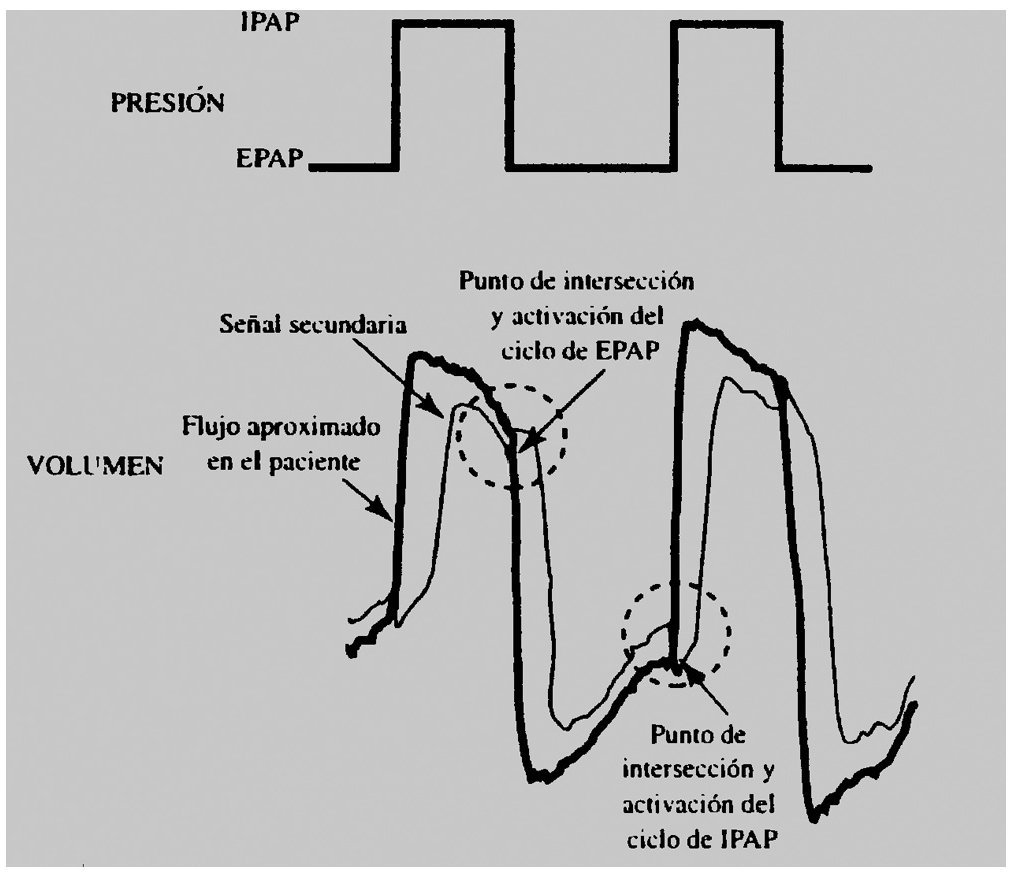
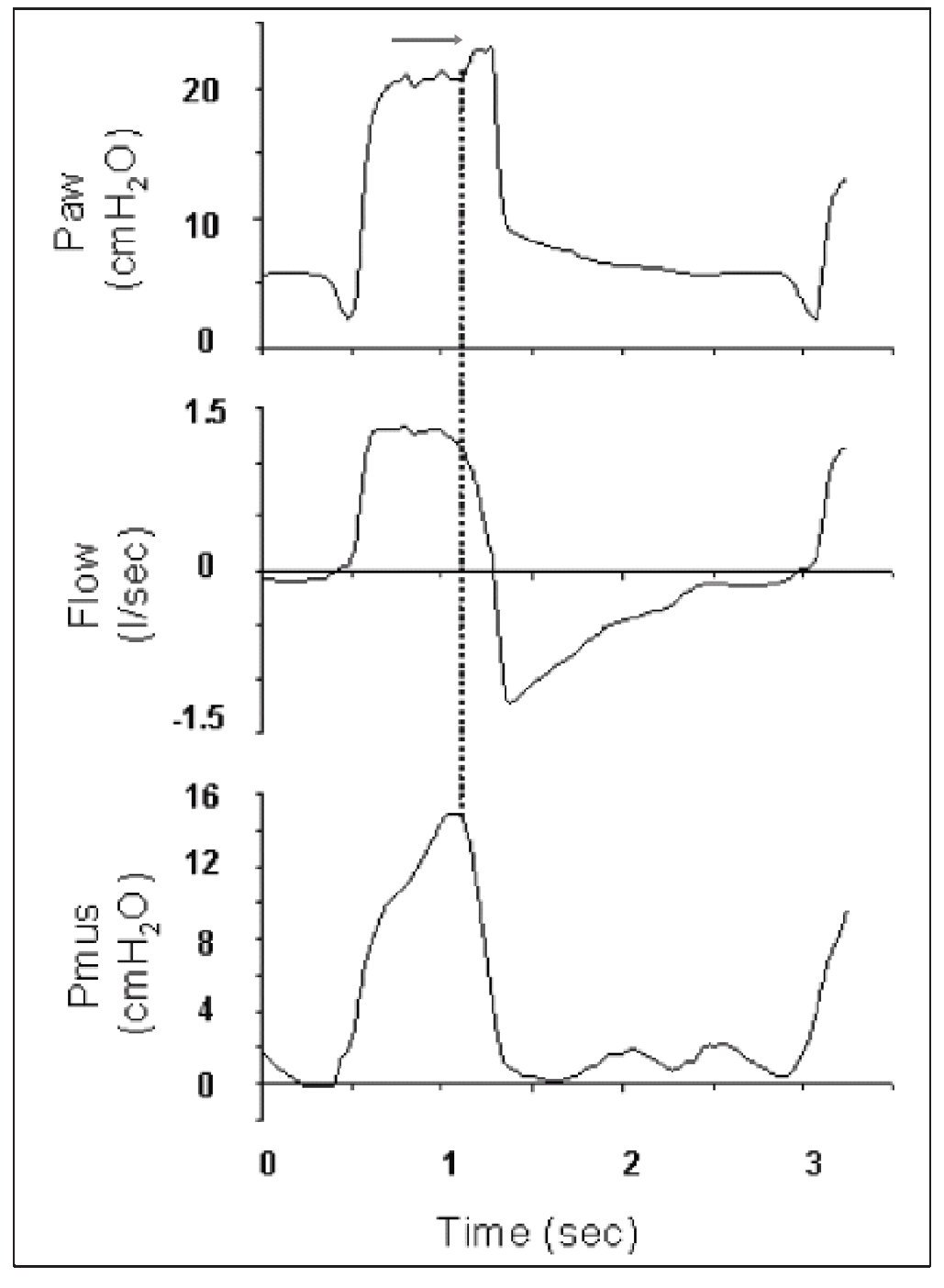
El inicio de la fase de trigger se puede observar en la curva de flujo como un cambio en la forma del flujo espiratorio o una deflexión en la curva de presión. El tiempo entre este cambio de la curva de flujo y el momento en que la curva de presión muestra su ascenso es el retraso de trigger. Si el cambio en el flujo espiratorio en sentido ascendente, indicando inspiración, no se sigue de una respiración, tendremos un esfuerzo inspiratorio fallido (fig. 2).
Figura 2 Se muestran, de arriba abajo, las curvas de flujo, presión (Paw) y presión esofágica (Pes). En la parte de la derecha, arriba, se muestra un detalle de las curvas de Pes y flujo en el que se puede apreciar el inicio del esfuerzo inspiratorio del paciente (descenso en la curva de Pes) y el inicio del flujo inspiratorio (línea punteada). El tiempo entre las dos es el retraso en el trigger. Las flechas en color negro en la curva de Pes indican los esfuerzos fallidos. Modificada de Prinianakis et al10.
El retraso en el trigger y el esfuerzo fallido tienen causas comunes. Están en relación con factores derivados del ventilador y debidos al propio paciente. Los factores debidos al paciente son la hiperinsuflación dinámica, bajo impulso respiratorio central y debilidad muscular. En cuanto al ventilador, los niveles altos de asistencia y la asincronía espiratoria en forma de retraso de apertura de la válvula de espiración (tiempo inspiratorio mecánico superior al tiempo inspiratorio neural) son los factores asociados a retraso de trigger y esfuerzos fallidos7,11.
En estudios previos se decía que el esfuerzo inspiratorio era mayor con el trigger de presión que con el de flujo. Sin embargo, con los ventiladores de nueva generación esta diferencia es inapreciable. No obstante, la forma de señal de flujo o autotrack disminuye el retraso de trigger y los esfuerzos ineficaces. Obviamente, el retraso en el disparo del ventilador y los esfuerzos ineficaces no constituyen un problema con el PdiDV y NAVA, en los que la entrega de flujo ocurre inmediatamente después de iniciarse el esfuerzo del paciente7,10.
Para disminuir el retraso en el disparo del ventilador y los esfuerzos ineficaces es importante disminuir la auto-presión positiva al final de la espiración (PEEP) (utilizando bajos volúmenes corrientes, prolongando el tiempo espiratorio, disminuyendo la resistencia espiratoria al flujo y acortando el tiempo en que la inspiración mecánica se opone a la espiración neural del paciente), aumentar la presión generada por los músculos inspiratorios durante la fase de trigger (disminuyendo el nivel de sedación y corrigiendo la alcalosis), aplicar PEEP externa para contrarrestar la autoPEEP, disminuir el umbral de presión o flujo del trigger del ventilador y utilizar ventiladores de nueva generación, con un tiempo medio de retraso de trigger de 100-120 milisegundos7.
Asincronía durante la fase de presurización
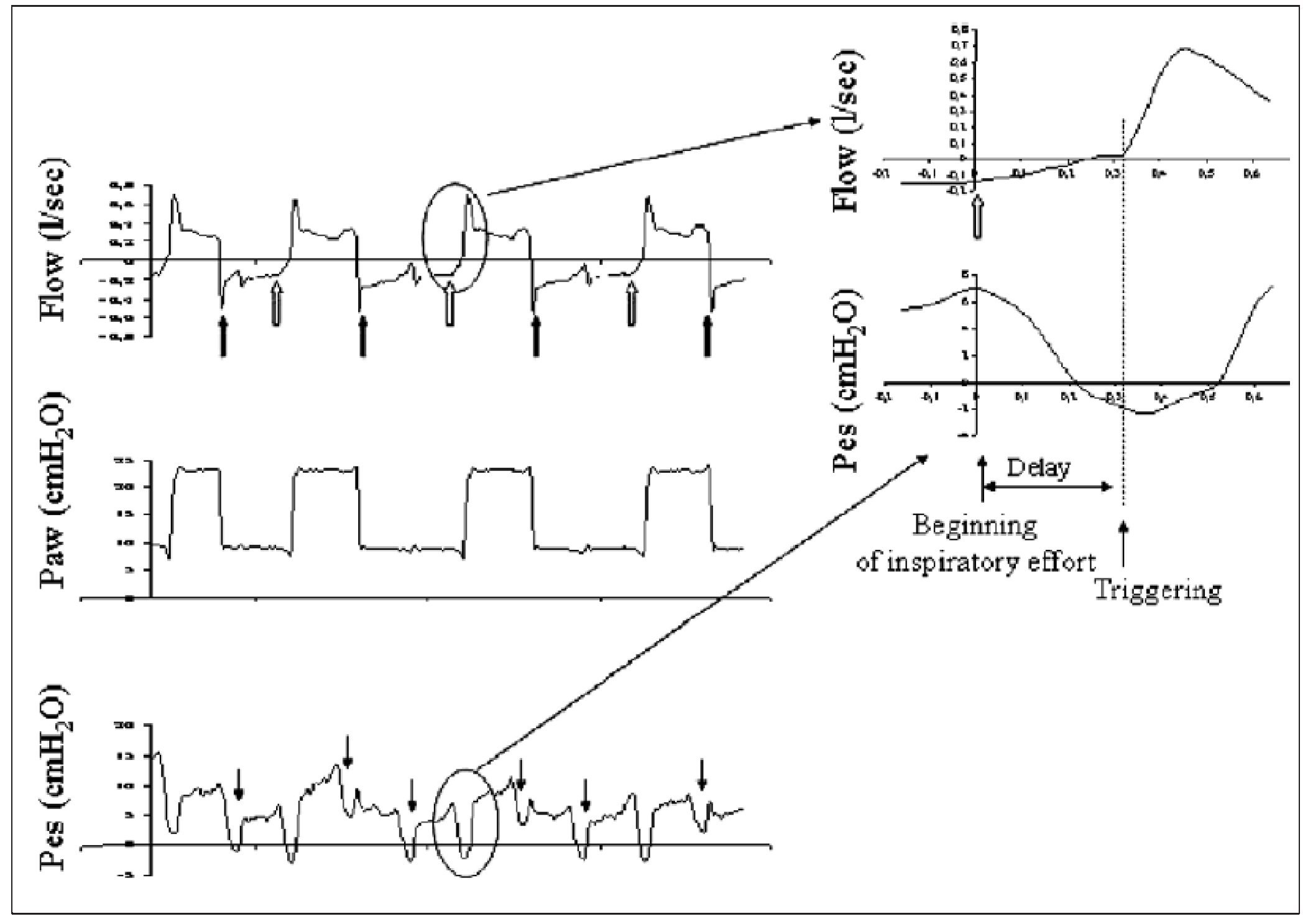
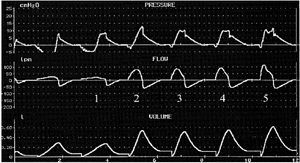
La asincronía durante la fase de presurización se producirá siempre que la demanda de flujo del paciente no sea suplida por el flujo aportado por el ventilador. El tiempo en que se alcanza la presión prefijada, denominado tiempo de rampa (rise time), puede tener una notable influencia en la sincronía durante esta fase. No existe una regla fija para determinar qué tiempo de rampa es mejor, pero sabemos que tanto los tiempos prolongados como los excesivamente cortos se asocian a asincronía7,8 (fig. 3).
Figura 3 Curvas de presión, flujo y volumen en un paciente ventilado con presión de soporte con diferentes tiempos de rampa (1, 2, 3, 4 y 5 ciclos de la gráfica), yendo desde un tiempo muy lento en la curva 1 hasta un tiempo muy rápido en la 5. La forma de la curva de presión muestra una forma excavada al principio, siendo más estable en la curva mostrada en posición 4 (mejor tiempo de rampa). El tiempo más rápido (número 5) muestra una sobreelevación inicial en la curva de presión que indica una entrega excesivamente rápida de flujo. Modificada de Nilsestuen y Hargett8.
En las últimas dos décadas se han incorporado nuevos modos ventilatorios que mejoran la asincronía paciente-ventilador. En la ventilación proporcional asistida (PAV), la presión entregada por el ventilador es proporcional al esfuerzo del paciente, asistiendo el flujo y volumen del enfermo con una proporcionalidad prefijada. La PdiDV y la NAVA ya han sido comentados. Estos nuevos modos representan un músculo inspiratorio externo controlado directa o indirectamente por el impulso respiratorio del paciente. De estos tres modos, solo la PAV se está utilizando en la práctica clínica habitual7.
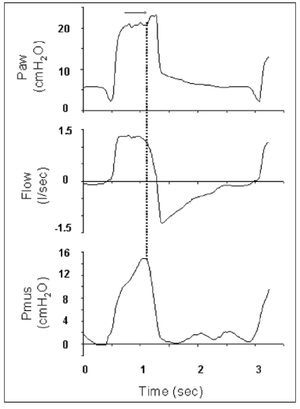
La forma de la curva de flujo nos puede orientar hacia la posibilidad de asincronía durante la fase de presurización. En presión de soporte, si el paciente relaja toda la musculatura respiratoria después del trigger, la duración de la fase de presurización depende de la constante de tiempo del sistema respiratorio y del valor de porcentaje de flujo escogido para el ciclado a espiración. Si el paciente no relaja sus músculos respiratorios después de la fase de trigger, la duración de la fase de presurización es impredecible, ya que la presión ejercida por los músculos respiratorios (Pmus) puede variar respiración a respiración. Por lo tanto, cualquier desviación de la forma de la curva de flujo en condiciones pasivas (un patrón de flujo descendente) nos alertará de la posible asincronía. Por ejemplo, una forma de flujo redondeada o constante indica un esfuerzo inspiratorio mantenido por inadecuado soporte de presión (fig. 4)11.
Figura 4 Curvas de presión en la vía aérea, flujo y presión de los músculos respiratorios (Pmus) en un paciente ventilado en modo presión de soporte. Obsérvese que la Pmus continúa aumentando durante toda la fase de inspiración mecánica, lo que indica esfuerzo inspiratorio importante durante esta fase, por lo que la curva de flujo se hace constante y no descendente como debería ser si no se efectuara este importante esfuerzo. Del mismo modo, puede observarse una elevación de la presión al final de la inspiración (flecha en la curva de Paw tras la línea punteada), que indica que el tiempo inspiratorio mecánico excede al tiempo inspiratorio neural, invadiendo la espiración del paciente. Modificada de Prinianakis et al10.
Si bien un flujo inspiratorio reducido produce asincronía, como hemos visto, un flujo excesivamente elevado puede provocar taquipnea en el paciente. Este efecto parece estar mediado por el reflejo de Hering-Breuer (inhibición refleja de la inspiración al alcanzarse un volumen umbral determinado). El flujo excesivamente rápido activaría los receptores pulmonares de estiramiento, los cuales, por vía vagal, informan al centro respiratorio, el cual cortaría rápidamente la inspiración. Este acortamiento en el tiempo inspiratorio neural se acompaña invariablemente de un acortamiento del tiempo espiratorio neural, ya que las dos fases del ciclo están estrechamente relacionadas. Por otra parte, un tiempo inspiratorio muy corto promueve que el tiempo inspiratorio mecánico se extienda en el tiempo espiratorio neural, lo que prolongaría esta fase. En definitiva, la respuesta de la frecuencia respiratoria al patrón de flujo seleccionado dependerá de qué mecanismo predomine4. Otros autores atribuyen el aumento de la frecuencia respiratoria a un acortamiento del tiempo inspiratorio motivado específicamente por el alto flujo aportado (terminación refleja de la inspiración relacionada con el flujo), y no mediado por el reflejo de Hering-Breuer12.
Los flujos elevados son seleccionados con frecuencia con la intención de acortar el tiempo inspiratorio y dar más tiempo a la espiración, evitando la autoPEEP. Sin embargo, el acortamiento de los tiempos neurales por el flujo excesivamente elevado podría provocar el efecto contrario al deseado4.
Asincronía espiratoria
La asincronía espiratoria se produce cuando el tiempo inspiratorio mecánico precede o excede el tiempo inspiratorio neural.
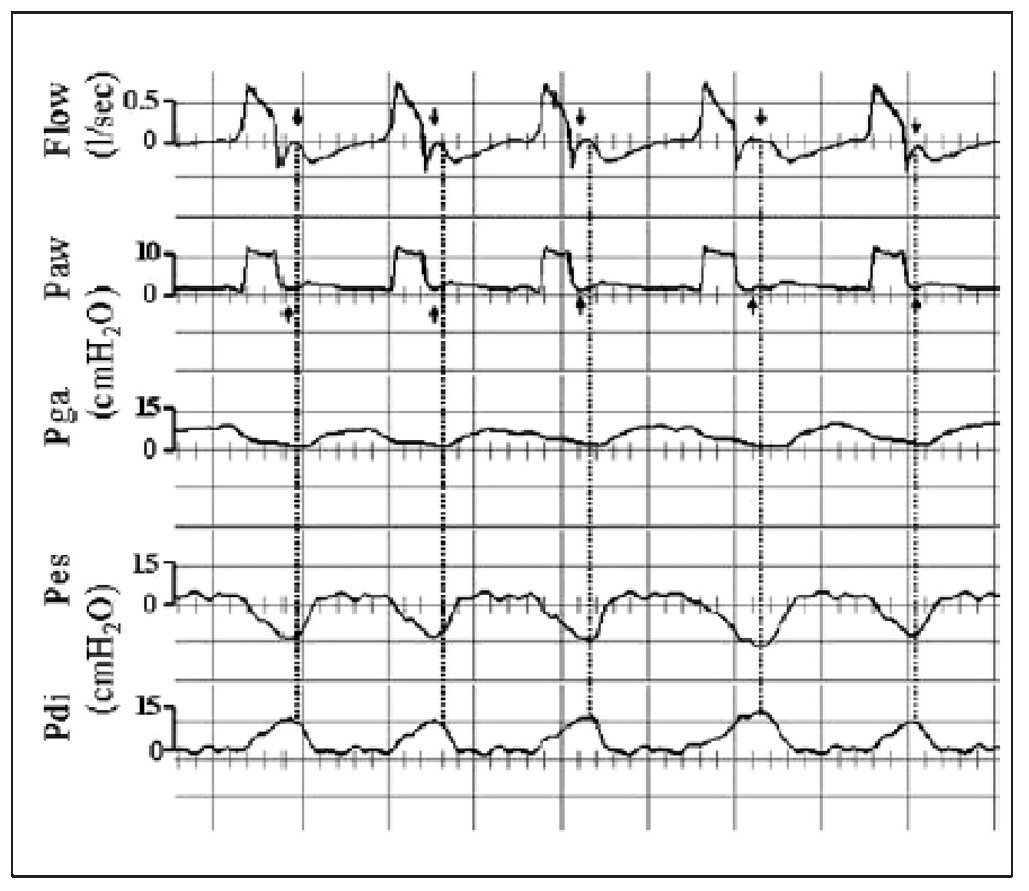
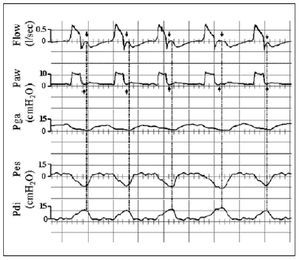
Cuando el tiempo inspiratorio mecánico es más corto que el tiempo inspiratorio neural, el sujeto continúa contrayendo sus músculos respiratorios durante la espiración mecánica. Con la presión de soporte esto puede ocurrir por una presión programada demasiado baja, una constante de tiempo del sistema respiratorio corta, un criterio de ciclado a espiración elevado e hiperinsuflación dinámica, la cual disminuye el gradiente de presión y por tanto el flujo7,11. En la curva de flujo, tras un descenso inicial durante la espiración, vemos un ascenso hacia la línea de base que indica esfuerzo inspiratorio mantenido del paciente (fig. 5). Este hecho se debe a que al finalizar la inspiración mecánica e iniciarse la espiración, la presión de retroceso elástico es superior a la presión de los músculos inspiratorios y, por lo tanto, la presión alveolar es positiva y origina flujo espiratorio. Puesto que el volumen pulmonar y, por tanto la presión de retroceso elástico, disminuye mientras continúa el esfuerzo inspiratorio que se opone a dicha presión, se produce una disminución del flujo espiratorio. La posterior relajación de la musculatura inspiratoria elimina esta presión de oposición, y el flujo espiratorio se restablece dependiendo del retroceso elástico pulmonar y de las propiedades resistivas del paciente y del circuito espiratorio. En algunas ocasiones, el esfuerzo inspiratorio es de tal magnitud que alcanza el umbral de disparo del ventilador y se produce un doble trigger en la misma respiración11.
Figura 5 Curvas de flujo (Flow), presión en la vía aérea (Paw), presión gástrica (Pga), presión esofágica (Pes) y presión transdiafragmática (Pdi) en un paciente ventilado con presión de soporte. Tras un descenso inicial en la curva de flujo (flujo espiratorio), se produce un nuevo ascenso hacia la línea de base (flechas negras en la curva de flujo). Esto indica un esfuerzo inspiratorio mantenido del paciente. En la curva de presión en la vía aérea (Paw), este esfuerzo mantenido se traduce en una distorsión cóncava inmediatamente después de descender la presión a la línea de base. Tomada de Prinianakis et al10.
El tiempo inspiratorio mecánico puede superar el tiempo inspiratorio neural, lo cual produce asincronía. En las curvas de presión o flujo puede ser difícil observar este tipo de asincronía, especialmente si el paciente no contrae sus músculos espiratorios. A pesar de ello, en presión de soporte puede observarse una rápida caída en la curva de flujo inspiratorio. En la curva de presión, durante la fase inspiratoria podemos observar una pequeña elevación al final de la misma, que indica relajación brusca de los músculos inspiratorios o contracción de los espiratorios (fig. 4). La repercusión de este hecho es más notable en los pacientes con obstrucción al flujo aéreo, en los que la incursión del tiempo inspiratorio mecánico en el tiempo neural espiratorio provoca mayor grado de hiperinsuflación y asincronía añadida durante la fase de trigger. Si este incremento de presión supera un cierto umbral (1,5-3 cmH2O), termina la fase de entrega de gas.
Las causas de este último tipo de asincronía son un excesivo soporte de presión, una constante de tiempo prolongada y un criterio de ciclado a espiración excesivamente bajo7,8,11.
Los modernos ventiladores tienen la capacidad de poder variar el criterio de ciclado a espiración. En los pacientes con constantes de tiempo cortas (lesión pulmonar aguda) sería conveniente escoger un criterio de ciclado bajo, alargando el tiempo inspiratorio mecánico. En los pacientes con constantes de tiempo prolongadas (pacientes obstructivos), un criterio de ciclado más elevado reduciría el tiempo inspiratorio mecánico. Con esta medida, en ambos casos estaríamos contribuyendo a prevenir la asincronía espiratoria. El uso de dispositivos como la NAVA o la PdiDV podría eliminar esta asincronía7.
Interfases e interacción paciente-ventilador
Hay 6 tipos diferentes de interfases comercializadas: máscara oronasal, máscara total, máscara nasal, pipeta bucal, olivas nasales y helmet. De estas, la máscara oronasal es la más utilizada en la situación de fallo respiratorio agudo. Comparadas con las máscaras nasales, alcanzan mayores presiones en la vía aérea, la respiración bucal no le afecta, tienen menos fugas y el grado de cooperación del paciente no es tan necesario. Por el contrario, son menos confortables, el paciente no puede hablar, comer ni beber durante la ventilación. Si se produce erosión del puente de la nariz, podemos recurrir a la máscara total o al helmet6.
El utilizar una interfase correcta es crucial para el éxito de la VMNI. Disminuir la fuga aérea excesiva es un aspecto importante, ya que esta produce asincronía y disminuye las presiones alcanzadas en la vía aérea, lo que resta eficacia a la técnica. Escoger un tamaño adecuado de mascarilla es conveniente, pero también lo es la elección del arnés que la sujeta. La fijación de la máscara a la cara del paciente se puede optimizar con almohadillados en la interfase escogida. Sin embargo, es inevitable el que se produzca alguna fuga, siendo recomendable utilizar ventiladores que puedan monitorizarlas y compensarlas13.
Otro aspecto importante es el espacio muerto de la máscara (VDm). Aparte del espacio muerto estático de la interfase (VDme), directamente relacionado con el volumen que tiene, algunos autores añaden el espacio muerto dinámico (VDdin), que es el debido a la cantidad de gas exhalado que se vuelve a inhalar, limitando y comprometiendo la ventilación alveolar. Este VDdin se puede contrarrestar con un flujo suficiente durante la espiración. En este sentido, se ha comprobado la poca repercusión que tiene el volumen de VDm siempre que exista una adecuada presurización durante la fase espiratoria. Esta eficacia del flujo durante la espiración se podría optimizar utilizando puertos espiratorios sobre el puente nasal de la máscara14.
Un reciente estudio compara dos interfases empleadas en el fallo respiratorio agudo, helmet y máscara oronasal. Los autores miden los tiempos de retraso después de un esfuerzo inspiratorio (tiempo de retraso de trigger y tiempo en retornar al nivel de PEEP basal), el producto presión-tiempo durante la fase inspiratoria y analizan los esfuerzos fallidos utilizando diversas sensibilidades de trigger y niveles de presión de soporte (PS). El funcionamiento de los ventiladores se afectó significativamente al utilizar el helmet, con tiempos de retraso de más del doble al compararlos con la máscara oronasal. Este efecto fue más pronunciado con niveles de PEEP < 8 cmH2O. Del mismo modo, con helmet, la aplicación de PS tuvo un efecto favorable sobre el retraso de los tiempos inspiratorios. Con el empleo de máscara oronasal no se observó esta repercusión al utilizar PEEP y PS. El producto presión-tiempo durante la fase de trigger (PTPtrigger) y durante el retorno al nivel basal de PEEP (PTPPEEP), como estimación del esfuerzo inspiratorio, fue menor con helmet que con máscara oronasal. Este hallazgo se atribuyó a que el mayor reservorio del helmet amortiguó los cambios de presión durante el esfuerzo inspiratorio. Sin embargo, el producto presión-tiempo de toda la fase inspiratoria (PTPTOT) fue similar para las dos interfases15.
Humidificación e interacción pacienteventilador
Desde hace años existe consenso en la necesidad de acondicionamiento de los gases inspirados, y en que esto repercute en el mantenimiento de un adecuado funcionamiento ciliar y en las características reológicas del moco respiratorio. La humidificación de los gases inspirados es esencial en el tratamiento de los pacientes que necesitan ventilación mecánica mediante tubo orotraqueal y en VMNI16.
Para humidificar y calentar el gas inspirado disponemos de intercambiadores calor-humedad (HME) y humidificadores activos. Los HME restan eficacia a la VMNI en la disminución del esfuerzo inspiratorio, comparados con los humidificadores activos, en los pacientes tratados por fallo respiratorio agudo. Esto puede ser debido a un aumento del espacio muerto, lo cual provoca efectos negativos sobre el intercambio de gases. La forma en la que los sistemas de humidificación afectan al trigger se desconoce; sin embargo, el incremento del esfuerzo inspiratorio y espacio muerto puede sugerir indirectamente que los HME pueden interferir con la interacción paciente-ventilador6.
* Autor para correspondencia.
Correo electrónico: rartachor@telefonica.net (R. Artacho Ruiz).
Aceptado para su publicación el 17 de febrero de 2009