Cuantificar la variación de la masa muscular y el peso en pacientes críticos e identificar los factores asociados.
MetodologíaEstudio de cohortes. Se recogieron variables demográficas, peso, balance hídrico y kilocalorías diarias, administración de sedantes y relajantes y fisioterapia motora.
Se realizaron 3 medidas consecutivas mediante ultrasonidos del bíceps braquial y recto anterior del cuádriceps, al ingreso y cada 5 días hasta el alta.
ResultadosSe estudiaron 68 pacientes, la edad mediana fue 73,5 [57-78,5] años y la estancia mediana de 9,5 [5,5-15] días. Los pacientes recibieron una media de 16 (DE=5,7) kilocalorías diarias por Kg/peso, el 91,2% sedación, el 44,1% relajantes musculares y un 20% fisioterapia.
Los pacientes presentaron una pérdida de masa muscular en el bíceps braquial de 4,9 (DE= 3,9) mm, p<0,001 y de 5,6 (DE=4,8) mm en el recto anterior, p<0,001. El análisis de regresión seleccionó la estancia y los relajantes musculares como variables que influían en la pérdida de masa muscular en el bíceps braquial (R2=0,4) y solo la estancia en el recto anterior (R2=0,3). Los pacientes pesaban al ingreso una media de 81,1 (DE=15) Kg y al alta 81,2 (DE=14,2) Kg, p =0,95.
ConclusionesEl paciente crítico presenta una pérdida de masa muscular significativa relacionada con la estancia y el tratamiento con relajantes musculares. Al alta los enfermos tienen un peso similar al del ingreso, pero una importante disminución de su musculatura.
Quantify the muscle mass and body weight variation in critically ill patients and to identify associated factors.
MethodA descriptive follow-up study. Data for demographic variables, body weight, fluid balance, daily kilocalories, the amount of sedation and muscle relaxants received and motor physiotherapy applied were collected.
Three consecutive measurements were performed in the brachial biceps and quadriceps rectus by using ultrasound, upon admission and every 5 days until discharge.
Results68 patients were included. Average age was of 73.5 [57-78,5] years. The median length of stay was 9.5 [5.5 -15] days. The median 16 (SD=5.7) daily kilocalories per kg/weight, 91.2% received sedation, 44.1% received muscle relaxants and 20% received physiotherapy.
The patients presented a muscle wasting of 4.9 (SD=3.9)mm, p <.001 in the brachial biceps and 5.6 (SD=4.8)mm, p <.001 in the quadriceps rectus. Regression analysis selected the length of stay and the muscle relaxants are the most influential variables in the brachial biceps muscle wasting (R2=0.4), and length of stay as the most influential in the quadriceps rectus muscle wasting (R2=0.3). Patient's mean body weight on admission was of 81.1 (SD=15)kg and 81.2 (SD=14.2)kg on discharge, p=.95.
ConclusionsThe critically ill patient presents a significant muscle waste related with the length of stay and the treatment received with muscle relaxants. Patients are being discharged with a similar body weight to which they were admitted but with a significant reduction of muscle mass.
Los pacientes críticos sufren una PMM durante su ingreso en UCI y las causas son multifactoriales como el reposo prolongado, inflamación sistémica, determinados fármacos o el estado nutricional.
El presente estudio confirma lo que se conoce hasta el momento, siendo los días de estancia el principal factor contribuyente a la PMM. En este sentido, la enfermera podría convertirse en la principal promotora de una movilización temprana.
¿Implicaciones del estudio?La enfermera puede dinamizar el proceso de movilización precoz dentro del equipo asistencial así como convertirse en el nexo entre fisioterapeutas y familiares, para que estos puedan contribuir de manera activa en la rehabilitación motora dentro del cuidado integral al paciente.
A pesar de que los constantes avances tecnológicos y sanitarios han permitido mejorar el tratamiento, los cuidados y la supervivencia del paciente crítico, estos continúan perdiendo una gran cantidad de peso durante su estancia en la Unidad de Cuidados Intensivos (UCI)1,2 siendo una gran proporción atribuible a la disminución del tejido magro3. Sin embargo, la pérdida de masa muscular (PMM) puede pasar desapercibida debido a la retención de líquidos que se produce en muchos pacientes en la etapa más aguda de su enfermedad pudiendo llegar a significar entre el 10-20% de su peso total4, por lo que las medidas antropométricas tradicionales no son aplicables. Campbell et al.5 sugirieron que los ultrasonidos podrían ser un indicador precoz de la PMM, hecho ratificado posteriormente6, la cual puede tener claras implicaciones para el paciente, ya que según Kelly et al.7, más de la mitad refieren tener problemas físicos, como debilidad y fatiga, que les dificulta la vuelta a sus tareas anteriores.
Según queda reflejado en la literatura médica existen varios factores, a parte de la patología base8 del paciente, que pueden contribuir en mayor o menor proporción en la PMM, como son la inmovilización prolongada2,9, tipo de nutrición recibida10, la hiperglucemia11 y tipo de fármacos12 administrados durante el curso clínico de la enfermedad crítica como sedantes, relajantes neuromusculares o corticoides13.
Aunque la debilidad adquirida en la UCI y la polineuropatía del paciente crítico son patologías con manifestaciones clínicas de PMM, el propósito de este trabajo se centra principalmente en la evolución de la masa muscular y en la identificación de las causas que pueden favorecer su desarrollo y que pueden ser potencialmente tratables por las enfermeras. Por ello el objetivo de dicho estudio fue cuantificar la variación de la masa muscular y el peso en personas ingresadas en una unidad de cuidados intensivos durante cinco días o más e identificar los factores asociados.
MetodologíaSe realizó un estudio de cohortes en una UCI polivalente de doce camas cuyo ratio enfermera paciente es de 1:2. Se trata de un hospital de nivel terciario de 481 camas, repartidas en 34 especialidades médicas y quirúrgicas. Su área de influencia inmediata es de 315.000 habitantes. Este estudio se llevó a cabo desde noviembre del 2011 a enero del 2013. Se incluyeron todos los pacientes con una edad mínima superior a los 18 años. Se excluyeron aquellos pacientes con tratamiento de quimioterapia o proceso tumoral activo y patología neuromuscular previa y aquellos con estancia en UCI inferior a 5 días. Se recogieron datos demográficos (edad y sexo), diagnóstico médico (sepsis, cirugía, traumatología, neurocirugía y otros diagnósticos médicos), peso y talla, obesidad (índice de masa corporal >30), días de estancia en UCI, índice de gravedad Acute Physiology Score and Chronic Health Evaluation (APACHE III), balance hídrico diario, kilocalorías diarias administradas y tipo de dieta (nutrición enteral, parenteral, o vía oral), realización de fisioterapia motora, horas de ventilación mecánica, administración de sedantes (midazolam, propofol y remifentanilo) y relajantes musculares (cloruro de suxametonio y besilato de atracurio) en perfusión continua o administración en bolo, grado de sedación según escala Ramsay, tratamiento con corticoides y valores de glucemias diarios (se registró el valor más alto del día).
Se midió la musculatura del bíceps braquial y del recto anterior del cuádriceps al ingreso y cada 5 días hasta el alta (como valor del alta se utilizó el de la última medición) por un único observador, el cual fue debidamente formado y entrenado. Se realizaron 3 medidas consecutivas mediante ultrasonidos (Ecógrafo Siemens Acuson X300® con transductor lineal VF10-5 de 6-10MHz. Siemens Medical Solutions, EE. UU. Inc. Mountain View CA94043 EE. UU.), con la imagen congelada, siendo el valor final la media de las tres mediciones, con la finalidad de minimizar la variabilidad intrasujeto. Las mediciones se realizaron en los miembros derechos, mientras el paciente permanecía en decúbito supino y con el cabezal elevado a 30°. En la primera medida se realizaba una marca en la piel con un rotulador permanente (para que sirviera de referencia en futuras mediciones), que correspondía a la zona media entre la punta del trocánter mayor y el polo superior de la rótula para la pierna y desde la punta del acromion hasta la punta del olécranon con el codo en extensión y el antebrazo en supinación, para el brazo.
Cálculo de la muestraTeniendo en cuenta, que según datos bibliográficos14 más del 90% de los pacientes críticos sufren PMM durante su ingreso en la UCI, con una precisión del 5% y un riesgo alfa del 5%, y con una población diana en nuestra unidad inferior a 400 ingresos que reúnan la condición de estancia superior a 5 días, con 65 pacientes es suficiente para llevar a cabo la estimación de la PMM.
Análisis estadísticoEstadística descriptiva con medias y proporciones. Se aplicó la prueba de normalidad Kolmogorov-Smirnov para conocer la distribución de las variables cuantitativas. Aquellas variables con distribución no normal se expresaron con medianas y percentiles 25 y 75. El análisis bivariable se llevó a cabo con la t-Student para comparar medias o sus equivalentes no paramétricos, y para datos apareados cuando se analizaron en momentos distintos en los mismos pacientes. También se utilizaron técnicas de correlación, método de Pearson o Spearman según contexto. Se aplicó el modelo de regresión lineal múltiple. Se realizó un cribado previo de predictores excluyendo aquellos donde el análisis bivariable con la variable PMM en brazo o PMM en recto anterior se había obtenido una p≥0,1. Las variables seleccionadas se analizaron con el método de regresión paso a paso (Stepwise). La significación estadística se estableció con una p≤0,05 y los datos se analizaron con el programa SPSS versión 18 para Windows.
El estudio contó con la aprobación del Comité Ético de Investigación Clínica de la entidad, respetando en todo momento la confidencialidad de los datos. No se consideró necesario solicitar el consentimiento informado a los pacientes por no tratarse de un estudio de intervención, ya que la medición de la masa muscular por el método de ultrasonidos ni perjudica ni afecta a los pacientes.
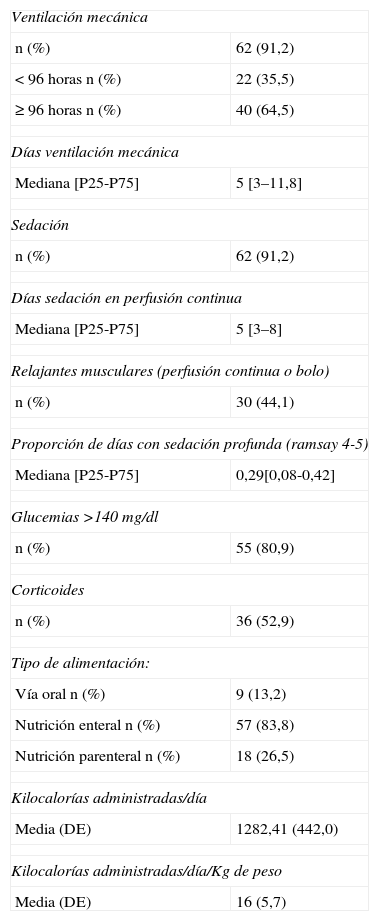
ResultadosSe estudiaron un total de 68 pacientes, cuyas características demográficas se recogen en la tabla 1, siendo la sepsis el diagnóstico médico que motivó la mayor parte de ingresos en UCI. En la tabla 2 se describen sus características clínicas, mostrando los factores de riesgo que la literatura asocia a la PMM, evidenciándose unos porcentajes elevados de pacientes sedados y de pacientes que durante su estancia en UCI recibieron alguna dosis de relajante muscular. La tabla también muestra un importante número de pacientes que presentaron hiperglucemia y recibió corticoterapia.
Características demográficas
| Número de pacientes | 68 |
| Edad (años) | |
| Mediana [P25-P75] | 73,5 [57–78,5] |
| Sexo | |
| Hombres n (%) | 47(69,1) |
| Mujeres n (%) | 21(30,9) |
| Estancia(días) | |
| Mediana [P25-P75] | 9,5 [5-15,5] |
| Diagnóstico de ingreso: | |
| Sepsis n (%) | 42 (61,8) |
| Cirugía n (%) | 4 (5,9) |
| Traumatología n (%) | 3(4,4) |
| Neurocirugía n (%) | 7(10,3) |
| Otros diagnósticos n (%) | 12(17,6) |
| Obesidad (IMC>30) | |
| n (%) | 16(23,5) |
| Apache III | |
| Mediana [P25-P75] | 74 [60–96,5] |
Apache:Acute Physiology Score and Chronic Health Evaluation; IMC: índice de masa corporal; P25:percentil 25; P75:percentil 75.
Características clínicas
| Ventilación mecánica | |
| n (%) | 62 (91,2) |
| < 96 horas n (%) | 22 (35,5) |
| ≥ 96 horas n (%) | 40 (64,5) |
| Días ventilación mecánica | |
| Mediana [P25-P75] | 5 [3–11,8] |
| Sedación | |
| n (%) | 62 (91,2) |
| Días sedación en perfusión continua | |
| Mediana [P25-P75] | 5 [3–8] |
| Relajantes musculares (perfusión continua o bolo) | |
| n (%) | 30 (44,1) |
| Proporción de días con sedación profunda (ramsay 4-5) | |
| Mediana [P25-P75] | 0,29[0,08-0,42] |
| Glucemias >140mg/dl | |
| n (%) | 55 (80,9) |
| Corticoides | |
| n (%) | 36 (52,9) |
| Tipo de alimentación: | |
| Vía oral n (%) | 9 (13,2) |
| Nutrición enteral n (%) | 57 (83,8) |
| Nutrición parenteral n (%) | 18 (26,5) |
| Kilocalorías administradas/día | |
| Media (DE) | 1282,41 (442,0) |
| Kilocalorías administradas/día/Kg de peso | |
| Media (DE) | 16 (5,7) |
P25:percentil 25; P75:percentil 75.
A un total de 13 pacientes que representa el 19,1%, se les realizó fisioterapia motora durante su ingreso en la UCI, los cuales comenzaron a recibirla sobre el 14.° día de ingreso y durante una media de 6,2 (DE=4) días. El 41,2% (28 pacientes) sedestaron en cama y al 17,6% (12 pacientes) se realizó la transferencia a sillón.
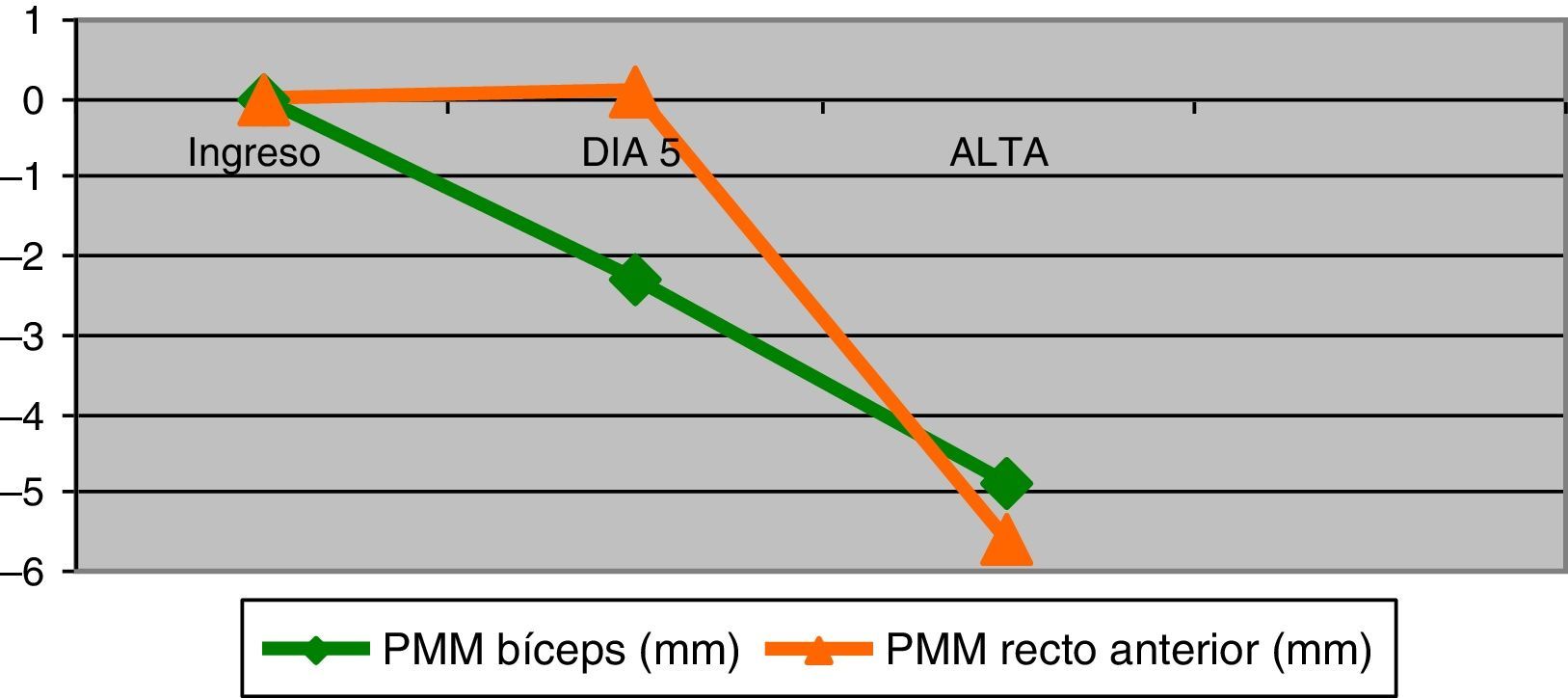
Masa muscularDe las mediciones realizadas al ingreso se obtuvo una media del grosor del bíceps braquial y del recto anterior de 23,7 (DE=5,7)mm y 24,4 (DE=7,7)mm, respectivamente. Durante la estancia en UCI los pacientes presentaron una PMM en el bíceps braquial de 4,9 (DE=3,9)mm (IC95%:3,9 a 5,8), p<0,001 y de 5,6 (DE=4,8)mm (IC95%=4,5 a 6,8) en el recto anterior, p<0,001. En la figura 1 muestra la evolución de dicha pérdida. Esto representó para el bíceps braquial una disminución del 20,7% del total de su masa y el 23,0% para el recto anterior. El análisis de regresión lineal múltiple seleccionó la estancia en UCI y los relajantes musculares como variables que influyeron en la PMM del bíceps braquial (R2=0,4; p< 0,001) y los días de estancia en la PMM del recto anterior (R2=0,3; p<0,001).
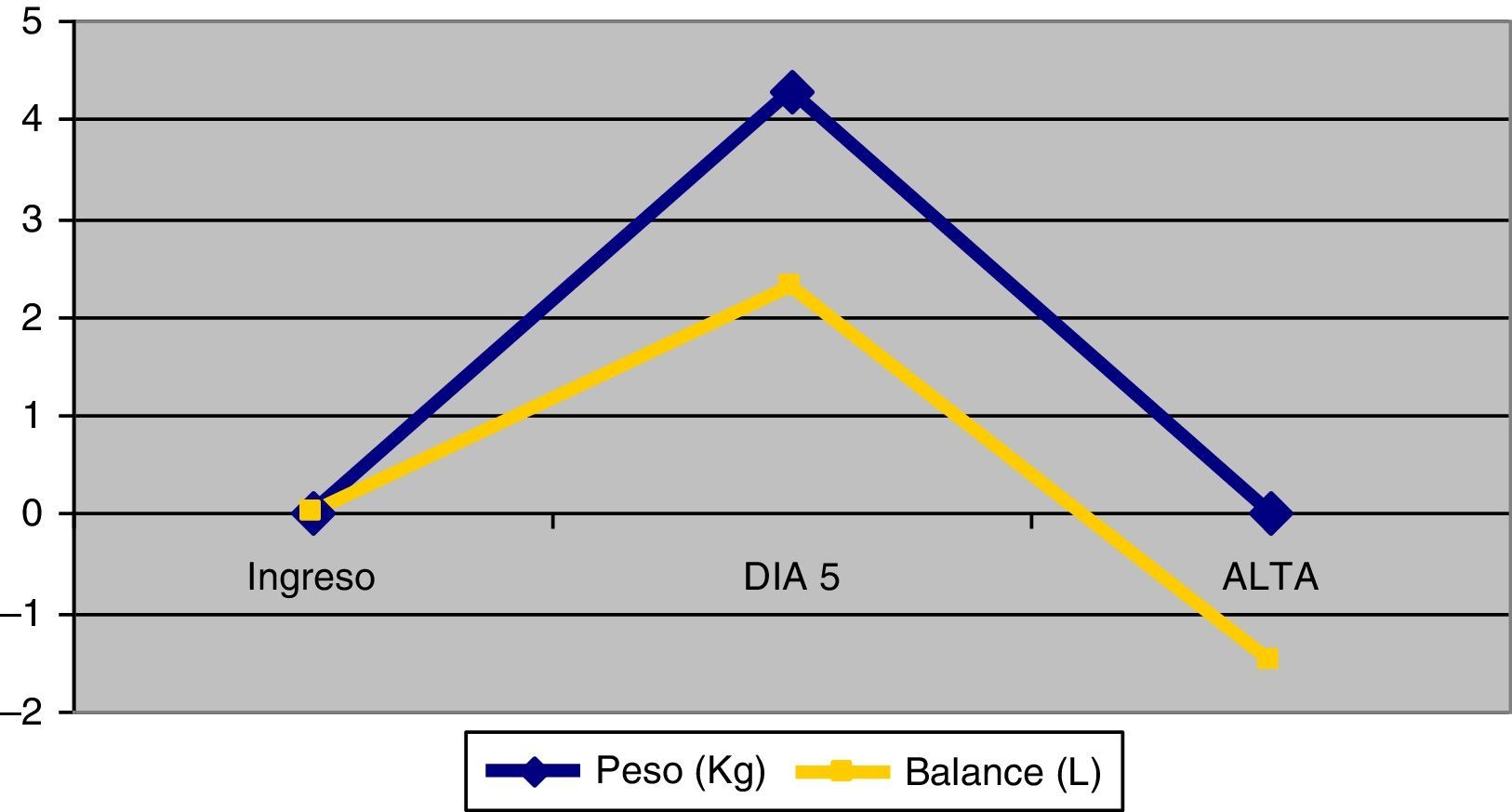
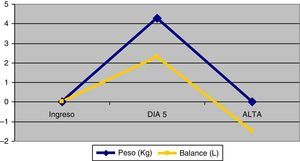
PesoLos pacientes pesaban al ingreso una media de 81,1 (DE=15) kg y al alta 81,2 (DE=14,2), p=0,95. Como se muestra en el figura 2, entre el 1.° y el 5.° día los pacientes incrementaron el peso con una media de 4,3 (DE= 6,6) Kg (IC95%: 2,7 a 5,9), p<0,001. Entre el 5.° día de ingreso y hasta el alta perdieron un promedio de 4,3 (DE=4,8)kg (IC95%: 3,0 a 5,6), p< 0,001.
Entre el primer día del ingreso y el 5.° día los pacientes hicieron balance hídrico positivo con una media de 2,3 litros (DE=4,4) (IC95%: 1,2 a 3,4) p<0,001. Del 5.° día de ingreso hasta el alta de la unidad presentaron balance negativo con una media de 3,8 litros (DE=6,0) (IC95%: 2,4 a 5,3), p<0,001.
La correlación existente entre peso y balance hídrico fue r=0,8, p<0,001.
La correlación entre PMM del bíceps y PMM del recto anterior y el peso fue de r=-0,286, p=0,02 y r=-0,270, p=0,03, respectivamente.
DiscusiónLos datos de este estudio confirman, de nuevo, que existe una importante PMM en el paciente crítico. En la literatura científica encontramos poblaciones muy diversas cuya PMM oscila entre un 10-21%15–18, aunque su comparación es complicada dada la variabilidad metodológica utilizada: diferentes días de seguimiento, grupos musculares y métodos de medición (ecografía, tomografía axial computerizada, resonancia magnética,…)
Existen varios factores que pueden contribuir a la PMM19,20 entre los que se encuentra una administración excesiva de sedantes, la inmovilidad o escasa terapia física y la inflamación sistémica provocada por la enfermedad crítica. No obstante el análisis multivariante seleccionó los días de estancia como un factor asociado a la PMM al igual que otros estudios como Gruther et al.21 y Walsh et al.20. El ingreso en UCI y en consecuencia la permanencia durante días en la cama, puede ser considerado sinónimo de reposo prolongado, el cual tiene un efecto perjudicial para el músculo, incluso en sujetos sanos, como reportó el estudio de Mulder et al.17 en el que se randomizaron dos grupos que permanecían en reposo varias semanas, y el grupo que no realizó ejercicios durante ese período sufrió una PMM del 14% en el cuádriceps femoral. Esta pérdida suele producirse de una manera constante y rápida durante la primera semana14,15,22. De hecho, en el presente estudio los pacientes sufren cerca del 50% de PMM en los primeros 5 días.
En nuestro estudio, el uso de relajantes musculares ha sido seleccionado como variable predictora en la PMM. No obstante, una revisión liderada por Puthucheary23, se opone a la relación causal entre el uso de relajantes musculares y debilidad del músculo esquelético, alegando que existen factores confundidores como la sedación prolongada y otros que pueden favorecerla. Aunque debilidad adquirida en UCI y PMM están íntimamente ligados, en nuestro caso, y como hemos aclarado en un inicio, el objetivo se limita a estudiar la evolución de la PMM en el enfermo crítico en una población heterogénea. En este sentido, no se han encontrado artículos que hablen en estos términos, pero parece lógico pensar que la administración de relajantes musculares favorece la inmovilidad del paciente y por lo tanto la PMM.
Como ya se ha comentado, una sedación excesiva se ha reportado como un factor contribuyente a la PMM20. Aunque la mayor parte de los pacientes de este estudio recibieron sedación, solo estuvieron sometidos a una sedación profunda un 30% del tiempo que estuvieron ingresados en la UCI. Esto podría ser una explicación al hecho de que la sedación no haya sido seleccionada como factor de la PMM.
El control de la glucemia capilar es un parámetro habitual en la UCI, y aunque en este estudio la glucemia superior a 140mg/dl no ha sido elegida como un factor de riesgo para la PMM, las últimas investigaciones publicadas apuntan a que el tratamiento y control de la hiperglucemia de manera agresiva con insulina por vía intravenosa puede ayudar a reducir dicha pérdida11. Por otro lado, existe cierta controversia en la literatura, sobre si la administración de corticoides puede favorecer la PMM13, hecho que no se ha podido relacionar en este estudio.
Las guías24 sobre nutrición en el paciente crítico recomiendan un aporte calórico entre 25 y 35 kcal/kg de peso al día dependiendo de su patología de base. A pesar de que el aporte que recibían los enfermos de este estudio fue inferior al aconsejado, esta variable no se ha podido relacionar con la PMM, al igual que en los estudios de Puthucheary et al.15 y el de Reid et al.14.
Respecto al peso de la población estudiada, se observa durante los primeros 5 días un incremento de este que se asocia directamente a un balance hídrico positivo. De la misma manera, la evolución del peso y del balance hídrico hasta el momento del alta sigue un patrón decreciente. No obstante, esta variación del peso durante la estancia en UCI no se traduce en una diferencia significativa entre el peso al ingreso y al alta, a pesar de la importante PMM que ha sufrido el paciente durante su permanencia en la UCI.
La PMM en el recto anterior tarda más días en evidenciarse (fig. 1), observándose a partir del 5.° día de estancia. Esto puede estar relacionado con la presencia de edema en zonas de declive, como consecuencia del balance hídrico positivo de los primeros días, que puede artefactar la lectura ecográfica y enmascarar la PMM.
Una movilización temprana en el paciente de UCI puede contribuir a reducir la atrofia y la debilidad muscular20 y por tanto puede tener un rol importante en la preservación y protección muscular2. Un estudio multicéntrico demostró que solo un 27% de los pacientes recibió terapia física en la UCI9, cifra superior a la obtenida en este estudio, en el cual dicha rehabilitación empezó a las 2 semanas de ingreso, y posiblemente cuando el paciente ya había superado la fase aguda de su enfermedad. No obstante, existen estudios que sugieren que una movilización, incluso en la fase aguda, es posible y segura para el paciente25.
Limitaciones del estudioNo ha sido posible aportar el número de pacientes excluidos durante el periodo de recogida de datos y sus causas.
Debido a que el interés principal del estudio era plasmar la PMM en el paciente crítico en general, se desconoce el porcentaje de pacientes estudiados con patologías previas de insuficiencia renal crónica, insuficiencia cardiaca o enfermedad obstructiva crónica, las cuales pueden incrementar dicha pérdida. Así mismo y dentro de la muestra estudiada, no se ha podido determinar el grado de disfunción multiorgánica mediante SOFA Score (Sequential Organ Failure Assessment) de los pacientes con sepsis ni la cantidad de tiempo al que estuvieron tratados con relajantes musculares, aunque dichos fármacos fueron administrados principalmente en bolo y de forma puntual.
ConclusionesLos datos sugieren que hay una PMM durante el ingreso en la UCI y los factores que más influyen son los días de estancia y el hecho de recibir relajantes musculares, este último al ser indicado por el médico, es poco modificable por las enfermeras. En cambio, ellas si puede tener un papel determinante en los días de estancia ya que los cuidados realizados tienen una repercusión directa en la evolución del paciente.
Existe un aumento de peso durante los primeros días de ingreso atribuible a la presencia de edema que disminuye al alta de la unidad.
Aparentemente el peso no es un buen indicador de la PMM en el paciente crítico. Los pacientes salen de la UCI con un peso similar al del ingreso, pero con una importante disminución de la musculatura.
Si consideramos estancia en UCI como un sinónimo de inmovilidad, la enfermera podría promover de manera precoz la movilidad y sedestación del enfermo crítico, así como dentro del equipo multidisciplinar fomentar la recuperación motora por parte de los fisioterapeutas y servir como nexo entre estos y la familia, invitándola a colaborar activamente en programas de rehabilitación que favorecerían al paciente.
FinanciaciónLos autores del trabajo manifiestan que no han recibido ninguna subvención, beca o soporte financiero para la realización del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.