¿ INTRODUCCIÓN
En cuanto a las neoplasias malignas, el cáncer de colon y recto (CCR) ocupa el tercer lugar en incidencia a nivel mundial, por debajo del cáncer de pulmón y mama. Los tumores del tubo digestivo representaron 32% de las defunciones informadas en México en 2001 y se estima que en 2009 se diagnosticarán más de 3700 casos, de los cuales aproximadamente la mitad fallecerán.1,3 El CCR es una de las neoplasias malignas que mayor interés han despertado en los últimos años en la comunidad oncológica, tanto por su importancia epidemiológica como por los múltiples avances terapéuticos que se han desarrollado en los últimos años.
Para el CCR, la cirugía ha sido y sigue siendo la mejor arma terapéutica; sin embargo, de cada 100 pacientes que se diagnostican, 55 tienen enfermedad avanzada y han desarrollado o desarrollarán metástasis, lo que los hace candidatos a recibir tratamiento sistémico. De los otros 45 que no recaerán después de cirugía, un alto porcentaje también son candidatos a tratamiento sistémico adyuvante. La mediana de supervivencia en pacientes con cáncer de colon y recto metastásico (CCRm) manejados únicamente con tratamiento de apoyo era de seis meses.4 Durante muchos años, el tratamiento sistémico se limitó básicamente a una droga, el 5-fluorouracilo (5-FU), con un índice de respuesta de entre 10% a 25% y un incremento en la supervivencia a 10 meses.5 En el tratamiento de la enfermedad metastásica, la utilidad de otros agentes antineoplásicos era cuestionable, por lo que la investigación se dirigió durante mucho tiempo fundamentalmente a lograr una mayor eficacia del 5-FU, modulando su actividad con diferentes drogas, dentro de las cuales se destaca el leucovorin, única que por su actividad clínica se mantiene hasta la actualidad en el tratamiento del CCR. Algunos de los moduladores utilizados y que permanecen exclusivamente como antecedente histórico son: metotrexate, interferon, levamizol, PALA, dipiridamol, alopurinol, entre otros.
A su vez, los pobres resultados del tratamiento de la enfermedad metastásica contribuyeron a la ausencia de un tratamiento adyuvante efectivo. Fue hasta 1990 en que por primera vez se aprobó el 5-FU en el tratamiento postoperatorio de pacientes con ganglios positivos.6 Dicha droga junto con el leucovorin se mantuvo como tratamiento estándar durante más de 10 años antes de incluir nuevas drogas a los esquemas terapéuticos.
En la actualidad existen múltiples opciones para el tratamiento sistémico; que incluyen agentes antineoplásicos como las fluoropirimidinas, irinotecan y oxaliplatino, y los anticuerpos monoclonales: bevacizumab, cetuximab y panitumumab.
El estadio clínico y patológico del paciente con CCR siempre ha sido un factor pronóstico muy importante. Otros elementos como el antígeno carcinoembrionario (ACE), tienen valor pronóstico; sin embargo, no existe consenso en la literatura. En los últimos años se ha incorporado el estatus del K-RAS como un factor predictivo, a pesar de que probablemente no tiene valor pronóstico. La presencia o ausencia de mutaciones del K-RAS permite individualizar mejor el tratamiento de estos pacientes.
Los avances en el manejo del CCR se han traducido en un significativo incremento en el beneficio clínico de los pacientes. Esto a su vez ha planteado nuevos retos en el tratamiento integral de estos enfermos. Algunos de estos desafíos los representan las siguientes preguntas. ¿Cuáles son las opciones terapéuticas derivadas del desarrollo de las nuevas drogas, en general y en situaciones clínicas específicas? y ¿cuál debe ser la duración del tratamiento en aquellos pacientes que han logrado un beneficio sostenido? Las respuestas a estas preguntas tienen múltiples e importantes implicaciones tanto clínicas como económicas.
Considerando lo anterior, del 10 al 12 de septiembre de 2009 los laboratorios Roche convocaron a un grupo de médicos mexicanos con experiencia en el tema a un foro de opinión en el diagnóstico y tratamiento del cáncer CCRm. Asistieron a la reunión especialistas en patología, cirugía oncológica, oncología médica y radioterapia, con la intención de discutir y analizar los aspectos más relevantes del tema. El principal objetivo del foro fue compartir información y conocer la opinión de los participantes a través de la siguiente dinámica: conferencias para toda la audiencia, trabajo en equipos y posteriormente la presentación y discusión de los resultados de los diferentes grupos. Se elaboraron conclusiones que intentan reflejar las prácticas internacionales actuales y los criterios prevalentes en México, reconociendo los alcances y limitaciones de cada institución y de algunas zonas del país. En el foro se privilegió el tiempo destinado al trabajo en equipos, que se desarrolló en pequeños grupos en distintas salas, las cuales estaban acondicionadas con la infraestructura electrónica necesaria para permitir la consulta bibliográfica en línea. El foro se concentró principalmente en los siguientes puntos:
1. Análisis de los diferentes factores pronósticos y predictivos.
2. Evaluación de los diferentes esquemas terapéuticos disponibles y sus indicaciones.
3. Análisis de algunas situaciones clínicas específicas tales como las metástasis hepáticas y la enfermedad localmente avanzada o metastásica como presentación inicial.
4. Duración del tratamiento sistémico.
Estos puntos representaron la directriz que guió la discusión de los diferentes grupos de trabajo. La intención del siguiente documento no es presentar una revisión detallada del tema si no un resumen de los aspectos más relevantes en la práctica clínica.
¿ DISCUSIÓN Y CONCLUSIONES
Factores pronósticos y predictivos: Un factor pronóstico es aquel que influye en evolución de un paciente independientemente del tratamiento. Un factor predictivo es aquel que influye en la evolución del paciente de acuerdo a determinado tratamiento. Los factores pronósticos pueden o no ser predictivos. De la misma forma que los factores prediuctivos también pueden o no ser pronósticos. Un ejemplo de factores pronósticos que también son predictivos, son los receptores hormonales y el HER2 en cáncer de mama. Un ejemplo de factor predictivo que no parece tener valor pronóstico es el K-RAS en cáncer de colon.
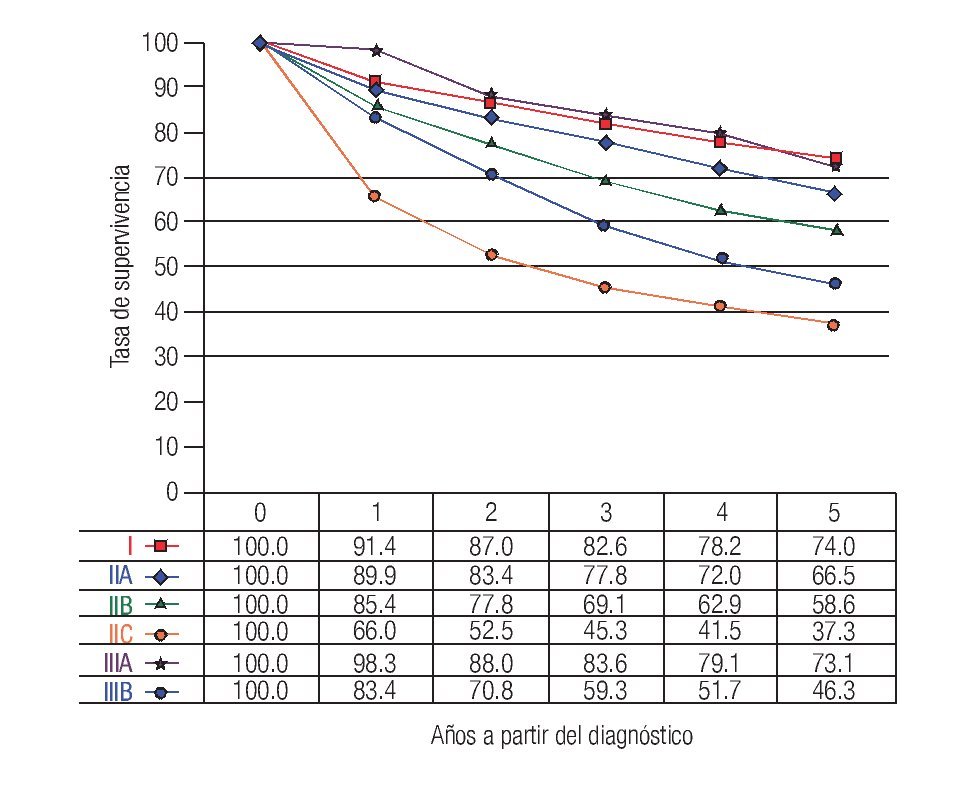
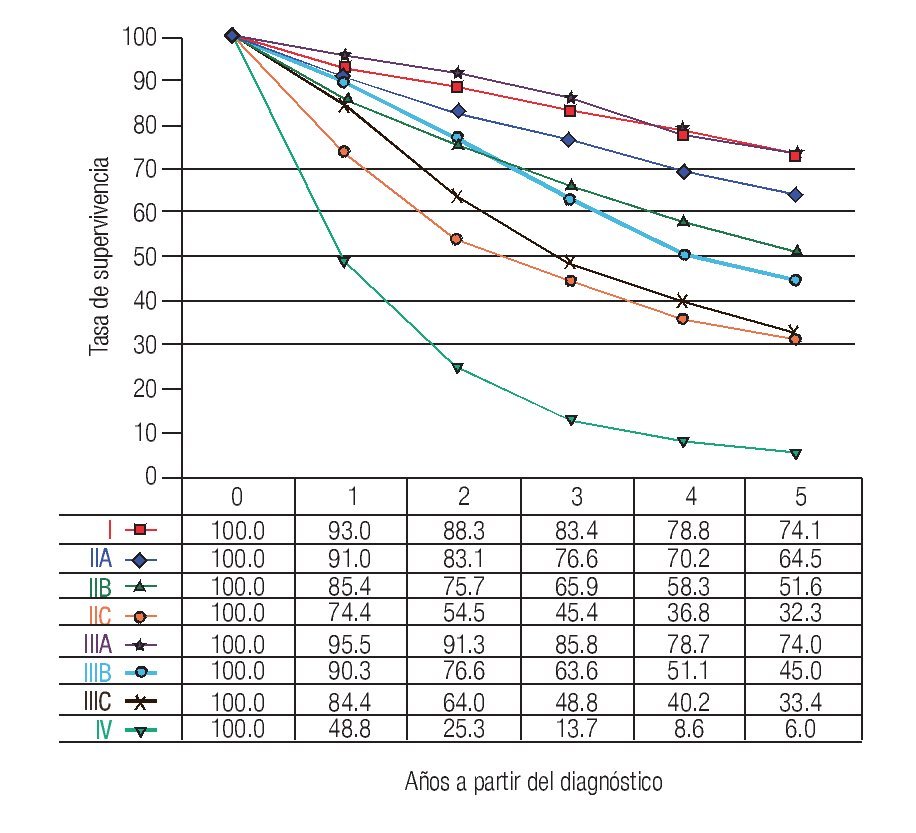
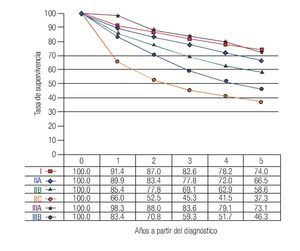
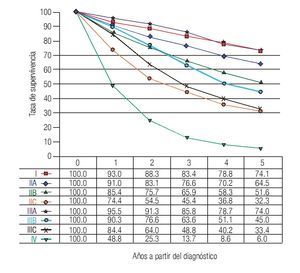
TNM: El factor pronóstico más importante en CCR es el estadio (Figuras 1 y 2), que establece claras diferencias en la supervivencia. En relación a los ganglios, es importante conocer no solamente la presencia de metástasis, también el número total de ganglios resecados. Se recomienda que estos sean cuando menos 12. El número total de ganglios extirpados es particularmente importante en pacientes sin metástasis ganglionares ya que el pronóstico mejora de acuerdo al número total de ganglios resecados.7-10
Figura 1. Tasas de supervivencia observadas en 28 491 casos de adenocarcinoma de colon.
Figura 2. Tasas de supervivencia observadas en 9860 casos con adenocarcinoma de recto.
Antígeno carcinoembrionario: En relación con el ACE y el pronóstico, si bien existen algunas controversias, siempre hay que determinarlo y su valor pronóstico es el siguiente: En pacientes con niveles preoperatorios altos, la persistencia de ACE elevado después de una resección completa significa actividad tumoral residual. Por otro lado, la supervivencia a cinco años parece ser superior en aquellos pacientes con ACE preoperatorio < 5 ng/mL.11 La determinación periódica del ACE durante el seguimiento también es útil en la detección temprana de recurrencias e inclusive puede ser útil en el pronóstico de los pacientes a partir de la recaída.
Inestabilidad Microsatélite (IM): Representa la expansión o contracción de secuencias de ADN causadas por la inserción o deleción de unidades repetidas. La repetición más frecuente es la del dinucleótido citosina y adenina. Cuando la IM es ≥ 30% se denomina IM alta y confiere un mejor pronóstico que cuando es baja o estable, a pesar de que estos tumores pueden ser poco diferenciados. La IM alta se ha reportado como un factor predictivo a la respuesta al 5-FU, sin embargo la información no es concluyente.12-16
P53: Las mutaciones de p53 representan la alteración genética más frecuente en cáncer. Sin embargo, a pesar de la extensa bibliografía en relación a p53 en cáncer de colon, su valor pronóstico aun es incierto.17
KRAS y BRAF: Las mutaciones en KRAS están presentes en 40% a 45% de los pacientes y se asocian con resistencia a los agentes dirigidos al receptor del factor de crecimiento epidermoide, cetuximab y panitumumab.18-20 El BRAF es uno de los componentes de la vía de señalización de RAS-RAF-MAPK. De 72% de pacientes con KRAS silvestre que no responden a cetuximab y panitumumab, en 14% existen mutaciones de BRAF;21 las cuales explican el por qué, cuando menos en algunos casos de resistencia en pacientes con KRAS silvestre. Conocer el estatus mutacional del KRAS representa el primer paso en la individualización del tratamiento dirigido en pacientes con CCRm.
¿ DIFERENTES AGENTES ANTINEOPLÁSICOS Y ESQUEMAS APROBADOS EN CCRm
Durante muchos años, el tratamiento sistémico del CCRm se basó casi exclusivamente en 5-FU y leucovorin. A pesar de que fueron muchas las drogas que se combinaron con el 5-FU, los resultados no mejoraron hasta que a fines de 1990 el irinotecan y el oxaliplatino se agregaron al 5-FU y leucovorín y elevaron la supervivencia a 14 -16 meses.5 El uso de estos agentes creó los ya populares esquemas conocidos como FOLFIRI o ILF cuando contienen irinotecan y FOLFOX para oxaliplatino. Estos esquemas no son fijos ya que representan combinaciones que permiten diferentes dosis e intervalos de aplicación de sus componentes.22 A su vez, el 5-FU puede sustituirse por la fluoropiridimidina oral, capecitabina, logrando una eficacia terapéutica semejante pero con un perfil de toxicidad distinto, principalmente a expensas del síndrome mano-pie que se presenta con mayor frecuencia con la capecitabina.23 En relación a la selección del irinotecan u oxaliplatino, también son en gran parte los efectos secundarios de cada uno de estos agentes lo que determina la preferencia por alguno de ellos en cada paciente en particular.
En cuanto al perfil de toxicidad de estos dos agentes, principalmente se debe tener presente el riesgo de neuropatía y alergia con el oxaliplatino y la diarrea e interacciones con otros medicamentos, en particular los metabolizados por el CYP3A4, como el ketoconazol, con el irinotecan.24
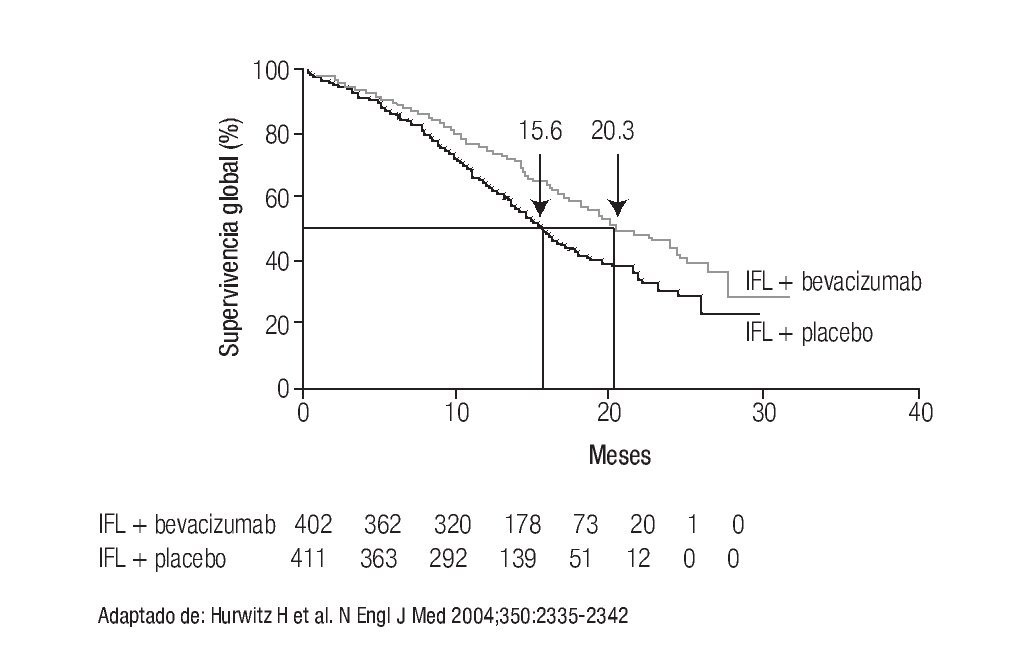
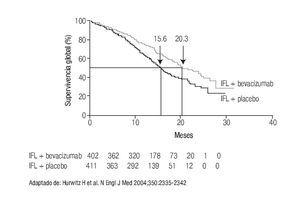
A las alternativas anteriores se han incorporado otras opciones, producto del desarrollo de los anticuerpos monoclonales. El primero de ellos fue bevacizumab, que representa el primer anticuerpo monoclonal aprobado por la FDA dirigido a inhibir la angiogénesis. La inclusión de bevacizumab incrementó la supervivencia otros cinco meses o más (Figura 3),25 logrando que en la actualidad la mediana de supervivencia de pacientes con CCRm sea de cuando menos 21 meses.5
Figura 3. IFL ± bebacizumab en CCRm.
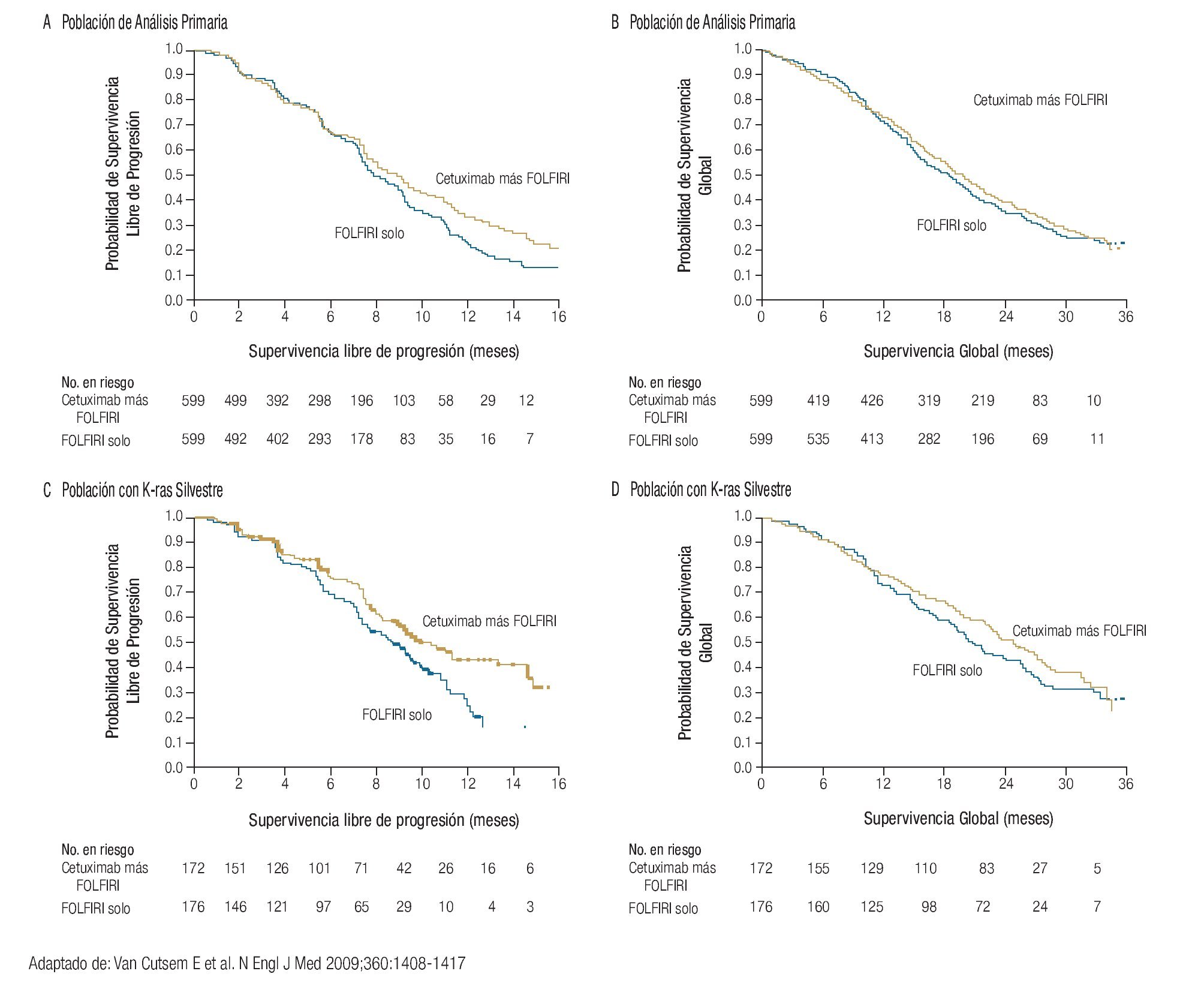
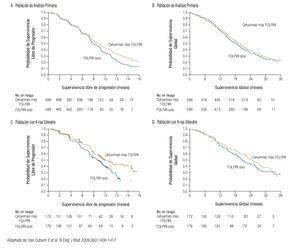
El siguiente anticuerpo monoclonal aprobado para el tratamiento de pacientes con CCRm fue el cetuximab, agente dirigido al receptor del factor de crecimiento epidermoide. Los resultados con cetuximab más irinotecan administrado sin selección previa de los pacientes, fueron superiores en supervivencia libre de progresión al irinotecan.26 Sin embargo, cuando se identificó que los pacientes con K-ras mutado tenían mínimas posibilidades de responder a cetuximab, los enfermos con K-ras silvestre experimentaron una mayor supervivencia libre de progresión y supervivencia global (Figura 4).18-20
Figura 4. Supervivencia global y libre de progresión de acuerdo a K-ras.
Un aspecto importante en relación al uso de los anticuerpos monoclonales en CCRm, es el hecho de que "mucho más no es mejor". Es decir, la combinación de bevacizumab más cetuximab27 o bevacizumab más panitumumab28 no fueron más eficaces y si más tóxicas que el uso de uno de ellos únicamente.
Sobre la elección de bevacizumab o cetuximab como parte del tratamiento de primera línea en pacientes con K-ras silvestre, en general se recomienda al bevacizumab como la primera opción.
¿ PACIENTES CON METÁSTASIS HEPÁTICAS
La diseminación metastásica del CCR es principalmente a ganglios linfáticos, hígado y pulmones. Esto significa que la enfermedad metastásica a hígado tiene un pronóstico más favorable de lo que significan las metástasis hepáticas de neoplasias como mama y pulmón. Por lo tanto, con la resección de dichas metástasis existe la posibilidad de supervivencia a cinco años de 20%, con 75% de estos pacientes libres de actividad tumoral. En pacientes con metástasis hepáticas no resecables, el uso de quimioterapia puede convertirlas en lesiones extirpables. Cuando se emplea quimioterapia preoperatoria en pacientes candidatos a recibir toda la gama de medicamentos con que se cuenta en la actualidad, probablemente una mejor opción sea la de utilizar cetuximab en lugar de bevacizumab, ya que un procedimiento quirúrgico después de haber utilizado bevacizumab, debe esperar de seis a ocho semanas.
La resección de metástasis pulmonares también se traduce en un beneficio terapéutico, ya que más de 25% de los pacientes pueden estar vivos a los cinco años. Obviamente existen factores que determinan el pronóstico de estos pacientes, tales como la presencia de metástasis únicas o múltiples, si la resección es parcial o completa y hay elevación del ACE.
¿ DURACIÓN DEL TRATAMIENTO SISTÉMICO
El beneficio clínico prolongado que experimentan muchos pacientes con CCRm gracias a los nuevos agentes antineoplásicos, ha planteado una situación de gran trascendencia clínica y económica, dado el alto costo de las drogas. Esta situación es la de cuánto tiempo se debe mantener el tratamiento en enfermos que mantienen estabilidad de la enfermedad, inclusive sin respuesta en la reducción del tumor. Este dilema antes del uso de drogas como el oxaliplatino y bevacizumab no era común. Se ha reportado que indicadores de beneficio clínico como la supervivencia libre de progresión y la supervivencia global pueden ser independientes a la respuesta tumoral.29,30 De tal manera, que en pacientes que han experimentado beneficio clínico aun sin respuesta parcial del tumor, ¿cuánto tiempo debe mantenerse el tratamiento?; ya existe la experiencia de que si la tolerancia al tratamiento ha sido buena, se puede mantener un esquema terapéutico o suspenderlo temporalmente,31,32 los resultados no son concluyentes, pero probablemente existe un efecto adverso en aquellos que suspenden el tratamiento. El mantener un tratamiento con una droga como bevacizumab prolonga la supervivencia, inclusive aún en presencia de progresión de la enfermedad.33
¿ AGRADECIMIENTOS
Agradezco la colaboración de los médicos a continuación mencionados porque contribuyeron activamente en la realización del foro de médicos mexicanos.
Dr. Saúl Rodríguez Ramírez, Dr. Ricardo Villalobos Valencia, Dr. Marcelino Ramírez Márquez, Dr. Juan Manuel Castro Cervantes, Dr. Douglas Ramón Canúl Rodríguez, Dr. Ricardo Javier Almaguer Alonso, Dr. Carlos García Gutiérrez, Dr. Antonio Araiza Llaguno, Dra. María Isabel Enríquez Aceves, Dr. Arturo Guel Pañola, Dr. Jesús López Hernández, Dr. Joaquin Juárez Durán, Dr. Alejandro Juárez Ramiro, Dr. Carlos Ronquillo, Dr. Sergio Gainza Lagunes, Dr. Juan Pablo Flores Gutiérrez, Dra. Leticia Bornstein M.D., MSci., Dr. Fernando Silva, Dr. Eduardo Urquieta Hernández, Dr. Germán Millán, Dra. Leticia Vázquez.
También agradezco al laboratorio farmacéutico Roche, por su convocatoria al foro y a la editorial médica Wolters Kluwer Pharma Solutions por su asistencia y apoyo bibliográfico en línea.
Correspondencia: Dr. Juan W. Zinser-Sierra.
Avenida San Fernando N° 22, colonia Sección XVI Delegación Tlalpan C.P. 14080. Teléfono:
(55) 5652 3011 extensión 3302. Teléfono celular 55 5400 4945.
Correo electrónico:juanwzinser@infosel.net.mx