¿ INTRODUCCIÓN
El cáncer de próstata es una de las neoplasias más comunes en el hombre y de las principales causas de muerte en los EUA con una estimación de 219 000 nuevos casos y con 27 000 muertes cada año. La incidencia se incrementa con la edad: más del 65% de los casos son diagnosticado en hombres con edad de 65 o más años.1 En México, con base en el Reporte Histopatológico de Neoplasias Malignas (RHNM) de 2005, ocupa el primer lugar de incidencia en hombres mayores de 65 años con 4026 casos.2
La IMRT que es un avance de la Radioterapia Conformada (3DRTC), utiliza haces de intensidad no uniforme, para lo cual la optimización del cálculo que realizan los programas especiales es indispensable para lograr una distribución de dosis muy superior.3,4
En la IMRT, se busca lograr distribuciones de dosis homogéneas y/o heterogéneas con gradientes acelerados, empleando haces de radiación de intensidad no uniforme, en los que se modula o controla la intensidad del haz de radiación para lograr altas dosis en el tumor y al mismo tiempo minimizar la dosis en los tejidos sanos adyacentes.3,4
En nuestro país, la primera institución en utilizar procedimientos de IMRT, fue la Unidad de Radioterapia del Servicio de Oncología del Hospital General de México (septiembre 11, 2006) con el primer caso tratado con esta técnica; el diagnóstico fue un cáncer de próstata ECII, con factores de riesgo intermedio.
En la unidad de radioterapia del Hospital General de México (HGM), a la fecha se han tratado 160 pacientes con distintos diagnósticos oncológicos, en este artículo se presenta la experiencia obtenida en el manejo de los pacientes con tumores en el área de cabeza y cuello y de la próstata, haciendo énfasis en los detalles y consideraciones técnicas del procedimiento y su correlación clínica.
¿MÉTODOS
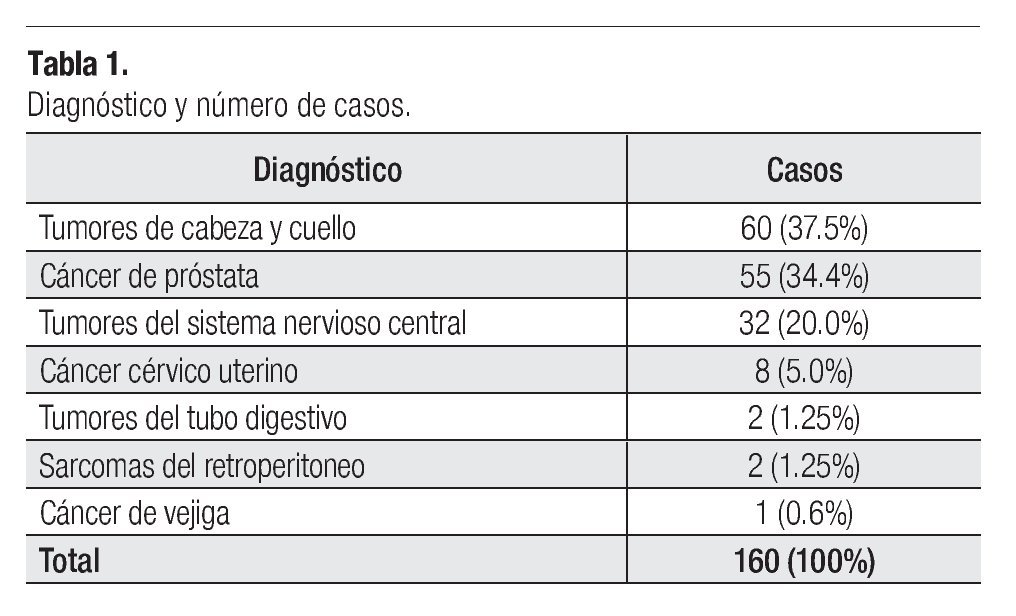
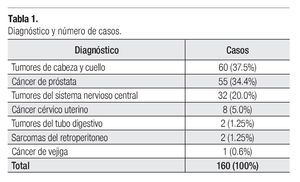
De septiembre de 2006 a septiembre de 2009, un total de 160 pacientes fueron tratados mediante la técnica de IMRT por diversas patologías oncológicas en nuestra Institución que se resumen en la Tabla 1.
Todos los pacientes fueron tratados con IMRT con un Acelerador Lineal Varian 21 EX, las dosis variaron de acuerdo a la entidad tratada y se especificarán en los párrafos subsecuentes. Los equipos para el procedimiento de la IMRT constan de:
1) Tomógrafo GE multicorte. 2) Sistemas de fijación de acuerdo al subsitio de tratamiento. 3) Sistema de planeación Eclipse, v.7.25, con sistema Somavisión, v.7.25. 4) Acelerador Lineal dual marca Varian 21 EX.
Para la planeación del tratamiento de la IMRT se realizaron fusiones de imágenes de IRM y/o PET-CT con imágenes tomográficas simples y/o contrastadas del caso o sitio a tratar.
Las variables estudias fueron:
a) Sexo.
b) Edad.
c) Karnosfky.
d) Etapa clínica.
e) Informe histopatológico, de acuerdo al sitio del primario.
f ) Dosis al Volumen Grueso Tumoral (GTV).
g) Dosis al Volumen Tumoral Clínico (CTV).
h) Dosis al Volumen Tumoral Planeado (PTV).
i) Dosis a los distintos órganos de riesgos (OAR).
j) Tiempo total de tratamiento.
k) Respuesta Clínica.
l) Respuesta Radiológica post-Radioterapia.
m) Toxicidad aguda.
Esta revisión consiste en un estudio de tipo observacional, retrospectivo longitudinal, descriptivo para determinar la asociación entre dos variables se realizó la prueba de Ji cuadrada para independencia. Para el análisis de control local, falla local, locoregional, metástasis a distancia y muerte fueron estimados por el método de Kaplan-Meier. La planeación del tratamiento y administración de la IMRT cumple con los siguientes puntos:
1. Posicionamiento del paciente y su inmovilización.
2. Adquisición de imágenes mediante Tomografía Computada (TC), en fases simple, contrastada y FOV, en algunos casos complementada con imágenes de Resonancia Magnética (IMR) y/o PET-CT.
3. Definición anatómica de contorno, volúmenes blancos (GTV, CTV, PTV) y órganos de riesgo (OAR).
4. Prescripción de las dosis de tratamiento para los volúmenes blanco y de tolerancia para los órganos de riesgo.
5. Diseño de los campos de irradiación (orientación de los haces).
6. Cálculo y representación de la dosis.
7. Análisis y evaluación de los histogramas dosisvolumen en las estructuras específicas (GTV, CTV, PTV y OAR).
8. Evaluación del plan de tratamiento (control de la calidad pre tratamiento), aprobación y documentación de la misma.
9. Implementación del plan de tratamiento y su verificación.
En cuanto a la prescripción, la distribución de la dosis debe de cumplir con los puntos siguientes:
1. El 100% de la dosis prescrita debe de cubrir 100% del GTV.
2. El 100% de la dosis prescrita debe de cubrir 95% del PTV.
3. No más de 1% del PTV puede recibir una dosis como mínima de 93% de la dosis prescrita.
4. No más de 20% del PTV puede recibir una dosis mayor de 110% de la dosis prescrita.3-5
Respecto a la optimización del cálculo de la dosis, pruebas de aceptación, comisionamiento y de control de calidad existen artículos de varias instituciones que avalan cada uno de estos parámetros3-8 y en nuestra institución también se lleva al cabo cada uno de estos distintos programas y pruebas de control de calidad, mismos que ya fueron detallados en una publicación previa.5
Todos los pacientes fueron evaluados semanalmente durante el tratamiento de IMRT y al término del mismo, al mes y posteriormente cada dos meses el primer año. Cada dos a tres meses el segundo año y cada cuatro meses a partir del tercer año. Durante el seguimiento se realizó exploración clínica, estudios de imágenes dependiendo del sitio (TC, IRM) y pruebas de laboratorio incluyendo marcadores tumorales (PSA). En caso de surgir alguna duda que no se aclarara con los estudios ya señalados, se solicitó el PEC-CT corporal. La morbilidad aguda y crónica fue evaluada de acuerdos a los criterios de toxicidad de la RTOG.9
¿ RESULTADOS
Se trató a un total de 160 pacientes con distintas neoplasias de diversos sitios del cuerpo en la Unidad de Radioterapia del Servicio de Oncología del Hospital General de México. Todos los pacientes fueron evaluados, analizados y aceptados por el Comité Interno de IMRT de la Unidad de Radioterapia
Del los 160 pacientes, 55 (34.4%) corresponden a diagnóstico de cáncer de próstata, siendo la mediana de edad 66 años, la moda de 65 y el rango de 51 a 86 años. Se empleo la estadificación clínica de la AJCC, 6a Edición, 2000,10 correspondiendo el T2a en ocho pacientes (14.5%), T2b en 22(40%), T2c en 23(41.8%) y T3a en dos (3.6%).
Doce pacientes presentaron antígeno prostático específico (APE) inicial menor de 10 ng/mL, 15 con valores entre 10 y 20 ng/mL y 28 con valores mayores a 20 ng/mL, con un rango de cuatro a 250 ng/mL. Todos los pacientes tuvieron confirmación histopatológica a través de biopsias transrectales o por resección transuretral (RTU).
Las sumas de los puntajes de Gleason fueron los siguientes: Gleason menor de seis en 24 pacientes; Gleason de siete en 19 y con Gleason de ocho a 10 en 12 pacientes.
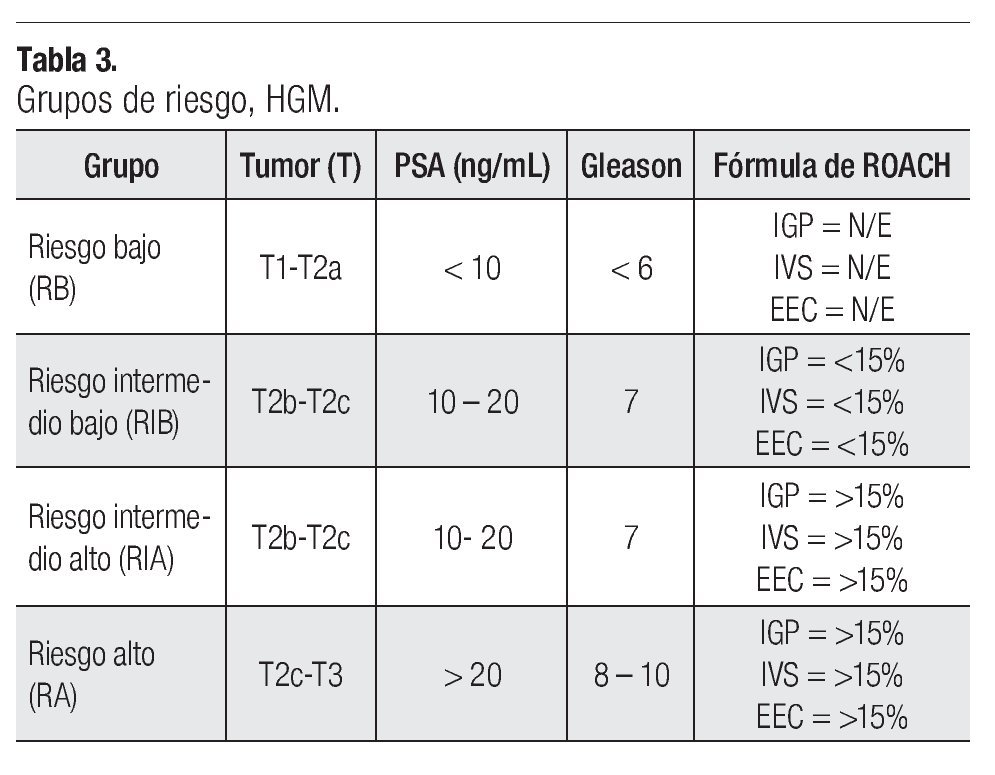
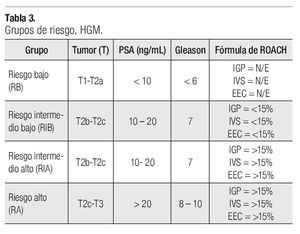
En la estadificación por grupos de riesgo empleamos la de D´Amico11 con modificación al integrar las fórmulas de Roach en el análisis de la probabilidad de Invasión Ganglionar Pélvica (IGP), Invasión de Vesículas Seminales (IVS) y Extensión Extracapsular (EEC) (Tabla 2), dando cuatro grupos de riesgos (GR): Riesgo Bajo (RB), Riesgo Intermedio Bajo (RIB), Riesgo Intermedio Alto (RIA) y Riesgo Alto (RA) (Tabla 3). Nuestros pacientes quedaron agrupados de la siguiente manera: RB en cuatro pacientes, RIB en 13, RIA en ocho y RA en 30 pacientes.
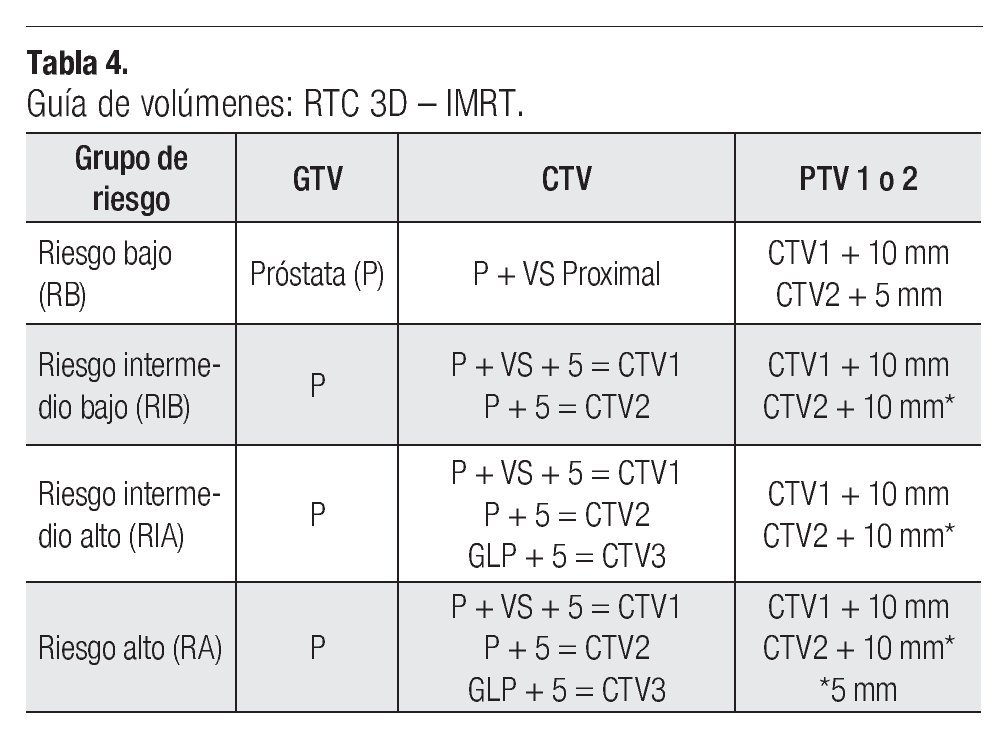
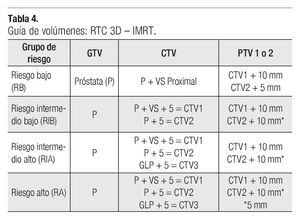
Todos los pacientes fueron tratados con la técnica de IMRT dinámica en posición decúbito dorsal o decúbito ventral (prono), con inmovilizadores para la pelvis. Se delinearon los contornos de la próstata, vesículas seminales y órganos de riesgos (recto, vejiga y cuellos de fémur), para obtener los distintos volúmenes clínicos se siguieron los parámetros definidos en el ICRU 50, ICRU 62, RTOG 0521, RTOG 0126 y RTOG 9406;12-16 delineándose los distintos volúmenes para el GTV (próstata), CTV (próstata más vesículas seminales), dándose los márgenes de 5 mm para obtener los distintos CTV1, CTV2 y contorneando el CTV3 con su respectivo margen (ganglios pélvicos). Se expanden los contornos CTV1, CTV2 uniformemente 10 mm en todos los sentidos excepto en el sentido posterior hacia el recto que sólo se dieron 5 mm, obteniendo así los volúmenes de planeación PTV1, PTV2.
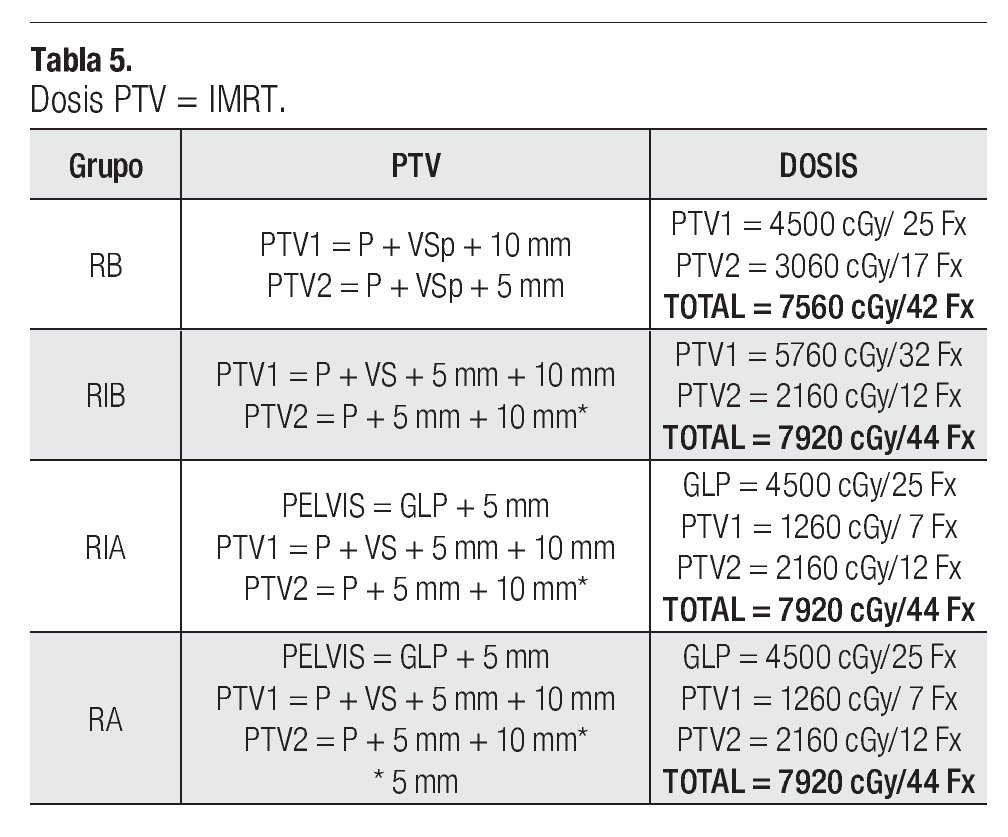
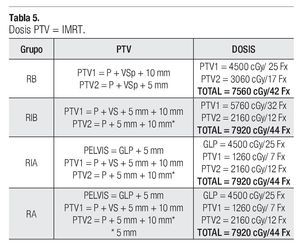
En la Tabla 4, se correlacionan los distintos grupos de riesgo (RB, RIB, RIA, RA) y sus volúmenes respectivos de GTV, CTV y PTV. La irradiación fue administrada por cuatro campos ortogonales antero posteriores y laterales conformados a la pelvis en la primera fase en los grupos de RIA y RA con energía de RX de 18 MV, seguido después de una segunda y tercera fase a CTV1, CTV2, PTV1 y PTV2 respectivamente con energía de 6 MV mediante una técnica de siete campos con IMRT. La dosis total administrada y dependiendo de los distintos grupos de riesgo se prescribieron al PTV1 y PTV2, recibiendo los pacientes con RB dosis de 75.60 Gy/42 fracciones a la próstata como órgano confinado, los pacientes con RIB dosis de 79.20 Gy/44 fracciones también a como órgano confinado y a los paciente con RIA y RA una dosis total de 79.20 Gy/44 fracciones con tres fases de tratamiento, como se puede observar en la Tabla 5.
Durante el tratamiento se verificó la alineación de los campos de irradiación mediante las imágenes portales (DRR) de los haces de tratamiento, tres veces a la semana, los días lunes, miércoles y viernes. El bloqueo androgénico total (BAT) o bloqueo hormonal total (BHT) se inicio dos meses antes de iniciar tratamiento de radioterapia, durante ella y la duración de la misma fue en RIB seis meses, RIA de 12 a 18 meses y RA de 24 meses, no administrándose a los pacientes con RB.17,18 Las combinaciones que se realizaron fueron de bicalutamida o flutamida asociada a goserelina o buserelina o leuprorelina.17,18
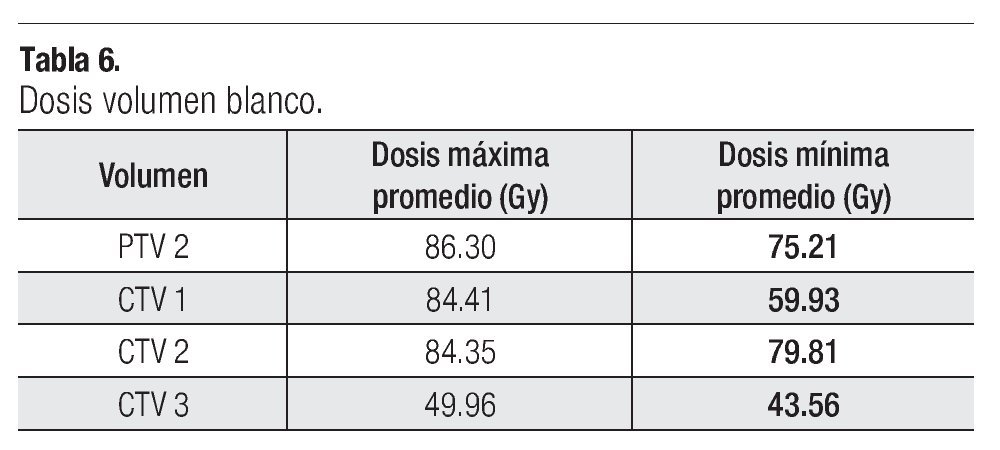
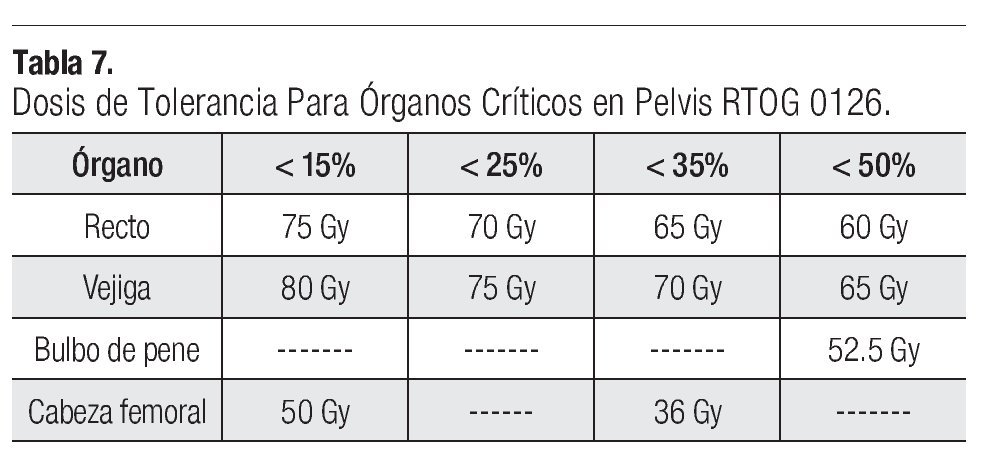
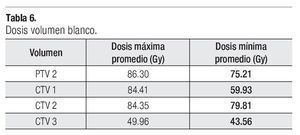
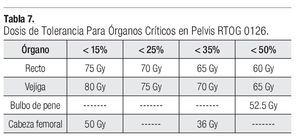
La dosis a los distintos órganos blancos como serían el PTV2, CTV1, CTV2, CTV3, en el promedio de su dosis máxima y minina se describe en la Tabla 6. Respecto a la tolerancia para los distintos órganos críticos en la pelvis se siguieron las recomendaciones del protocolo RTOG 012615 y de la guía de IMRT para próstata de nuestra unidad, no sobrepasándose las dosis recomendadas para cada uno de los órganos críticos (Tabla 7).
La dosis administrada al CTV1 (próstata más vesículas seminales), fue con una mínima promedio de 59.93 Gy y una máxima de 84.81 Gy, en el CTV2 (Próstata) la mínima promedio fue de 79.81 Gy y la máxima promedio de 84.35 Gy, en el CTV3 (ganglios pélvicos) las dosis fueron de 43.56 Gy para la mínima y 49.96 Gy en la máxima, y en el PTV2 (próstata con márgenes) la dosis fueron de 75.21 Gy y 86.30 Gy para la mínima y máxima promedio respectivamente.
Respecto a la dosis de tolerancia para los órganos críticos en la pelvis (recto, vejiga, cabeza femoral y bulbo del pene) se siguieron las recomendaciones de la RTOG 0126, no sobrepasándose las dosis en relación al porcentaje del volumen del órgano involucrado.
En cuanto a la toxicidad gastrointestinal (GI) y genitourinaria (GU) fueron evaluadas de acuerdo a las recomendaciones de la guía de RTOG 9406 (16), observándose toxicidad GI grado 0 en 38/55 (69.15), grado I en 12/55 (21.8%), grado II en 5/55 (9.1%), no presentándose toxicidad grado III o grado IV. Respecto a la GU, 33/55(60%) fueron grado 0, 14/55(25.5%) grado I, 7/55(12-7%) grado II y un solo caso (1.8%) fue grado III.
Existe control clínico (CC), control bioquímico (CBQ) y de imágenes por GGO, TAC Abdómino-pélvico en 53 de 55 pacientes (96.36%). Siendo este CC, CBQ en 4/4 de los RB, 13/13 de RIB, 8/8 de RIA y en 28/30 en los de RA.
En dos pacientes de RA se documentó recaída bioquímica siendo positivo en los estudios de extensión de GGO y PET-CT corporal los estudios en que se corroboraron la actividad, uno en el cuerpo del esternón y el segundo en la columna torácica. El seguimiento de este grupo de tiene un promedio de 20 meses con un rango de seis a 30 meses.
¿ DISCUSIÓN
Nuestro estudio confirma las observaciones de otras instituciones respecto a las patologías que pueden ser abordadas por medio de la IMRT.7,19,20 Los tumores del área de cabeza y cuello, son el grupo más frecuentemente tratados con ésta modalidad y que en nuestra serie correspondieron a 60 pacientes (37.5%), seguido por el cáncer de próstata con 55 casos (34.4%), en tercer lugar por las lesiones del SNC, 32 pacientes (20.0%) y en menor proporción por otras patologías.
Con relación a otros grupos de estudios en Estados Unidos y Europa, la frecuencia en orden decreciente es de los tumores del área de cabeza y cuello, cáncer de próstata, cáncer de mama, tumores ginecológicos y tumores del sistema nervioso central.7,19,20
Durante los pasados 10 a 15 años, la comprensión e integración de factores pronósticos individuales tales como el Antígeno Prostático Específico (PSA o APE) pretratamiento, la biopsia de la próstata y su correlación con el score o escala de Gleason y la estadificación de la American Joint Commission on Cancer (AJCC), en esquemas o sistemas de Grupos de Riesgos (GR), han permitido agruparlos en tres grupos (bajo, intermedio y alto), existiendo varias clasificaciones (D´Amico, Mt. Sinaí, Memorial Sloan - Kettering).21-23 Con estos sistemas de agrupamiento ha permitido realizar recomendaciones para el tratamiento dependiendo del grupo de riesgo. Otros factores pronósticos que han ido tomando relevancia es la probabilidad de afectación ganglionar pélvica (IGP), invasión de vesículas seminales (IVS) y la extensión extracapsular (EEC), que a través de las formulas de Roach nos da un valor predictivo de riesgo de afectación a estas estructuras siendo mayor o menor de 15%.24-26
En nuestra serie integramos estas probabilidades de afectación (IGP, IVS, EEC) a los grupos de riesgo (GR) ya establecidos y definimos cuatro grupos: Riesgo Bajo (RB), Riesgo Intermedio Bajo (RIB), Riesgo Intermedio Alto (RIA) y Riesgo Alto (RA). De un total de 55 pacientes, 4/55 (7.3%) son RB, 13/55 (23.7%) son RIB, 8/55 (14.5%) son RIA y 30/55 (54.5%) son RA.
La radioterapia externa (RTE) representa una opción de tratamiento curativo para los pacientes con diagnóstico de cáncer de próstata. (27,28, 29). En los informes número 50 y 62 de la International Commission of Radiation Units and Measurements (ICRU), han realizado unas series de recomendaciones para definir el volumen blanco tumoral (GTV, CTV, PTV) y los volúmenes de los distintos órganos de riesgo (OAR) para ser abarcados con la RTE.12,13 Estas definiciones son aceptadas como el estándar mínimo en la comunidad de radioterapeutas para las definiciones de los distintos volúmenes de tratamiento en los pacientes con cáncer.
Más recientemente el Grupo Genitourinario de la EORTC27 ha establecido una guía para los distintos volúmenes de tratamiento con RTE en los pacientes con diagnóstico de cáncer de próstata. Los volúmenes objetivos (GTV, CTV, PTV) se definen en la TC de planificación de tratamiento y que han sido también analizados en sus distintos crecimientos por otros autores.30-32 El GTV para el adenocarcinoma de próstata es definido en si como la propia próstata, sólo en caso de corroborarse un T3b el GTV seria la próstata más las vesículas seminales enteras (VS). El CTV es determinado de acuerdo al GR (RB, RIB, RIA, RA) de cada paciente, pero en línea general debe de incluir como mínimo la próstata (GTV) y la parte proximal de las vesículas seminales, entendiéndose como parte proximal de estas el primer centímetro, tanto en el plano radial como superior.
Varias instituciones, entre ellas Fox Chase Cancer Center,33,34Memorial Sloan-Kettering Cancer Center,22,35M.D. Anderson Cancer Center,36 han definido el CTV con base a los distintos GR, si es RB será la próstata incluyendo o no la parte proximal de las vesículas proximales, en caso de RI debe de ser incluida la próstata más las vesículas seminales y en caso de RA el CTV debe de incluir la próstata más VS y el tejido periprostático. Un margen de 5 mm alrededor de estas estructuras es realizado para así obtener los respectivos CTV 1 o CTV2 (próstata).22,33-36 Los contornos del CTV1 o CTV2 se expanden con un margen que varía entre cinco a 10 mm en todos los sentidos excepto en el posterior (recto) que es sólo de 5 mm.
La dosis total administrada y dependiendo de los distintos grupos de riesgos (GR) se prescribieron al PTV1 y PTV2, recibiendo el RB una dosis de 7560 cGy/42 fracciones a la próstata como órgano confinado, el RIB dosis de 7920 cGy/44 fracciones igualmente a la próstata, y a los pacientes con RIA y RA una dosis de 7920 cGy/44 fracciones como dosis total a la próstata. La prescripción de la dosis en nuestros planes de tratamiento en IMRT se estableció que 95% del PTV debe de recibir 100% de la dosis administrada. Respecto a este punto, Yaparpalvi R y colaboradores en 2008 realizaron un análisis sobre la metodología de la prescripción de la dosis de acuerdo a varias instituciones basados en diferentes protocolos y hay diferencias entre las guías de la RTOG, el punto de referencias del ICRU y de la dosis promedio en el PTV.37
De los datos recolectados de pacientes tratados con RTE con técnicas convencionales y con dosis hasta 70 Gy, documentan que la sobrevida libre de recaída bioquímica (SVLRBC) de siete a 10 años es de 65% en tumores T1 y T238 y de 25% en T3.39 Con porcentajes de recurrencias locales entre 23% a 65% en pacientes con tumores T1-T3.40,41 Múltiples estudios, aleatorizados y no, han mostrado mejoría en el control local con el empleo de alta dosis administrada a la próstata.22, 33,42, 43
Se ha establecido que dosis mayores de 74 Gy resultan en un mejor control bioquímico y control local que las dosis convencionales menores de 70 Gy. Más recientemente, otros reportes sugieren que dosis mayores de 80 Gy pueden ser necesarias para el control tumoral óptimo.44-46
En el 2000 Zelefsky y colaboradores,47 publicaron un estudio en que compara a 61 pacientes que recibieron una dosis de 81 Gy con RT-3D con 171 pacientes que reciben la misma dosis pero con IMRT. Los planes de la IMRT resultó tener una mejor cobertura en el CTV de la prescripción de la dosis al compararse con los de RT-3D (p < 0.01). Además la IMRT reduce el volumen de la pared rectal y vesical que recibe dosis de 75 Gy (p < 0.01). Clínicamente lo anterior se traduce en una reducción de la toxicidad aguda GU y GI al administrar la IMRT (p = 0.05). Lo más importante es que el porcentaje de toxicidad tardía de sangrado rectal grado 2 o 3 fue reducido de 10% con la RT-3D a 2% con la IMRT.
En 2002, Zeleksky y colaboradores,46,48 realizaron otra publicación con la administración de 81 Gy con IMRT y a los tres años de seguimiento la presencia de complicaciones tardía GI y GU grado dos o mayor eran de 4% y 15% respectivamente además que ofrecía el mismo control bioquímico que las series de no IMRT. Esta serie fue recientemente actualizada49 con una media de seguimiento de siete años y reportan toxicidad GI y GU grado dos o mayor de 2% y 15% respectivamente, observándose también un excelente control bioquímico.
De Meerler y colaboradores,50 informaron también su toxicidad y el control bioquímico de 113 pacientes tratados con IMRT con dosis de 74 a 76 Gy. Con una mediana de seguimiento de 36 meses, la morbilidad asociada al tratamiento es baja con porcentajes de 17% y de 19% para complicaciones tardías grado dos o mayor a nivel GI y GU respectivamente. El control bioquímico para los pacientes de RB, RI, RA fue de 100%, 94% y 74%, respectivamente.
Una reciente publicación de la Clínica Mayo51 que comparan el control bioquímico y de toxicidad en 272 pacientes tratados con RT-3D (68.4 Gy) y de 145 pacientes con IMRT (75.6 Gy). El escalonamiento de la dosis representa un incremento de 14% en la mejoría del control bioquímico (p <0.0001). El esquema con IMRT fue bien tolerado y no hay diferencia significativa entre los dos grupos a pesar del incremento de 7 Gy en la dosis en el brazo de IMRT.
En un estudio de la Universidad de Chicago52 comparó los resultados de toxicidad entre 106 pacientes con IMRT a dosis de 76 Gy y 355 pacientes tratados con RT-3D a 70 Gy. La IMRT genera una mejor conformación de la dosis y reduce el V30-V70 tanto de la vejiga como del recto y que clínicamente resulta en una disminución de las toxicidades. La incidencia de la toxicidad rectal tardía grado uno fue reducida del 25% a 8% y la de grado dos o mayor, de 11% a 6% (p < 0.001).
Kupelian y colaboradores,53 recientemente también informaron sus resultados de IMRT con esquema hipofraccionado (70 Gy con 2.5 Gy por fracción), entrando en este estudio 770 pacientes. Con una mediana de seguimiento de 45 meses, la toxicidad tardía grado dos o mayor GI fue menor del 5% y la toxicidad GU grado dos o mayor fue menor de 6%. El control bioquímico a cinco años de acuerdo a los GR fue de 95%, 85% y 68% para el RB, RI y RA, respectivamente.
La toxicidad aguda también ha sido analizada en las series de IMRT. En el MSKCC encuentran toxicidad GU grado dos y tres en 22% y 1%, respectivamente, en 81 pacientes tratados con IMRT, siendo la toxicidad GI aguda grado dos de 4%, no evidenciándose de grado tres. Estos resultados de toxicidad aguda son también semejantes a los reportados por otros autores.54,55
Recientemente, el MSKCC ha publicado sus resultados del protocolo de escalamiento de dosis con IMRT hasta 86.4 Gy.56 Se analizaron 478 pacientes encontrándose toxicidad aguda GU grado tres en menos de 1% y no toxicidad aguda GI grado tres o cuatro. Respecto a la toxicidad tardía GU grado tres fue de 3% y ninguno con grado cuatro. La toxicidad tardía GI grado dos fue de 3%, grado tres menor de 1% y ninguno grado cuatro. El control bioquímico a cinco años, y dependiendo del RB, RI, RA, fue de 98%, 79% y 72%, respectivamente.
En nuestra serie, las dosis promedio administrada en el CTV1 (próstata más vesículas seminales) fue con una mínima de 59.93 Gy y una máxima de 84.81 Gy, en el CTV2 (próstata) la mínima fue de 79.81 Gy y la máxima de 84.35 Gy, en el CTV3 (ganglios pélvicos) la dosis fueron de 43.56 Gy en la mínima y de 49.96 Gy en la máxima y en el PTV2 (próstata más margen) las dosis fueron de 75.21 Gy y 86.30 Gy para la mínima y máxima respectivamente, siendo estas dosis muy cercanas a lo administrado por otros centros internacionales.
Respecto a la toxicidad GI y GU fueron evaluadas de acuerdo con las recomendaciones de la guía de la RTOG 9406, correspondiendo la toxicidad GI grado 0 o no toxicidad en 69.1%, grado I en 21.8%, grado II en 9.1%, no presentándose toxicidad grado III o IV. La toxicidad GU fue G III en 1.8%, grado II en 12.7%, grado I en 25.5% y no toxicidad o grado 0 en 60%. Estos resultados de nuestra serie son muy cercanos a los que se reportan en otras instituciones con la administración de IMRT.
El control bioquímico de nuestro grupo con un promedio de 26 meses de seguimiento y rango de seis a 38 meses es de 96.36% del todo el grupo, siendo de 100% en los RB, RIB, RIA y de 93.3% en el RA.
¿ CONCLUSIONES
La radioterapia externa a altas dosis sin complicaciones sólo es posible con técnica conformal tridimensional o con técnica de intensidad modulada. Las ventajas de la IMRT: el volumen tratamiento a altas dosis se adapta exactamente al volumen de planeación en Las tres dimensiones, existe por lo tanto una mejor protección de los tejidos sanos vecinos, pudiéndose aumentar las dosis administradas al tumor prostático sin incrementar las complicaciones, lo que permite aumentar el porcentaje de curaciones. Al compararse los distintos planes de IMRT con la radioterapia convencional a la pelvis, han demostrado que el volumen del intestino delgado, recto, vejiga que recibe dosis altas pueden ser reducidos entre 20% a 50%.
Con la IMRT y escalada de dosis el control bioquímico aumenta en todos los grupos de riesgo, pero especialmente en los de riesgo alto. La adecuada inmovilización del paciente, la identificación exacta de la etapa clínica de la enfermedad, el conocimiento para la selección y delineación de la potencial enfermedad subclínica que requiere radiación adyuvante para definir los distintos volúmenes de tratamientos GTV, CTV, PTV son fundamentales. También es sumamente importante la definición y delineación de los distintos órganos de riesgos (OAR), los cuales son cruciales para evaluar los distintos histogramas dosis volumen y su potencial impacto en la toxicidad aguda y tardía.
Los datos de nuestra serie de pacientes tratados con IMRT nos permite tener un conocimiento de este procedimiento como seguro, reproducible y tener las distintas herramientas para un excelente control de calidad, para poder así lograr los resultados tanto en el control local, bioquímico así como en la toxicidades como son informadas en la literatura médica.
Correspondencia: Dr. Pomponio José Luján Castilla.
Dr. ATL N°6 Manzana 3, Unidad Belisario Domínguez, Tlalpan. 14310, México
D. F. Teléfono: (55)5678 5918.
Correo electrónico:pjlujanc@yahoo.com.mx.