Se sabe que, a nivel mundial, el cáncer de mama es el tipo de enfermedad neoplásica que se diagnostica con mayor frecuencia y la principal causa de mortalidad en mujeres. Diversos estudios han demostrado que la mayoría de estos tumores son positivos a los receptores de estrógeno y/o progesterona, los cuales representan un riesgo constante de recurrencia tardía. La hormonoterapia ha sido el primer tratamiento sistémico que ha comprobado su eficacia en pacientes que expresan receptores hormonales positivos. Hasta hace pocos años, el tamoxifeno y la supresión ovárica eran las mejores terapias hormonales de las que se disponía tanto en el entorno de adyuvancia como en casos avanzados. Los inhibidores de la aromatasa, así como los nuevos inhibidores de la vía de señalización de mTOR, han generado un importante avance en el tratamiento del cáncer de mama al mejorar la supervivencia y el intervalo libre de enfermedad en estas pacientes. En esta revisión se lleva a cabo un repaso de dichos tratamientos y los estudios que los han respaldado, así como de sus posibles efectos adversos.
Breast cancer is known to be the most commonly diagnosed malignancy and the main cause of death in women worldwide. Several studies have demonstrated that most these cancers are positive for estrogen and/or progesterone receptors, which represent a constant risk for late recurrence. Hormone therapy has been the first systemic treatment that has proven to be effective in patients who express positive hormone receptors. Until recent years, tamoxifen and ovarian suppression were the best hormone therapies available both for adjuvance and advanced disease. Aromatase inhibitors, as well as the new mTOR pathway inhibitors, have driven an important advance in the treatment of breast cancer by improving survival and disease-free interval for these patients. In this article, we make a review of these treatments and the studies that have supported them, as well as their potential adverse effects.
A nivel mundial, el cáncer de mama (CM) es la neoplasia maligna más frecuentemente diagnosticada y la causa principal de mortalidad oncológica en mujeres1. En 2012, se esperaba que aproximadamente 230,000 casos serían diagnosticados en los EE. UU. y que 40,000 pacientes morirían por esta enfermedad2. De todos los casos de CM invasivo, aproximadamente 3 cuartos son positivos a los receptores de estrógenos (RE) y/o progesterona (RP)3. Información recolectada por el programa SEER entre 1980 y 2008 sugería que la incidencia de CM negativo a los RE y/o RP estaba disminuyendo, en tanto que la incidencia de casos de enfermedad con positividad a RE/RP se estaba incrementando4. El comportamiento de la enfermedad positiva a los receptores hormonales (RH+, receptores hormonales-positivos) es diferente del de aquella con receptores hormonales negativos (RH−, receptores hormonales-negativos) en cuanto a su agresividad (sobre todo en cuanto a la evolución de la enfermedad y el tiempo y sitio de recurrencia). Las pacientes con tumores RH-positivos experimentan durante su vida un riesgo constante de recurrencia tardía, así como de muerte relacionada con cáncer5,6. En las pacientes con CM RH-positivo tratadas con tamoxifeno (TAM) por 5 años, más de la mitad de todas las recurrencias ocurren entre 6 y 15 años tras el diagnóstico7. Para poder reducir la morbimortalidad del CM con RH-positivos, deberán concretarse estrategias a fin de confrontar el reto. Esta revisión se centrará en la última evidencia científica en el manejo del CM RH-positivo en el contexto adyuvante y en el de terapia endocrina de primera línea en el entorno de CM avanzado.
Terapia endocrina para cáncer de mama positivo a receptores hormonales incipiente en mujeres posmenopáusicas (tabla 1)El propósito de la terapia endocrina adyuvante consiste en prevenir que las células del CM reciban una estimulación endógena por el estrógeno. La información actual respalda la eficacia de la terapia endocrina en el contexto adyuvante para pacientes con CM RE-positivo incipiente.
Terapia endocrina para CM RH-positivo temprano
| Diseño | Autores | Ensayo clínico | Fármacos | Seguimiento (meses) | SLE: HR (valor de p) | SG HR (valor de p) |
|---|---|---|---|---|---|---|
| Primera línea | Forbes et al., 2008 | ATAC | Anastrozol vs. tamoxifeno | 120 | 0.91 (p=004) | 0.95 (p=04) |
| Mouridsen et al., 2008 | BIG 1-98 | Letrozol vs. tamoxifeno | 76 | 0.88 (p=0.03) | 0.87 (p=0.08) | |
| Dowsett et al., 2010 | Metanálisis (ATAC y BIG 1-98) cohorte 1 | Inhibidores de la aromatasa vs. tamoxifeno | 69.6 | 0.769 (p<0.00001) | 0.94 (p>0.1) | |
| Cambio | Coombes et al., 2007 | IES | Tamoxifeno a exemestano vs. tamoxifeno | 56 | 0.76 (p=0.0001) | 0.85 (p=0.08) |
| Boccardo et al., 2006 | ITA | Tamoxifeno a anastrozol vs. tamoxifeno | 64 | 0.57 (p=0.005) | 0.56 (p=0.1) | |
| Jonat et al., 2006 | Metanálisis (ABCSG-8/ARNO 95/ITA) | Tamoxifeno a anastrozol vs. tamoxifeno | 30 | 0.59 (p<0.0001) | 0.71 (p=0.04) | |
| Kaufmann et al., 2007 | ARNO 95 | Tamoxifeno a anastrozol vs. tamoxifeno | 30.1 | 0.66 (p=0.049) | 0.53 (p=0.045) | |
| Secuencial | Mouridsen et al., 2008 | BIG 1-98 | Tamoxifeno/letrozol vs. letrozol vs. letrozol/tamoxifeno vs. letrozol | 71 | 1.05 (p=NR) 0.96(p = NR) | 1.13 (p=NR) 0.90 (p=NR) |
| Rea et al., 2009 | TEAM | Tamoxifeno/exemestano vs. Exemestano | 61 | 0.97 (p=0.60) | 1 (p=0.999) | |
| Jakesz et al., 2008 | ABCSG 8 | Tamoxifeno/anastrozol vs. Tamoxifeno | 72 | 0.85 (p=0.67) | 0.78 (p=0.32) | |
| Dowsett et al., 2010 | Metanálisis Cohorte 2 | Tamoxifeno/AI vs. tamoxifeno | 46.8 | 0.71 (p<0.00001) | 0.78 (p=0.02) | |
| Extendido | Goss et al., 2007 | NCIC CTG MA.17 | Tamoxifeno/letrozol vs. tamoxifeno/Placebo | 64 | 0.68 (p≤0.001) | 0.98 (p=0.853) |
| Jakesz et al., 2007 | ABCSG-6a | Tamoxifeno/anastrozol vs. tamoxifeno/Placebo | 62.3 | 0.62 (p=0.031) | 0.89 (p=0.570) | |
| Mamounas et al., 2008 | NSABP B-33 | Tamoxifeno/exemestano vs. tamoxifeno/Placebo | 30 | 0.68 (p=0.07) | NR | |
| Davies et al., 2005 | ATLAS | Tamoxifeno X 10 a vs. tamoxifeno X 5 a | 74.4 | 0.90 (p=0.02) | 0.99 (p=0.8) | |
| Gray et al., 2008 | aTToM | Tamoxifeno X 10 a vs. tamoxifeno X 5 a | 50.4 | 0.94 (p=0.4) | NR | |
| Fisher et al., 2001 | NSABP B-14 | Tamoxifeno X 10 a vs. tamoxifeno X 5 a | 84 | 1.4 (p=0.03) | 1.5 (p=0.07) |
ABCSG-6a: Austrian Breast and Colorectal Cancer Study Group trial 6a; ABCSG-8: Austrian Breast and Colorrectal Cancer Study; ARNO 95: Anaztrozole-Novaldex trial; ATAC: arimidex, tamoxifeno, solo o en combinación; ATLAS: Adjuvant Tamoxifen Longer Against Shorter; aTToM: Adjuvant Tamoxifen Treatment Offer More; BIG 1-98: Breast International Group 1-98; CM: cáncer de mama; HR: hazard ratio; IES: Intergroup Exemestane Study; ITA: Italian Tamoxifen Anastrazole; NCIC CTG MA 17: National Cancer Institute Canada Clinical Trials Group MA.17 trial; NR: no reportado; NSABP-B-14: National Surgical Adjuvant Breast and Bowel Project B-14 trial; NSABP-B-33: National Surgical Adjuvant Breast and Bowel Project B-33 trial; RH: receptor hormonal; SG: supervivencia global; SLE: supervivencia libre de enfermedad; TEAM: Tamoxifen Exemestane Adjuvant Multicentre trial.
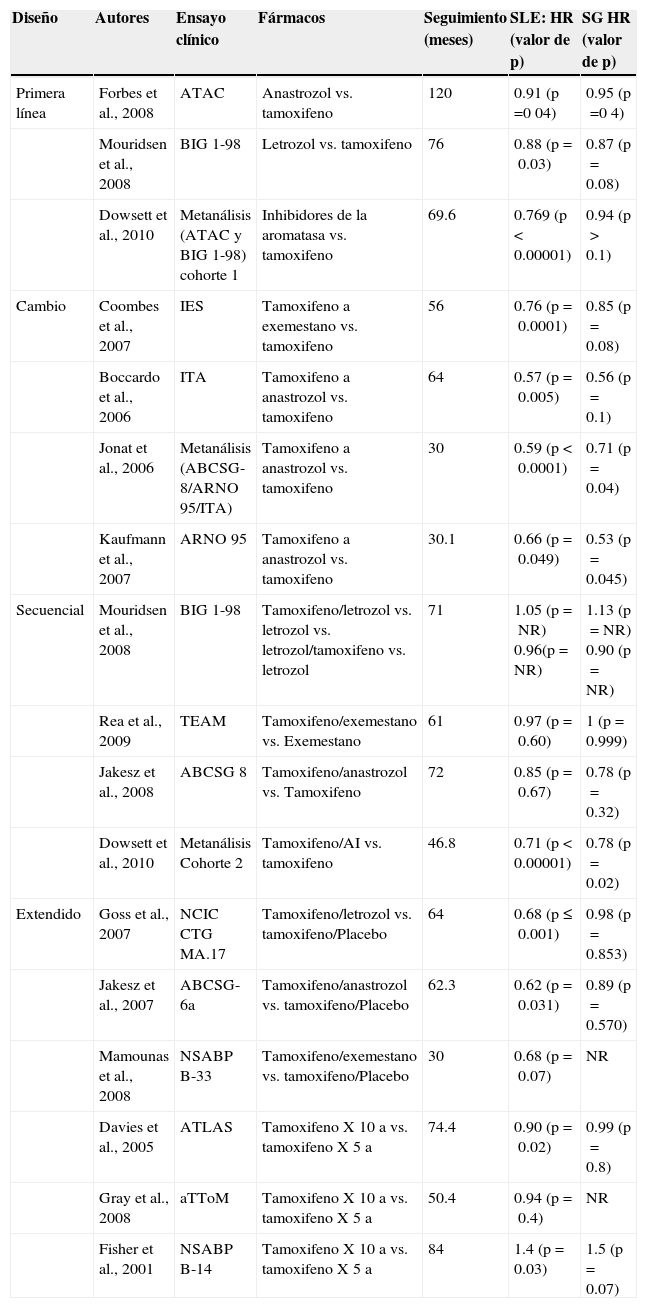
En primer lugar, una actualización reciente de la revisión sistemática y metanálisis de ensayos aleatorizados del Grupo Colaborativo de Ensayos de Cáncer de Mama Incipiente (EBCTCG – Early Breast Cancer Trialists Collaborative Group) demostró que el uso de TAM adyuvante se asoció a una reducción del 39% en el índice de recurrencia anual de la enfermedad y a un 31% de disminución en la mortalidad anual por CM en las pacientes con CM RH-positivo incipiente7. Este efecto positivo es independiente del uso de quimioterapia, de la edad de la paciente, del estado menopáusico o del estado de afectación de los ganglios linfáticos axilares. Inicialmente, estos hallazgos lo convirtieron en un tratamiento de referencia para esta población de pacientes. Este fármaco se mantiene como una opción terapéutica endocrina adyuvante para mujeres posmenopáusicas con bajo riesgo de recurrencia y su uso es respaldado por algunas guías de tratamiento internacionales8,9. Además, el uso de 5 años de TAM tiene un efecto definitivo y altamente significativo solo para las mujeres que tienen RE positivos o enfermedad con RE desconocidos con una reducción relativa de aproximadamente un 39% en la incidencia de CM contralateral (HR 0.61 [IC 95%: 0.50-0.73])4. En cuanto a la duración optima del tratamiento con TAM, si bien existía cierta controversia respecto a las ventajas de los esquemas de 2 contra 5 años de TAM, ahora se sabe bien que la duración de TAM que parece ser más efectiva en la reducción de la recurrencia y muerte, así como la mejor tolerada en el CM RH-positivo y que ha sido señalada como la duración convencional del tratamiento es 5 años10,11.
Sin embargo, con el advenimiento de los inhibidores de la aromatasa (IA) no esteroideos anastrozol y letrozol, así como del IA esteroideo exemestano, los tratamientos de referencia han ido evolucionando. Los IA han demostrado una actividad superior frente a TAM en el tratamiento endocrino adyuvante de pacientes posmenopáusicas con CM RH-positivo. Estos fármacos han sido evaluados en diferentes escenarios endocrinos: como primera línea de tratamiento, cambio a un IA tras 2-3 años con TAM o terapia secuencial tras 5 años de TAM.
Los ensayos ATAC5–7 y Breast International Group (BIG) 1-988–10 han explorado el papel de 2 diferentes IA, anastrozol y letrozol, respectivamente, como terapia inicial o de primera línea en comparación con TAM. Estos ensayos han confirmado la superioridad de los IA en el entorno adyuvante, con una mejora en la supervivencia libre de enfermedad (SLE), pero sin diferencias significativas en términos de supervivencia global (SG). Un metanálisis de datos de ATAC y BIG 1-98 demostró que, al cabo de 5 años de tratamiento, las mujeres asignadas aleatoriamente a IA en comparación con las mujeres asignadas a TAM experimentaron un 2.7% menos de recurrencia y una reducción no significativa en la mortalidad por CM12. Cabe señalar que en el análisis más reciente del ensayo ATAC se demostró que las diferencias absolutas en el tiempo hasta la recurrencia no solo fueron favorables a anastrozol frente a TAM, sino que también se incrementaron con el tiempo (diferencias absolutas en el tiempo hasta la recurrencia: 2.7% a 5 años y 4.3% a 10 años), en tanto que los índices de recurrencia permanecieron significativamente más bajos con anastrozol que con TAM después de completar el tratamiento13.
En las estrategias de cambio, después de 2-3 años de TAM, las pacientes fueron asignadas aleatoriamente a la administración de un IA o a continuar el tratamiento con TAM. El Intergroup Exemestane Study (estudio IES)14,15, el Italian Tamoxifen Anastrozole trial (ensayo ITA)16 y el análisis combinado de los estudios Anaztrozole-Novaldex trial (ARNO 95) y Austrian Breast and Colorrectal Cancer Study (ABCSG-8)17, han demostrado una ventaja en términos de SLE en las pacientes que cambiaron a IA después de TAM. Un metanálisis de 3 de dichos ensayos (ARNO-95, ABCSG-8 e ITA) confirmó que entre las pacientes que cambiaron a anastrozol, en comparación con aquellas que permanecieron con TAM, se observaron tasas inferiores de recurrencia de la enfermedad y muerte, lo cual derivó en mejoras significativas en la SLE (p<0.0001), la supervivencia libre de eventos (p<0.0001), la supervivencia libre de recurrencia distante (p=0.002) y la SG (p=0.04)18.
Dos ensayos han evaluado directamente la terapia inicial con IA frente al tratamiento secuencial: los estudios BIG 1-988 y Tamoxifen Exemestane Adjuvant Multicentre trial (TEAM)19, demostrando la equivalencia entre ambas estrategias.
Varios ensayos han examinado la eficacia del tratamiento adyuvante extendido más allá de los 5 años de duración. Estos han incluido el tratamiento extendido con TAM o un IA por más de 5 años o el tratamiento secuencial con un IA en mujeres que se encontraban libres de enfermedad al cabo de 5 años de tratamiento con TAM. Los estudios Adyuvant Tamoxifen, Longer Against Shorter trial (ATLAS)20 y el Adjuvant Tamoxifen Treatment Offer More (aTTom)21 demostraron una recurrencia inferior entre las mujeres que continuaron con TAM (aunque en el último, la diferencia no fue significativa). Sin embargo, un estudio más reciente (NSABP B-14) no encontró beneficio con el tratamiento extendido con IA después de TAM, en tanto que el estudio NCIC-CTG MA.1722,23 y el ensayo ABCSG-6a24 demostraron un decremento estadísticamente significativo en el riesgo de recurrencia en comparación con las mujeres que no recibieron más tratamiento. El ensayo National Surgical Adjuvant Breast and Bowel Project (NSABP) B-42 puede proporcionar información adicional acerca de la duración del tratamiento con IA después de la administración inicial de TAM25.
En conclusión, con respecto a la terapia adyuvante hormonal, los diversos estudios son consistentes en demostrar que el uso de un IA de tercera generación en mujeres posmenopáusicas con CM RH-positivo disminuye el riesgo de recurrencia, incluida la recurrencia ipsilateral de neoplasias de mama, CM contralateral y enfermedad metastásica distante, en comparación con TAM solo cuando el IA es utilizado como terapia adyuvante inicial, terapia secuencial o tratamiento extendido. Por lo tanto, las guías de tratamiento internacionales recomiendan que las mujeres posmenopáusicas con CM incipiente reciban un IA como terapia adyuvante inicial, secuencial con TAM, o como terapia extendida en situaciones en las que el tratamiento endocrino está indicado26–28. En las mujeres posmenopáusicas, el uso exclusivo de TAM por 5 años se limita a aquellas que declinan o que presentan alguna contraindicación para el uso de IA.
Terapia endocrina de primera línea para cáncer de mama metastásico (tabla 2)Inhibidores de la aromatasaEl uso de TAM fue establecido en el tratamiento del CM metastásico (CMM) hormono-sensible con base en la superioridad y duración de su respuesta y su perfil de toxicidad favorable cuando fue comparado en ensayos aleatorizados con estrógenos en dosis altas, andrógenos, progestinas, así como con IA y aminoglutetimida en pacientes posmenopáusicas. La probabilidad de respuesta a TAM es del 65% en los tumores RE- y RP-positivos, del 30% en aquellos RE- o RP-positivos y menos del 5% en los tumores RE- y RP-negativos29. TAM ha sido desplazado recientemente por los IA en el escenario posmenopáusico.
Tratamiento de primera línea en CM metastásico RH-positivo
| Autores | Ensayo clínico | Fármacos | Seguimiento (meses) | TPP: meses (valor p) | Tasa de respuesta. % (valor p) | Beneficio clínico | SLP meses (valor p) | SG (valor p) |
|---|---|---|---|---|---|---|---|---|
| Bonneterre J et al., 2000 | TARGET 1 (No EE. UU.) | Anastrozol vs. tamoxifeno | 19 | 8.28.3(p=0.941) | 32.932.6(p=0.787) | 56.255.5(p=NR) | NR | NR |
| Nabholts J M et al., 2000 | TARGET 2 (EE. UU.) | Anastrozol vs. tamoxifeno | 17.7 | 11.15.6(p=0.005) | 2117(p=NR) | 5946(p=0.0098) | NR | NR |
| Bonneterre J et al., 2001 | Análisis combinado(TARGET 1 y 2) | Anastrozol vs. tamoxifeno | 18.2 | 10.76.4(p=0.022) | 2927(p=NR) | 57.152(p=NR) | NR | NR |
| Milla S et al., 2003 | Ensayo español | Anastrozol vs. tamoxifeno | 13 | 187(p<0.01) | 3626(p=0.172) | 8356(p<0.001) | NR | 17.416(p=0.003) |
| Mouridsen H et al., 2007 | Ensayo PO25 | Letrozol vs. tamoxifeno | 32 | 9.46(p<0.0001) | 3221(p=0.0002) | NR | NR | 3430(p=0.53) |
| Paridaens RJ et al., 2008 | EORTC BCCG | Exemestano vs. tamoxifeno | 29 | NR | 4631(p=0.005) | NR | 9.95.8(p=0.121) | 43.337.2(p=0.821) |
| Mauri D et al., 2006 | Metanálisis | IA vs. tamoxifeno | NR | NR | NR | NR | NR | HR 0.87 (AI tercera generación) (p≤0.001) |
| Gibson L et al., 2009 | Metanálisis | IA vs. otra terapia endocrina | NR | NR | NR | HR 0.70(p=NR) | NR | HR 0.88 (AI tercera generación)(p=0.004) |
| Robertson FR et al., 2010 | FIRST(Fase II) | Fulvestrant vs. anastrozol | 16.5 | 23.413.1(p=0.01) | 23.821.1(p=NS) | 72.567(p=0.386) | NR | NR |
CM: cáncer de mama; Ensayo PO25: letrozol en CM avanzado: el PO25 trial; EORTC BCCG: European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group; FIRST: Fulvestrant First-Line Study; HR: hazard ratio; IA: inhibidores de la aromatasa; NR: no reportado; NS: estadísticamente no significativo; RH: receptor hormonal; SG: supervivencia global; SLP: supervivencia libre de progresión; TARGET 1 y 2: Tamoxifen or Arimidex Randomized Group Efficacy and Tolerability trial 1 y 2; TPP: tiempo para progresión.
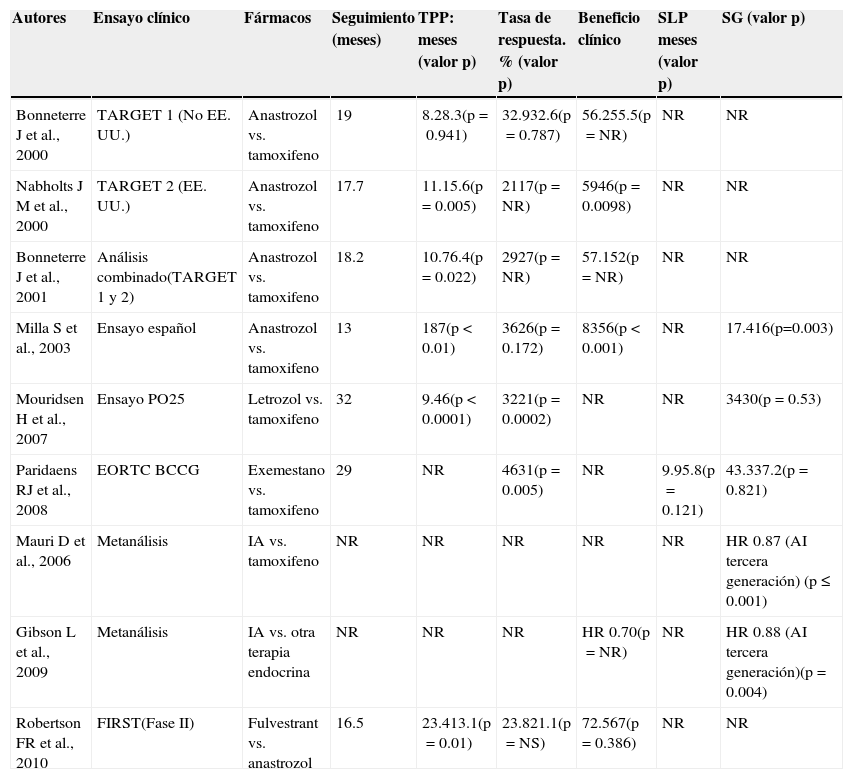
Dos ensayos fase iii con enmascaramiento doble compararon TAM frente a anastrozol en el contexto de primera línea para CMM posmenopáusico30,31. Dichos estudios incluyeron a pacientes con RE/RP-positivos o desconocidos y, en el análisis combinado, el IA resultó superior a TAM únicamente en aquellas pacientes con RH-positivos, observándose un beneficio en materia de supervivencia libre de progresión (SLP) (10.7 vs. 6.4 meses). Un tercer ensayo demostró una mejoría significativa en tiempo hasta la progresión de la enfermedad y el tiempo hasta la muerte en el grupo tratado con anastrozol en comparación con el grupo con TAM (18 vs. 7 meses y 17.4 vs. 16 meses, respectivamente).
Solo existe un ensayo fase iii, aunque sin enmascaramiento doble, en el que se comparó letrozol frente a TAM en primera línea (tiempo hasta la progresión de la enfermedad: 9.4 vs. 6 meses)32. Un análisis planeado prospectivamente de la población por intención de tratar demostró que letrozol mejoró significativamente la SG en comparación con TAM durante los primeros 24 meses del ensayo. Considerando el exemestano como tratamiento de primera línea en el entorno metastásico, un estudio fase iii demostró una SLP superior con TAM (9.9 vs. 5.8 meses); sin embargo, esto no se tradujo en un beneficio en la SLP a largo plazo33.
Dos metanálisis de ensayos con asignación aleatoria de IA con otra terapia endocrina como tratamiento de primera línea demostraron una SG significativamente superior (riesgo relativo [RR]: 0.89; intervalo de confianza [IC] del 95%: 0.80-0.99), favorable al tratamiento con un IA de tercera generación34,35.
FulvestrantFulvestrant es un antagonista de los RE que no posee efectos agonistas. El Fulvestrant First-Line Study Comparing Endocrine Treatments (FIRST) es un estudio fase ii que evaluó fulvestrant 500mg frente a anastrozol como primera línea de tratamiento para CM RH-positivo avanzado36. Fulvestrant 500mg mejoró el tiempo para progresión (TPP) en comparación con anastrozol (23.4 vs. 13.1 meses), lo cual corresponde a una reducción del 35% en el riesgo de progresión (RR: 0.66; IC del 95%: 0.46-0.92).
Terapia endocrina de segunda línea para cáncer de mama metastásicoInhibidores de la aromatasaLa ausencia completa de resistencia cruzada entre los IA esteroideos y no esteroideos es respaldada por varios estudios que demostraron beneficio clínico (respuesta objetiva o enfermedad estable por>24 semanas) con exemestano tras la administración previa de IA no esteroideos37. La secuencia opuesta también fue investigada en pacientes que recibieron exemestano como tratamiento endocrino de primera línea: cuando fueron cruzadas a letrozol (n17) o anastrozol (n=1) al momento de la progresión, el 55.6% obtuvo un beneficio clínico38.
FulvestrantComo segunda línea y líneas subsecuentes, fulvestrant (250mg mensuales, sin dosis inicial de carga) parece ser tan efectivo como anastrozol en pacientes posmenopáusicas con CM avanzado resistente a TAM, sin que se observen diferencias en el TPP o la SG39–41. Fulvestrant (500mg el día 0, 250mg los días 14, 28 y 250mg mensuales) también ha sido comparado con exemestano en pacientes cuyo CM recurrió tras una terapia previa con IA en el ensayo EFECT42. En este estudio tampoco se registraron diferencias significativas entre fulvestrant y exemestano en el TPP o la SG.
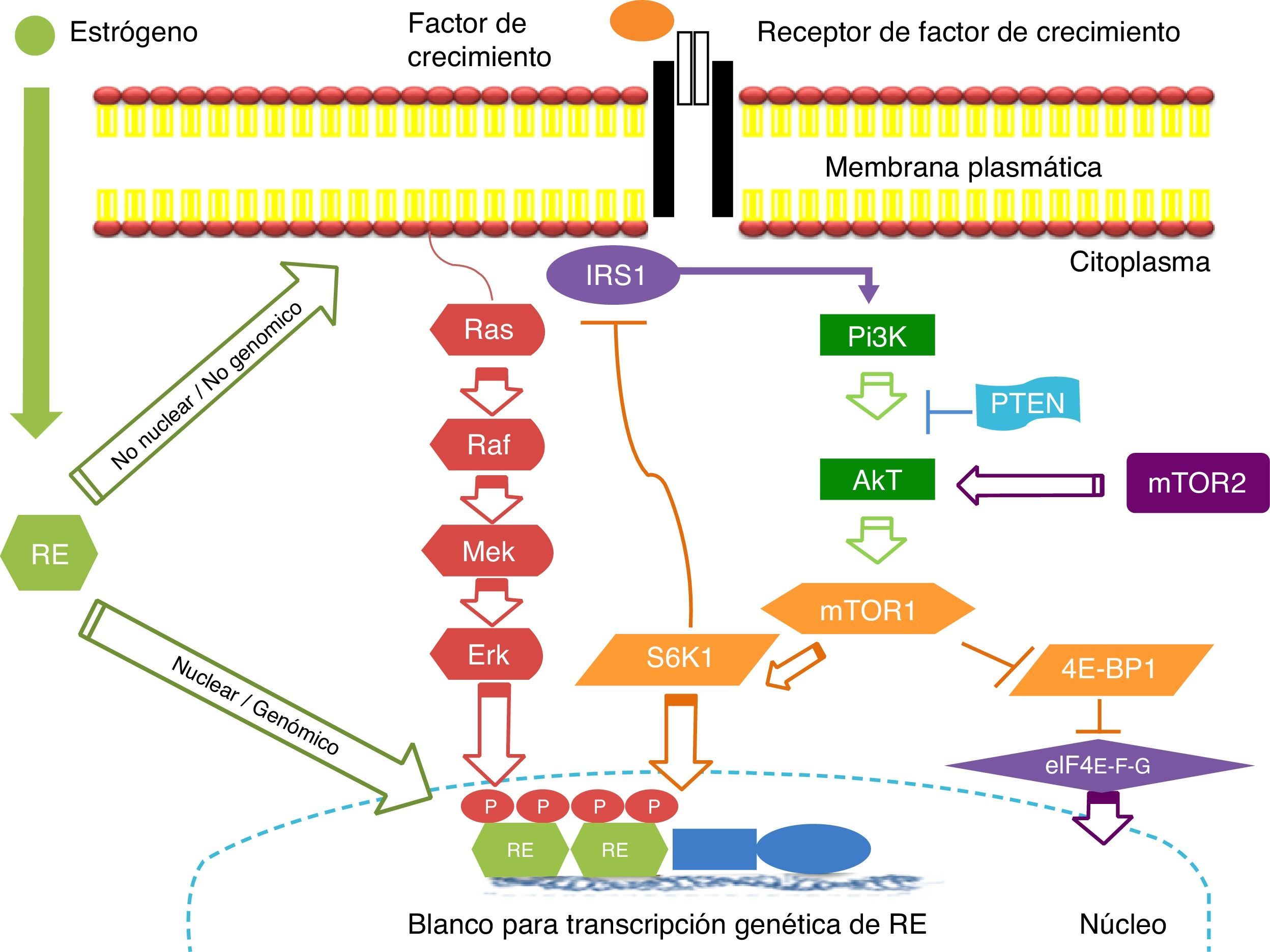
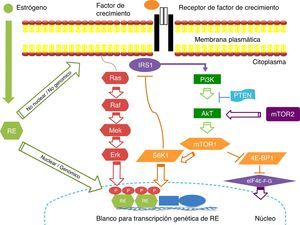
Resistencia del cáncer de mama positivo a receptores hormonales contra el tratamiento (mecanismos de resistencia propuestos)Vía de señalización: mTOR (fig. 1)El objetivo de rapamicina en los mamíferos (mTOR –mammalian target of rapamycin) es una serina/treonina proteína-cinasa que se localiza en la vía de señalización corriente abajo de fosfatidilinositol-3-cinasa (PI3K)/(Akt). La vía de señalización mTOR se encuentra involucrada principalmente en la regulación del crecimiento y la proliferación celular mediante el control de estos procesos a nivel traduccional. Posee 2 mensajeros principales corriente abako involucrados en el control de la traducción: la cinasa p70 S6 ribosomal (S6K1) y la proteína de unión al factor de iniciación 4E (4E-BP1)43. Ambas proteínas son activadores de la traducción críticos para la biogénesis y traducción ribosomal, incluyendo la síntesis de proteínas necesarias para la progresión del ciclo celular. Además de su efecto en la traducción proteica mediado por S6K1 y 4E-BP1, la activación de mTOR deriva en la fosforilación de varios efectores y factores de transcripción corriente abajo, los cuales a su vez ejercen influencia sobre la proliferación y la supervivencia celular y la angiogénesis.
La vía de señalización de PI3K/Akt/mTOR regula la proliferación, migración, supervivencia celular, metabolismo y apoptosis. Esta cascada de señalización está desregulada en el cáncer de mama, aumentando la proliferación celular. La activación del receptor de la vía PI3K/Akt/mTOR es mediada a través de proteínas adaptadoras tales como IRS1 y Ras. Las proteínas mTOR regulan la actividad de reguladores traduccionales como 4E-BP1 y S6K. Existe comunicación cruzada (cross-talk) bidireccional entre los receptores de estrógenos (RE) y los receptores de factores de crecimiento (ejemplo: HER2) los cuales median la señalización vías PI3K/Akt y MAPK. Estas 2 vías pueden directamente fosforilar al RE genómico, resultando en un aumento de la transcripción de genes regulados por estrógenos. El RE también puede interactuar en una manera no genómica con receptores de factores de crecimiento en la superficie celular y facilitar la vía de señalización vía PI3K/Akt. IRS1: proteínas sustrato 1 del receptor de insulina; mTor: mammalian target of rapamycin; PI3K, fosfatidilinositol; PTEN: phosphatase and tensin homolog; RE: receptor de estrógeno; S6K1, cinasa p70 S6 ribosomal; 4E-BP1:proteína de unión al factor de iniciación 4E.
La vía de señalización PI3K/Akt se encuentra desregulada en un gran número de cánceres humanos, lo cual favorece el incremento de la señalización a través de los mecanismos de mTOR44. Se han identificado mutaciones en el dominio catalítico de PI3K en el 20-25% de los casos de CM44,45. De manera similar, entre un 15 y un 35% de las pacientes con CM presentan una reducción en la expresión de PTEN (Phosphatase and Tensin Homolog, eliminado en el cromosoma 10), un inhibidor endógeno de la vía PI3K/AKT46.
Papel de la vía de señalización PI3K/AKT/mTOR en la resistencia endocrina en el cáncer de mamaLa función clásica de los RE radica en su función nuclear, también referida como actividad genómica, la cual puede alterar la expresión de genes importantes para la función celular normal, la cual puede favorecer el crecimiento y la supervivencia de los tumores. La vía de señalización de los RE también es regulada por receptores de membrana con función tirosina-cinasa, entre ellos el receptor del factor de crecimiento epidérmico (EGFR, Epidermal Growth Factor Receptor), HER2, y el receptor del factor de crecimiento similar a la insulina (IGF1-R)47. Esta activación de los RE por una señalización mediada por receptores de factores de crecimiento es en ocasiones referida como activación de receptores independiente del ligando. Estas cinasas de membrana activan vías de señalización que inducen la fosforilación de los RE, así como de sus coactivadores y correpresores en múltiples sitios para llevar a cabo sus funciones específicas48.
La resistencia a la terapia endocrina de novo y adquirida es un problema clínico importante en el tratamiento del CM. La evidencia actual sugiere mecanismos diversos, genómicos y no genómicos para la comunicación cruzada en la resistencia endocrina a TAM o a los IA. Diferentes mecanismos se ven involucrados cuando las células del CM se adaptan para evadir las manipulaciones que bloquean la señalización de los RE, la cual involucra las vías EGFR/HER2, Ras/MAPK, ERK1/2 e IGF/PI3K/Akt49.
Las propiedades de crecimiento independientes de los estrógenos son mediadas, al menos parcialmente, por la vía PI3K/Akt/mTOR, y la hiperactivación de esta vía favorece la supervivencia de las células a pesar de la presencia de un bloqueo endocrino continuo.
No obstante, el bloqueo directo de la vía mTOR es un área intrigante en el tratamiento del CM, puesto que presenta el potencial para modular vías dependientes e independientes de factores de crecimiento que contribuyen a la patogénesis y progresión de las neoplasias de mama.
Clínicamente, la resistencia a la terapia endocrina se clasifica como primaria o secundaria. La resistencia primaria es definida como cualquier recidiva durante la terapia con IA o progresión dentro de los 6 meses posteriores al inicio de la terapia con IA en el contexto metastásico, en tanto que resistencia hormonal secundaria se refiere a un tiempo de recaída tardío (≥6 meses) o respuesta previa y progresión subsecuente al tratamiento con IA en pacientes con metástasis.
Inhibidores de mTOR y su aplicación en el cáncer de mama con receptores hormonales positivosDatos de ensayos preclínicosLos preclínicos han demostrado que las células de CM con señalización incrementada de Akt son resistentes a la terapia hormonal, pero su sensibilidad puede ser restablecida mediante el tratamiento con everolimus (RAD) u otros inhibidores de mTOR50,51. Por otra parte, en modelos de CM con respuesta a estrógenos, concentraciones subnanomolares de RAD redujeron el crecimiento de células de CM in vitro y, en combinación con el IA letrozol, se observó un incremento en las actividades antitumorales52.
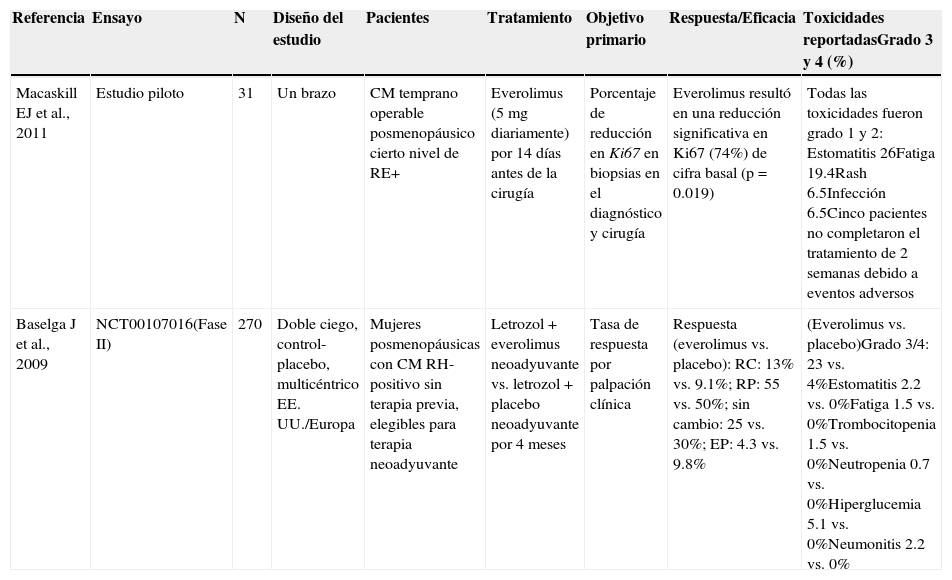
Tratamiento con inhibidores de mTOR en el contexto neoadyuvante en cáncer de mama con receptores hormonales positivos (tabla 3)Everolimus fue evaluado (eficacia y seguridad) por primera vez como monoterapia en un estudio piloto en el entorno prequirúrgico en 31 pacientes posmenopáusicas con CM incipiente operable, no seleccionadas con base en el estado de RE, RP o HER2, aunque todos los tumores tenían cierto nivel de positividad a RE53. Everolimus se administró a una dosis de 5mg una vez al día los 14 días previos a la cirugía. El criterio principal de valoración de este estudio consistió en evaluar los cambios inmunohistoquímicos en términos de proliferación (Ki67), apoptosis (caspasa-3 activa), p-AKT, p-S6, p-mTOR, estado de RE y RP en biopsias obtenidas al momento del diagnóstico y durante la cirugía (14 días después del tratamiento). El tratamiento con RAD fue bien tolerado; el evento adverso reportado más frecuentemente fue estomatitis grado 1/2 en el 26% de las pacientes. La terapia con RAD derivó en una significativa reducción de una media del 74% en los valores de Ki67 con respecto al valor basal (p=0.019). La tinción para la determinación de p-S6 se vio significativamente reducida independientemente del nivel de Ki67 (p<0.001). No se reportaron datos acerca del grado de respuesta patológica en estas pacientes, motivo por el cual no se incluyó entre los criterios de valoración primarios o secundarios en este estudio piloto.
Estudios clínicos para Inhibidores de mTOR en CM RH-positivo. Escenario neoadyuvante
| Referencia | Ensayo | N | Diseño del estudio | Pacientes | Tratamiento | Objetivo primario | Respuesta/Eficacia | Toxicidades reportadasGrado 3 y 4 (%) |
|---|---|---|---|---|---|---|---|---|
| Macaskill EJ et al., 2011 | Estudio piloto | 31 | Un brazo | CM temprano operable posmenopáusico cierto nivel de RE+ | Everolimus (5mg diariamente) por 14 días antes de la cirugía | Porcentaje de reducción en Ki67 en biopsias en el diagnóstico y cirugía | Everolimus resultó en una reducción significativa en Ki67 (74%) de cifra basal (p=0.019) | Todas las toxicidades fueron grado 1 y 2: Estomatitis 26Fatiga 19.4Rash 6.5Infección 6.5Cinco pacientes no completaron el tratamiento de 2 semanas debido a eventos adversos |
| Baselga J et al., 2009 | NCT00107016(Fase II) | 270 | Doble ciego, control-placebo, multicéntrico EE. UU./Europa | Mujeres posmenopáusicas con CM RH-positivo sin terapia previa, elegibles para terapia neoadyuvante | Letrozol+everolimus neoadyuvante vs. letrozol+ placebo neoadyuvante por 4 meses | Tasa de respuesta por palpación clínica | Respuesta (everolimus vs. placebo): RC: 13% vs. 9.1%; RP: 55 vs. 50%; sin cambio: 25 vs. 30%; EP: 4.3 vs. 9.8% | (Everolimus vs. placebo)Grado 3/4: 23 vs. 4%Estomatitis 2.2 vs. 0%Fatiga 1.5 vs. 0%Trombocitopenia 1.5 vs. 0%Neutropenia 0.7 vs. 0%Hiperglucemia 5.1 vs. 0%Neumonitis 2.2 vs. 0% |
CM: cáncer de mama; EP: enfermedad progresiva; mTOR: mammalian target of rapamycin; N: número de pacientes; RC: respuesta completa; RE: receptor de estrógeno; RH: receptor hormonal; RP: respuesta parcial.
Se llevó a cabo un ensayo fase ii con asignación aleatoria y enmascaramiento doble en 270 mujeres posmenopáusicas con CM RE-positivo operable54. Las pacientes fueron distribuidas al azar a un tratamiento neoadyuvante de 4 meses con letrozol (2.5mg/día) combinado con RAD (10mg/día) o placebo. El criterio principal de valoración fue la respuesta clínica evaluada mediante palpación. Se obtuvieron biopsias al inicio y al cabo de 2 semanas de tratamiento. Las muestras tumorales fueron valoradas para determinar el estado de mutación de PI3K y cambios inducidos por el tratamiento en los niveles de Ki67, S6 fosforilada, D1 ciclina y el estado de RP mediante inmunohistoquímica. La tasa de respuesta (TR) mediante palpación clínica en el brazo con RAD resultó superior a la registrada con letrozol solo (i.e., con placebo; 68.1 vs. 59.1%; p=0.062, al nivel α=0.1 unilateral previamente establecido). Se observó una notoria disminución de la expresión de los RP y la ciclina D1 en ambos brazos de tratamiento, en tanto que únicamente en el brazo con RAD se detectó una significativa regulación a la baja de la S6 fosforilada. Se registró una respuesta antiproliferativa, definida como una reducción en la expresión de Ki67 el día 15, en el 57% de las pacientes en el brazo con RAD vs. 30% en el brazo con placebo (p<0.1).
Se registraron reducciones de la dosis o la interrupciones del tratamiento como resultado de un evento adverso en el 52.9% de las pacientes tratadas con RAD frente al 7.6% de aquellas tratadas con placebo. No se consignaron fallecimientos durante el estudio. Los eventos adversos grado 3/4 en el brazo letrozol-everolimus fueron hiperglucemia (5%), estomatitis (2%), neumonitis (2%), e infecciones (2%). Los 3 casos de neumonitis grado 3 resolvieron completamente tras la interrupción del tratamiento con RAD.
Este estudio demostró que RAD incrementa significativamente la eficacia de letrozol en el tratamiento del CM RE-positivo de diagnóstico reciente en términos de, respuesta tanto clínica como antiproliferativa.
Tratamiento con inhibidores de mTOR en el contexto de cáncer de mama con receptores hormonales positivos avanzado (tabla 4)Los resultados de un estudio fase ib de pacientes con CM RE-positivo avanzado, quienes se encontraban estables o en progresión bajo tratamiento con letrozol, demostró que la terapia diaria con letrozol (2.4mg/día) y RAD (10mg/día) fue bien tolerada. Las toxicidades fueron concordantes con aquellas observadas con la monoterapia con RAD; no se detectaron interacciones farmacocinéticas aparentes y se encontró evidencia de actividad antitumoral55.
Tratamiento en CM metastásico RH-positivo con inhibidores de mTOR
| Referencia | Ensayo/(Fase) | N | Diseño del estudio | Pacientes | Tratamiento | Objetivo primario | Respuesta /Eficacia | Toxicidades reportadas grados 3 y 4 (%) |
|---|---|---|---|---|---|---|---|---|
| Awada A et al., 2008 | (Fase Ib) | 18 | Abierto con escalamiento de dosis | RE+, CM metastásico estable o sin respuesta a letrozol | Letrozol+everolimus 5mg (6 pts) y letrozol+everolimus 10mg (12 pts) | Seguridad y farmacocinética | Mejor respuesta 10mg cohorte (n=12): 8.3%, TRO: 42%, EE: 33%, EE: >6 m, EP: 25% | No farmacocinética interacción de everolimus y anastrozol; un paciente con grado 3 neutropenia y trombocitopenia |
| Baselga J et al., 2005 | (Fase II) | 92 | Aleatorizado fase ii | Letrozol+temsirolimus 30mg vs. letrozol+temsirolimus 10mg vs. letrozol | SLP | SLP: 13.2 vs. 11.5 vs. 11.6m TRG: 40 vs. 33 vs. 45% | Hiperglucemia (10%)Astenia (3%) | |
| Chow L et al., 2006 | NCT00083993(Fase III) | 992 | AleatorizadoDoble ciego, control-placebo, multicéntrico global | Mujeres posmenopáusicas con CM localmente avanzado o metastásico, primera línea metastásica | Letrozol+temsirolimus vs. letrozol+placebo | SLP | SLP:9.2 vs. 9.2mTRO: 24 vs. 24% | (Brazo temsirolimus)Disnea 3Neutropenia 3Hiperglucemia 4 GGT 3 |
| Bachelot T et al., 2010. Bourgier C, et al., 2011 | TAMRAD(Fase II) | 111 | Aleatorizado | RE+, RP+, HER2-; Resistencia a IA | Tamoxifeno+everolimus vs. tamoxifeno | TBC | TBC: 61.1 vs. 42.1% (p=0.045) TPP: 8.6 vs. 4.5m, HR=0.54 (p=0.0021) ST: HR 0.45 (p=0.007) TPP en resistencia primaria: 5.4 vs. 3.8m, HR 0.70 (p=NS) ST en resistencia primaria: HR=0.73 (p=0.41) TPP en resistencia secundaria: 14.8 vs. 5.5m, HR=0.46 (p=0.0087) ST en resistencia secundaria: HR=0.21 (p=0.002) | (Brazo everolimus)Estomatitis 11.1Dolor 9.3Anorexia 7.4Fatiga 5.6Tromboembolia 5.6Rash 3.7Diarrea 1.9Neumonitis 1.9 |
| Bhattacharyya GS, et al,. 2011 | (Fase II) | 400 | Aleatorizado | RE+, RP+, HER2Grupo 1: Exposición previa a IA o falla con tamoxifeno en 6 meses anterioresGrupo 2: Sin exposición previa a IA | Tamoxifeno+sirolimus vs. Tamoxifeno | TR y TPP | Grupo 1: RR: 38.8 vs. 4.1% (p=0.00018) TPP: 11.7 vs. 3.3m, HR=0.43 (p=0.0023) TPP in resistencia primaria: 7.4 vs. 2.2m, HR=0.62 (p=NS) Grupo 2: RR: 75.6 vs. 32.7% (p=0.0043) TPP: 16 vs. 9m, HR=0.48 (p=0.0028) | (Brazo sirolimus)Anemia 21Hiperglucemia 16Hipercolesterolemia 11Hipertrigliceridemia 11Estomatitis 8Fatiga 6Diarrea 3Neumonitis 1 |
| Baselga J et al., 2011 | BOLERO-2(Fase III) | 724 | AleatorizadoDoble ciego | RE+, RP+, HER2-; resistencia a letrozol o anastrozol | Exemestano + Everolimus vs. Exemestano | SLP | SLP valoración local: 6.93 vs. 2.83m, HR=0.43 (p=1.4×10−15). SLP valoración local: 10.6 vs. 4.1m, HR=0.36 (p=3.3×10−15) | (Brazo everolimus)Estomatitis 8Fatiga 4Disnea 4Anemia 6Hiperglucemia 5AST 4Neumonitis 3 |
AST: aspartato transaminasa; BOLERO: Breast Cancer Trials of Oral Everolimus; CM: cáncer de mama; EE: enfermedad estable; EP: enfermedad progresiva; GGT: gamma-glutamil transferasa; HR: hazard ratio; IA: inhibidores de la aromatasa; mTOR: mammalian target of rapamycin; N: número de pacientes; NS: no significativo; RE+: positivo para receptores de estrógeno; RP: respuesta parcial; RP+, HER2-: EGFR2 humano negativo; positivo para receptores de progesterona; RR: razón de riesgo; SLP: supervivencia libre de progresión; TAMRAD: tamoxifeno (TAM) con everolimus (RAD) trial; TBC: tasa de beneficio clínico; TPP: tiempo hasta la progresión de la enfermedad; TR: tasa de respuesta; TRG: tasa de respuesta global; TRO: tasa de respuesta objetiva.
Un estudio fase ii en 92 mujeres comparó la eficacia y la seguridad de letrozol 2.5mg solo o en combinación con temsirolimus diario 10 o 30mg56. Las pacientes en el grupo con temsirolimus 30mg, experimentaron una SLP más prolongada en comparación con aquellas tratadas exclusivamente con letrozol (18 vs. 9.5 meses, respectivamente).
Con base en estos resultados, se llevó a cabo un ensayo fase iii con asignación aleatoria y doble enmascaramiento que evalúo temsirolimus en combinación con letrozol en mujeres posmenopáusicas con CM localmente avanzado o CMM57.
Novecientas noventa y 2 mujeres fueron asignadas aleatoriamente en una razón 1:1 a la administración de temsirolimus oral (30mg/día por 5 días cada 2 semanas) o placebo en combinación con letrozol (2.5mg/día). En el análisis provisional (intermedio), el grupo con la combinación terapéutica presentó un índice superior de eventos adversos grado 3-5 comparado con el grupo control de monoterapia (37 vs. 22%). No se detectaron diferencias en las TR globales, las tasas de beneficio clínico (TBC) ni en la SLP entre los 2 grupos después de que se registraron 382 eventos (52%) en el análisis intermedio, lo cual mostró que la adición de temsirolimus a letrozol no generó ninguna mejora en el desenlace clínico en mujeres posmenopáusicas con CM avanzado o metastásico.
Inhibidores de mTOR: sirolimus en cáncer de mama metastásicoUn ensayo clínico reciente evaluó la adición de TAM a sirolimus (SIR) en CMM RH-positivo, HER2-negativo, en un centro único con 3 hospitales de referencia perifericos58. El estudio fue realizado en 2 grupos, incluyendo 200 pacientes en cada grupo: a) Exposición previa a IA o fallo con TAM dentro de los 6 meses previos y b) Ausencia de exposición previa a IA. Las pacientes fueron asignadas aleatoriamente a TAM (20mg una vez al día) o a TAM con SIR (2mg/día). El criterio principal de valoración fue la TR y el TPP. Los resultados del grupo a) demostraron una TR del 4.1 vs. 38.8% (p=0.00018) y el TPP fue de 3.3 meses vs. 11.7 meses (HR: 0.43; p=0.0023) con TAM y TAM/SIR, respectivamente. De manera notable, en las pacientes que progresaron dentro de los 6 meses posteriores, la magnitud del beneficio fue menor (TPP: 2.2 vs. 7.4 meses; HR: 0.62; p=NS). En el grupo b), la TR fue del 32.7 vs. 75.6% (p=0.0043) y el TPP fue de 9 vs. 16 meses (HR: 0.48; p=0.0028).
Los eventos adversos grado 3/4 en el brazo con SIR fueron principalmente secundarios a la anemia (21%) y anomalías metabólicas (hiperglucemia 16%, hipercolesterolemia 11%, hipertrigliceridemia 11%). Los casos estomatitis grado 3/4 se reportaron únicamente en el 8%. La conclusión de este estudio fue que el tratamiento con la combinación incrementó la TR y el TPP, a la vez que produjo mayores niveles de calidad de vida ajustada por supervivencia.
Inhibidores de mTOR: everolimus en cáncer de mama metastásicoEl estudio clínico fase ii TAMRAD incorporó a 111 pacientes con CMM HR-positivo, HER2-negativo, quienes habían recibido previamente terapia adyuvante con un IA59. Tras la estratificación de conformidad con la presencia de resistencia primaria o secundaria (determinada por la progresión temprana o tardía después del tratamiento con el IA previo), las pacientes fueron asignadas aleatoriamente 1:1 a tratamiento con TAM solo (20mg/día) (n=57) o en combinación con RAD (10mg/día) (n=54). El criterio principal de valoración del ensayo fue la TBC, definida como el porcentaje de pacientes con respuesta completa o respuesta parcial o enfermedad estable a 6 meses. En un análisis exploratorio tras un seguimiento de una media de 24 meses, la TBC fue del 42.1% en el grupo con TAM y del 61.1% (p=0.045) en el grupo con TAM/RAD)60.
De manera similar, el TPP favoreció el grupo con la combinación (4.5 meses vs. 8.6 meses; HR: 0.54; p=0.0021), así como la SG (HR: 0.45; p=0.007).
Si bien los eventos adversos asociados a interrupciones permanentes del tratamiento no fueron más frecuentes con la combinación (7% TAM vs. 5.6% TAM/RAD), la totalidad de eventos adversos resultó superior con la combinación, en particular, episodios de fatiga, estomatitis, exantema, anorexia y diarrea, los cuales requirieron reducciones de dosis en un 28% de las pacientes (ninguna con TAM).
Las diferencias en la TBC fueron más acentuadas en las pacientes con resistencia hormonal secundaria (44.3% con TAM vs. 74.1% con TAM/RAD). Al analizar el TPP en función de la resistencia hormonal intrínseca, Bachelot notó que, entre las pacientes con resistencia primaria, el TPP fue de 2.8 meses con TAM y de 5.4 meses con la combinación (HR: 0.70; p=NS). Entre aquellas con resistencia hormonal secundaria, el TPP fue de 5.5 meses con TAM y de 14.8 meses con TAM/RAD (HR: 0.73; p=0.41 vs. HR: 0.21; p=0.002).
Dos biomarcadores de la activación de mTOR fueron evaluados en 35 pacientes en el tumor primario. pS6K y 4E-BP1 son efectores corriente abajo en la vía de señalización mTOR: pS6K es estimulado y 4E-BP1 es inhibido por mTOR. Las pacientes con expresión elevada de pS6K y baja de 4E-BP1 demostraron el mayor beneficio en el TPP en función de la expresión de biomarcadores. Estos resultados preliminares del análisis de traducción demuestran una posible correlación entre biomarcadores de activación de mTOR y la eficacia de RAD.
Los datos de seguridad demostraron que la toxicidad fue manejable en ambos grupos. La dosis de RAD tuvo que ser disminuida a 5mg/día en el 20% de los casos y el 7 y el 22% tuvieron que suspender el tratamiento de manera permanente debido a toxicidades en los brazos con TAM y TAM+RAD, respectivamente. Los eventos adversos severos (grados 3-4)>10% fueron estomatitis (0/11%, TAM/RAD+TAM) y dolor (19/9%).
Con base en estos resultados, los investigadores planean realizar estudios adicionales a fin de evaluar la combinación de RAD y terapia hormonal como opción de segunda línea para mujeres con CM RH-positivo, HER2-negativo.
Ensayo fase iii BOLERO-2BOLERO-2 es un ensayo fase iii que incluyó a 724 mujeres posmenopáusicas con CM RE-positivo, HER2-negativo avanzado, quienes cursaban con CM avanzado refractario (con recurrencia o progresión posterior a terapia previa con letrozol o anastrozol)61. Las pacientes fueron asignadas al azar en una proporción de 2:1 a un tratamiento con RAD 10mg/día o placebo, ambos brazos con la administración adicional de exemestano 25mg/día. El criterio principal de valoración del ensayo fue la SLP. No se permitió el cruce de brazo tras la progresión. Las terapias previas incluyeron TAM (48%), fulvestrant (16%) y un régimen de quimioterapia (25%). Por definición del protocolo, el 84% de las pacientes presentaba sensibilidad previa a la terapia hormonal (respuesta o estabilización prolongada en el ámbito metastásico o al menos 2 años de terapia adyuvante).
El ensayo fue detenido después de que en un análisis intermedio previamente especificado en febrero de 2011 se encontró una mejora significativa en la SLP en una evaluación local del grupo con terapia combinada: media de 6.9 meses vs. 2.8 meses (HR: 0.43; p=1.4×10−15). En la evaluación central, RAD incremento la media de supervivencia de 4.1 a 10.6 meses (HR: 0.36; p=3.3×10−15). En cada uno de los subgrupos definidos prospectivamente se observó uniformidad del efecto del tratamiento con un HR estimado que osciló entre 0.25 y 0.60. La TR global y la TBC fueron significativamente superiores en el grupo con la combinación (9.5 vs. 0.4%, p<0.0001 y 33.4 vs. 18%, p<0.0001, respectivamente). Los datos de SG aún eran inmaduros al momento del análisis preliminar, pero se habían consignado un total de 83 fallecimientos: un 10.6% en el brazo con la combinación y un 13.0% en el brazo con exemestano.
El motivo principal para la interrupción definitiva del medicamento fue la progresión de la enfermedad. Un porcentaje superior de pacientes suspendió de manera permanente el tratamiento en el brazo con la combinación, en comparación con el brazo de control, debido a eventos adversos (6.6 vs. 2.5%). Los eventos adversos grado 3 y 4 más frecuentes en el brazo con RAD fueron estomatitis (8%), anemia (5%), disnea (4%), hiperglucemia (4%), fatiga (3%) y neumonitis (3%). Si bien los efectos secundarios grado 3-4 fueron más frecuentes en el brazo con la combinación, esto no se tradujo en diferencias en la calidad de vida.
Este es el primer estudio fase iii a gran escala de un agente molecular (terapia dirigida), RAD, el cual en combinación con una terapia endocrina reportó una mejora significativa en la SLP y la TR, así como un perfil de seguridad manejable. Los resultados del ensayo fueron reportados antes de lo previsto en el primer análisis preliminar en virtud de que el resultado con la combinación había excedido el umbral de significación previamente especificado para la SLP. Consecuentemente, los datos de SG aún son inmaduros y son esperados con gran interés. El estudio mantiene el enmascaramiento hasta el momento. La magnitud del efecto de RAD en este ensayo fue sumamente importante, con un HR de 0.36, lo cual resulta equiparable al efecto de trastuzumab en CMM HER2-positivo, de gefitinib en cáncer pulmonar de células no pequeñas con mutación del EGFR) y de imatinib en tumores del estroma gastrointestinal, de modo que la magnitud del efecto de RAD en este entorno se ubica dentro del rango de las principales ventajas establecidas recientemente en oncología médica.
Mecanismos propuestos: resistencia a mTORSe han descrito 2 vías reguladoras que podrían limitar la efectividad de los fármacos que han sido desarrollados para modificar el mTOR en el cáncer44. La cinasa S6K, activada en la vía mTOR, se encarga de fosforilar y desestabilizar las proteínas sustrato 1 y 2 del receptor de insulina (IRS1/IRS2 – insulin-receptor substrate 1 and 2) en células con respuesta al factor de crecimiento similar a la insulina (IGF)62. La inhibición de mTOR puede bloquear la retroalimentación negativa del IGF-1R que interfiere con la señalización de AkT/PI3K. Esto deriva en un incremento en la fosforilación de Akt, actividad proteína-cinasa y señalización corriente abajo, lo cual potencialmente podría contrarrestar la inhibición de mTOR43. Por lo tanto, la preocupación se ha concentrado en que la pérdida de este ciclo de retroalimentación negativa podría superar y limitar la efectividad antitumoral del bloqueo de mTOR63. Con base en modelos preclínicos, la inhibición doble tanto de IGF-1R (con anticuerpos monoclonales o inhibidores de tirosina-cinasa) como de mTOR deriva en un efecto antiproliferativo superior a cada una de las estrategias por separado, de modo que esta combinación está siendo evaluada actualmente en ensayos fase i/ii en pacientes con CM43,64.
También existe un ciclo de regulación positiva que involucra al complejo mTOR2 que es activado directamente por factores de crecimiento65. En contraste con mTOR1, el complejo mTOR2 fosforila a Akt de manera directa, y se piensa que se requiere de la activación completa de la vía Akt por señales mitogénicas. El complejo mTOR2 funciona como un regulador positivo de Akt corriente arriba y transmite una señal estimuladora adicional a mTOR1. Sin embargo, los análogos de rapamicina que actúan sobre las proteínas de mTOR parecen bloquear de manera específica el complejo mTOR1 sin inhibir el complejo mTOR266,67.
Implicaciones prácticasTolerancia y toxicidadComo se ha descrito previamente, las principales toxicidades asociadas al uso de inhibidores de mTOR son estomatitis, neumonitis, y anomalías metabólicas. Desde que temsirolimus68 y RAD69,70 fueron aprobados para el tratamiento del carcinoma de células renales metastásico en 2007 y 2008, respectivamente, la mayoría de la experiencia en el manejo de las toxicidades relacionadas con estos compuestos proviene de los estudios de registro. Recientemente, un grupo de expertos publicó la guía para el manejo de efectos adversos selectos relacionados con el uso de RAD en el tratamiento del carcinoma de células renales metastásico71. Para recomendaciones clave y modificaciones específicas a las guías, a continuación se presentan algunas sugerencias.
EstomatitisSi bien la experiencia en el tratamiento de la estomatitis asociada a RAD es limitada, la eficacia de los corticosteroides tópicos y enjuagues bucales en el tratamiento de la estomatitis inducida por quimioterapia ha sido revisada ampliamente y puede ser aplicable a pacientes en tratamiento con RAD72,73. El panel recomienda mantener una higiene oral adecuada, tratamiento de los focos infecciosos y evitar productos que contengan alcohol o peróxido, dado que pueden exacerbar la afección. Asimismo, el panel recomienda examinar a los pacientes para detectar infecciones por herpes u hongos, con la institución de un agente antiviral o antimicótico en caso necesario.
Neumonitis intersticialEn las pacientes con síntomas respiratorios iniciales o con múltiples metástasis pulmonares documentadas, deberá llevarse a cabo un abordaje diagnóstico por tomografía computarizada de tórax, así como pruebas de la función respiratoria y saturación arterial de oxígeno, previamente al uso de RAD. En las pacientes sin evidencia de compromiso de la función pulmonar, se pueden realizar pruebas de la función pulmonar y estudios por tomografía computarizada a discreción del médico tratante. En caso de síntomas moderados o severos durante el tratamiento con RAD, se puede considerar una interrupción temporal de la terapia; tras la resolución de los síntomas, se puede reiniciar RAD a una dosis reducida de 5mg/día.
Anomalías metabólicasLa aparición de valores de laboratorio anormales puede ser manejada habitualmente sin interrupción del tratamiento. Se recomienda intervención a partir del grado 2 de toxicidad, adecuando la magnitud de la intervención a la anomalía metabólica específica. Las pacientes con diabetes subyacente requieren de monitorización cercana y, potencialmente, modificaciones a su régimen hipoglucemiante. Dado que se observó que la hiperglucemia se presentó principalmente en pacientes con niveles de glucosa en ayuno anormales previos al tratamiento, se remarca la necesidad de alcanzar un control glucémico optimo antes de iniciar la administración de RAD. También se recomienda la monitorización periódica de los niveles de glucosa en ayunas.
Nuevas estrategias y perspectivasExiste una necesidad clínico-terapéutica no satisfecha en el CM RH-positivo, HER2− avanzado. En vista de que los estudios preclínicos han respaldado la hipótesis de que la inhibición de mTOR potencialmente podría revertir la resistencia a la terapia endocrina, serán de particular interés estudios futuros que evalúen la inhibición de mTOR en combinación con la inhibición de vías paralelas compensatorias de mTOR (p. ej., inhibidores de IGF-1R). Con base en BOLERO-2 y otros resultados positivos, la inhibición de mTOR en combinación con terapia endocrina será considerada una nueva estrategia terapéutica para mujeres con CM avanzado previamente tratado con IA. Se requieren nuevos marcadores diagnósticos para seleccionar a las pacientes con base en la actividad de mTOR, a fin de poder aprovechar al máximo los efectos de esta prometedora clase de fármacos.
Entre las perspectivas desconocidas y futuras, resta por resolver e investigar las siguientes interrogantes: ¿Cuál es el tratamiento de primera línea en pacientes que progresan con hormonoterapia, entre quimioterapia vs. hormonoterapia? ¿Cuál es el uso de RAD más allá de la progresión? ¿Combinación con quimioterapia? ¿Cuál es el papel de RAD en el entorno neoadyuvante o adyuvante? ¿Cuáles son los posibles biomarcadores predictivos de respuesta o resistencia al tratamiento con inhibidores de mTOR?
Conflicto de interesesLos autores declaran no tener conflicto de intereses.