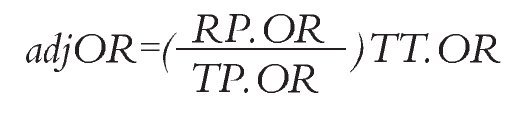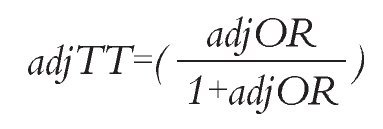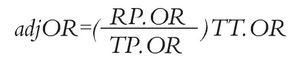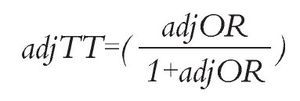¿ INTRODUCCIÓN
El cáncer pulmonar (CP) es una enfermedad en la cual las células anormales que se encuentran en el epitelio pulmonar se desarrollan descontroladamente.1 Dentro de los factores de riesgo conocidos para padecer CP se encuentran el tabaquismo, la edad, los antecedentes familiares y la exposición constante a humo de leña, asbesto, radón u otras sustancias químicas.2
La incidencia anual de CP oscila entre 1.2 y 1.35 millones de casos en todo el mundo; es más frecuente en los hombres que en las mujeres (con una razón de 2 a 1) y típicamente se presenta entre los 40 y 70 años de edad.3,4 El CP es considerado como la primera causa de muerte por cáncer a nivel mundial;5 la tasa de supervivencia a cinco años para todos los estadios apenas alcanza 16%.6
El cáncer de pulmón de células no pequeñas (CPCNP) es el tipo más común, representando aproximadamente 80% a 85% de todos los casos.5,7-9 En México, durante el año 2007, los tumores malignos de tráquea, bronquios y pulmón fueron responsables de 5.7% y 2.5% del total de egresos hospitalarios originados por cáncer en hombres y mujeres, respectivamente.10 Las defunciones generadas por este grupo de tumores en el país durante 2008, se ubicaron en quinto lugar dentro de la mortalidad por cáncer en mujeres y en el segundo puesto en hombres, con un total de 6716 decesos.11
Debido a su elevada incidencia y a que la mayoría de los pacientes son diagnosticados en etapas avanzadas de la enfermedad, el CP representa un grave problema de salud pública y genera un alto impacto económico y social. Un estudio efectuado mediante revisión de expedientes clínicos de pacientes con CP en el Instituto Mexicano del Seguro Social reveló un costo anual de tratamiento de $148 837 (a precios de 2004).12 Esta cifra resulta mucho menor que los costos estimados en Estados Unidos, donde se sabe que cada mes de tratamiento para CP oscila entre US$ 3 733 a US$ 11 496 por paciente.13
Los tratamientos empleados en la atención del CP tienen como objetivo prolongar la supervivencia y maximizar la calidad de vida de los pacientes. Sin embargo, no siempre se puede lograr dicha meta.14 El pronóstico para los pacientes con CPCNP es pobre, ya que más de 75% de los casos son diagnosticados en estadios localmente avanzados o con metástasis, lo que impide que sean candidatos a una cirugía de resección. En situaciones como ésta, el tratamiento consiste básicamente en administrar terapia paliativa y sólo un porcentaje de pacientes que goza de buen estatus de desempeño recibe quimioterapia con base en algún platino. La tasa de supervivencia global a cinco años para los pacientes con CPCNP avanzado o metastásico es apenas de 3% a 5%.15,16
El desarrollo de nuevas terapias y estrategias de combinación de éstas para el tratamiento del CPCNP avanzado significa que actualmente se dispone de varias opciones en diversas líneas de tratamiento. La terapia de elección en primera línea para pacientes con un buen estatus de desempeño consiste en una combinación de quimioterapias, de preferencia aquellas que contienen un platino. En caso de progresión de la enfermedad, se puede recurrir a la administración de agentes como erlotinib o gefitinib. La decisión sobre cuál de estas terapias resulta óptima depende de factores tales como eficacia, perfil de seguridad y características de los pacientes.17-19 Por lo tanto, el objetivo del presente estudio es comparar los parámetros de eficacia de erlotinib y gefitinib utilizados como monoterapia en pacientes con CPCNP avanzado o metastásico y con falla previa a una o dos líneas de tratamiento. Ante la ausencia de comparaciones directas (estudios head to head), se generó un análisis de comparación indirecta ajustada.20,21
¿ MÉTODOS
Estrategia de búsqueda: Se llevó a cabo una revisión sistemática en PubMED/Medline, Embase,Cochrane, CancerLit (National Cancer Institute; clinical trial results), OVID y LILACS. Adicionalmente, se realizó una búsqueda manual en Internet y se dio seguimiento a las referencias bibliográficas de interés. Las palabras clave o términos de búsqueda fueron: "erlotinib", "gefitinib" y "cáncer de pulmón de células no pequeñas". Se impusieron los siguientes límites a la búsqueda: a) que los estudios clínicos fueron en humanos; b) pacientes mayores de 18 años; c) publicación en texto completo y en idioma inglés o español. La búsqueda está actualizada hasta abril de 2009.
Criterios de elegibilidad: Por motivos de análisis, sólo se incluyeron estudios clínicos controlados con placebo, cuya población de estudio estuviera conformada exclusivamente por pacientes con CPCNP y donde la molécula de estudio, erlotinib o gefitinib, haya sido administrada como monoterapia (en dosis y esquemas aprobados17). Se excluyeron estudios de farmacocinética, investigaciones retrospectivas y estudios no aleatorizados.
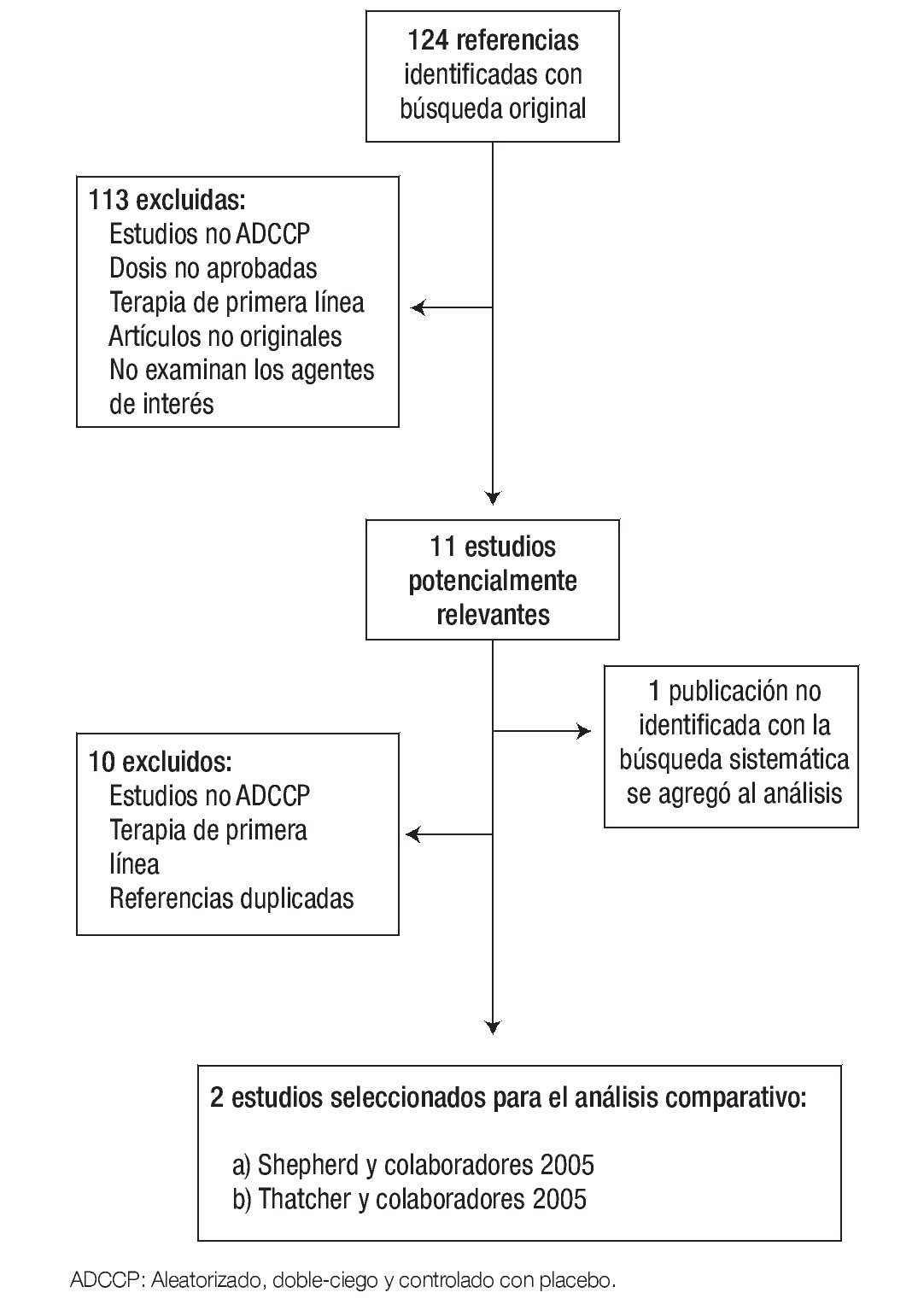
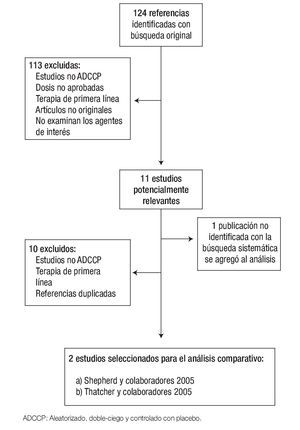
Selección de estudios y extracción de datos: Dos de los autores (AA, JR), revisaron independientemente cada uno de los resúmenes de las 124 referencias identificadas con la estrategia de búsqueda, para excluir aquellos que no cumplieran con los criterios de inclusión; también se encargaron de revisar el texto completo de los estudios potencialmente relevantes. La Figura 1 muestra el diagrama de flujo de la selección de estudios. La calidad de los artículos fue evaluada mediante la escala de PEDro (Physioterapy Evidence Database). Esta escala considera dos aspectos: 1) la "verosimilitud" (o "validez interna") del ensayo y 2) si contiene suficiente información estadística para hacerlo interpretable.22 Los principales datos relacionados con el diseño del estudio, las características de la población reclutada y resultados originales de eficacia y seguridad fueron recolectados en un formato estandarizado.
Figura 1. Diagrama de flujo de revisión sistemática y selección de estudios.
Medidas de eficacia: Se registraron las razones de riesgo (hazard ratio, HR) de supervivencia libre de progresión (SLP) y supervivencia global (SG) del agente activo (erlotinib o gefitinib) en relación al uso de placebo. De igual forma, la proporción de pacientes con respuesta global (completa o parcial, RG) en cada grupo de estudio fue tomada en cuenta para la investigación. Es importante mencionar que las variables tiempo de falla y tiempo libre de progresión fueron aceptadas como equivalentes. Aunque estrictamente ambas definiciones no son idénticas, en las revisiones sistemáticas y meta-análisis suelen emplearse como términos intercambiables o al menos considerarse comparables entre sí e incluso con respecto a otras variables como tiempo para progresión.23-25
Análisis estadístico: Las HR de SLP y SG de erlotinib vs. gefitinib se calcularon mediante una comparación indirecta ajustada siguiendo el método descrito por Bucher.20 Este método permite mantener la aleatorización de cada ensayo. Las probabilidades ajustadas de RG fueron estimadas siguiendo la técnica propuesta por Glenny.21 Esta técnica consiste en calcular una probabilidad de RG y su respectivo momio (denominado RP.OR) el cual actúa como referencia para los pacientes que recibieron placebo en los estudios seleccionados, ponderados según el número de pacientes en cada uno de ellos. Posteriormente, se calculan los momios para el tratamiento activo (TT.OR) y para placebo (TP.OR) en cada estudio individual y se define la razón de momios ajustada "adjOR" aplicando la siguiente ecuación:
Al final, se aplica la siguiente ecuación, donde "adjTT" es la tasa de RG ajustada para el tratamiento de interés:
Para comprobar si la diferencia en el logaritmo natural de las HR de erlotinib y gefitinib (cada uno comparado contra placebo) resulta estadísticamente significativo, se utilizó la prueba t de Student. En el caso de las tasas de RG, ajustadas mediante comparación indirecta, se empleó la prueba exacta de Fisher para diferencia de proporciones entre erlotinib y gefitinib. El análisis estadístico se llevó a cabo en Microsoft Excel® (Microsoft Corp., Redmon, WA, USA), Stata versión 9 (StataCorp LP, College Station, TX, USA) y en el software denominado Comprehensive Meta Analysis®, CMA versión 2 (Biostat, Inc., Englewood, NJ, USA).
¿ RESULTADOS
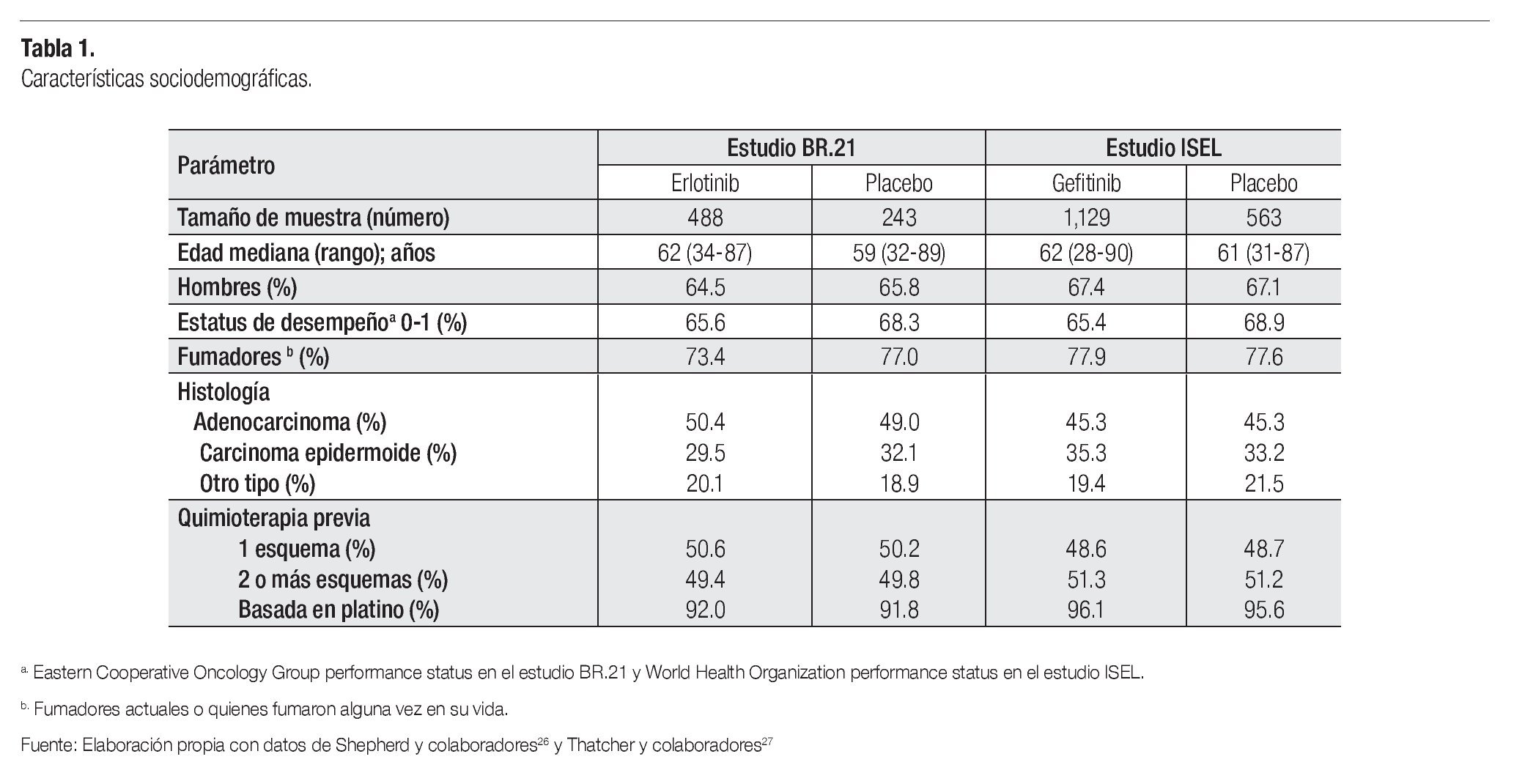
Los dos estudios finalmente seleccionados26,27 alcanzaron el valor máximo de 10 puntos posibles en la escala de PEDro. El estudio BR.21, publicado por Shepherd y colaboradores en 2005, es un ensayo clínico fase III, con 731 pacientes con CPCNP estadio IIIB o IV procedentes de Argentina, Alemania, Australia, Brasil, Canadá, Chile, China, Grecia, Israel, México, Nueva Zelanda, Rumania, Suiza, Tailandia y Sudáfrica.26 El estudio ISEL, publicado por Thatcher y colaboradores en 2005, es un ensayo clínico fase III donde participaron 1692 pacientes con CPCNP procedentes de 210 centros en 28 países de Europa, Asia, América Central, Sudamérica, Australia y Canadá.27 En el estudio BR.21, los pacientes fueron asignados aleatoriamente a erlotinib 150 mg o placebo, por vía oral;26 mientras que en el estudio ISEL, los pacientes fueron distribuidos aleatoriamente en uno de dos grupos: gefitinib 250 mg diarios por vía oral o placebo.27 En ambos estudios, tanto los pacientes como los investigadores permanecieron ciegos a los tratamientos administrados y los resultados fueron analizados conforme a intención a tratar.
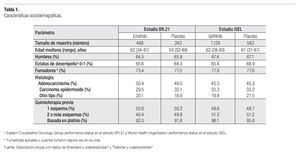
Las características basales de la población investigada en cada uno de estos dos ensayos clínicos se presentan en la Tabla 1. Como se puede observar, al interior de cada uno de los estudios seleccionados, los grupos de tratamiento resultan absolutamente comparables entre sí; y los factores pronóstico se encuentran bien balanceados entre ambos estudios.
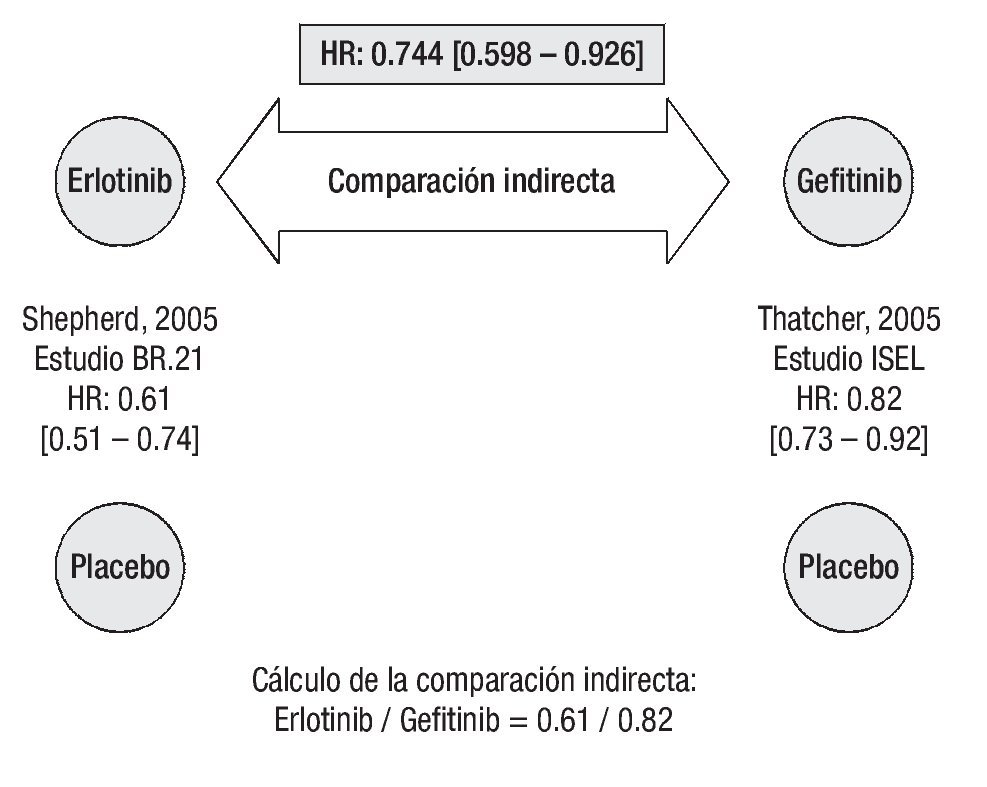
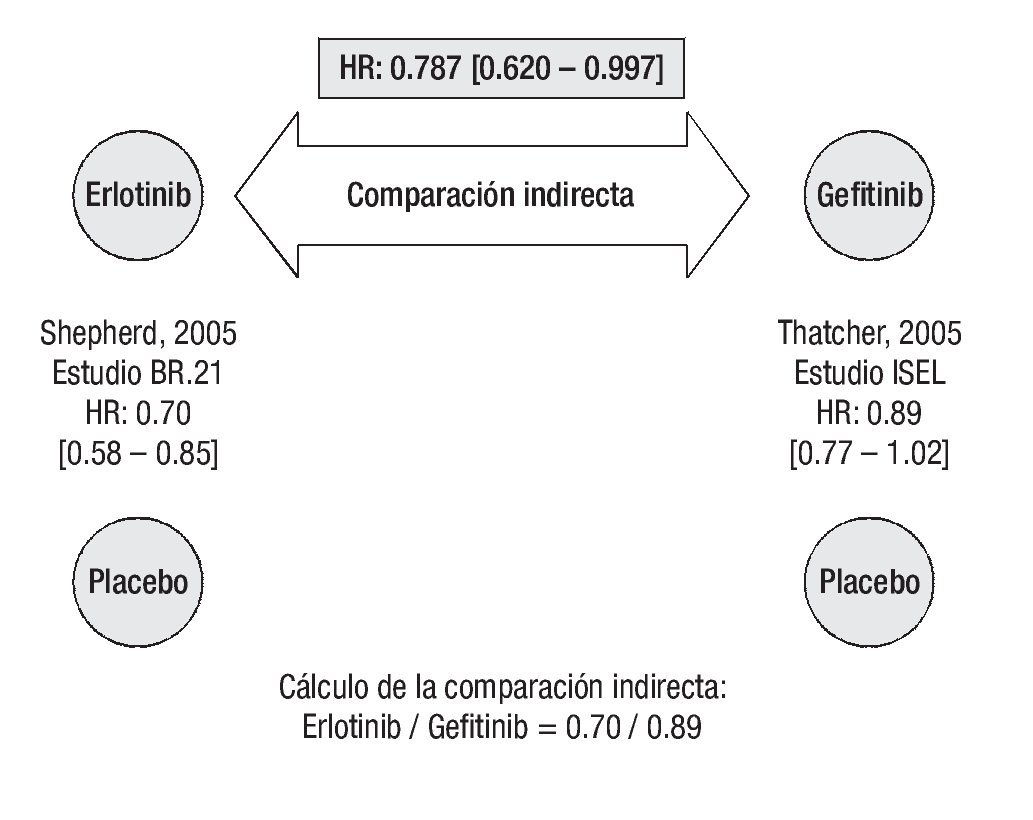
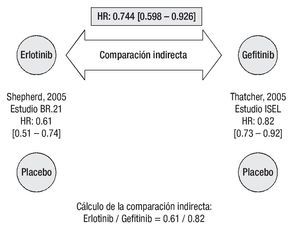
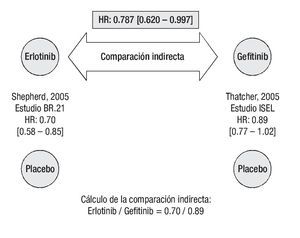
Supervivencia libre de progresión: De acuerdo con los resultados del estudio BR.21, el tratamiento con erlotinib reduce significativamente el riesgo de progresión o muerte en pacientes con CPCNP localmente avanzado o metastásico que han recibido previamente quimioterapia.26 De igual forma, gefitinib se asocia con una reducción significativa en el tiempo para falla al tratamiento.27 La comparación indirecta ajustada según el método de Bucher20 establece que el tratamiento con erlotinib es superior a la terapia con gefitinib en prolongar la SLP (Figura 2). La HR indirecta calculada para SLP de erlotinib vs. gefitinib fue de 0.744 (p = 0.0082).
Figura 2. Comparación indirecta entre erlotinib y gefitinib para supervivencia libre de progresión. Los datos entre corchetes muestran el intervalo de confianza al 95%.
Supervivencia global: En el estudio BR.21, el riesgo de muerte fue significativamente más bajo para erlotinib que para placebo.26 En cambio, en el estudio ISEL no se logró establecer significancia estadística en la HR para SG a favor del tratamiento activo (p = 0.087), aunque sí se puede hablar de una tendencia a favor de gefitinib sobre placebo.27 La comparación indirecta ajustada según el método de Bucher20 establece que el tratamiento con erlotinib también es superior a la terapia con gefitinib en prolongar la supervivencia de los pacientes (Figura 3). La HR indirecta calculada para SG de erlotinib vs. gefitinib fue de 0.787 (p = 0.0475).
Figura 3. Comparación indirecta entre erlotinib y gefitinib para supervivencia global. Los datos entre corchetes muestran el intervalo de confianza al 95%.
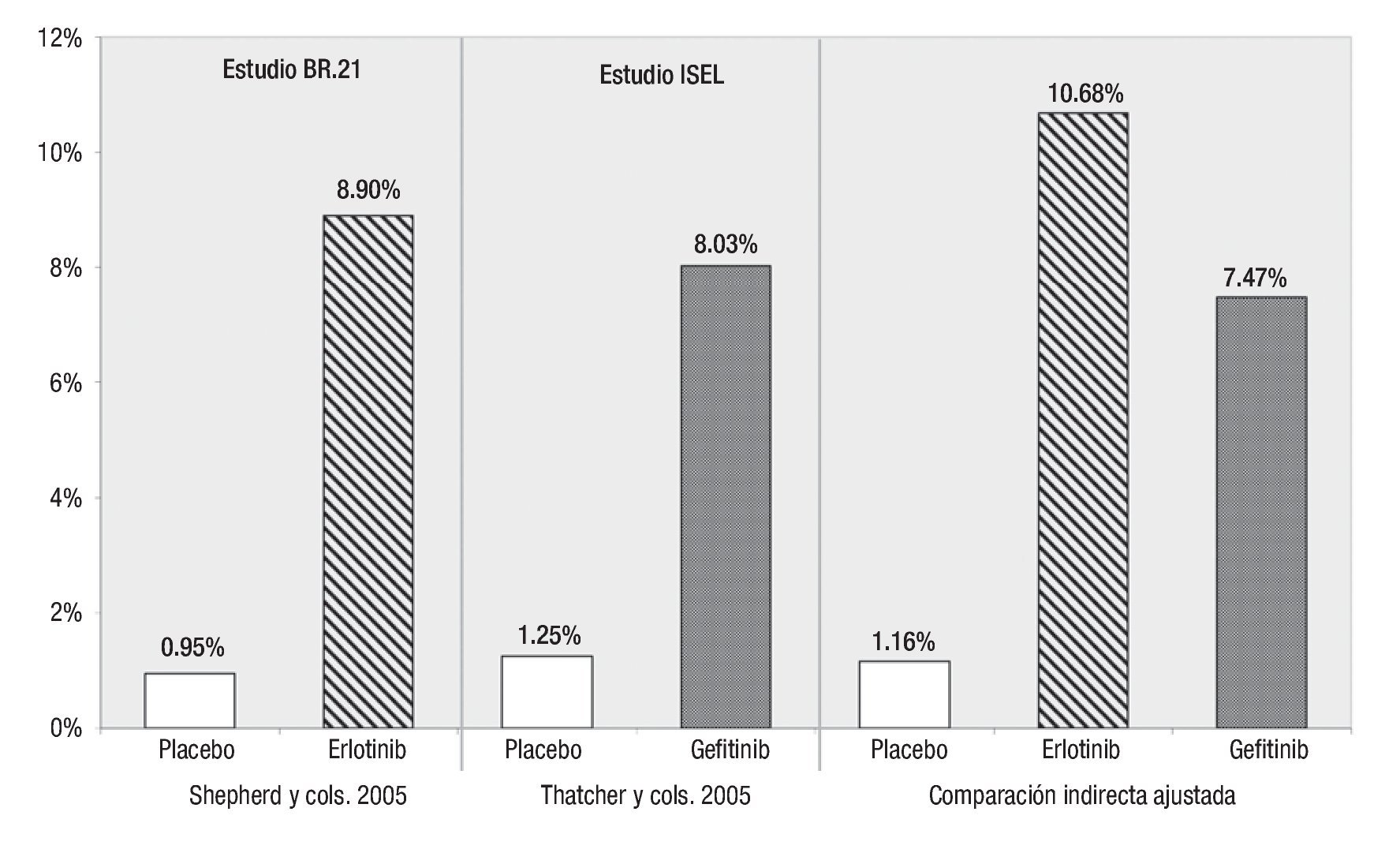
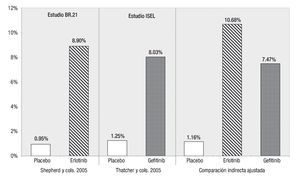
Respuesta global: Las tasas de RG informadas en los estudios originales son 8.9% para erlotinib y 8.0% para gefitinib. En ambos casos, los agentes activos resultaron significativamente superiores al uso de placebo.26,27 Al ajustar estos valores tomando en consideración las tasas de respuesta en los pacientes que recibieron placebo en los dos estudios, según la técnica de Glenny,21 se amplía el margen a favor de erlotinib (Figura 4). Así, la tasa de RG ajustada mediante comparación indirecta es de 10.7% para erlotinib vs. 7.5% para gefitinib, siendo la diferencia entre ellos estadísticamente significativa (p = 0.0484). La razón de momios para RG, utilizando las tasas de RG ajustadas de erlotinib vs. gefitinib, es de 1.48.
Figura 4. Comparación indirecta entre erlotinib y gefitinib para respuesta global.
¿ DISCUSIÓN
El desarrollo de nuevas tecnologías médicas ha permitido lograr avances notables en diversas áreas terapéuticas. En oncología, cada vez es más frecuente identificar nuevos esquemas que resultan en beneficio de los pacientes que se encuentran en etapas avanzadas de la enfermedad, permitiéndoles prolongar su expectativa de vida y mejorar la calidad de la misma. Erlotinib y gefitinib son dos agentes orales que inhiben la tirosina quinasa del receptor del factor de crecimiento epidérmico (EGFR, por sus siglas en idioma inglés). En la actualidad, erlotinib se utiliza como segunda o tercera línea de tratamiento y gefitinib se recomienda en los pacientes con CPCNP con mutación del gen EGFR.17,28-30 Sin embargo, en algunos países gefitinib continúa siendo empleado en el CPCNP refractario, independientemente de la situación mutacional. En el presente estudio, se comparó la eficacia terapéutica entre erlotinib y gefitinib, expresada en diferentes medidas de desenlace clínico.
Aunque idealmente la evidencia científica para la toma de decisiones debiera provenir de ensayos clínicos controlados que hayan incluido y comparado directamente a todas las intervenciones competitivas de interés, en la práctica pocas veces se logra cumplir con este requisito, especialmente cuando el número de intervenciones a comparar se incrementa o cuando involucran medicamentos altamente novedosos.31 Las comparaciones indirectas son comúnmente utilizadas para evaluar la eficacia relativa de diferentes intervenciones que compiten entre sí, cuando no se dispone de comparaciones directas entre ellas. Uno de los métodos más aplicados es el de la "comparación indirecta ajustada". Este método consiste en analizar la efectividad de diversos tratamientos de interés, que han sido previamente evaluados (de forma directa) con un comparador común (por ejemplo, placebo o cuidados paliativos). Así, los datos de eficacia para cada tratamiento son ajustados, con base en las diferencias con respecto al comparador común.20,21
Para poder generar una comparación indirecta ajustada que resulte confiable, es necesario que los estudios que se utilicen como evidencia tengan características similares en cuanto a diseño, duración, medición de la eficacia y características de la población estudiada.21,31 Como se pudo constatar, los estudios BR.21 e ISEL cumplen a la perfección con estas condiciones, ya que su diseño es prácticamente idéntico y las variables que son consideradas clave en el pronóstico de los pacientes (edad, sexo, estatus de desempeño, tabaquismo, histología del tumor e historia de quimioterapia previa) estuvieron distribuidas casi por igual entre ambos estudios.26,27 Lo anterior, garantiza que la comparación indirecta entre ambos agentes sea justa y válida.
Los resultados del presente estudio muestran que erlotinib ofrece una serie de ventajas, en términos de desenlaces clínicos, sobre el uso de gefitinib. La comparación indirecta ajustada de las HR de SLP establece que erlotinib reduce en 25.6% el riesgo de progresión o muerte en comparación con gefitinib. De igual forma, la comparación indirecta ajustada de las HR de SG establece una reducción de 21.3% en el riesgo de muerte cuando se utiliza erlotinib como terapia. En ambos casos, la diferencia resultó estadísticamente significativa a favor de erlotinib. La comparación indirecta se basa en las HR y no en las medianas de SLP y SG debido que las HR presentan un panorama más completo sobre el riesgo de que ocurra un evento determinado e incorporan información de todo el tiempo de seguimiento de los pacientes.32 El incremento en la mediana de tiempo para falla de gefitinib con respecto a placebo fue de 0.4 meses (3.0 vs. 2.6 meses) en el estudio ISEL.27 Misma diferencia de 0.4 meses se identificó en el estudio BR.21, donde las medianas de SLP fueron 2.2 y 1.8 meses para erlotinib y placebo, respectivamente.26 En el estudio ISEL, el tiempo para falla se definió como el tiempo transcurrido desde la aleatorización hasta que el paciente suspendió el tratamiento por cualquier causa; sin embargo, un paciente con progresión de la enfermedad pudo haber decidido mantener la terapia, por lo que el tiempo para falla constituye una definición menos estricta que la SLP y por lo mismo las cifras son ligeramente más altas en el estudio publicado por Thatcher y colaboradores que en el estudio BR.21.26,27 Por otra parte, la diferencia absoluta y relativa en la mediana de SG favorece a erlotinib (6.7 meses para erlotinib vs. 4.7 meses para placebo en el estudio BR.21 en comparación de 5.6 y 5.1 meses en los grupos de gefitinib y placebo en el estudio ISEL).26,27
La proporción de pacientes con RG (completa o parcial) ajustada también es mayor para erlotinib (10.7%) que con gefitinib (7.5%). Con estos datos, la razón de momios para RG de erlotinib con respecto a gefitinib es de 1.48, lo que indica que el momio de alcanzar una RG con erlotinib es casi 50% más alto que el momio de alcanzar una RG con gefitinib. Si los datos originales de RG reportados por Shepherd26 y Thatcher27 se utilizan para calcular una razón de momios de RG ajustada entre erlotinib y gefitinib con la técnica de Bucher20, el resultado es similar.
Una de las limitaciones del presente estudio consiste en que los datos para comparar la eficacia terapéutica de erlotinib y gefitinib proceden de dos ensayos clínicos por separado. Sin embargo, hasta el momento no se conoce un estudio que los haya comparado directamente y la alternativa de análisis más sólida en estos casos es precisamente la comparación indirecta ajustada. La validez potencial de las comparaciones indirectas se ha investigado en diversos estudios empíricos. Song y colaboradores (2003), evaluaron los resultados de una serie de comparaciones directas e indirectas, y encontraron que en 41 de 44 casos, los resultados del análisis fueron concordantes.33 Profundizando aun más, Song y colaboradores (2008), han sugerido que las comparaciones indirectas en realidad pueden tener menos sesgos que las comparaciones directas. En tres estudios de caso, los autores observaron que los efectos de los nuevos medicamentos estimados en los estudios de comparación directa tendían a ser mayores que los estimados a través de comparaciones indirectas, y que las diferencias podrían no explicarse satisfactoriamente por la variación aleatoria o el sesgo y la heterogeneidad en las comparaciones indirectas.34
Otra de las posibles limitaciones es que, en nuestro estudio, la comparación indirecta de eficacia se realizó tomando en consideración únicamente los ensayos clínicos doble-ciego, aleatorizados y controlados con placebo disponibles para erlotinib y gefitinib. Existe otra técnica de análisis conocida como meta-análisis de redes que incorpora una mayor cantidad de evidencia al permitir el uso de de diferentes comparadores comunes (placebo, otros agentes activos, entre otros). Un artículo publicado recientemente presenta un meta-análisis de redes para diversas terapias indicadas para tratamiento del CPCNP localmente avanzado o metastásico.35 En dicho estudio, los autores incluyeron resultados de seis ensayos clínicos con erlotinib, gefitinib, pemetrexed y docetaxel. Haciendo uso de análisis bayesiano, los autores del meta-análisis de redes calculan que existe 85% de posibilidades de que erlotinib sea superior en SG a los otros tres agentes; pemetrexed sería la alternativa más efectiva en 12% de los casos y correspondería ese honor a docetaxel en el restante 3% de los escenarios.35
Una tercera limitación consiste en que el análisis se enfocó exclusivamente en la eficacia terapéutica, dejando de lado el aspecto de seguridad. Aunque el artículo encabezado por Thatcher27 sí presenta información completa en cuanto al número (y porcentaje) de pacientes con eventos adversos, en el estudio BR.2126 sólo se presentan porcentajes, lo que dificulta realizar un análisis comparativo exacto. Además, hay que recordar que estos dos estudios fueron diseñados para medir eficacia y quizás no estén potenciados para determinar la incidencia de eventos adversos en particular. No obstante, estudios de revisión coinciden en que ambos agentes son seguros y bien tolerados, por lo que no se esperan diferencias importantes en este rubro.28,29
Otro factor relevante para la toma de decisiones es el costo de tratamiento con estas terapias, el cual debe ser evaluado en conjunto con las potenciales ventajas en eficacia y seguridad que brindan estos nuevos agentes. Un estudio de farmacoeconomía basado en el ensayo clínico pivote de erlotinib sugiere que el uso de este medicamento en la población adecuada puede ser considerada como una estrategia costo-efectiva, incluso si se compara con la atención en etapa de cuidado paliativo.36 En otro estudio de evaluación económica, erlotinib se comportó como una estrategia dominante (es decir, más efectiva y menos costosa) al compararse contra docetaxel, dando lugar a ahorros de costos, una ligera ganancia en supervivencia y mejoras importantes en calidad de vida producto de un perfil de seguridad más favorable.37 La evidencia disponible alrededor del mundo es consistente con el hecho de que erlotinib representa una estrategia costo-ahorradora en relación al uso de quimioterapias basadas en docetaxel o pemetrexed en segunda o tercera líneas de tratamiento de CPCNP avanzado.38-41 Un estudio de impacto presupuestal realizado en Brasil, evidenció ahorros potenciales de tres a 28 millones de reales brasileños (precios de 2007) a favor de erlotinib en comparación de docetaxel y pemetrexed, para el primer año de tratamiento en segunda línea de CPCNP.39 Un análisis similar en Portugal, señaló que los ahorros anuales por utilizar erlotinib en lugar de docetaxel o pemetrexed oscilan entre 135 046 euros y 3.79 millones de euros (precios de 2008).40 En Estados Unidos, el uso de erlotinib resultaría costo-ahorrador en 65% y 87% de los pacientes tratados actualmente con docetaxel y pemetrexed, respectivamente.41
¿ CONCLUSIONES
Los resultados derivados del presente estudio sugieren que existen ventajas importantes a favor de erlotinib cuando se compara contra gefitinib en los tres parámetros más relevantes de eficacia terapéutica en el área de oncología. Las estimaciones de supervivencia libre de progresión, supervivencia global y tasa de respuesta global ajustadas por placebo resultaron significativamente más altas para erlotinib que con gefitinib en pacientes con CPCNP localmente avanzado o metastásico.
¿ AGRADECIMIENTOS
Esta investigación se realizó con el apoyo financiero de Productos Roche, S.A. de C.V., compañía que manufactura Tarceva® (erlotinib).
Los autores declaran que no tienen ningún interés competente más allá que el de haber recibido el patrocinio por parte de Productos Roche, S.A. de C.V. y que el análisis de la información y la redacción del artículo se realizaron bajo total autonomía.
Correspondencia: Fernando Carlos Rivera.
Insurgentes Sur No. 598 Piso 2 204 Mza. Col. Del Valle, Del. Benito Juárez, C.P. 03100, México D.F.
Teléfono: (55) 5523 0931.
Correo electrónico: fernando. carlos@racsalud.com