La leucemia en el embarazo es rara. Se diagnostica solo en uno de cada 75,000 a 100,000 casos, y 2/3 son de variedad mieloide. Estas neoplasias se caracterizan por una progresión clínica rápida y son potencialmente fatales si no son tratadas con celeridad. No hay un tratamiento estándar, y al establecer el diagnostico la quimioterapia debe aplicarse inmediatamente para salvaguardar la vida de la madre, y aunque hay reportes aislados de su uso a partir del segundo trimestre con buenos resultados, en el primer trimestre se asocia a severos efectos adversos en el producto, lo que constituye un gran dilema terapéutico. La paciente requerirá un manejo interdisciplinario por hematología, obstetricia, oncología y terapia, pero sobre todo requerirá ser informada sobre la importancia en el tiempo de inicio de la quimioterapia y los riesgos inherentes al embarazo y los riesgos de decidir no interrumpirlo. La información sobre el diagnóstico y el tratamiento de la leucemia mieloblástica aguda en el embarazo es limitada en la literatura universal.
The diagnosis of leukaemia is very rare during pregnancy, with a prevalence of 1:75,000 to 100,000 pregnant women. Around two-thirds are myeloid type, and it is characterised by a fast and lethal progression without early treatment. After early diagnosis, the chemotherapy should be established immediately to ensure the life of the mother. Although there are a few cases reports of good outcomes in second trimester, there are many adverse effects in the foetus in first trimester, making it a huge therapeutic dilemma. The patient will require interdisciplinary management, including haematology, obstetrics, and oncology. In particular they will also need to be informed about the importance in the timing of early chemotherapy and the inherent risks in pregnancy, as well as the risks of deciding not to interrupt it. The information on the diagnosis and treatment of acute myeloid leukaemia in pregnancy is limited in world literature.
La verdadera incidencia de leucemia en el embarazo no es bien conocida; se cree que es alrededor de uno de cada 75,000 a 100,000 embarazos, y de estos, 2/3 son de variedad mieloide. Aunque su prevalencia es alrededor de los 66años de edad, puede presentarse en mujeres en edad fértil, y cuando se manifiesta en mujeres embarazadas su diagnóstico normalmente tiene lugar durante los últimos trimestres1-3.
Estas neoplasias se caracterizan por una progresión clínica rápida y son potencialmente fatales si no son tratadas con rapidez1-3 Mientras más temprano sea el embarazo en el momento del diagnóstico, mayor es el riesgo para el binomio. La paciente requerirá un manejo interdisciplinario por hematología, obstetricia, oncología y terapia, pero sobre todo requerirá ser informada sobre los riesgos inherentes al embarazo y los riesgos de decidir continuar con él, así como la importancia en el tiempo de inicio de la quimioterapia, ya que la patología tiene una evolución agresiva y veloz1-4.
La terminación electiva del embarazo se considera más segura para la madre, ya que puede ser más estrechamente controlado, en comparación a tomar el riesgo de un aborto espontáneo, que tiene altas posibilidades de complicarse debido a la trombocitopenia y la falla en la coagulación; la interrupción farmacológica será siempre preferible a la quirúrgica4.
La información sobre el diagnóstico y el tratamiento de la leucemia mieloblástica aguda en el embarazo es limitada en la literatura universal, por lo que, dada su baja incidencia, lo poco común de su presentación clínica y como contribución al escaso número de casos descritos en la literatura nacional, presentamos el caso de un embarazo de primer trimestre complicado por leucemia mieloide aguda y la descripción del abordaje multidisciplinario llevado a cabo.
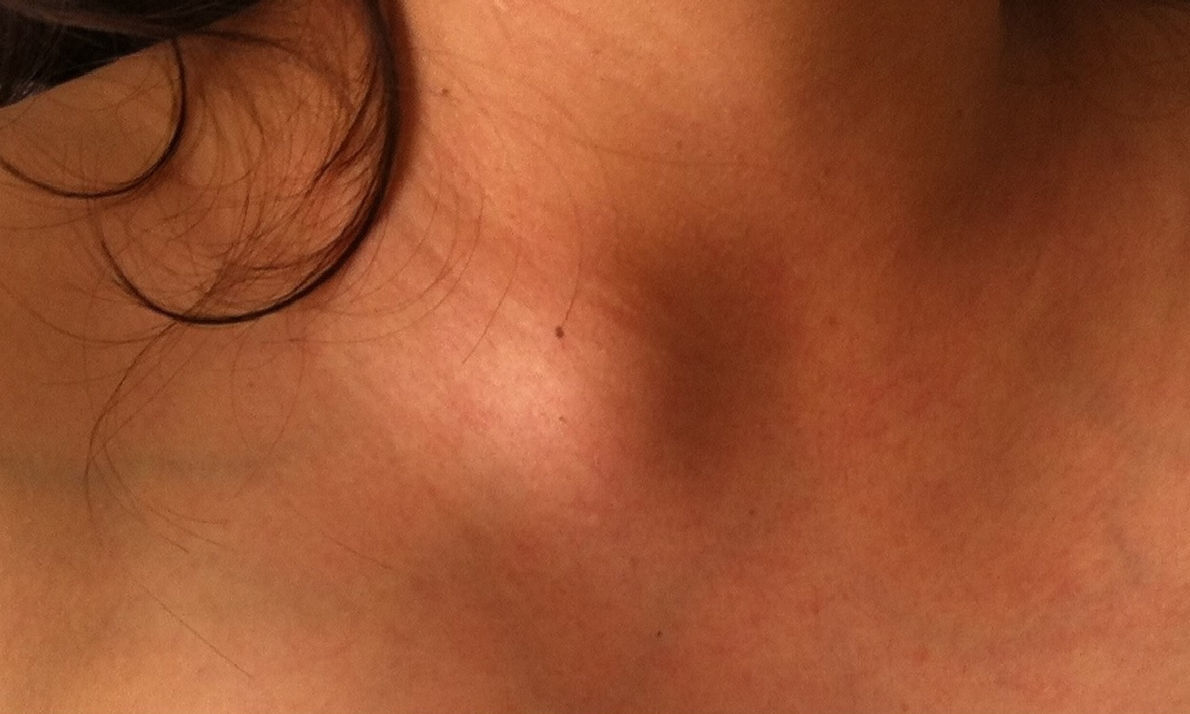
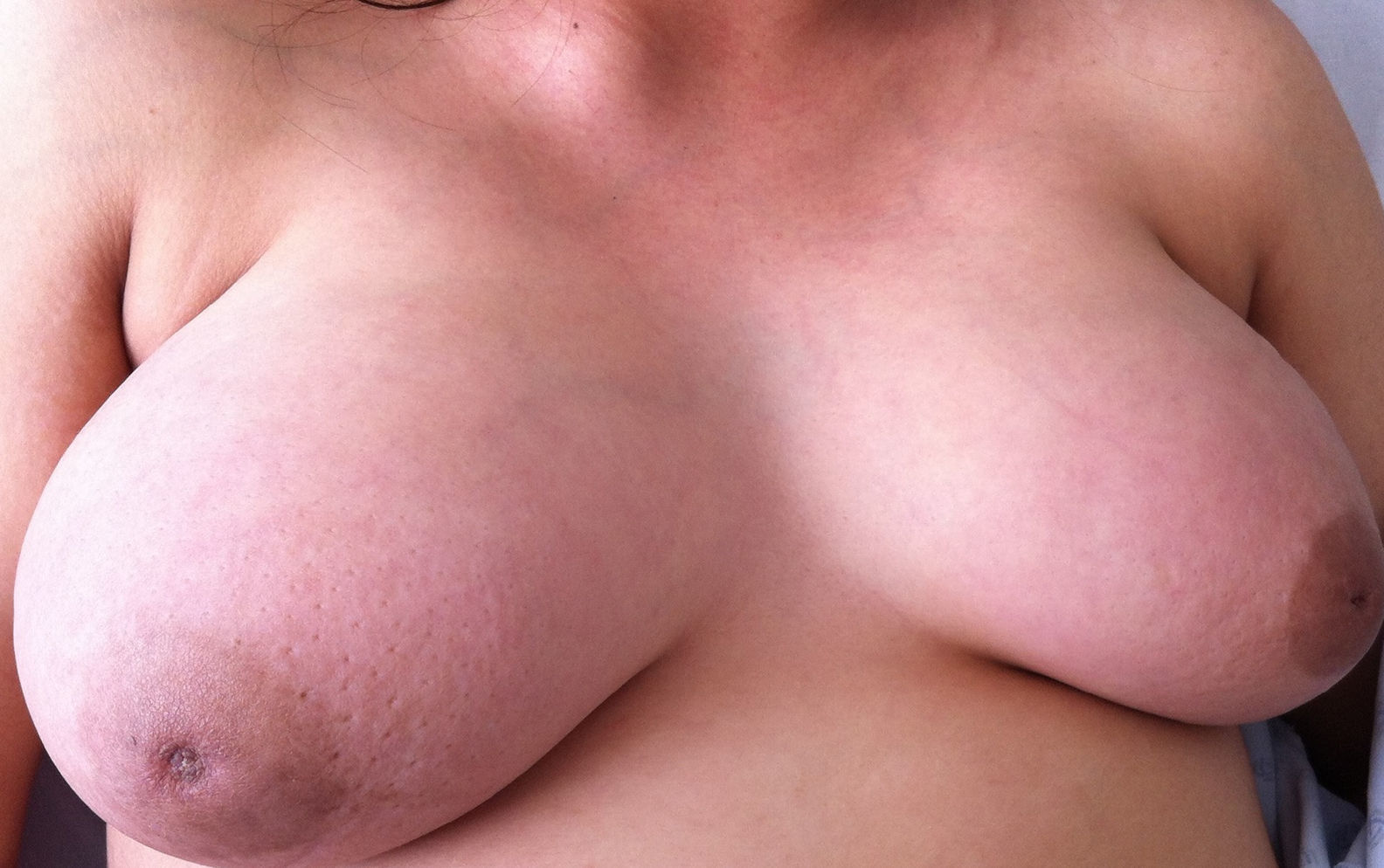
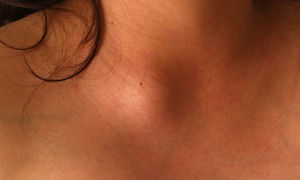
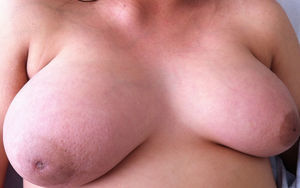
Caso clínicoPaciente de 26 años de edad quien inicia 3meses antes de su internamiento con astenia, adinamia, hiporexia y ataque al estado general, con disminución de 8kg de peso en 2meses, con diaforesis profusa nocturna y con aparición de lesión nodular supraclavicular dolorosa (fig. 1), Acude a valoración por agregarse dolor ardoroso en tórax y mamas, con predominio en mama izquierda y que se irradia a región axilar y dorsal, con intensidad 10/10 y aumento unilateral del volumen mamario (fig. 2). Es valorada por un médico externo, quien realiza biometría hemática con pancitopenia, por lo cual es enviada a tercer nivel. Se interna en la unidad de cuidados críticos obstétricos con diagnóstico de embarazo de 18 semanas por ultrasonido y pancitopenia en estudio. Se realiza ultrasonido obstétrico por parte del servicio de materno fetal, reportando embarazo de 20.2 semanas de gestación, con peso de 373g, líquido amniótico 3.2cc (oligohidramnios) y placenta fúndica posterior grado1. El servicio de hematología realiza panel viral e inmunológico, el cual se reporta negativo para hepatitisA y B, citomegalovirus, tétanos y herpes.
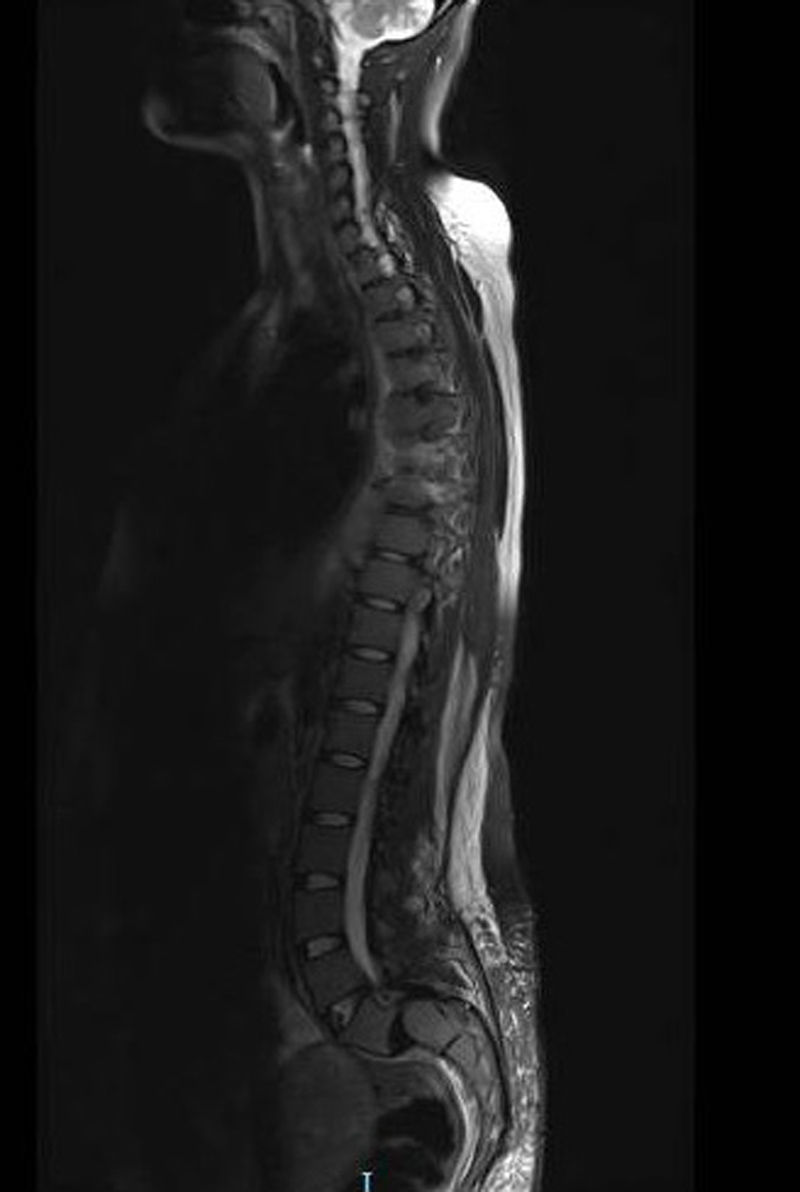
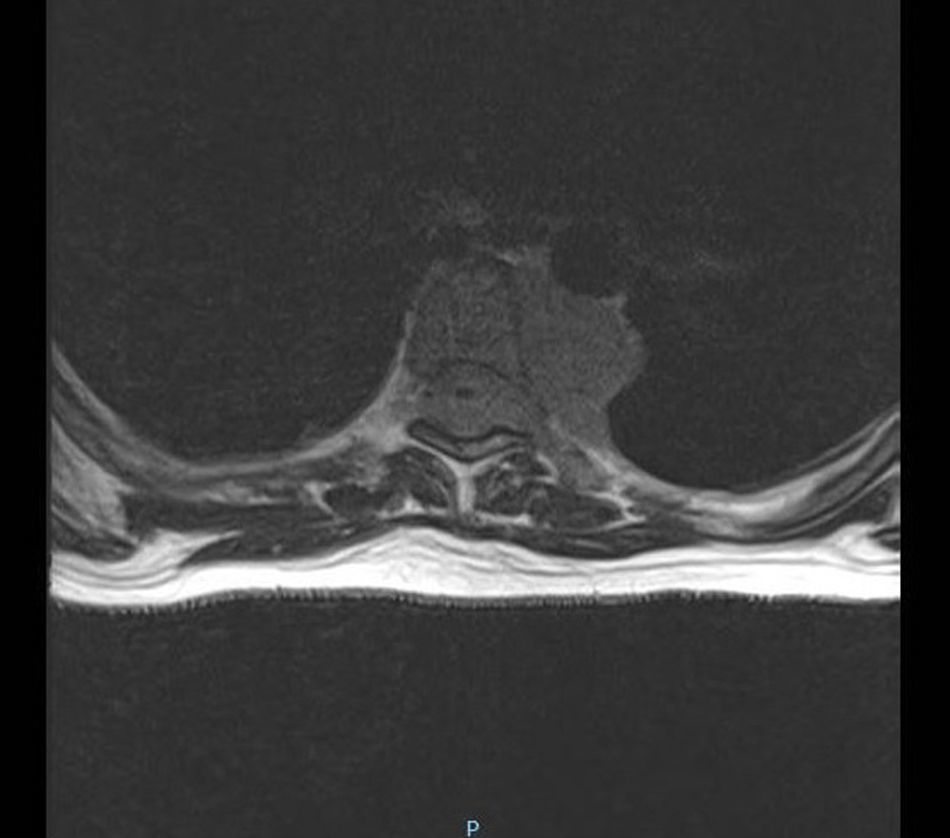
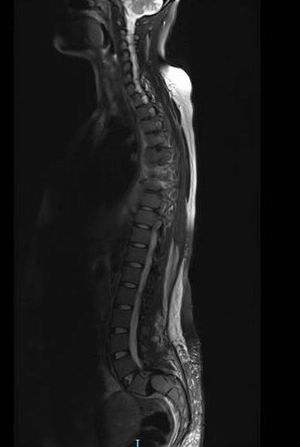
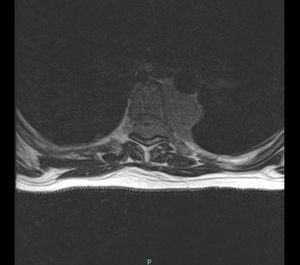
Se inicia tratamiento con transfusión de hemocomponentes seriada y filgastrim. Las mamas son valoradas por el servicio de oncología con ultrasonido, que reporta ambas mamas con tejido glandular abundante y cambios leves por condición fibroquística bilateral; se observan adenomegalias de tipo inflamatorio en la región axilar bilateral, con datos de probable celulitis en el cuadrante interno de la mama izquierda, y se cataloga como un BIRADS3. Se realiza biopsia de hueso, que reporta médula ósea normocelular y sin megacariocitos, con infiltración masiva por mielomonoblastos tipo M4 y depresión severa del resto de las series; la imagen corresponde a leucemia aguda tipo mielomonoblástica tipo 4. Se considera que las lesiones en mama son causadas por infiltración de células mielomonoblásticas, sin descartar proceso infeccioso agregado. Se presenta el caso en el comité de materno fetal, con la conclusión de inducir el parto ya que el pronóstico es pobre para el producto. El procedimiento de inducto-conducción se inicia con análogos de prostaglandinas, resolviéndose por parto vaginal con revisión instrumentada de cavidad por retención de restos. Se inicia fase de inducción de quimioterapia. Durante el internamiento presenta déficit neurológico, caracterizado por pérdida progresiva de sensibilidad y movilidad de las extremidades inferiores, que concluye en paraplejía con déficit sensitivo desde T4 e incontinencia urinaria. Se le realiza velocidades de conducción, con estudio electrofisiológico anormal; las alteraciones encontradas son indicativas de bloqueo de la conducción de cordones posteriores distales a T3 con compromiso de segmentos proximales por ausencia de ondas derechas, así como disminución en la frecuencia de provocación al estímulo izquierdo. Se realiza punción lumbar, la cual descarta infiltración por leucemia aguda mieloide a sistema nervioso central. Se realiza resonancia magnética de urgencia (fig. 3) con lesiones medulares localizadas en ambas regiones paravertebrales, cuyo comportamiento es isointenso al cordón espinal en secuencia T1, T2 y STR, todas en situación extramedular en el lado izquierdo de D4 hasta D6, invadiendo forámenes neurales y ejerciendo efecto de masa con desplazamiento y compresión de la médula espinal en sentido contralateral, así como intenso edema de cordón espinal; lesiones similares en D6 y D8 de la región paravertebral derecha (fig. 4). D8 y D9 de la región paravertebral izquierda se extienden en sentido ventral para fusionarse en una masa tumoral única que se sitúa en la superficie ventral de los cuerpos vertebrales de D6 a D9, con posibilidad diagnóstica de schwannoma o neurofibroma. Se programa para biopsia de lesión tumoral, la cual debe diferirse por fiebre y coagulopatía, por lo que se inicia transfusión de hemocomponentes. A los 2días la paciente presenta evento cerebral vascular probablemente isquémico, que requiere manejo avanzado de la vía aérea. Veinticuatro horas después presenta paro cardiorrespiratorio que no cede a maniobras avanzadas de resucitación, declarándose defunción.
DiscusiónLa leucemia mieloblástica aguda representa el 3.2% de todos los cánceres en el embarazo5.
Se caracteriza por un rápido crecimiento de células leucémicas inmaduras y expresión de antígenos6. Es un raro y funesto hallazgo, y su diagnóstico en el embarazo es difícil, ya que el hallazgo de anemia y trombocitopenia son comunes, pueden ser multifactoriales y requieren una sospecha mayor, muchas veces iniciada por recuento anormal eritrocitario o cambios formes en los componentes sanguíneos; la aparición de neutropenia es más rara durante el embarazo. Este hallazgo, o la aparición de pancitopenia causada por la sustitución de la médula ósea por células leucémicas, muchas veces son la causa de un estudio más profundo2,4. Cuando las células leucémicas invaden la médula ósea pueden llegar al torrente sanguíneo y propagarse a otros lugares del organismo. Las manifestaciones cutáneas de la leucemia pueden ser simultáneas hasta en un 38% al diagnóstico hematológico, y un 57% son posteriores a este7,8. Pueden manifestarse como una masa tumoral extramedular compuesta por células inmaduras de series mieloides, conocida como sarcoma granulocítico (mieloblastoma, tumor mieloide extramedular, cloroma o sarcoma monocítico) asociado en un 2 a 8% a los subtipos de M0 a M58-11. La infiltración del parénquima mamario por células leucémicas es muy rara, y puede encontrarse en 3 situaciones: al inicio de la enfermedad, durante la recaída y en pacientes que han recibido radioterapia11,12. En algunas pacientes con involucramiento del sistema nervioso central pueden encontrase masas dependientes de la duramadre, y en aquellos con actividad leucémica, grandes zonas de infiltración leucémica a la médula ósea11, razón por la cual a nuestra paciente se le realizó estudio de líquido cefalorraquídeo para descartar afectación a este nivel. El pronóstico de la paciente con el hallazgo de involucro a nivel linfático y mamario es malo, y la sobrevida promedio reportada en la literatura a 2años es del 6% (figs. 1 y 2)11. Los criterios diagnósticos son los mismos tanto en el embarazo como en las mujeres no gestantes. Estos están definidos por la clasificación de neoplasias mieloides de la OMS13. Cuando el diagnóstico de leucemia es sospechado, se deben realizar un análisis de sangre periférica y una biopsia de médula ósea que incluya morfología (más del 20% de blastos) y realizar estudios citogenéticos, inmunofenotípicos, inmunohistoquímicos y estudios de biología molecular para permitir la tipificación y las características del pronóstico4,13. Desde los años setenta las leucemias mieloides pueden subdividirse de acuerdo a la clasificación francesa-americana-británica (FAB) de la leucemia mieloide aguda, que divide las leucemias en subtipos del M0 al M7 según el tipo de célula de la cual se ha desarrollado y según cuán maduras sean las células. Esto se basa principalmente en la apariencia de las células leucémicas en el microscopio después de una tinción de rutina (los subtipos del M0 al M5 comienzan en formas inmaduras de glóbulos blancos, la M6 en formas muy inmaduras de glóbulos rojos, y el M7 se inicia en formas inmaduras de células que producen plaquetas) (tabla 1). Cuando la leucemia coincide con el embarazo, hay un aumento de la incidencia de aborto espontáneo, muerte fetal intrauterina, retardo del crecimiento intrauterino, trabajo de parto prematuro, nacimiento prematuro y lactantes de bajo peso al nacer4,7,14. Sumado a esto, el uso de quimioterapia puede causar defectos en el desarrollo fetal, dependiendo de la etapa en la cual se administre. En el caso de nuestra paciente coincide con el periodo fetal (8-38 semanas de gestación), en el cual el crecimiento y la diferenciación del tracto gastrointestinal y renal, así como de la corteza cerebral, continúan siendo susceptibles a la toxicidad inducida por quimioterapia, por lo cual la quimioterapia se asocia a abortos, muerte fetal y malformaciones congénitas hasta en un 20%15,16. Debido a este impacto desfavorable en el pronóstico fetal y a las complicaciones asociadas al tratamiento en embarazos tempranos, es razonable considerar la interrupción electiva del embarazo cuando el diagnóstico se hace en el primer trimestre (nivel de evidencia 2C). Es preferible la inducción farmacología del aborto para tener un control más estrecho del estado plaquetario y de la coagulación en condiciones electivas, lo cual no puede ser valorado en abortos de libre evolución. E incluso si hay un estrecho control de la hemostasia, puede lograrse la terminación por medio de intervención quirúrgica4. En resumen, cuando el diagnóstico se realiza en el primer trimestre la paciente debe ser aconsejada y advertida para considerar la terminación del embarazo. En el segundo y tercer trimestre la inducción de quimioterapia con daunorubicina y citarabina puede ser introducida con regular conservación del desarrollo de anormalidades congénitas y monitorización de la función cardiaca fetal16. El tratamiento de la leucemia mieloide aguda está divida en fase de inducción y fase de posremisión (consolidación). El objetivo de la quimioterapia de inducción es producir una reducción importante en la carga leucémica y restaurar la hematopoyesis normal, en pacientes menores de 60años (como en nuestro caso) el régimen está basado en daunorubicina y citarabina17. En el caso presentado nuestra paciente también recibió filgastrim, por la presencia de neutropenia febril, y hemoconcentrados seriados para corregir la coagulopatía secundaria. Sin embargo, debido al estadio avanzado de la enfermedad, la afectación multisistémica y su evolución rápida tuvimos un mal pronóstico a pesar de la atención pronta y multidisciplinaria.
Clasificación francesa-americana-británica (FAB) de la leucemia mieloide aguda
| Subtipo FAB | Nombre |
|---|---|
| M0 | Leucemia mieloblástica aguda indiferenciada |
| M1 | Leucemia mieloblástica aguda con maduración mínima |
| M2 | Leucemia mieloblástica aguda con maduración |
| M3 | Leucemia promielocítica aguda |
| M4 eos | Leucemia mieloblástica aguda con eosinofilia |
| M5 | Leucemia monolítica aguda |
| M6 | Leucemia eritroide aguda |
| M7 | Leucemia megacarioblástica aguda |
Los autores declaran no tener ningún conflicto de intereses.