Introducción: Antes de la llegada de los factores estimulantes de colonias de granulocitos (FEC-G) era común que al administrar esquemas mielosupresores, se presentara un efecto adverso temible: la neutropenia. Por ello, al tratar una neoplasia tan importante como el cáncer de mama, con esquemas a base de taxanos y antraciclinas, se hizo imperativo el uso de fármacos que eviten o disminuyan su severidad.
Objetivo: Observar el beneficio obtenido con pegfilgrastim como profilaxis primaria, en pacientes con cáncer de mama bajo tratamiento con esquemas potencialmente neutropénicos, conociendo el impacto y la frecuencia con que se presenta la neutropenia a lo largo del tratamiento.
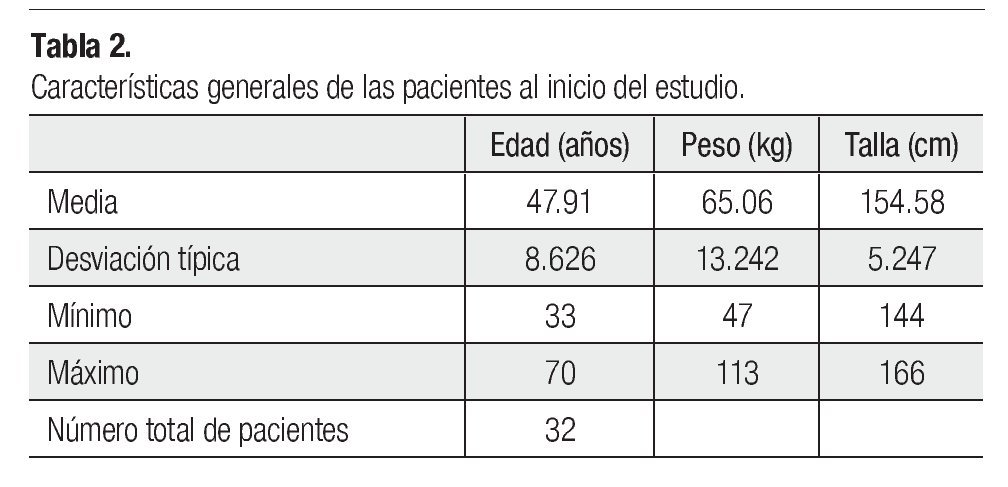
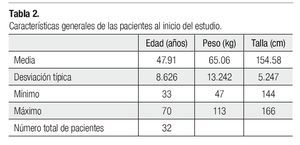
Métodos: Se incluyeron 32 pacientes del Hospital ISSSTEP con diagnóstico histopatológico de cáncer de mama, con rango de edad entre 33 y 70 años. Ingresaron pacientes candidatas a cualquiera de los siguientes esquemas: docetaxel 100 mg/m2, docetaxel 75 mg/m2 o 100 mg/m2 combinado con doxorrubicina 50 mg/m2, doxorrubicina 50 mg/m2 con ciclofosfamida 500 mg/ m2 y fluorouracilo 500 mg/m2, doxorrubicina 60 mg/m2 combinada con ciclofosfamida 600 mg/m2 y que mínimo recibieran cuatro ciclos de quimioterapia, tuvieran ECOG 0-2 y una expectativa de vida mayor a tres meses. Se evaluó la biometría hemática de cada paciente a los siete y 21 días.
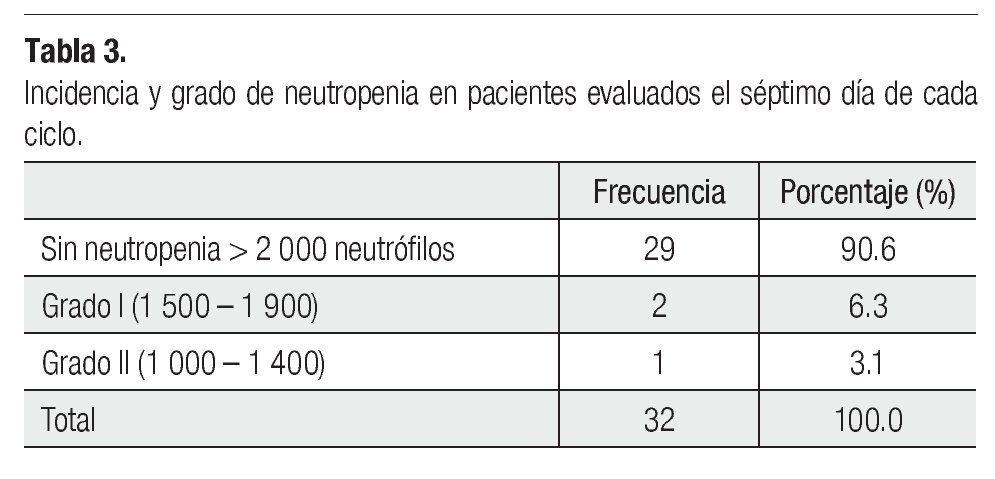
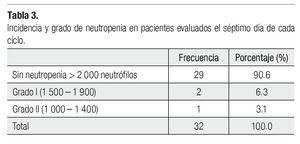
Resultados: Sólo ocurrieron tres casos de neutropenia (dos grado I y una grado II), ningún paciente cursó con neutropenia febril o fue hospitalizado por infección.
Conclusión: El uso de pegfilgrastim disminuye el riesgo de sufrir neutropenia y sus complicaciones, cuando ésta se presenta, reduce su severidad.
Introduction: Prior to the arrival of colony stimulating factors it was frequent that by administering myelosuppressing regimes a terrible adverse effect would appear: that is neutropenia. Therefore, when treating such an important neoplasia as is breast cancer with agents like taxanes and anthracyclines, the use of these factors becomes imperative to avoid neutropenia or diminish its severity.
Objective: To observe the benefit attained with pegfilgrastim as primary prophylaxis in patients with breast cancer treated with potentially neutropenic regimes and to recognize its impact on the frequency and severity of neutropenia during treatment.
Methods: Thirty-two patients were included from the Hospital ISSSTEP with patological diagnosis of breast cancer, and ages ranging from 33 to 70 years. Patients received the following schemes: docetaxel 100 mg/m2, docetaxel 75 mg/m2 or 100 mg/m2 combined with doxorubicin 50 mg/m2, doxorubicin 50 mg/m2 with cyclophosphamide 500 mg/m2 and fluorouracil 500mg/m2, doxorubicin 60 mg/m2 combined with cyclophosphamide 600 mg/m2 . They received at least four chemotherapy cycles, had ECOG 0 - 2 and a life expectancy higher than 3 months. We requested blood tests on day 7th and 21st.
Results: Only three cases of neutropenia were present (two cases of grade I neutropenia and one case grade II). No patient was hospitalized during the treatment due to infection or had febrile neutropenia.
Conclusion: The use of pegfilgrastim decreases the risk of neutropenia and its complications.
¿ INTRODUCCIÓN
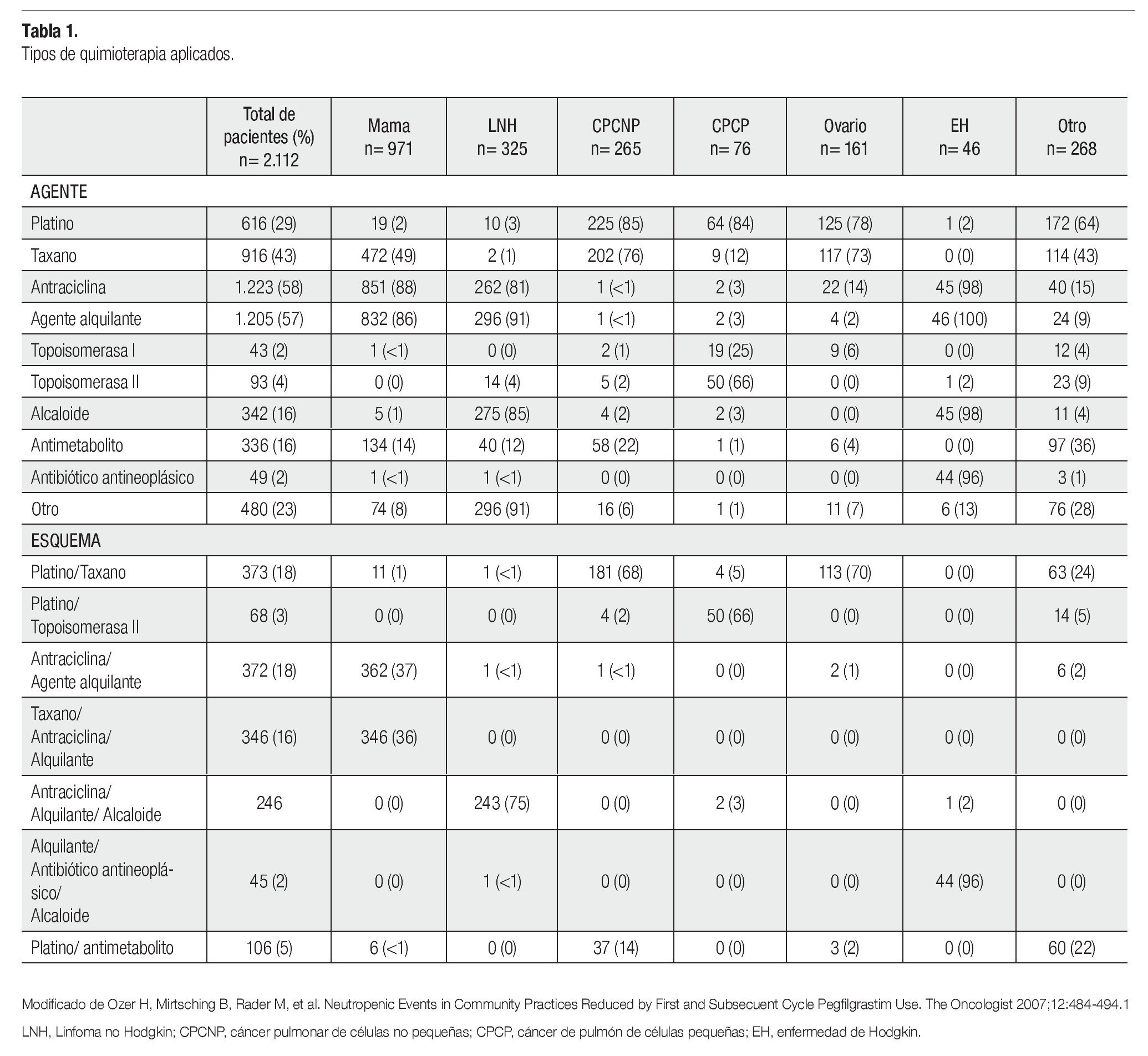
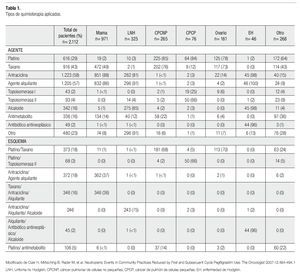
Existen esquemas de quimioterapia para el tratamiento de cáncer de mama, que resultan mielosupresores y cuyo empleo conlleva a un efecto adverso muy común, la neutropenia. Entre los fármacos que conforman dichos esquemas y que son utilizados de manera cotidiana, contamos con las antraciclinas como base, y taxanos como monodroga, en especial el docetaxel (Tabla 1).1
Actualmente para combatir dicho efecto adverso (neutropenia), se cuenta con un factor estimulante de colonias de granulocitos (FEC-G) pegilado, conocido como pegfilgrastim. Su uso puede revertir esta neutropenia a través de una reducción en la severidad de la misma, o incluso evitar su aparición a lo largo del tratamiento de la quimioterapia, si es usado como profilaxis primaria, como se mostrará más adelante.
El fármaco predecesor del pegfilgrastim es el filgrastim, el cual surgió hace más de una década. Una de las más importantes funciones de este FEC-G recombinante humano, es la promoción del desarrollo de neutrófilos, cuando ejerce su acción sobre células progenitoras de colonias formadoras de granulocitos en la medula ósea. El pegfilgrastim funciona como ligando del receptor de factor de crecimiento, ubicado en la superficie de células hematopoyéticas progenitoras.2
Se debe mencionar que el filgrastim es una proteína que es producida por E. coli recombinante,3 la cual no se encuentra pegilada, haciendo la pequeña gran diferencia con el pegfilgrastim. Se destaca entonces la gran importancia que tienen las moléculas PEG, las cuales protegen a la proteína recombinante de su degradación enzimática. Además, la inyección subcutánea de los conjugados PEG de alto peso molecular es absorbida de manera lenta. Las moléculas PEG a su vez retardan la depuración renal del FEC-G,4 lo cual trae como consecuencia, niveles altos del fármaco que son conservados justo en el momento que se requiere, es decir, durante la neutropenia. Otro beneficio que se rescata de este mismo fármaco, es que una vez recuperado el nivel de neutrófilos y el fármaco ha cumplido su función, la concentración del mismo ya se ha reducido.
El pegfilgrastim a comparación del filgrastim, tiene una vida media prolongada y esto es gracias a la pegilación. De hecho, algunos autores han denominado este fármaco como la promesa cumplida de la pegilación,5 debido a que permite su administración en dosis única.
Tanto el filgrastim como el pegfilgrastim son aplicados en el intervalo posquimioterápico por vía subcutánea, aunque en diferente manera, ya que el primero requiere de una administración diaria durante once días, mientras que el segundo requiere de una administración única. De cualquier manera ambos se administran para cumplir dos objetivos: 1) superar el nadir neutropénico y 2) lograr recuperar la cifra de neutrófilos.6
Muchas pacientes se benefician con el uso del FEC-G, así lo demuestra el estudio llevado por Green y colaboradores en 2003, quienes realizaron un estudio aleatorizado, doble ciego, multicéntrico en pacientes con cáncer de mama, aplicándoles el siguiente esquema: doxorrubicina (60 mg/m2) y docetaxel (75 mg/m2) cada tres semanas, durante cuatro ciclos, con un seguimiento ya sea de una dosis única subcutánea de 6 mg de pegfilgrastim a las 24 horas de la aplicación de quimioterapia, en cada uno de los ciclos, o de una dosis diaria de 5 mg/ Kg vía subcutánea de filgrastim (11 inyecciones por ciclo).
El uso de este esquema de quimioterapia, sin el apoyo de FEC- G, generalmente causa en promedio cuatro días de neutropenia severa (grado IV), pero este estudio mostró que la duración promedio de neutropenia grado IV fue de 1.8 y 1.6 días, para los grupos que recibieron pegfilgrastim y filgrastim, respectivamente. Este estudio a su vez muestra que el pegfilgrastim tiene una eficacia equiparable al filgrastim. También el pegfilgrastim demostró una menor incidencia de neutropenia febril, durante el tratamiento completo en comparación con filgrastim (13% vs 20%).7
El otro estudio clínico de relevancia es el realizado por Holmes y colaboradores, quienes iniciaron un estudio multicéntrico utilizando el mismo esquema (doxorrubicina combinado con docetaxel) y administrando tras éste, filgrastim o pegfilgrastim, con la peculiaridad de haber calculado la dosis de pegfilgrastim a 100 µg/Kg, a diferencia de la dosis estándar usada por Green de 6 mg. Este estudio destacó que la aplicación única de pegfilgrastim tuvo la misma eficacia, que un promedio de 11 dosis de filgrastim. Además se encontró una importante diferencia, entre la duración de la neutropenia grado IV durante los ciclos dos a cuatro (0.7, 0.6 y 0.9 para pegfilgrastim, y 1.1, 1.2 y 1.3 días para filgrastim) y sólo el 9% de los pacientes, que recibieron pegfilgrastim presentaron neutropenia febril en comparación con el 18% del brazo, que recibió filgrastim.8
También debemos destacar la relevancia, que tienen las indicaciones del pegfilgrastim en pacientes con cáncer de mama, debido a que este fármaco puede ser aplicado como profilaxis primaria, cuando la administración del FEC-G se realiza a partir del segundo día de cada ciclo de quimioterapia, desde el primero y durante todos los ciclos de tratamiento, y como profilaxis secundaria cuando el uso de FEC se administra para todos los ciclos subsecuentes de quimioterapia, después de un evento de neutropenia febril.9
De manera resumida, se enfatiza que el beneficio clínico es observado cuando se utiliza alguno de los FEC-G, ya sea filgrastim o pegfilgrastim, pues ambos tienen una eficacia semejante, reduciendo el tiempo de duración de la neutropenia grado IV y disminuyendo el riesgo de sufrir neutropenia entre ciclos. Igualmente, cuando ocurre un episodio de neutropenia febril es menos probable que se presente cuando se administra pegfilgrastim que filgrastim.
Algunos autores han cuestionado el intervalo de 24 horas, para la aplicación de pegfilgrastim como profilaxis primaria. Incluso Kaufman y colaboradores realizaron un estudio fase II, en el cual evalúan la administración de pegfilgrastim, el mismo día de la quimioterapia, con el esquema taxano ciclofosfamida y a las 24 horas de su aplicación, en pacientes con cáncer de mama en etapas tempranas y avanzadas. Este estudio revalida la importancia de la ventana de 24 horas, entre la aplicación de la quimioterapia y el pegfilgrastim. La aplicación simultánea de la quimioterapia y el pegfilgrastim demostró una disminución de la eficacia para reducir la duración de la neutropenia severa, asociándose con un mayor porcentaje de eventos de neutropenia febril (10% vs 3% durante el primer ciclo, 15% vs 5% durante todo el tratamiento).10
Balducci apoya la profilaxis primaria, describiéndola como una acción proactiva en contraste con el uso reactivo (profilaxis secundaria) de FEC-G, en respuesta a neutropenia severa.11
¿ MÉTODOS
Actualmente, el pegfilgrastim se está utilizando como herramienta en la profilaxis primaria de neutropenia inducida por quimioterapia, principalmente utilizando esquemas específicos para cáncer de mama -la neoplasia más frecuente en mujeres-, tales como: docetaxel monodroga, docetaxel combinado con doxorrubicina, doxorrubicina con ciclofosfamida y fluorouracilo y doxorrubicina combinada con ciclofosfamida. Teniendo en cuenta que dichos esquemas son mielosupresores, y sabiendo que provocan neutropenia, se decidió realizar un estudio clínico fase II para determinar la eficacia del pegfilgrastim. Se trata de un estudio prospectivo, abierto, no aleatorizado, de acceso expandido de pegfilgrastim, en pacientes con cáncer de mama que reciben quimioterapia a base de taxanos y antraciclinas.
Se consideró neutropenia, el hallar una cuenta de neutrófilos por debajo de 2 000 células/mm3. Los grados de neutropenia se clasificaron en base a los datos ofrecidos por la Escala Modificada de Toxicidad Común NCI (O5 DIC 95), la cual señala los siguientes grados:
- Grado 0, neutrófilos mayor de 2 000 células/mm3.
- Grado I, neutrófilos entre 1 900 - 1 500 células/mm3.
- Grado II, neutrófilos entre 1 400 - 1 000 células/mm3.
- Grado III, neutrófilos entre 900 - 500 células/mm3.
- Grado IV, neutrófilos menor a 500 células/mm3.
La fuente de donde se obtuvieron las pacientes incluidas, fue el Instituto de Seguridad y Servicio Social para los Trabajadores del Estado de Puebla (ISSSTEP), el cual cuenta con una Unidad de Oncología, que ingresó a 32 pacientes de acuerdo a los siguientes criterios:
Pacientes con el diagnóstico histopatológico de cáncer de mama, candidatas a cualquiera de los siguientes esquemas:
- Docetaxel monodroga a la dosis de 100 mg/m2.
- Docetaxel 75 mg/m2 o 100 mg/m2 combinado con doxorrubicina 50 mg/m2.
- Doxorrubicina 50 mg/m2 con ciclofosfamida 500 mg/ m2 y fluorouracilo 500 mg/m2.
- Doxorrubicina 60 mg/m2 combinada con ciclofosfamida 600 mg/m2.
Para quienes se tenía planeado un mínimo de cuatro ciclos de quimioterapia, con un ECOG 0-2 y una expectativa de vida mayor de tres meses. La edad límite fue entre 18 y 70 años. Debían tener una buena función medular, hepática y renal.
Fueron excluidas pacientes que hubieran recibido previamente FEC-G 21 días previos a su ingreso, aplasia medular, con proceso infeccioso activo o estar tomando antibióticos siete días antes del inicio del tratamiento y que presentaran alguna comorbilidad en descontrol, como diabetes mellitus, hipertensión arterial, entre otros. Así, como aquellas pacientes que hubieran recibido radioterapia en dos o tres de los siguientes sitios anatómicos: pelvis, tórax y huesos largos.
Hay que recalcar, que todas las pacientes al momento de su ingreso firmaron el consentimiento informado, tenían un excelente estado general, medido por el grado de desempeño ECOG 0-2, sin alteración alguna en la función medular, hepática y renal.
Este estudio nos permitió evaluar la biometría hemática, a los siete días de aplicado el tratamiento y a los 21 días, en pacientes con cáncer de mama que utilizan esquemas tipo FAC (fluorouracilo, doxorrubicina y ciclofosfamida) O FEC (fluorouracilo, epirrubicina y ciclofosfamida) y docetaxel a dosis mayores de 75 mg/m2 cada 21 días. Esto con la finalidad de conocer el grado de protección ofrecida por este medicamento.
La descripción de las pacientes se resume en la Tabla 2.
El esquema de tratamiento más usado fue doxorrubicina y ciclofosfamida en un total de 12 casos, seguido por docetaxel monodroga con 10 casos. El esquema menos utilizado fue docetaxel combinado con doxorrubicina, el cual se utilizó en dos de los casos. El número de ciclos administrados a cada paciente fue el siguiente: a 18 pacientes se aplicaron cuatro ciclos de quimioterapia y a 13 pacientes se le administraron un total de seis ciclos. Solamente a una paciente se le aplicó cinco ciclos de tratamiento.
¿ RESULTADOS
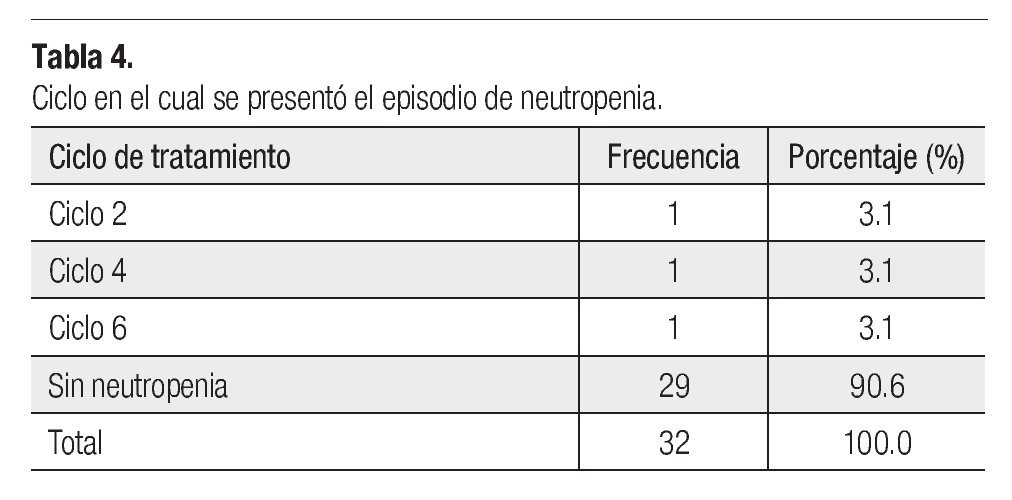
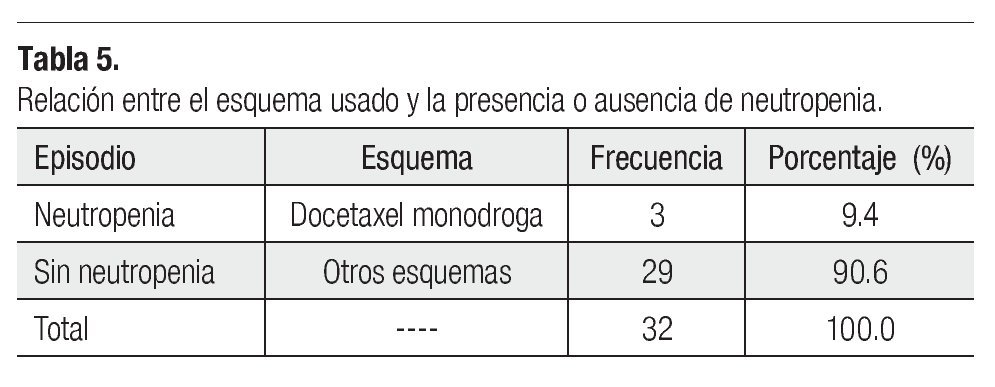
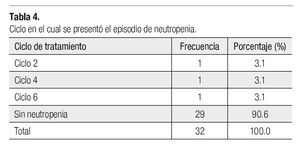
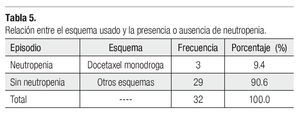
Es importante mencionar que todas las pacientes recibieron más de cuatro ciclos y se les administró pegfilgrastim desde el primero, esto tuvo un gran impacto en la neutropenia, pues sólo tuvimos tres casos de ésta evaluada en los días siete y 21 (Tabla 3), siendo grado I o II. Dichas neutropenias no ocurrieron en el primer ciclo, sino en los subsecuentes (Tabla 4). Ninguna de las pacientes cursó con neutropenia febril, ni fue hospitalizada por presentar algún proceso infeccioso. La relación entre esquema y presencia de neutropenia se presenta la Tabla 5.
¿ DISCUSIÓN
Se debe tener en cuenta, que la mielosupresión es diferente según el agente antineoplásico utilizado, también es cierto que la combinación de antineoplásicos predispone más a sufrir un episodio de neutropenia severa, lo cual se hace aún más destacable, cuando se le compara con regímenes monodroga. Sin embargo, en este estudio la mayor incidencia de neutropenia ocurrió cuando se dio tratamiento con monoterapia a base de docetaxel. Es de resaltar, que aunque se dieron eventos de neutropenia, el 90% de las pacientes no cursó con dicho evento adverso y en los casos en los cuales ocurrió esta complicación, los episodios fueron de bajo grado gracias al uso de pegfilgrastim. Nadie cursó con neutropenia febril y no hubo necesidad de internar alguna paciente, por haber presentado una infección. A lo largo de este estudio, se pudo ver que la neutropenia se puede presentar en cualquier ciclo de quimioterapia, aún con el uso de pegfilgrastim como profilaxis primaria. También es rescatable comentar (aunque en nuestro estudio sólo se incluyeron individuos bajo administración de pegfilgrastim como profilaxis primaria), que aquellas pacientes que inicialmente no recibieron pegfilgrastim, pueden beneficiarse cuando este fármaco es utilizado como profilaxis secundaria.
Con este estudio se apoya el uso de pegfilgrastim como profilaxis primaria, ante el uso de esquemas que de antemano se conoce que causarán neutropenia. Podemos dejar de depender de medidas antes usadas, para favorecer la mejor tolerancia del paciente a su tratamiento, como lo eran la reducción de la dosis de fármacos o el aplazamiento en la aplicación de la quimioterapia, para esperar a que se recuperara la cuenta de neutrófilos.
Una de las principales limitaciones de este estudio recae en el número de la población muestra, probablemente se requiera una mayor cantidad de pacientes, para sacar conclusiones más concretas y aplicables a la población en general.
Un punto desfavorable que debemos señalar es el costo del pegfilgrastim, de esta forma el factor económico juega un papel muy importante ante las bondades ofrecidas por el uso de FEC-G pegilado, siendo quizá un obstáculo para poderse utilizar en muchas pacientes y evitarles un episodio de neutropenia.
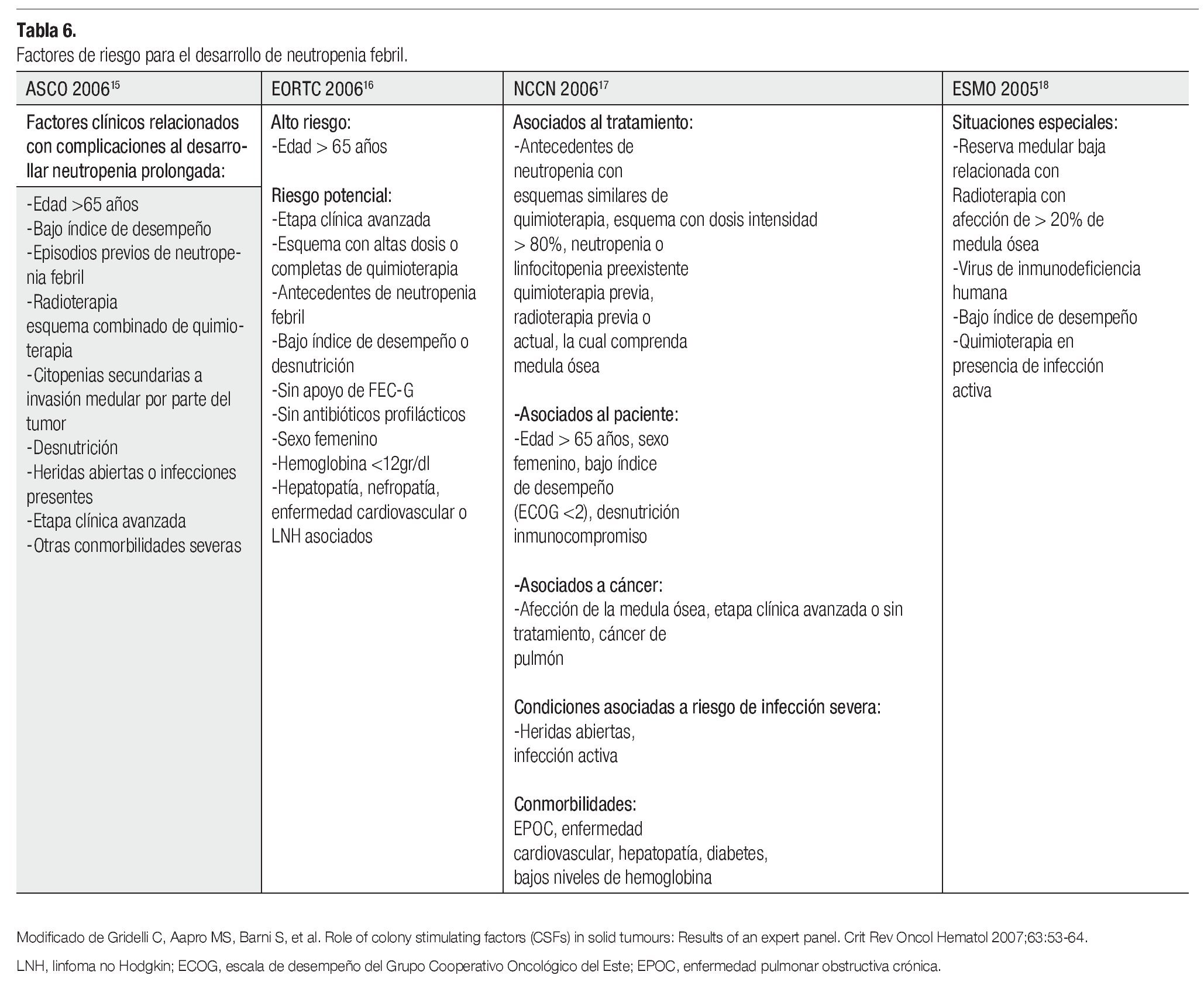
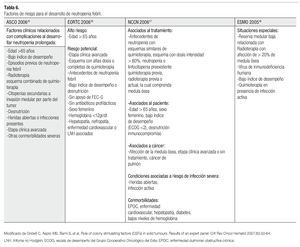
Hay que tomar en cuenta, que también existen factores de riesgo que predisponen a un paciente a desarrollar neutropenia febril, evento definido por la ASCO12 como: la presencia de una temperatura de 38.5°C o mayor, mantenida por más de una hora, que se desarrolla de manera concomitante con una neutropenia absoluta, reflejada por una cifra de menos de 500 células/ mm3. La Tabla 6 nos enseña como las diversas organizaciones mundiales reconocen las condiciones, que pueden predisponer a un evento de neutropenia. A partir de esto, podemos introducir la clasificación del riesgo de neutropenia febril, teniendo como antecedentes: en primer lugar, saber que se está utilizando un esquema mielotóxico y en segundo lugar, valorando los factores de riesgo que nuestro propio paciente presenta.
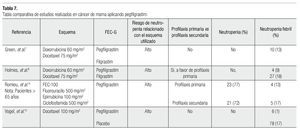
El riesgo de neutropenia febril se clasifica en tres niveles: bajo (menor al 10%), intermedio (10% a 20%) y alto (mayor de 20%). Vogel y colaboradores realizaron un estudio reciente fase III aleatorizado, doble ciego, controlado vs placebo, para determinar si las pacientes con un riesgo contemplado del 10% a 20% de neutropenia febril se verían beneficiados con el apoyo de pegfilgrastim.13
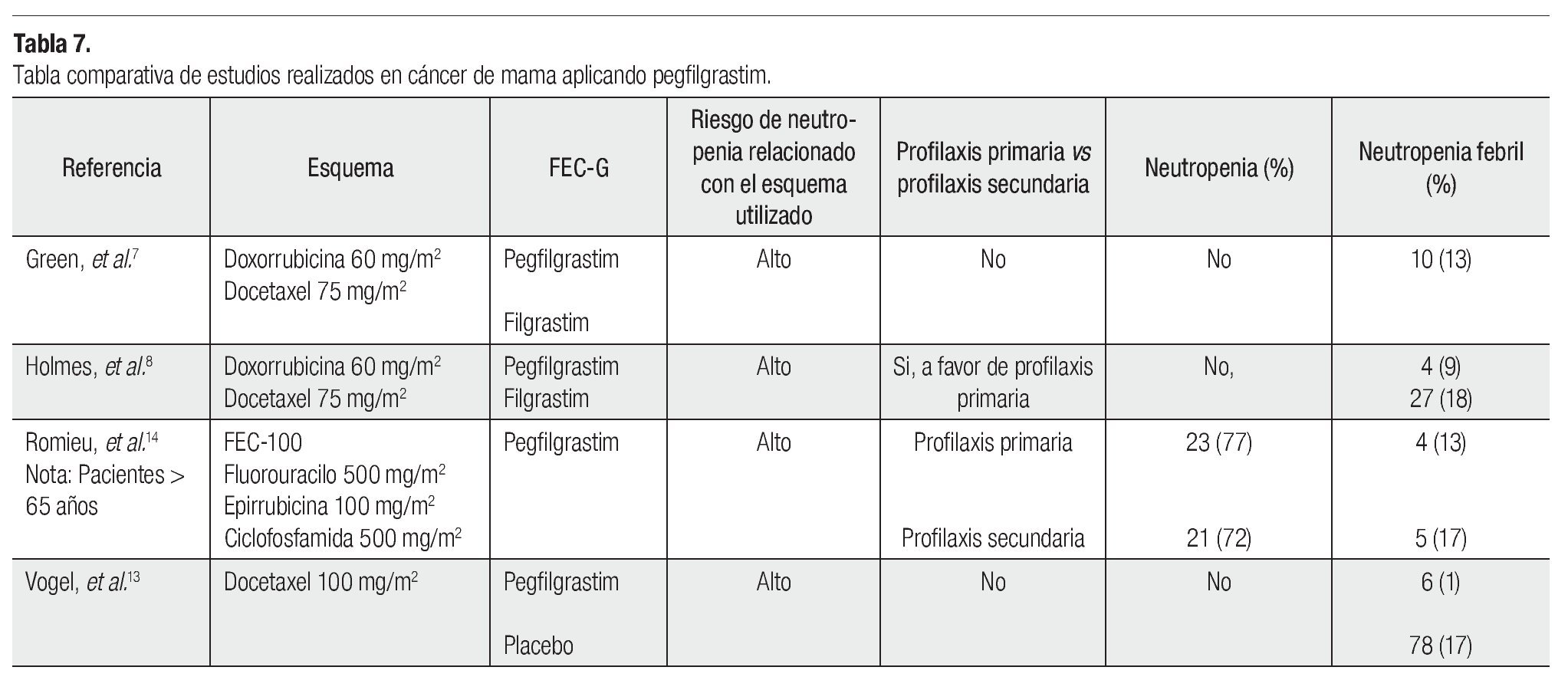
En este estudio, 928 pacientes recibieron docetaxel (100 mg/m2) tres semanas. Este ensayo amplió la percepción que teníamos sobre la aplicación de profilaxis primaria, en pacientes con todo tipo de riesgo, incluso en las de menor grado. Los resultados arrojados mostraron que aquellas pacientes que recibieron pegfilgrastim, en menor porcentaje desarrollaron neutropenia febril (1%) en comparación a pacientes que recibieron placebo (17%), asimismo esto se vio reflejado en la necesidad de hospitalizar a las pacientes, pues se dio un número menor de las mismas, en pacientes que recibieron pegfilgrastim (1% vs 14%). En definitiva, se vio que el uso de FEC-G otorga beneficio clínico evidente a pacientes con riesgo moderado de neutropenia febril. En la Tabla 7 se presenta la comparación de diversos estudios, en los cuales el tratamiento de cáncer de mama (con diferentes esquemas) se asoció a la administración de pegfilgrastim, mostrando el riesgo de neutropenia asociada al esquema, el tipo de profilaxis (FEC-G) que se aplicó y el beneficio obtenido ante la neutropenia y neutropenia febril.14
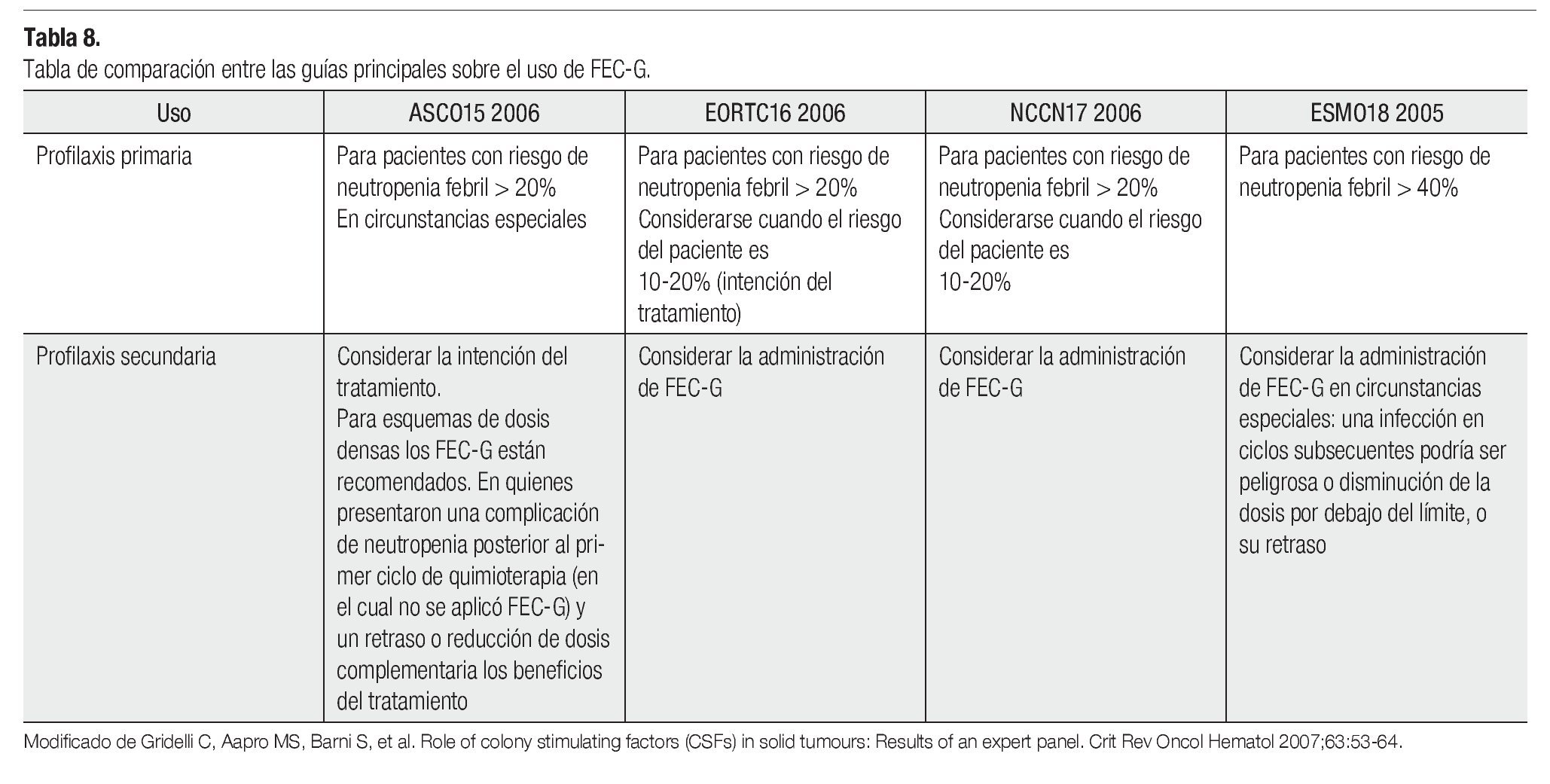
Finalmente es necesario enfatizar que la implementación del pegfilgrastim, tiene fundamentos y lineamientos que fueron creados para el óptimo uso del mismo. No sólo la gran diversidad de estudios realizados en el campo de los FEC-G han evidenciado los bioefectos de éstos, sino también los beneficios clínicos que aportan, al reducir el número y la gravedad de los eventos neutropénicos. La información proveniente de estos trabajos ha contribuido a la formación de guías, cuyo principal objetivo es hacer buen uso de esta herramienta farmacológica. La actualización y mejora de las mismas, conforme a nuevos datos son reveladas a la luz pública, ofreciendo a la comunidad médica una serie de conceptos vigentes, que ayudan a homogenizar y optimizar nuestra práctica diaria. Entre las guías más importantes se encuentran las expedidas por: la ASCO,15 la EORTC,16 la NCCN17 y la ESMO.18
Los tres pilares principales de estas guías para la consideración del empleo de FEC-G son:
1) Características del paciente, es decir, los factores de riesgo que presenta.
2) El tratamiento de quimioterapia recomendado. Se debe preferir el uso de esquemas, si están disponibles, con menor riesgo de neutropenia febril, que no necesiten el apoyo de FEC-G, siempre y cuando tengan la misma eficacia de un tratamiento con mayor mielotoxicidad.
3) La intención del tratamiento. Ya sea con fines curativos, extender la vida del paciente, control sintomático o paliativa.15
Es importante comentar que los ensayos que han comprobado la eficacia de la quimioterapia de dosis densa, las guías del ASCO recomiendan el uso de profilaxis primaria con FEC-G. Como reflexión se presenta la Tabla 8, la cual resume las guías principales del uso del FEC-G.
Una vez elegido el esquema y habiendo valorado los factores de riesgo inherentes al paciente, nos avocamos a deducir cuál podría ser el riesgo de neutropenia de dicho caso. Si obtenemos como resultado de lo anterior, un riesgo mayor al 20% para el desarrollo de neutropenia febril, entonces se requerirá la aplicación de profilaxis primaria. Dicha profilaxis se indica para casos, en los que la intención del tratamiento es curativa, con motivo de prolongar la sobrevida, la calidad de vida o para un manejo sintomático. En lo que se refiere a un tratamiento paliativo, la NCCN define que el uso del FEC-G es razonable, pero también se deben considerar otras alternativas como el uso de quimioterapia con menor mielotoxicidad o la disminución de dosis, entre otros.
Para pacientes que presentan un riesgo intermedio es buena opción, pero también debe tenerse en cuenta otro tratamiento con menor riesgo de toxicidad. Y finalmente en los pacientes con riesgo bajo, la profilaxis primaria no se recomienda, salvo en pacientes que por alguna causa se encuentren en riesgo de consecuencias severas a neutropenia febril.
Todas las guías coinciden en que la aplicación de FEC-G debe proporcionarse durante las primeras 24 a 72 horas posteriores a la quimioterapia, en el caso especial del pegfilgrastim, en las primeras 24 horas, ya sea de manera individualizada (100 µg/Kg) o en dosis estándar de 6 mg. La profilaxis secundaria con FEC-G debe considerarse en pacientes que en un inicio no cumplen con criterios para recibir profilaxis primaria, y sin embargo presentaron algún evento neutropénico durante su tratamiento.12
¿ CONCLUSIÓN
El cáncer de mama es una de las neoplasias malignas más estudiadas a nivel mundial. El espectro de esquemas utilizado para tratarla es muy diverso, por lo que se debe conocer, comprender y reflexionar que no todos los esquemas de tratamiento representan un riesgo potencial para generar eventos neutropénicos. Para muchos pacientes, el uso de FEC-G principalmente como profilaxis primaria posee un gran valor para tolerar de manera adecuada la quimioterapia, evitar complicaciones como la neutropenia o incluso si se llegara a presentar, que sea de menor grado. Así como también reducir el número de hospitalizaciones, como lo reflejamos en los resultados de nuestro estudio. Se resalta que en estos momentos, se tiene un mejor entendimiento del impacto que ejerce la neutropenia febril y su prevención en el tratamiento de los pacientes oncológicos.
Correspondencia: Dr. Eduardo Téllez Bernal.
Diagonal Díaz Ordaz # 3906, Col. Anzures. C.P. 72530. Puebla, Puebla.
Teléfono: 011 52 (222) 2 37 98 80. Fax: 011 52 (222) 2 44 67 06 o 2 44 15 31.
Correo electrónico: umoetb@yahoo.com