Introducción: Evaluar la supervivencia, tolerancia y toxicidad con radioterapia pélvica sola vs radioterapia y quimioterapia simultánea más braquiterapia (HDR vs LDR), en pacientes con cáncer cervicouterino (CCU).
Material y Métodos: Es un estudio retrospectivo, en el cual se incluyeron 118 pacientes candidatas a tratamiento radical con radioterapia, de marzo de 2005 a octubre de 2011. Se evaluó el beneficio de la terapia combinada. En todas las pacientes se ofreció braquiterapia de alta o baja tasa de dosis.
Resultados: La sobrevida global fue del 82%. No encontramos diferencia estadísticamente significativa entre terapia combinada vs radioterapia sola (p=0.952). La toxicidad es similar entre ambos grupos, no encontramos diferencia estadísticamente significativa en supervivencia entre HDR vs LDR.
Conclusiones: La quimiorradioterapia es un tratamiento bien tolerado en pacientes con carcinoma cervicouterino. La supervivencia libre de enfermedad fue mejor para el grupo sometido a terapia combinada.
Introduction: The purpose of this study was to clarify outcome for concurrent chemoradiation in cervix cancer and evaluate the survival in patients treated with brachytherapy.
Material and methods: This is a retrospective analysis of 118 patients treated with definitive chemoradiation or radiotherapy alone between march 2006 to 2011. All patients were treated with external beam radiation and brachytherapy and we analyze the survival between groups using a Kaplan Meier method.
Results: The overall survival was 82%. There was no significant difference between chemoradiation vs radiation alone for overall survival p=0.952, compared to HDR, low dose rate brachytherapy was similar in overall survival p=0.556. The complications were similar in both groups.
Conclusions: Chemoradiation is feasible and well tolerated in patients with cervix cancer. In our study we did not find differences in overall survival, the disease free survival was better for the combined treatment.
¿ INTRODUCCIÓN
Desde una perspectiva mundial, el cáncer cervicouterino (CCU) sigue siendo una de las principales causas de muerte, representa la tercera neoplasia más frecuente en mujeres, con un estimado de casos nuevos en 2008 de 529 000, llegando a causar la muerte en 275 000. De estas, el 88% ocurrieron en países en vías de desarrollo: África 53 000 casos, América Latina Caribe 31 400 casos y 159 800 casos en Asia.1 El panorama en nuestro país es muy variable, con una gran mayoría de casos que son diagnosticados en etapas localmente avanzadas, lo cual conlleva a utilizar tratamientos más agresivos. Aunado a esto, se conoce un comportamiento biológico neoplásico diferente por regiones. Berumen y colaboradores han reportado una mayor persistencia de variantes de virus del papiloma humano (HPV) 16, en mujeres jóvenes mexicanas, que parece tener un potencial más oncogénico comparado con el europeo. Esto coincide con una mayor incidencia de cáncer, en poblaciones infectadas por esta variante.2
El tratamiento tradicional del CCU ha sido la cirugía o la radioterapia, en ciertas situaciones la combinación de ambas. Para casos localmente avanzados en los cuales existe riesgo de enfermedad extrauterina (etapas IIB a IVA), la radioterapia es el tratamiento primordial. Sin embargo, el porcentaje de curación disminuye en etapas avanzadas y con tumores voluminosos.3
Otra estrategia ha sido la adición de quimioterapia concomitantemente a radioterapia, debido a que el cisplatino ha sido reportado como la droga más activa por su papel radiosensibilizador, han surgido una gran diversidad de estudios con la finalidad de probar estos resultados.4 Dos meta-análisis han confirmado el beneficio terapéutico de quimiorradioterapia, e incluso se describe como terapia estándar en casos localmente avanzados.5,6 Otros estudios aleatorizados han demostrado que la quimiorradioterapia simultánea, basada en cisplatino y 5-fluouracilo (5FU) mejora significativamente la sobrevida, aunado a una toxicidad baja de efectos adversos en pacientes con CCU localmente avanzado.7 Desde 1999 y 2000, cuatro estudios aleatorizados han examinado el papel de la quimiorradioterapia vs radioterapia sola, o hidroxiurea en el tratamiento de CCU localmente avanzado (etapas IB2-IVA). En cada uno de estos estudios, el tratamiento combinado consistió en la adición de cisplatino con o sin 5FU y fue comparado con radioterapia sola con o sin hidroxiurea. Los resultados de estos estudios son consistentes para un beneficio en el grupo combinado, se demostró un riesgo relativo de muerte de 0.54 a 0.74 para los grupos de quimioradioterapia, comparado con radioterapia sola.8-10 Recientemente, un estudio ha demostrado que la combinación de quimiorradioterapia pélvica 45Gy más cisplatino, y cuatro fracciones de 6G y de braquiterapia de alta tasa de dosis (HDR), representa un esquema efectivo y tolerable para pacientes en etapas IB2 y II.11 Los resultados comparativos entre braquiterapia de baja y alta tasa de dosis son similares en etapas I y II, aunque una revisión reciente, reporta un menor control local y menor periodo libre de enfermedad en etapas III tratadas con HDR. Ahora bien, la probabilidad a cinco años de complicaciones intestinales y urinarias fue similar entre ambas terapias, mientras que las complicaciones rectales fueron mayores en el grupo sometido a baja tasa de dosis (LDR).12 Otro estudio demostró resultados similares en sobrevida global, sobrevida libre de recurrencia y control pélvico a tres años entre LDR y HDR en etapas IIB y IIIB, siendo las fallas a distancia el principal problema, sugiriendo a la quimioterapia como estándar para evitar esta situación.13 En este estudio, analizaremos los resultados obtenidos en pacientes sometidas a quimiorradioterapia vs radioterapia sola más braquiterapia LDR o HDR. Se analizará el beneficio en sobrevida, tolerancia y toxicidad de estos tratamientos en cada grupo de estudio.
¿ MATERIAL Y MÉTODOS
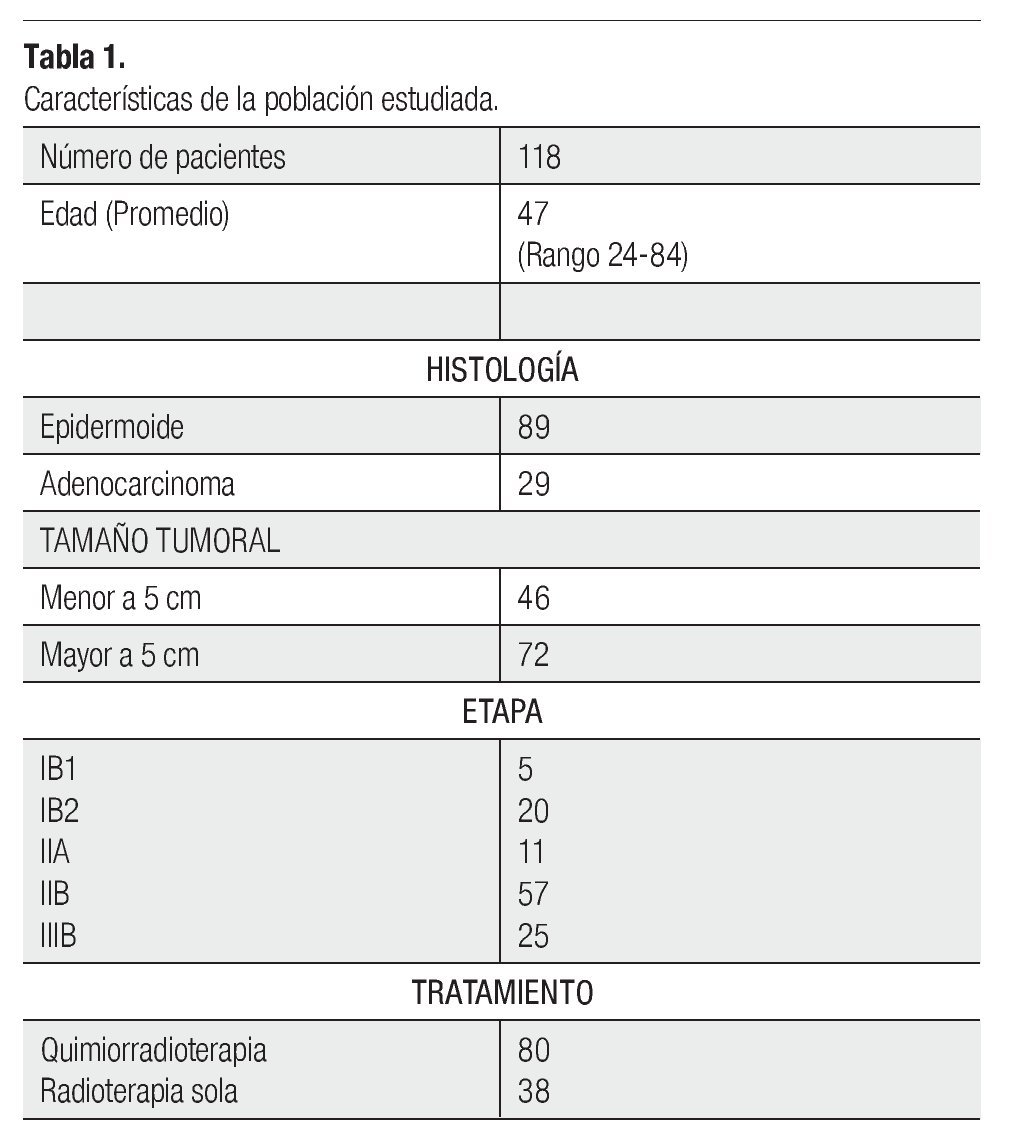
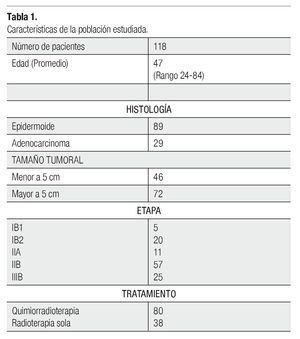
Es un estudio retrospectivo, en el cual se analizaron los expedientes de 118 pacientes con diagnóstico de CCU comprobado histopatológicamente, con un seguimiento de siete a 67 meses, candidatas a radioterapia radical en nuestro Hospital, durante el periodo comprendido entre marzo de 2005 a octubre de 2011. Se incluyeron todas aquellas pacientes de cualquier edad, con biopsia confirmatoria y que fueron estadificadas de acuerdo a la International Federation of Gynecology and Obstetrics (FIGO), tras una revisión clínica por palpación ginecorrectal, empleo de cistoscopia y rectoscopia bajo sedación. Se registró en cada caso, el volumen tumoral e histología documentada previa al protocolo de manejo, así como su hemoglobina inicial. Como criterio de exclusión se consideró el haber recibido radioterapia posoperatoria o quimioterapia neoadyuvante, y todas aquellas pacientes que por alguna razón médica, no pudieron recibir braquiteraédica, no pudieron recibir braquiteradica, no pudieron recibir braquiterapia intracavitaria. Se incluyeron todas las etapas IB1, IB2, IIA, IIB y IIIB epidermoide o adenocarcinoma, que tuvieran un estado clínico, hematológico y escala funcional adecuada, para recibir radioterapia radical y/o quimioterapia simultánea. En todas las pacientes se realizó una tomografía como estudio de rutina para descartar enfermedad retroperitoneal, antes de iniciar el protocolo de tratamiento. En el Tabla 1 se muestran las características del grupo estudiado.
Se registró de cada caso la edad, histología, grado de diferenciación, etapa, dosis de radioterapia pélvica, dosis y fraccionamiento de braquiterapia empleada, morbilidad rectal y vesical aguda y tardía, de acuerdo a los criterios emitidos por la RTOG-EORTC,14 así como la toxicidad hematológica, de acuerdo a los criterios de la OMS. Se registró la toxicidad tardía a nivel vesical y rectal, durante el seguimiento posterior al tratamiento radical. De igual manera, se revisó la presencia de persistencia tumoral y/o respuesta completa tras el manejo radical. En aquellos casos donde se documentó recurrencia y/o metástasis, se registró el sitio de la misma. Para el análisis estadístico se utilizó el paquete SPSS versión 15, la supervivencia fue determinada desde el momento de haber iniciado el tratamiento hasta la muerte o hasta la última visita médica. Se calculó la supervivencia en cada grupo, utilizándose el método de Kaplan-Meier. Se usó el método Log-rango para comparar ambos tratamientos.
TRATAMIENTO
El tratamiento consistió en radioterapia pélvica con acelerador lineal (VARIAN IX®) haces de 6MV y 18MV, previa simulación virtual (simulador TAC GE modelo Hi Speed®), en posición de decúbito dorsal con cuatro campos dosis de 50Gy en 25 fracciones, y planeación 3D en sistema eclipse versión 6.1. Los volúmenes de irradiación para la radioterapia externa fueron el tumor primario y ganglios pélvicos regionales, el límite superior fue colocado en el borde superior de L4-L5 y el límite inferior se modificó en cada paciente, de acuerdo al tamaño y extensión tumoral a nivel vaginal. De acuerdo al plan dosimétrico, se seleccionó la distribución isodósica adecuada para la cobertura óptima de los volúmenes de irradiación y dosis permisibles, en órganos de riesgo.
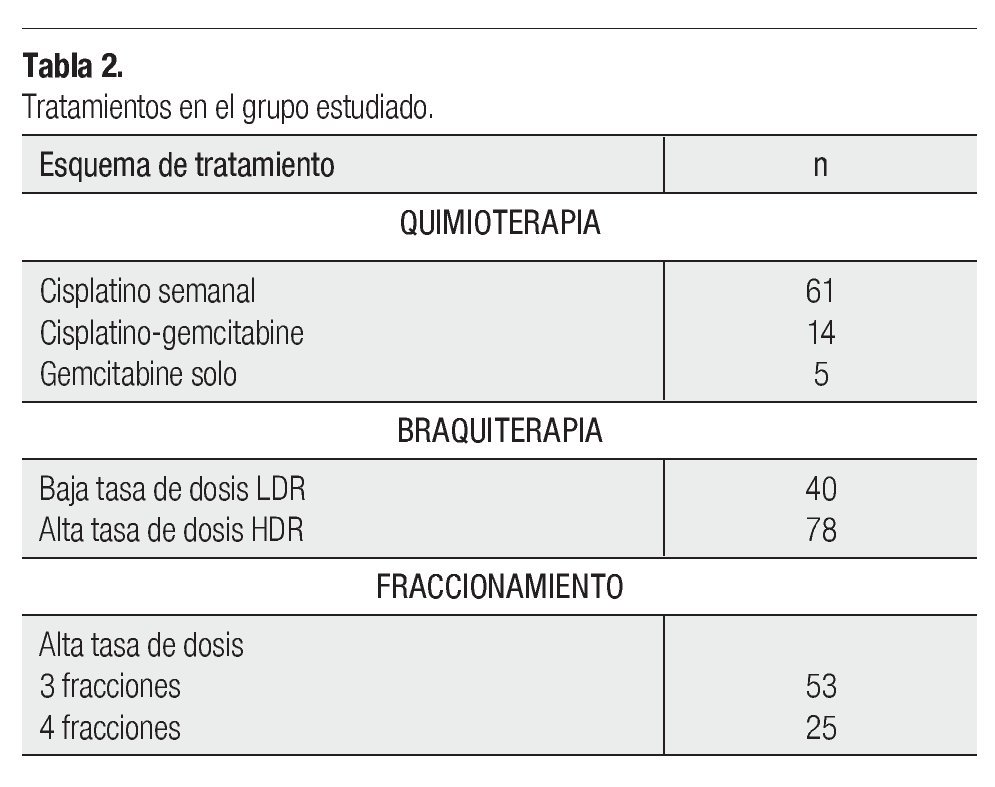
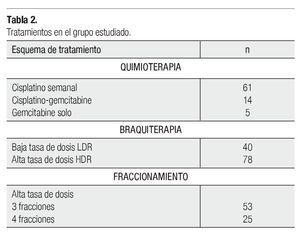
De acuerdo a la valoración médica, se incluyeron pacientes que fueran candidatas a quimioterapia con cisplatino semanal, dosis de 60 mg/m2 de superficie corporal (SC) y/o cisplatino-gemcitabine 60 mg/m2 SC y 125 mg m2 SC, respectivamente y un número minoritario sólo gemcitabiólo gemcitabilo gemcitabine, dosis de 125 mg/m2 SC. Una vez finalizada la teleterapia pélvica y quimioterapia simultánea, se programaron para recibir braquiterapia con HDR (sistema gammamed HDR) o LDR (Cs 137), de acuerdo a sus condiciones clínicas, geometría vaginal y criterios establecidos por la American Brachytherapy Society (ABS) para ambas modalidades.15,16 Se ofreció una dosis de 30Gy a puntos A de Manchester, una sola inserción en el caso de LDR y dos esquemas de fraccionamiento para HDR. Tres fracciones de 7.5Gy o cuatro fracciones de 5.2Gy, cada una como se indica en el Tabla 2.
¿ RESULTADOS
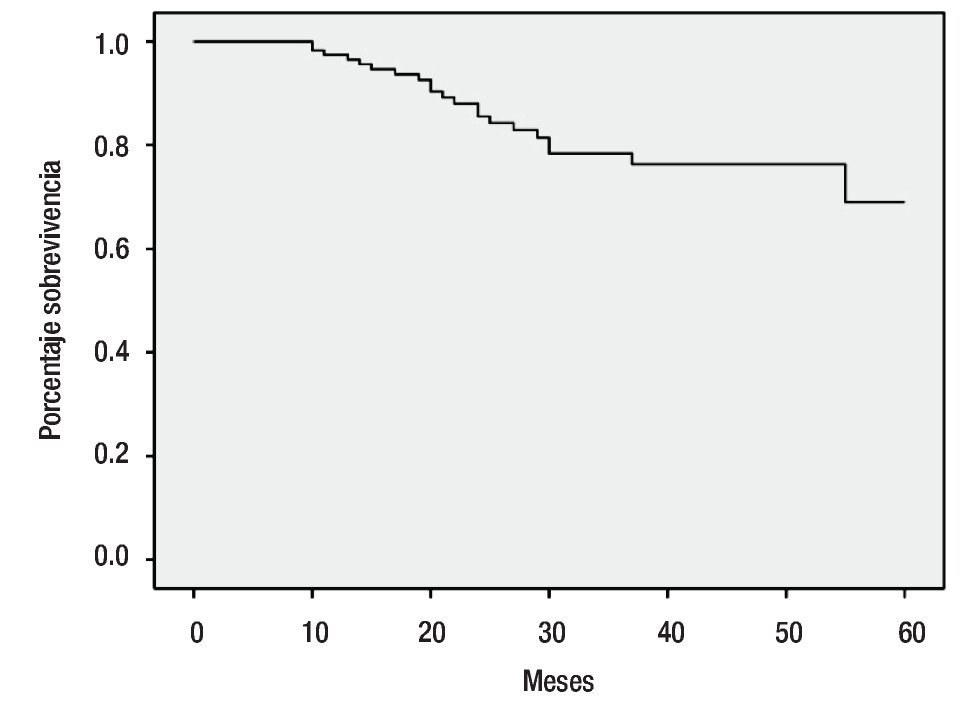
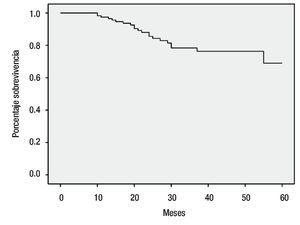
La mediana de seguimiento fue de 29.3 meses (rango de siete a 67 meses). Hasta el momento del análisis, se obtuvo un seguimiento en 117 pacientes, de las cuales 82 se encontraban vivas sin enfermedad (59 del grupo combinado y 23 del grupo de radioterapia sola), 14 pacientes vivas con enfermedad, 21 defunciones por enfermedad y sólo una paciente se perdió durante las visitas médicas. Durante el seguimiento se documentaron 32 (26.9%) recurrencias en total en el grupo estudiado, 20 pacientes en el grupo combinado y 12 en el grupo con radioterapia sola. Documentamos 10 pacientes con recurrencia cervical local y regional a nivel pélvico, ocho de ellas en el grupo combinado, seis pacientes a nivel pulmonar siendo tres en el grupo combinado, seis se presentaron a nivel retroperitoneal, cuatro de ellas del grupo combinado, 10 pacientes presentaron metástasis a nivel óseo, cerebral y ganglionar, cinco de ellas del grupo combinado. En relación a las recurrencias descritas, nueve se presentaron en pacientes con histología adenocarcinoma y el resto, en carcinomas epidermoides. Se registraron un total de cinco persistencias tumorales, todas con dimensiones mayores a 5 cm y del grupo combinado, tres pacientes en etapas IIB y dos en etapas IIIB. Encontramos un número mayor de recurrencias en pacientes en etapa IIIB, siendo el retroperitoneo y la pelvis, los sitios más frecuentes de presentación. En cuanto a la toxicidad hematológica grado tres, se documentaron un total de tres pacientes, siendo dos de ellas del grupo con quimioterapia combinada cisplatino/gemcitabine y la otra tratada con gemcitabine sola. Treinta y ocho pacientes del grupo combinado presentaron toxicidad grado uno y ocho pacientes grado dos. En cuanto a la presencia de morbilidad rectal aguda, en el grupo estudiado se presentaron 26 pacientes (21.8%) con proctitis grado dos y siete pacientes (5.9%) con cistitis grado dos, hasta el final del seguimiento. Se documentó un número mayor de pacientes con proctitis en el grupo con terapia combinada, mientras que la cistitis se presentó en número similar en ambos grupos. Utilizando el análisis de Kaplan-Meier para estimar la supervivencia del grupo estudiado, encontramos una supervivencia global de 82% a los 60 meses de seguimiento como se muestra en la Figura 1.
Figura 1.Supervivencia global.
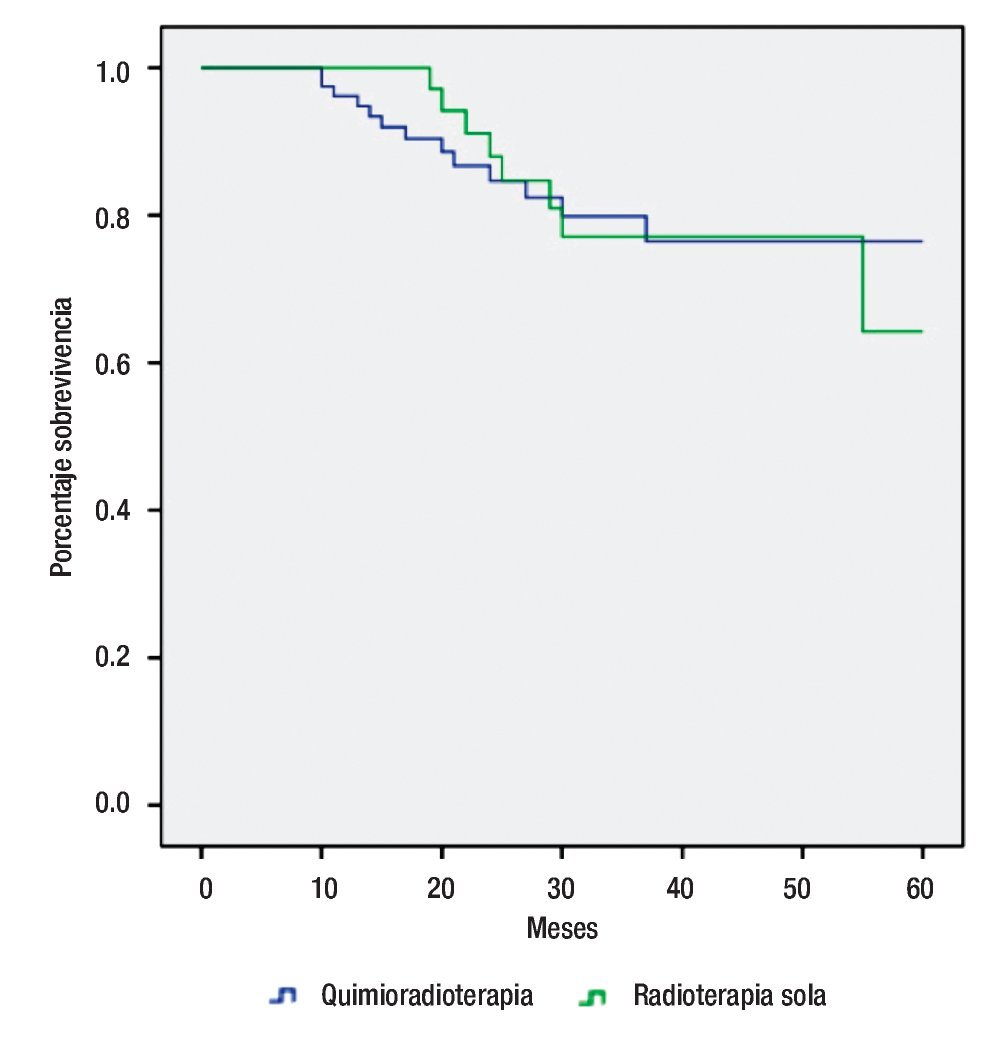
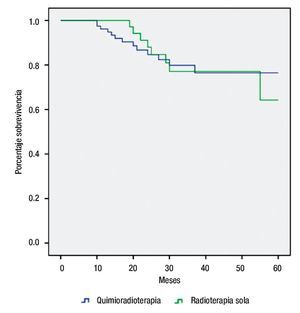
Utilizando una prueba Log-rango para comparar ambas modalidades terapéuticas, encontramos una discreta mejor sobrevida a 60 meses para el grupo combinado vs radioterapia sola, 83.8% vs 78.9, respectivamente (Figura 2). No obstante, sin diferencia estadísticamente significativa (p=0.977).
Figura 2. Supervivencia por tipo de tratamiento.
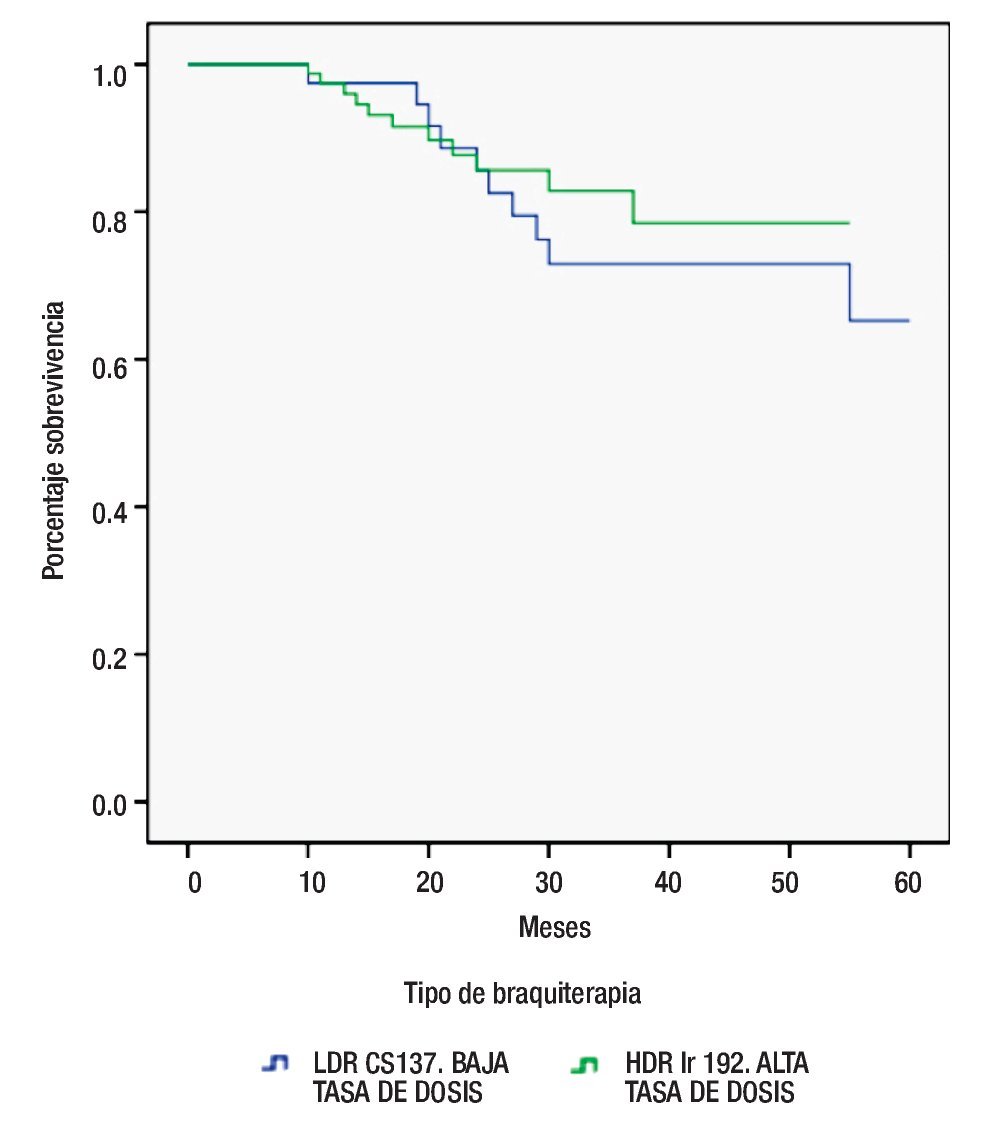
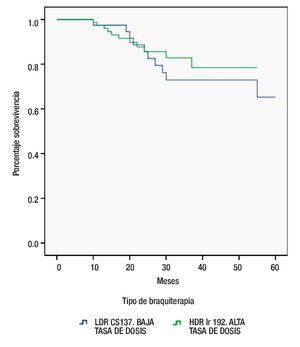
De igual manera y utilizando la misma metodología, la supervivencia entre ambas modalidades de braquiterapia demostró una discreta mejor supervivencia a los 60 meses para HDR Ir 192 vs LDR Cs 137, 85.9% vs 75.6%, respectivamente. Sin embargo, sin diferencia estadísticamente significativa (p=0.534) (Figura 3).
Figura 3. Supervivencia por tipo de braquiterapia.
En relación a la histología, encontramos una supervivencia estimada a los 60 meses de 85.4% vs 72.4% para epidermoide y adenocarcinoma, respectivamente, sin diferencia estadísticamente significativa (p=0.162). La supervivencia libre de enfermedad fue mejor para el grupo combinado a los 60 meses de seguimiento, 75% vs 68.4%, con un valor de p=0.506.
¿ DISCUSIÓN
Esta revisión de carácter retrospectiva confirma que la utilización simultánea de cisplatino semanal más radioterapia pélvica, ofrece resultados similares en toxicidad y tolerancia adecuada en pacientes en etapas localmente avanzadas, siendo mínimos los efectos adversos relacionados a la combinación terapéutica. No encontramos en ningún caso, la necesidad de interrupción del tratamiento por toxicidad intestinal ni hematológica. Aunque no encontramos diferencia estadísticamente significativa en supervivencia entre ambos grupos, debido a las características propias del estudio, podemos observar una mejor supervivencia a los 60 meses en el grupo combinado, lo que nos sugiere realizar un estudio prospectivo y con muestras homogéneas de pacientes. Un mayor número de fallas a distancia se documentaron en el grupo de terapia combinada, siendo el retroperitoneo y el pulmón, los sitios con mayor afectación. Esta situación sugiere el revalorar la inclusión retroperitoneal como opción de tratamiento en pacientes de alto riesgo, tal y como lo han demostrado los resultados del estudio fase III llevado a cabo por el RTOG 79-20, en donde la irradiación electiva paraaórtica reduce la recurrencia extra pélvica y mejora la sobrevida.17 Otros estudios, en los cuales se han utilizado los campos extendidos en etapas localmente avanzadas o en casos con actividad retroperitoneal, han demostrado una tolerancia adecuada con toxicidad aceptable. Sin embargo, la adición de quimioterapia a dicha modalidad incrementa sustancialmente la toxicidad, y dependerá del esquema quimioterápico elegido y de la técnica de irradiación empleada.18,19 De igual manera es importante hacer notar, que la adición de la quimioterapia no elimina el riesgo de recurrencia paraaórtica y exhibe una posibiórtica y exhibe una posibirtica y exhibe una posibilidad de diseminación secundaria a un reducido control pélvico de la enfermedad. En esta serie presentamos un número mayor de pacientes sometidos a terapia combinada, no nos es posible hacer una comparativa entre los esquemas de cisplatino semanal vs cisplatino-gemcitabine, debido al número reducido de casos sometidos a dicho esquema, el grado de toxicidad por estos esquemas deberá evaluarse en otro estudio. El número de pacientes con complicaciones tardías es similar en ambos grupos, no encontramos diferencia estadísticamente significativa en sobrevida entre ambos esquemas de braquiterapia. Este estudio es limitado por haber sido retrospectivo, no obstante, los datos de la toxicidad y la evolución de cada paciente fueron registrados durante el curso de ambos tratamientos, por lo cual se pudo hacer un seguimiento estrecho e incluso prevenir la toxicidad esperable por ambas modalidades. Cairns y colaboradores en una serie retrospectiva, reportan una tolerancia adecuada de pacientes con quimioradiación presentando una limitada toxicidad hematológica y gastrointestinal, con dosis semanales a base de cisplatino semanal dosis de 40 mg/m2 SC, por lo cual consideramos que puede ser un esquema adecuado para nuestra población.20 Recientemente en un meta-análisis que incluyó 18 estudios de 11 países, se demostró con clara evidencia la mejoría de la sobrevida global y sobrevida libre de enfermedad en pacientes en diferentes etapas. Se concluyó que la adición de quimioterapia al tratamiento radical con radioterapia, ofrece beneficio en todas las etapas de CCU, de igual manera se menciona una posible línea de investigación para esquemas de quimioterapia sin cisplatino, que pudieran tener mayor impacto y ofrecer beneficios adicionales. Se propone y sugiere realizar estudios prospectivos y controlados con diferentes drogas, para probar esta aseveración. Se describe de igual manera un beneficio mayor, en relación al control local y regional. Sin embargo, uno de los cuestionamientos es el beneficio limitado relacionado al riesgo de enfermedad a distancia.21
¿ CONCLUSIONES
Existe suficiente evidencia de una tolerancia adecuada y toxicidad aceptable, de la quimiorradioterapia pélvica en pacientes con CCU localmente avanzado. Este estudio confirma lo anterior y nos hace pensar sobre un diseño en un futuro próximo, de un protocolo prospectivo en grupos homogéneos de nuestra población para confirmar el beneficio demostrado en supervivencia, del esquema cisplatino semanal más radioterapia y braquiterapia de HDR.
AGRADECIMIENTOS
Al personal médico, asistencial y técnico del Hospital de Alta Especialidad "Dr. Juan Graham Casasus", Villa-Alta Especialidad "Dr. Juan Graham Casasus", Villahermosa, Tabasco. A nuestros pacientes.
Correspondencia: Dr. Daniel Romero Tejeda.
Hospital Regional de Alta Especialidad "Dr. Juan Graham Casasus". Carretera a la Isla Km 1+300. Col. Miguel Hidalgo. C.P. 86126. Villahermosa, Tabasco, México.
Teléfono: 993 310 03 00, ext 75293. Celular: 9931325748.
Correo electrónico: rotd720818@yahoo.com