Actualmente podemos prevenir el cáncer de cuello uterino con tres estrategias: la primera es abstinencia sexual; retrasar la vida sexual después de los 20 años, monogamia y el uso de condón; la segunda, a través de la prevención primaria (antes de la adquisición del virus del papiloma humano, vacunas profilácticas), en la etapa presexual y; la tercera, basada en la citología vaginal con tinción de Papanicolaou y pruebas de ADN. Para fines prácticos, la primera opción sólo la practica la minoría de la población, por lo tanto, carece de impacto significativo en la prevención del cáncer cervicouterino.
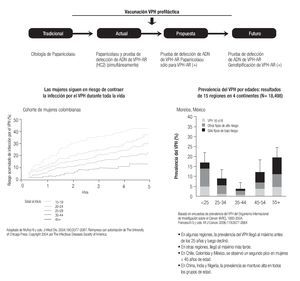
A pesar de que la citología vaginal reduce tanto la tasa de incidencia y mortalidad del cáncer cervicouterino (70%), para alcanzar estos resultados debe repetirse con frecuencia, ya que su baja sensibilidad, entre 30 a 57%, y su elevada tasa de falsos negativos hace que esta estrategia sea menos costo-efectiva.1,2
El cáncer cervicouterino es causado por una infección por el virus del papiloma humano (VPH). Es necesaria la infección por VPH para que aparezcan el cáncer cervicouterino de células escamosas (y su lesión precursora, la neoplasia intraepitelial cervical o NIC de grados 1 y 2/3) y el adenocarcinoma cervicouterino (y su lesión precursora, el adenocarcinoma in situ [AIS]).
El VPH también causa un subgrupo de cánceres vulvares y vaginales, así como sus lesiones precursoras, la neoplasia intraepitelial vulvar (NIV) y la neoplasia intraepitelial vaginal (NIVa).
La infección por el VPH es muy común. A falta de vacunación, más de 50% de los adultos sexualmente activos se infectarán con el VPH a lo largo de la vida. La mayoría de las infecciones por VPH desaparecen sin secuelas, pero algunas avanzan hasta desembocar en cáncer cervicouterino.
La infección por el VPH de los tipos 6, 11, 16 y 18 puede ocasionar resultados anormales en la citología vaginal y lesiones displásicas de grado leve (NIC 1, NIV 1 y NIVa 1). Las lesiones por el VPH de los tipos 6 y 11 tienen pocas probabilidades de progresar hasta el cáncer, pero son clínicamente indistinguibles de las lesiones premalignas causadas por el VPH de los tipos 16 y 18.3
Los VPH de los tipos 16 y 18 causan 70% de los cánceres de ano y de pene relacionados, así como sus lesiones precursoras.
La infección por el VPH de los tipos 6 y 11 también causa verrugas genitales (condilomas acuminados), excrecencias que aparecen en la mucosa cervicovaginal, vulvar y perianal y en los genitales externos, que rara vez progresan hasta el cáncer. Se ha calculado que el riesgo de por vida de contraer verrugas genitales es superior al 10%. La incidencia de estas lesiones, por lo general, es comparable entre hombres y mujeres.
El VPH de los tipos 6 y 11 también causa la papilomatosis respiratoria recurrente (PRR), una enfermedad de los lactantes y los adultos. La papilomatosis respiratoria recurrente se caracteriza por la aparición repetida de verrugas en las vías respiratorias. En Estados Unidos, cada año se diagnostican 5,900 casos, y el tratamiento requiere intervenciones quirúrgicas repetidas.
¿ ESTUDIOS CLÍNICOS
La neoplasia intraepitelial cervical 2/3 y el adenocarcinoma in situ son los precursores inmediatos del carcinoma de células escamosas invasor y del adenocarcinoma cervicouterino invasor, respectivamente. Se ha demostrado que su detección y extirpación previene el cáncer invasor (prevención secundaria); así pues, su prevención primaria mediante la vacunación también prevendrá el cáncer invasor.
No puede emplearse el cáncer cervicouterino invasor como un punto final en los estudios de eficacia de las vacunas contra el VPH, debido a la importancia de emplear medidas de prevención secundaria. Así pues, los precursores inmediatos, tales como la NIC 2 (displasia cervicouterina de grado moderado), la NIC 3 (displasia cervicouterina de grado alto, que incluye el carcinoma in situ), y el adenocarcinoma in situ son los puntos finales más apropiados para demostrar la prevención del cáncer cervicouterino mediante las vacunas contra el VPH.
La neoplasia intraepitelial cervical 3 y el adenocarcinoma in situ se clasifican como cánceres cervicouterinos de grado 0, según la FIGO (Federación Internacional de Ginecología y Obstetricia). La neoplasia intraepitelial vulvar y la neoplasia intraepitelial vaginal de grados 2 y 3 son las precursoras de los cánceres vulvares y vaginales relacionados con el VPH.4,5
¿ EFICACIA
Vacuna cuadrivalente. Es una vacuna recombinante con proteínas L1 parecidas a los tipos de VPH 6, 11, 16 y 18. Los tipos 16 y 18 causan aproximadamente:
70% de los casos de cáncer cervicouterino, adeno-carcinoma in situ, y NIC 3;
70% de los casos de cáncer vulvar y vaginal relacionados con el VPH, casos de NIV 2/3, y NIVa y;
50% de los casos de NIC 2.
Los tipos de VPH 6, 11, 16 y 18 causan aproximadamente:
35 a 50% de todos los casos de NIC 1, NIV 1 y NIVa.
Los tipos de VPH 6 y 11 causan aproximadamente:
90% de los casos de verrugas genitales y PRR; y
9 a 12% de los casos de NIC 1.
Los efectos de la vacuna cuadrivalente también han sido estudiados en el VPH tipos 31, 33, 52, 56, 58 y 59.
Estos tipos causan aproximadamente:
11.6% de los casos de cáncer cervicouterino;
32.2% de los casos de NIC 1
39.3% de los casos de NIC 2; y
24.3% de los casos de NIC y AIS.
La eficacia de la vacuna cuadrivalente se evaluó en 5 estudios clínicos de fase II y III, doble ciego, con distribución al azar, controlados con placebo. El primer estudio de fase II evaluó el componente de VPH 16 de la vacuna cuadrivalente (protocolo 005, N = 2,391), y el segundo todos los componentes de la vacuna cuadrivalente (protocolo 007, N = 551). Los estudios de fase III, denominados FUTURE (siglas en inglés de "Mujeres Unidas para Reducir Unilateralmente las Enfermedades Ecto y Endocervicales"), evaluaron la vacuna cuadrivalente en 5,442 (FUTURE I), 12,157 (FUTURE II), y 3,817 (FUTURE III) participantes. En conjunto, dichos estudios evaluaron a 24,358 mujeres que tenían entre 16 a 45 años al ingreso. La mediana de duración del seguimiento fue de 3.9, 2.9, 2.9, 2.9, y 1.6 años para el protocolo 005, el protocolo 007, FUTURE I, FUTURE II, y FUTURE III, respectivamente. Las participantes recibieron la vacuna o placebo el día de su ingreso, 2 y 6 meses después. Se analizó la eficacia por separado en cada estudio y en todos los estudios combinados.
¿ VACUNAS PROFILÁCTICAS
Proporcionan anticuerpos que neutralizan el virus del papiloma humano antes que puedan infectar células huésped. Aunque no advierten positividad del VPH a largo plazo, sí previenen en establecimiento de infección persistente y asimismo, el desarrollo de neoplasia cervical. Ya que los dos factores de riesgo más importantes para el cáncer de cuello uterino son:
a) Virus de alto riesgo
b) Persistencia
En cuatro estudios controlados por placebo aleatorizados que incluyeron un total de 15,000 sujetos, la vacuna cuadrivalente recombinante contra los tipos 6,11,16 y 18 han mostrado 90 al 100% de protección contra condilomas genitales más protección contra neoplasia cervical y vaginal en mujeres que tienen una serología negativa para los tipos del VPH cubiertos. En el 2006 la vacuna cuadrivalente recibió la aprobación de la FDA como vacuna para mujeres en edades de 9 a 26 años. Actualmente, esta vacuna se ha autorizado hasta los 45 años de edad y en los hombres tiene una respuesta hasta del 91% con títulos de anticuerpos protectores. Una vacuna bivalente para tipos 16 y 18 ha mostrado eficacia similar con 98 y 100% de seguridad con una protección cruzada eficaz para el tipo 45 y 31.
Ambas vacunas administradas en 3 dosis intramusculares durante un periodo de 6 meses, han mostrado ser extremadamente seguras y bien toleradas. Las estrategias de vacunación deben enfatizar la administración previa al inicio de la vida sexual, cuando la protección que proveen es cercana al 100%. De cualquier modo, una historia de relaciones sexuales previas o enfermedades relacionadas al VPH no están contraindicadas para la administración de la vacuna porque no se sabe qué tipo viral padecieron. Para realizar las pruebas para el VPH, no se recomienda una vacunación previa. El comité sobre prácticas de inmunización aconseja que la vacunación para el VPH debe ser administrada de rutina a mujeres en edades de 11 a 12 años y está permitida la administración de la misma para mujeres de 9 a 45 años, ya que una mujer de 26 a 45 sexualmente activa está en riesgo de infectarse con virus oncogénicos y enfermedades vinculadas con éstos.
¿ CONCLUSIÓN
En países en donde la prevalencia del cáncer de cuello uterino es elevada, es conveniente la prevención primaria con base en la vacuna profiláctica (bivalente o cuadrivalente), protegiendo 70 al 80% de cáncer de cuello uterino y deben realizarse los métodos de investigación mediante la citología vaginal y preferentemente con el estudio del ADN en pacientes vacunadas.
Correo electrónico:aranda_floresc@hotmail.com