¿INTRODUCCIÓN
La radioterapia de intensidad modulada (IMRT), representa una de las mayores innovaciones técnicas en la era moderna de la Radioterapia (RT). La IMRT es un avance de la Radioterapia Conformada (3DRTC), que utiliza haces de intensidad no uniforme, para lo cual la optimización del cálculo que realizan los programas especiales es indispensable para lograr una distribución de dosis muy superior.1,2
En las últimas décadas, el tratamiento del cáncer con RT externa ha evolucionado desde la irradiación general de toda la región donde se encontraba ubicado el tumor, hacia la conformación del haz de radiación, adaptándolo a la forma del tumor con el apoyo de imágenes diagnósticas (TC, IRM, PET-CT) para la planeación del tratamiento. El objetivo de la 3DRTC es conseguir distribuciones de dosis de radiación homogéneas mediante la superposición de haces de intensidad uniforme, en el volumen tumoral (VT), al mismo tiempo que se trata de evitar en la medida de lo posible el irradiar tejido sano, manteniendo un nivel de toxicidad aceptable en los órganos de riesgo adyacentes y aumentando las probabilidades de control del tumor.3,4
En la IMRT, que es una forma de 3DRTC más sofisticada y precisa, se busca distribuciones de dosis homogéneas y/o heterogéneas con gradientes acelerados, empleando haces de radiación de intensidad no uniforme, en los que se modula o controla la intensidad del haz de radiación para lograr altas dosis en el tumor y al mismo tiempo minimizar la dosis en los tejidos sanos adyacentes.3,4
En nuestro país, la primera Institución en iniciar procedimientos de IMRT, fue la Unidad de Radioterapia del Servicio de Oncología del Hospital General de México, siendo el 11 de septiembre de 2006 la fecha del primer caso tratado con esta técnica; el diagnóstico fue cáncer de próstata ECII, con factores de riesgo intermedio.
En nuestra Institución, hasta la fecha se han tratado 160 pacientes con distintos diagnósticos oncológicos, en este artículo se presenta la experiencia obtenida en el manejo de los pacientes con tumores en el área de cabeza y cuello, haciendo énfasis en los detalles y consideraciones técnicas del procedimiento y su correlación clínica.
¿MÉTODOS
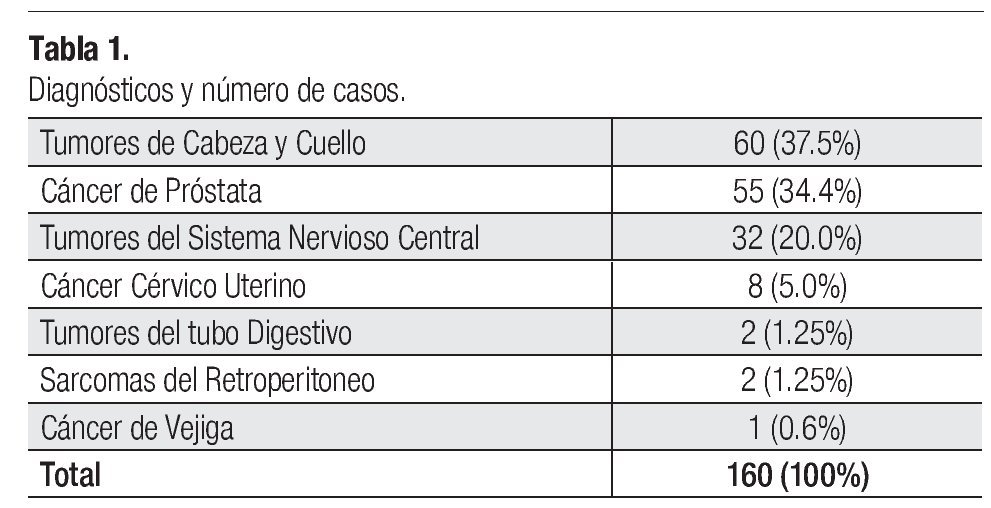
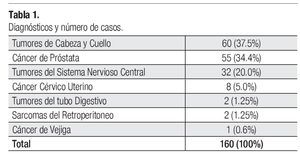
De septiembre de 2006 a septiembre de 2009, 160 pacientes fueron tratados mediante la técnica de IMRT por diversas patologías oncológicas en nuestra Institución que se resumen en la Tabla 1.
Todos los pacientes fueron tratados con IMRT con un Acelerador Lineal Varian 21 EX, las dosis variaron de acuerdo con la entidad tratada y se especificarán en los párrafos subsecuentes.
El equipo para el procedimiento de la IMRT consta de:
1. Tomógrafo GE multicorte.
2. Sistemas de fijación de acuerdo al subsitio de tratamiento.
3. Sistema de planeación Eclipse, v.7.25, con sistema Somavisión, v.7.25.
4. Acelerador Lineal dual marca Varian 21 EX.
Para la planeación del tratamiento de la IMRT se realizaron fusiones de imágenes de IRM y/o PET-CT con imágenes tomográficas simples y/o contrastadas del caso o sitio a tratar.
Las variables estudias fueron:
a. Sexo.
b. Edad.
c. Karnosfky.
d. Etapa Clínica.
e. Reporte Histopatológico de acuerdo al sitio del primario.
f. Dosis al Volumen Grueso Tumoral (GTV).
g. Dosis al Volumen Tumoral Clínico (CTV).
h. Dosis al Volumen Tumoral Planeado (PTV).
i. Dosis a los distintos órganos de riesgos (OAR).
j. Tiempo total de tratamiento.
k. Respuesta Clínica.
l. Respuesta Radiológica post-Radioterapia.
m. Toxicidad aguda.
Siendo esta revisión un estudio de tipo observacional, retrospectivo longitudinal, descriptivo (promedio, media, rango), para determinar la asociación entre dos variables, se realizó la prueba de Ji cuadrada para independencia. Para el análisis de control local, falla local, locorregional, metástasis a distancia y muerte fueron estimados por el método de Kaplan-Meier.
La planeación del tratamiento y administración de la IMRT cumple con los siguientes puntos:
1. Posicionamiento del paciente y su inmovilización.
2. Adquisición de imágenes mediante Tomografía Computada (TC), en fases simple, contrastada y FOV, en algunos casos complementada con imágenes de Resonancia Magnética (IMR) y/o PET-CT.
3. Definición anatómica de contorno, volúmenes blancos (GTV, CTV, PTV) y órganos de riesgo (OAR).
4. Prescripción de las dosis de tratamiento para los volúmenes blanco y de tolerancia para los órganos de riesgo.
5. Diseño de los campos de irradiación (orientación de los haces).
6. Cálculo y representación de la dosis.
7. Análisis y evaluación de los histogramas dosis-volumen en las estructuras específicas (GTV, CTV, PTV y OAR).
8. Evaluación del plan de tratamiento (control de la calidad pre tratamiento), aprobación y documentación de la misma.
9. Implementación del plan de tratamiento y su verificación.
Los criterios para utilizar la IMRT en las distintas localizaciones anatómicas tumorales, se basa en los siguientes criterios:
1. Mejorar la adaptación al volumen tumoral con formas cóncavas, convexas o con invaginaciones; ejemplo de lo anterior son los tumores paraespinales.
2. Adaptarse a restricciones espaciales anatómicas; ejemplo en tumores de pulmón o mediastinales.
3. Conseguir dosis heterogéneas en el volumen tratado y adaptarlas a las distintas prescripciones sobre zonas tumorales o ganglionares; ejemplo en cáncer de próstata, tumores del sistema nervioso central o de senos paranasales.
4. Conseguir dosis homogéneas en las áreas donde con las técnicas convencionales no se conseguían; ejemplo en el cáncer de mama o en la pared torácica.
5. Combinación de varios aspectos de los anteriores criterios, como sucede en el Cáncer de mama, en el que debe de corregirse la heterogeneidad de la dosis como en la convexidad de la superficie o en el cáncer de próstata en el que hay distintos volúmenes planificados (tumoral y OAR), con distintas dosis requeridas y una distribución cóncava de la dosis.
En cuanto a la prescripción, la distribución de la dosis debe de cumplir con los puntos siguientes:
1. El 100% de la dosis prescrita debe de cubrir 100% del GTV.
2. El 100% de la dosis prescrita debe de cubrir 95% del PTV.
3. No más del 1% del PTV puede recibir una dosis como mínima de 93% de la dosis prescrita.
4. No más del 20% del PTV puede recibir una dosis mayor de 110% de la dosis prescrita.4,5
Respecto a la optimización del cálculo de la dosis, pruebas de aceptación, comisionamiento y de control de calidad, existen artículos de varias instituciones que avalan cada uno de estos parámetros3,5-8 y en nuestra institución también se lleva al cabo cada uno de estos distintos programas y pruebas de control de calidad, mismos que ya fueron detallados en una publicación previa.4 Todos los pacientes fueron evaluados semanalmente durante el tratamiento de IMRT y al término del mismo, al mes y posteriormente cada dos meses el primer año. Cada dos a tres meses el segundo año y cada cuatro meses a partir del tercer año. Durante el seguimiento se realizó exploración clínica, estudios de imágenes dependiendo del sitio (TC, IRM) y pruebas de laboratorio. En caso de surgir alguna duda que no se aclarara con los estudios ya señalados, se solicitó el PEC-CT corporal. La morbilidad aguda y crónica fue evaluada de acuerdos a los criterios de toxicidad de la RTOG.9
¿ RESULTADOS
Se trató un total de 160 pacientes con distintas neoplasias de diversos sitios del cuerpo en la Unidad de Radioterapia del Servicio de Oncología del Hospital General de México. Todos los pacientes fueron evaluados, analizados y aceptados por el Comité Interno de IMRT de la Unidad de Radioterapia.
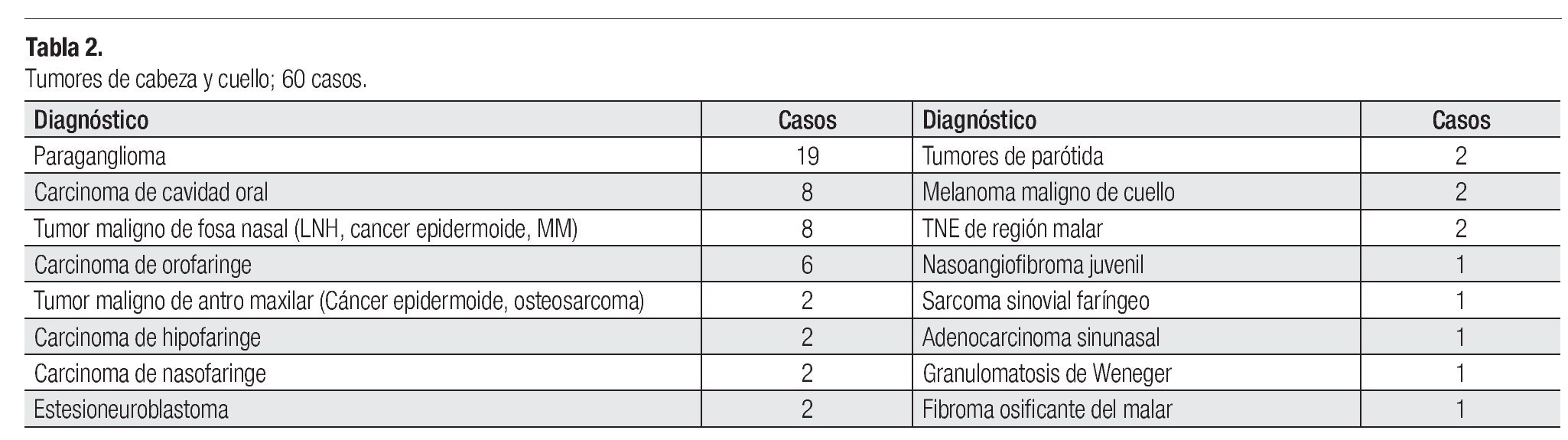
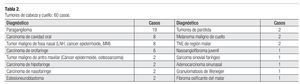
Respecto a los tumores del área de cabeza y cuello, un total de 60 pacientes (37.5%) se trataron, 32 del género femenino y 28 masculino, con un promedio de 50.8 años y con un rango de 11 a 89 años. Correspondiendo a 24 casos a tumores benignos y 36 a tumores malignos. En la Tabla 2 se muestra los distintos diagnósticos histopatológico de las lesiones tratadas en esta área. Del grupo de tumores benignos, 19 corresponden a paragangliomas, dos son adenoma pleomorfo de la parótida, uno es nasoangiofibroma juvenil, un fibroma osificante y otro con granulomatosis de Weneger.
Las características de los 19 paragangliomas se describen en la Tabla 3, llamando la atención la presencia de tres casos en una familia (paraganglioma familiar). En cada uno de estos casos, se segmentaron el GTV, CTV, PTV y los distintos órganos de riesgo, haciendo énfasis en las parótidas, médula espinal, mandíbula y esófago. La dosis prescrita fue de 54 Gy/30 fracciones (17 casos) y 50 Gy/25 fracciones (dos casos), administrándose una dosis promedio al GTV de 56.6 Gy y al PTV de 56.2 Gy, siendo el arreglo de los campos de tratamiento no coplanares con un promedio de nueve haces y con un rango de siete a 13 haces. En relación con la dosis a los órganos de riesgo, se lograron tener distribuciones muy por debajo de la dosis de riesgo de acuerdo al órgano, cumpliéndose los requisitos de acuerdo a la guía de IMRT para el área de cabeza y cuello de nuestra unidad.
El tiempo de seguimiento de este grupo de pacientes tiene un promedio de 15.1 meses, con un rango de seis a 30 meses, obteniéndose una respuesta completa (RC) en dos pacientes, respuesta parcial con reducción del volumen tumoral en más del 50% (RP) en 12 pacientes y estabilización de la lesión en cinco pacientes, la evaluación de la respuesta se valoró pre y postratamiento mediante exploración clínica y estudios de imágenes (TC e IRM de cuello).
La toxicidad aguda grado I, se presentó en 10 pacientes y grado II en tres, siendo las causas más frecuente la mucositis grado I en nueve de los 10 casos y faringitis fueron grado II en dos. La toxicidad crónica se ha presentado en tres casos, dos son grado I y corresponden a xerostomía, las cuales han evolucionado en mejoría, la tercera es un grado II por fibrosis subcutánea en el área de tratamiento.
Del resto de las lesiones benignas, dos adenomas pleomorfos que fueron tratados, uno es de la parótida recurrente a cirugías en tres ocasiones, prescribiéndose una dosis de 50 Gy/25 fracciones, encontrándose sin datos de AT a 18 meses del término del tratamiento, el segundo adenoma es de la región del paladar duro que recibe una dosis de 54 Gy en 30 fracciones y a 17 meses de seguimiento se encuentra sin evidencia de actividad.
El nasoangiofibroma juvenil recibió una dosis de 50 Gy /25 fracciones, encontrándose a los 15 meses sin datos de actividad tumoral. El fibroma osificante del antro maxilar y la Granulomatosis de Weneger recibieron una dosis de 45 Gy /25 fracciones y 20 Gy/10 fracciones respectivamente, encontrándose a 36 y 26 meses sin evidencia de actividad.
Respecto a las 36 lesiones malignas, 22 son carcinoma epidermoide, cinco linfoma no Hodgkin de fosas nasales, dos sarcomas, dos melanomas, dos neuroestesioblastomas, dos tumores neuroectodérmicos primitivo y un adenocarcinoma sino-nasal.
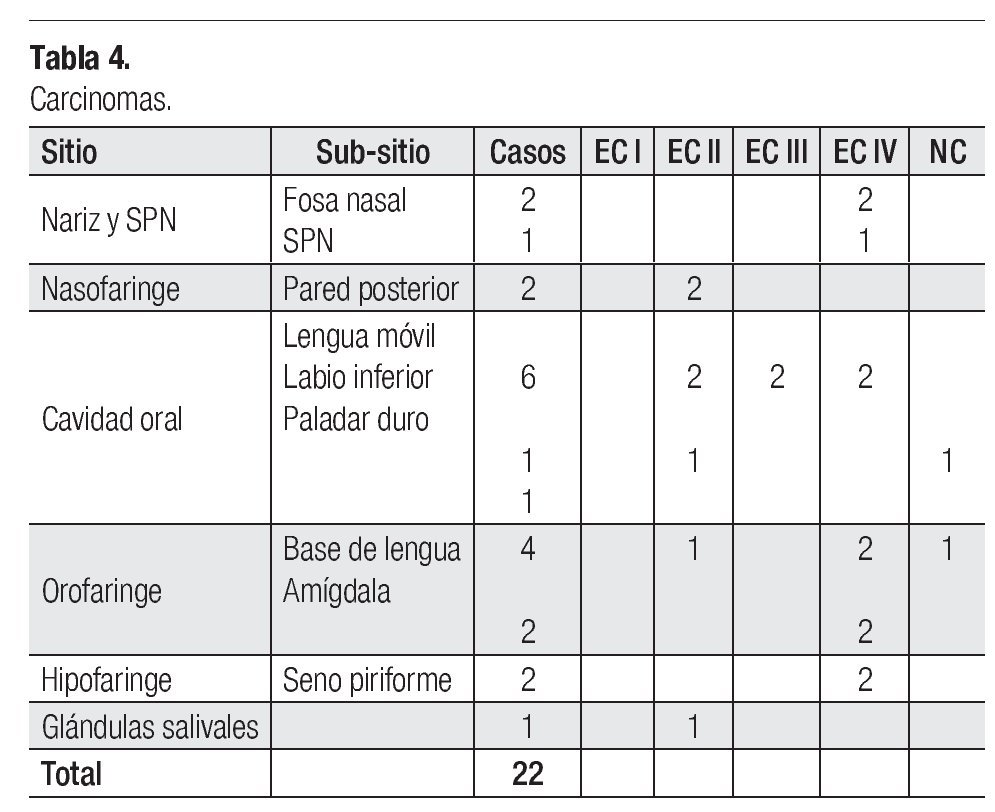
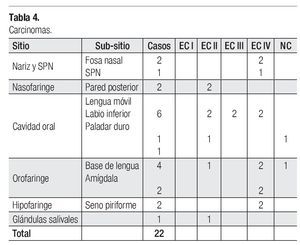
De los carcinomas epidermoides del área de cabeza y cuello, ocho casos correspondieron a mujeres y 14 hombres, con promedio de edad de 56.5 años. El número de casos por subsitios y TMN, se describen en la Tabla 4.
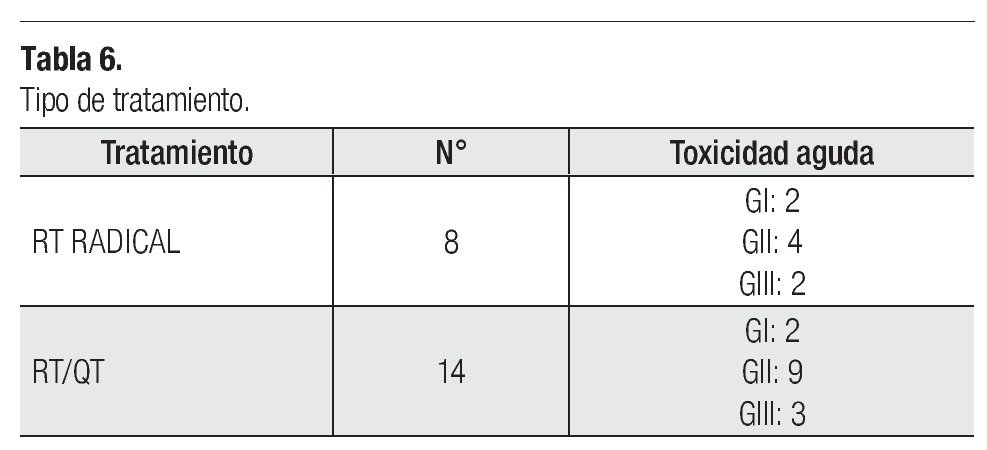
Se prescribieron tres esquemas de fraccionamiento: a) PTV1: 66 Gy en 33 fracciones y al PTV2: 60 Gy en 30 fracciones; b) PTV1: 60 Gy en 30 fracciones y al PTV2: 54 Gy en 30 fracciones; c) PTV1: 69.96 Gy en 33 fracciones y al PTV2: 59.40 Gy en 33 fracciones (IMRT Boost- concomitante). El promedio de campos no coplanares fue de 13, siendo el rango de 10 a 18 campos, la finalidad del tratamiento fue en 13 radical y en nueve como adyuvante.
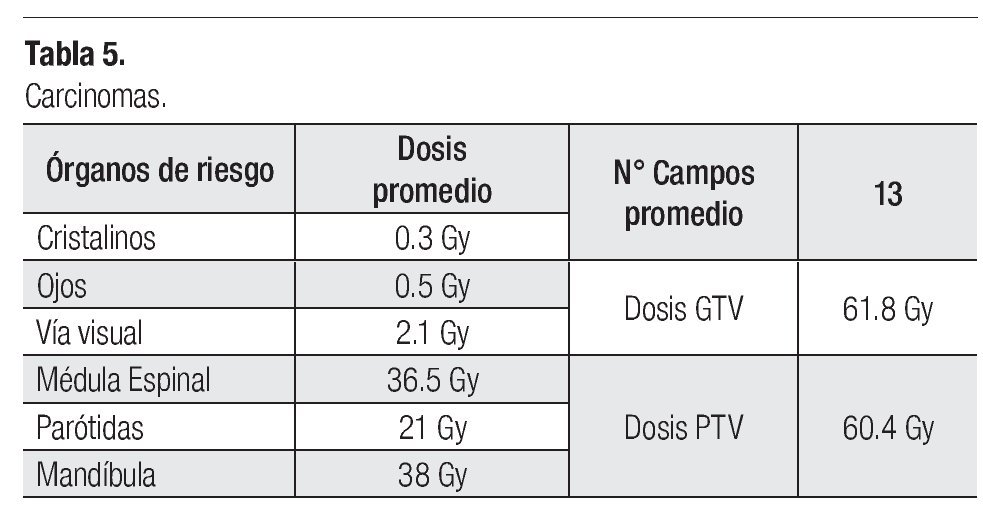
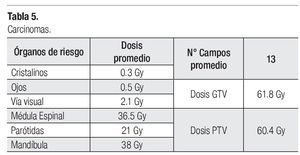
Los histogramas dosis-volumen (DVH) del GTV, CTV, PTV y de las estructuras normales criticas u órganos de riesgos (OAR), tales como parótidas, tallo cerebral, médula espinal, quiasma, nervios ópticos, ojos, mandíbula, etc., fueron revisados y analizados de las distintas planeaciones con TC, siguiéndose y respetándose las restricciones de acuerdo a la Guía de IMRT del área de cabeza y cuello, como se observa en la Tabla 5.
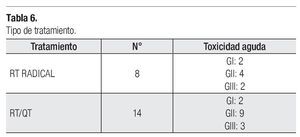
El tiempo promedio de seguimiento es de 14.5 meses, con un rango de seis a 18 meses, siendo el estado actual de los pacientes el siguiente: 14/22 (63.6%) están vivos sin actividad tumoral (VSAT), dos vivos con AT (VCAT), dos perdidos sin AT (PSAT), dos muertos con AT (MCAT) y dos muertos sin AT (MSAT). La toxicidad aguda estuvo relacionada si la IMRT fue radical o asociada a la Quimioterapia (5 FU más cisplatino), como se describe en la Tabla 6.
El segundo grupo de lesiones malignas del área de cabeza y cuello, fueron los Linfomas (LNH) de fosa nasal correspondiendo a cinco casos, cuatro hombres y una mujer. La dosis prescrita fue de 50 Gy en 25 fracciones (tres casos) y dos de 45 Gy en 25 fracciones, siendo adyuvante en cuatro casos y uno radical. Los DVH en el GTV, PTV y órganos de riesgo también se analizaron cumpliéndose los requisitos de cobertura en el GTV, PTV y no sobrepasándose la tolerancia en los distintos órganos de riesgo (cristalino, ojos, vía visual, médula espinal). El seguimiento promedio es de 12.7 meses con un rango de ocho a 21 meses, cuatro están VSAT y uno PSAT.
Del resto de las neoplasias malignas, dos resultaron sarcoma, uno de partes blandas, un sarcoma sinovial de la hipofaringe -que recibió una dosis adyuvante de 66 Gy en 33 fracciones- y el otro, un osteosarcoma del antro maxilar derecho -que recibió una dosis de 70 Gy en 35 fracciones-; se trataron con múltiples campos no coplanares, manteniéndose los mismos criterios respecto al CTV, PTV y órganos de riesgo de la guía de IMRT para el área de cabeza y cuello, ambos pacientes se encuentran VSAT a los 10 y 14 meses respectivamente.
Dos melanoma malignos del cuello, Breslow III y recibieron IMRT adyuvante con esquema de hipofraccionamienrto, dosis de 40 Gy en ocho fracciones, dos veces por semanas, con un seguimiento de 10 y 13 meses respectivamente ambos están VSAT.
Los dos casos de neuroestesioblastoma también recibieron tratamiento adyuvante, uno con dosis de 66 Gy en 33 fracciones por márgenes quirúrgicos positivos, y el otro con dosis de 54 Gy en 30 fracciones por márgenes negativos, ambos pacientes se encuentran VSAT a 25 y 29 meses respectivamente.
De los dos tumores neuroectodérmicos, recibieron dosis de 60 Gy/30 fracciones y 66 Gy/33 fracciones, siendo su evolución tórpida, ambos están fallecidos. Respecto al adenocarcinoma sinonasal recibió una dosis de 54 Gy/30 fracciones con intención adyuvante y se encuentra sin datos de actividad tumoral a 16 meses de seguimiento.
¿ DISCUSIÓN
Nuestro estudio confirma las observaciones de otras instituciones respecto a las patologías que pueden ser abordadas por medio de la IMRT.7,10,11 Los tumores del área de cabeza y cuello son el grupo más frecuentemente tratados con ésta modalidad y que en nuestra serie correspondieron a 60 pacientes (37.5%), seguido por el cáncer de próstata con 55 casos (34.4%), en tercer lugar por las lesiones del SNC, 32 pacientes (20.0%) y en menor proporción, por otras patologías.
Con relación a otros grupos de estudio en EEUU y Europa, la frecuencia en orden decreciente es de los tumores del área de cabeza y cuello, cáncer de próstata, cáncer de mama, tumores ginecológicos y tumores del sistema nervioso central.7,10,11
La radioterapia de intensidad modulada (IMRT) tiene dos potenciales ventajas en el tratamiento de los tumores del área de cabeza y cuello: a) una mejoría en la cobertura del tumor, b) una mejor protección de los tejidos sanos, dando por resultado una reducción en la toxicidad.
Los típicos tumores tratados en esta área son los de la nasofaringe y senos paranasales.7,10,11 La proximidad de estos tumores a estructuras como el cerebro, tallo cerebral, vías ópticas hacen que la planeación del tratamiento sea compleja. Difícilmente se puede evitar radiar tejidos sanos, dada la proximidad y lo avanzado en la etapa clínica de estas lesiones. En varias de estas situaciones, los planes de IMRT tienen distribución de dosis superior y mejor cobertura en el volumen tumoral.
Adams y colaboradores,12 compararon la dosimetría de la IMRT con RT3D en seis casos de tumores de senos paranasales, ellos documentaron que la IMRT puede cubrir más PTV del tumor arriba de 95% de la dosis planeada mientas que la dosis en el nervio óptico contra lateral era menor de 60 Gy. También fueron descritos resultados semejantes por otros autores al analizar la IMRT en este tipo de tumores.13,14
Comparaciones similares han sido también realizadas en el tratamiento del cáncer de nasofaringe y en la que varios grupos15-17 han mostrado una significativa mejoría en la cobertura del tumor con un gran porcentaje de dosis mayor y también dosis más bajas en los órganos críticos, tales como tallo cerebral, lóbulo temporal, vía óptica, médula espinal, parótidas y mandíbula.
En nuestra serie, los tumores del área de cabeza y cuello son el grupo que más se trató con IMRT: 37.3% de todas las patologías abordadas con esta tecnología. Estos datos coinciden con otras series,7,10,11 en las que los tumores del área de cabeza y cuello resultan como el sitio más frecuente para el empleo de la IMRT, especialmente en los Estados Unidos.18
De los 60 casos tratados, 36 (60%) son tumores malignos, de los que los tumores de fosa nasal y senos paranasales son los más frecuentes, seguidos de los de cavidad oral, orofaringe, nasofaringe, entre otros (Tabla 2). De estas 36 neoplasias, 22 (61.1%) son de estirpe epidermoide. En resultados de otras publicaciones,7,10 los subsitios del área de cabeza y cuello que son tratados con IMRT corresponden a nasofaringe, tumores de los senos paranasales, orofaringe y lesiones de la supraglotis como los más frecuentes, siendo también el carcinoma epidermoide la estirpe histológica de mayor indicación en las distintas series publicadas.
Un punto crítico en la administración del tratamiento de IMRT, no sólo en los tumores de cabeza y cuello, sino en todos los tumores, son las delimitaciones de los volúmenes objetivos (GTV, CTV1, PTV1, CTV2, PTV2).10,19,20 La adecuada delimitación del tumor primario (GTV) y su expansión (CTV), requiere del conocimiento de la anatomía del área de cabeza y cuello, así como del modelo clínico de la diseminación del tumor primario. La adecuada selección y delineación de los ganglios linfáticos de alto riesgo para enfermedad metastásica (CTV ganglionar), requiere del conocimiento del modelo de progresión metastásica a las diferentes zonas linfoportadora del cuello.19,20 Una reciente revisión de la bibliografía sobre el riesgo de metástasis en cada uno de los niveles ganglionares del cuello, ha sido publicado29,21 y otros excelentes artículos publicados han señalado cómo se deben delinear los distintos niveles de las zonas linfoportadoras del cuello en la tomografía computarizada (TC).20-23 En nuestros pacientes se realizó la delineación de estos volúmenes con base en la intención de tratamiento del tumor primario, IMRT radical o definitiva (GTV, CTV1, PTV1, CTV2, PTV2) o si era posquirúrgico (CTV1, PTV1, CTV2, PTV2).
Respecto a la prescripción de la dosis para el GTV o CTV, varias instituciones y publicaciones han desarrollado guías para considerar estos volúmenes,20,24,25 empleándose esquemas de fraccionamientos convencionales,19,20,26 esquemas de fraccionamiento acelerados20,27 o diferentes estrategias, como es el "incremento o Boost concomitante".26,28 Los resultados con estos esquemas son comparables respecto al control local (CL) con porcentajes entre 79% a 97% a cuatro años y al evaluar los efectos agudos, son aceptables; sin embargo, el porcentaje de complicaciones tardías aun no son evaluables.29,30-33
Los esquemas de IMRT con fraccionamiento acelerado o el de Boost concomitante, tienen un mejor efecto radiobiológico respecto al fraccionamiento convencional, ya que impiden la reparación del daño sub-letal de la radiación en el volumen tumoral y permiten dicha reparación en el tejido sano circunvecino.19
En nuestra serie, el esquema de fraccionamiento más utilizado fue el convencional, ya sea en el tratamiento de los tumores epidermoides o con otras estirpes histológicas (linfomas, sarcomas, adenocarcinoma), en comparación del esquema del "Boost concomitante", que se administró en 10 casos.
Los resultados con IMRT son excelente en los tumores de la nasofaringe con CL entre 90% a 97%, en SVLE entre 79% a 90%, y con SVG entre 79% a 88%.30,34 Ang y colaboradores,35 en cáncer de senos paranasales CL, informan 90% y SVG de 88% a 42 meses de seguimiento. En los tumores de la cavidad oral, se señala CL de 66% a 70% y SVG de 86%;36,37 en la orofaringe, se señalan cifras similares.37,38
En nuestro grupo de pacientes, en forma global y sin individualizar, se tiene una SVLE de 80% a 12.7 meses de seguimiento.
Un grupo importante, tratado en nuestra serie, es el que incluye a los tumores benignos; de un total de 24 casos, 19 son paragangliomas o tumores del glomus yugular (TGY), seguidos por dos adenomas pleomorfos. Los paragangliomas también conocidos como TGY o quemodectomas; que es un tumor raro, con una incidencia de aproximadamente de uno por 1 000 000 de personas.39 Su nomenclatura es confusa e imprecisa pero existe consenso en llamar a los TGY, a las lesiones que se originan en el bulbo yugular, en el glomus timpánico en el oído medio y los tumores del glomus vagal en el área del ganglio adyacente del nervio vagal. Mientras que los paragangliomas que se originan de las células quimiorreceptoras cercanas de la bifurcación de la carótida, son llamados tumores del cuerpo carotideo (TCC).40
El manejo de los TGY o de los TCC tradicionalmente ha sido la escisión quirúrgica, pero los resultados a largo tiempo de seguimiento ha demostrado que la radioterapia con fraccionamiento convencional también puede ser efectiva con respuesta de CL entre 85% a 100%.40-43
Recientemente, Selek y colaboradores,44 han recomendado el empleo de la IMRT con fraccionamiento convencional, debido a las formas irregulares de estas lesiones y de las cercanías a estructuras sanas muy radio-sensibles, en las que el GTV es igual al CTV y se expande con un margen de 3 mm para formar el PTV.
En nuestra serie de casos, los TGY se delinearon el GTV, CTV (GTV de más de 2 mm) y por último el PTV (CTV de más de 3 a 5 mm) y los distintos OAR, administrándose una dosis de 54 Gy/30 fracciones (17 casos) y 50 Gy/ 25 fracciones (dos casos), siendo la dosis promedio en el GTV de 56.6 Gy y en el PTV de 56.2 Gy. Respecto a la respuesta al tratamiento, se tiene RC en 15.8% y RP en 57.8%, para un total de 73.6% de respuestas objetivas, con más de 50% de reducción de la lesión inicial después del tratamiento de IMRT.
Del resto de las neoplasias benignas, los adenomas pleomorfos (dos), nasoangiofibroma juvenil (uno), fibroma osificante (uno), fueron tratados con dosis convencionales entre 45 Gy a 50 Gy en 25 fracciones y en conjunto con la granulomatosis de Weneger, que recibió solo 20 Gy, todos se encuentran sin evidencia de actividad tumoral en el seguimiento que se tienen de estos pacientes. En la literatura sin embargo no hay reportes sobre estas últimas lesiones respecto al manejo con IMRT y es debido en parte a lo relativamente reciente de la introducción de esta tecnología.
El empleo de la IMRT en los tumores del área de cabeza y cuello permite la reducción de la dosis en los órganos de riesgos y en particular en las glándulas salivales, en especial en las glándulas parótidas.45 La xerostomía es el evento secundario más importante y relevante a largo tiempo, después de haber administrado radiación y que genera un efecto deletéreo en la calidad de vida de los pacientes tratados con radioterapia.45,46 Varios autores han analizados los efectos de la radiación sobre las glándulas parótidas.46, 47, 48,49
Eisbrusch y colaboradores,47 demostraron que las parótidas que reciben un promedio menor de 26 Gy, muestran una preservación substancial del porcentaje del flujo salival y que mejoran paulatinamente durante el año posterior de haber recibido la radioterapia. Chao y colaboradores,48 también documentaron si ambas parótidas recibían una dosis promedio menor de 16 Gy un mínimo de 50% del flujo basal salival puede ser preservado y a 32 Gy 25% de ese flujo basal puede ser preservado.
Todos los pacientes de nuestra serie del área de cabeza y cuello toleraron el tratamiento de IMRT. La complicación aguda más frecuente fue la mucositis seguida de faringitis; esta última fue de grado 4 en tres casos y estuvo asociada a la administración de quimioterapia. Lo anterior está informado en la bibliografía, particularmente en el manejo del carcinoma de la nasofaringe, al asociar la IMRT con la quimioterapia;30,50 también se ha observado una excesiva toxicidad en la piel, sobre todo en los casos de IMRT con campos extendidos en los que se trata el primario y extensas zonas linfoportadoras, incluyendo las fosas supraclaviculares.30,51 En nuestro grupo de pacientes, 8.4% cursó con complicación tardía de fibrosis del tejido subcutáneo; sin embargo, puede haber múltiples factores para incrementar la reacción en piel en los pacientes tratados con IMRT y grandes campos.30,51
Una de las principales complicaciones de los pacientes tratados con radioterapia convencional, es la xerostomía, debida a las altas dosis de radiación bilateral de las glándulas salivales mayores. El flujo salival se reduce marcadamente a partir del 10 a 15 Gy, como lo han señalado varios autores,47,49,52-54 con dosis mayores de 50 Gy en ambas parótidas, el daño es irreversible generando la xerostomía permanente. La IMRT es capaz de reducir las dosis en la glándulas salivares mientras que en forma simultánea deposita alta dosis en el volumen blanco del primario. En nuestra serie, la dosis promedio a las parótidas es menor de 26 Gy o la dosis de 30 Gy cubriendo menos de 50% de las parótidas. La xerostomía a los tres meses después de la IMRT en nuestro grupo era de 64% grado 2, pero a los 14 meses sólo alcanzó 11% y 55.6% sin xerostomía. Al igual que en otras series publicadas,30,47-49 los pacientes tratados con IMRT recuperan su flujo salival de manera más completa que los tratados con radioterapia convencional.
¿ CONCLUSIÓN
La IMRT representa un nuevo paradigma en la planeación de la radioterapia con un enorme potencial para crecer. Los resultados de estudios preliminares, que analizan las curvas de distribución de dosis en las planeaciones e independientes del subsitio tratado, está asociado con una sustancial reducción en la toxicidad asociada al tratamiento. La adecuada inmovilización del paciente, la identificación exacta de la etapa clínica de la enfermedad, el conocimiento exacto para la selección y delineación de la potencial enfermedad sub-clínica que requiere radiación adyuvante para así definir los distintos volúmenes de tratamientos GTV, CTV, PTV. También es muy importante definir y delinear los distintos órganos de riesgo (OAR), los cuales son cruciales para evaluar los distintos histogramas, dosis, volumen y su potencial impacto en la toxicidad aguda y tardía.
Los datos de nuestra serie de pacientes en los distintos sub-sitios tratados con IMRT, nos permite tener un conocimiento sobre este procedimiento como seguro, reproducible y poseer las distintas herramientas para un excelente control de calidad, y lograr así los resultados en el control local, así como en la toxicidad como son presentadas en la bibliografía.
Correspondencia: Dr. Pomponio José Luján Castilla.
Dr. ATL. N° 6, Manzana 3. Unidad Belisario Domínguez, Tlalpan. 14310, México
D. F. Teléfono: 55 5678 5918.
Correo electrónico: pjlujanc@yahoo.com.mx