Introducción: El cáncer se ha convertido en un problema de salud pública, lo que ha obligado a utilizar las diversas terapias existentes para tratarlo, una de ellas la quimioterapia. Los agentes de quimioterapia tienen una toxicidad específica para diferentes niveles, la neurotoxicidad de los citotóxicos podría estar relacionada con el Síndrome de Dolor Miofacial (SDM). La doxorrubicina es un potente y efectivo fármaco antitumoral, empleado para el tratamiento de tumores sólidos y hematopoyéticos, sin embargo el factor que limita su uso clínico, es su toxicidad acumulativa e irreversible.
Objetivo: Conocer la relación existente entre la quimioterapia a base de doxorrubicina y la presentación del SDM.
Materiales y métodos: Se incluyeron pacientes que recibieron quimioterapia a base de doxorrubicina, y que presentaron algún síntoma relacionado con el SDM. Los pacientes fueron interrogados y explorados, para identificar los signos y síntomas de dicho síndrome. Se utilizó la prueba de ji cuadrada, para probar la independencia entre las variables.
Resultados: La frecuencia de SDM fue de 22.72%, el sexo femenino se afectó con mayor frecuencia. El cáncer de mama se presentó en un 75%, el esquema de quimioterapia más frecuente fue doxorrubicina + ciclofosfamida + docetaxel con un 25%. La prueba de ji cuadrada, mostró relación entre los agentes de quimioterapia y la presencia de mialgia, ya que el valor fue de 0.045 (p<0.05).
Antecedents. Cancer has become a public health problem, which means that physicians has the necessity of use different methods to treat patients, one of them is chemotherapy. Chemotherapy agents have an specific toxicity for different levels, neurotoxicity could be related with Miofacial Syndrome Pain. Doxorubicin is a potent and effective antitumoral drug, it is used to treat solid and hematopoietic tumors, nevertheless accumulative and irreversible toxicity limit its clinical use.
Objective. Know relationship between doxorubicin chemotherapy and Miofacial Syndrome Pain.
Patients and methods. This study includes 88 patients that were treated with chemotherapy based on doxorubicin and had a symptom related with Miofacial Syndrome Pain. Patients were interrogated and explored to identify signs and symptoms of the syndrome. It was used chi-squared test (χ2) to probe independency between variables.
Results. The frequency of Miofacial Syndrome Pain was 22.72%, women were more affected, 75% of the patients had diagnostic of breast cancer, the combination Doxorubicin+ Cyclophosphamide +Docetaxel was the most frequent. Chi-squared test (2) showed dependency between chemotherapy agents with myalgia and hypertonicity (p<0.05).
¿ INTRODUCCIÓN
El cáncer se ha convertido en un problema de salud pública, lo que ha obligado a utilizar las diversas terapias existentes para tratarlo. La quimioterapia es una de las medidas terapéuticas, consiste en la administración de fármacos que causan la muerte de las células cancerosas, destruyen los cromosomas y bloquean la división celular, la cual se emplea para tratar a pacientes con enfermedad avanzada o recurrente.1-4
La doxorrubicina es un agente de quimioterapia derivado de las antraciclinas, los cuales son aislados de Streptomyces peucetius variante caesius. Es un potente y efectivo fármaco antitumoral, empleado para el tratamiento de tumores sólidos y hematopoyéticos, sin embargo el factor que limita su uso clínico, es su toxicidad cardiaca acumulativa e irreversible.5-7
Se han propuesto diversos mecanismos por los cuales la doxorrubicina causa muerte celular, entre los que se incluyen la intercalación con el DNA, produciendo inhibición de la síntesis y de la función del DNA y consecuentemente la síntesis de RNA, inhibe la transcripción a través de la inhibición de la RNA polimerasa dependiente del DNA. Hay formación de radicales libres de oxígeno citotóxicos que producen rupturas en el DNA. 4,6-15 Se ha propuesto la interacción directa con el sistema contráctil de actina-miosina.14
Su toxicidad se caracteriza por cardiotoxicidad (hipotensión, taquicardia, arritmia), mielosupresión (leucopenia y trombocitopenia), náusea, vómito, mucositis, diarrea, impide la espermatogénesis, esterilidad, hiperpigmentación de las uñas, alopecia y color rojo naranja de la orina. También se ha reportado fatiga, anemia, dolor, toxicidad dermatológica (eritrodisestesia palmoplantar) y paralgesia.8,11,13,15,16
Gallego Rubio y colaboradores realizaron un estudio fase II, en el cual evaluaron la eficacia y seguridad de la adriamisina liposomal pegilada en combinación con ciclofosfamida, en pacientes con cáncer de ovario platinoresistentes. La toxicidad reportada fue neutropenia, anemia, mucositis, fatiga, astenia, letargo, nausea, vómito, anorexia, estreñimiento, estomatitis, disfagia, sequedad de boca, ageusia, dolor abdominal, trombocitopenia, eritrodisestesia palmo-plantar (síndrome mano-pie), edema, alopecia, lipotimia, urticaria, nerviosismo, parestesias y dispepsia.16
La toxicidad de los agentes de quimioterapia ha sido ampliamente estudiada, se atribuye a la inespecificidad de los citotóxicos que afectan a otras células y tejidos normales del organismo, sobre todo si se encuentran en división activa. Los agentes de quimioterapia tienen una toxicidad específica para diferentes niveles: medular, neurológico, dermatológico, pulmonar, cardiaco, gastrointestinal, hepático, renal, vesical, vascular, ocular y gonadal. La neurotoxicidad de los citotóxicos podría estar relacionada con el Síndrome de Dolor Miofacial (SDM).17,18
El SDM es un trastorno de músculos regionales caracterizado por hipersensibilidad localizada en bandas musculares, asociado a disfunción de la articulación temporomandibular, neuropatías y a veces, disfunción del sistema autónomo, en relación a factores conductuales y psicosociales.19-29 Se caracteriza por hipersensibilidad muscular, presencia de puntos gatillos sobre una banda tensa palpable, dolor referido, espasmo muscular, cefalea, alteraciones neurológicas (parestesia, disestesia, neuralgia, neuritis y/o parálisis facial), disfunción de la articulación temporomandibular y trastornos autonómicos. Su etiología es multifactorial, entre los factores etiológicos más importantes que dan origen al dolor y a la disfunción en general, se encuentran las desarmonías oclusales, hábitos parafuncionales, maloclusión, factores psicológicos o emocionales (ansiedad, depresión, tensión, estrés, frustración, etc.), traumas extrínsecos, masticación unilateral, lesiones de una raíz nerviosa, neuralgia o compresión nerviosa, procesos neuropáticos, inflamaciones articulares y trastornos de sueño.19-34
La multifactorialidad de la etiología, justifica los variados enfoques terapéuticos existiendo una gran dependencia entre ellos, por lo que el tratamiento es multidisciplinario y multimodal. Tradicionalmente, el tratamiento del SDM ha incluido el uso prolongado de AINE, férulas oclusales, fármacos miorrelajantes, antidepresivos, terapia física, técnicas de relajación, ultrasonido, estimulación electrogalvánica, masaje, acupuntura, inyecciones con anestésicos locales, solución salina, esteroides, toxina botulínica tipo A, estiramientos musculares, hipnoterapia, bio-feedback, entre otras.20,26,27,29,30-32,34-43
¿ MATERIALES Y MÉTODOS
Se realizó un estudio observacional, correlacional, prospectivo y transversal. En el periodo de noviembre de 2008 a junio de 2009 se reclutaron un total de 88 pacientes con diagnóstico de cáncer bajo tratamiento de quimioterapia, a base de doxorrubicina. Se evaluaron aquellos pacientes que presentaron algún síntoma relacionado con el SDM. Se explicó a los pacientes el estudio y se les invitó a participar, aquellos que firmaron consentimiento informado fueron incluidos en el estudio.
Los pacientes fueron interrogados y explorados para identificar los signos y síntomas propios del SDM, el dolor fue evaluado mediante una escala verbal numérica. Se excluyeron del estudio, aquellos pacientes que no presentaron dicho síndrome. Una vez obtenidos los datos, se capturaron en el programa Excel y posteriormente se realizó el análisis mediante el paquete estadístico SPSS (versión 17).
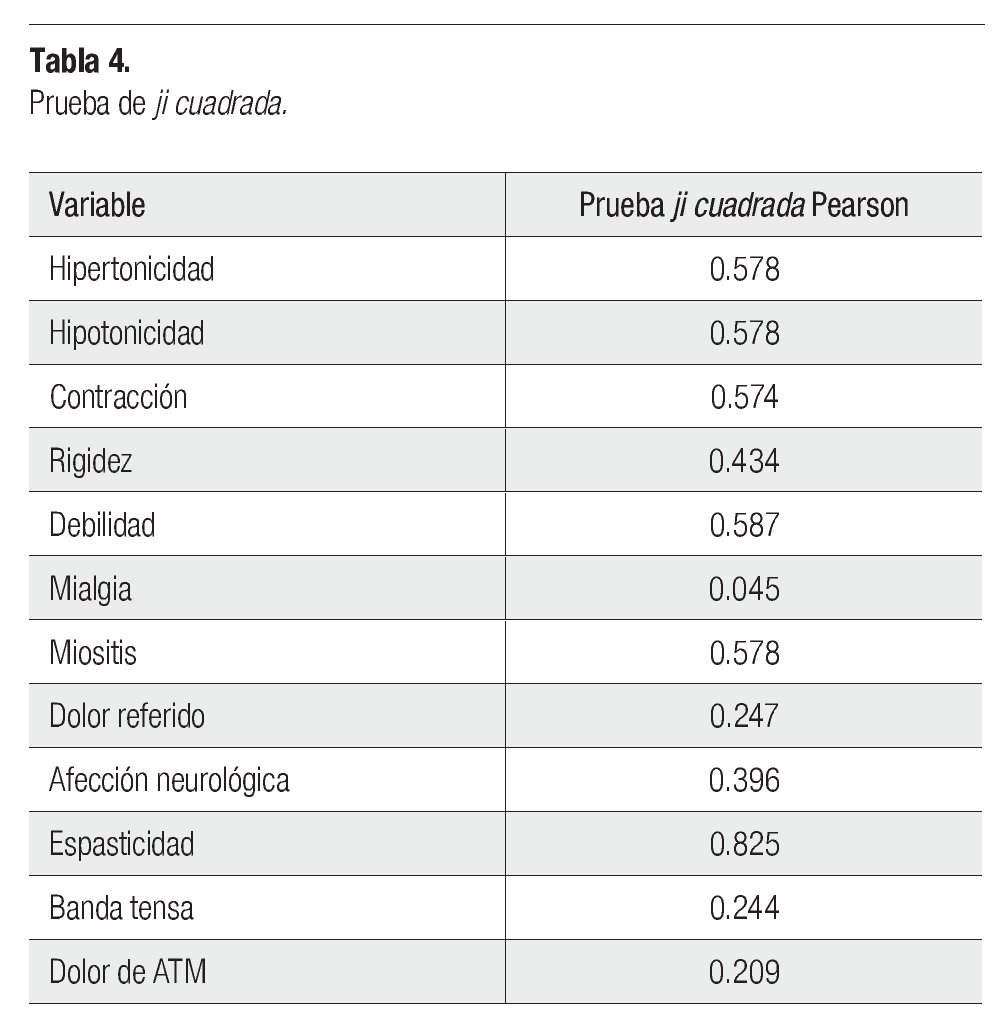
Para probar la independencia entre las variables agentes citotóxicos y los signos y síntomas del SDM se utilizó la prueba ji cuadrada.
¿ RESULTADOS
Se identificaron un total de 88 pacientes que recibieron esquema de quimioterapia a base de doxorrubicina, de los cuales 20 pacientes (22.72%) fueron diagnosticados con SDM, 19 pacientes del sexo femenino (95%) y uno del sexo masculino (5%). La edad de los pacientes se encontró en un rango de 40, con una edad mínima de 34 y edad máxima de 65. La media de edad fue de 52.30 y una desviación estándar de 7.491.
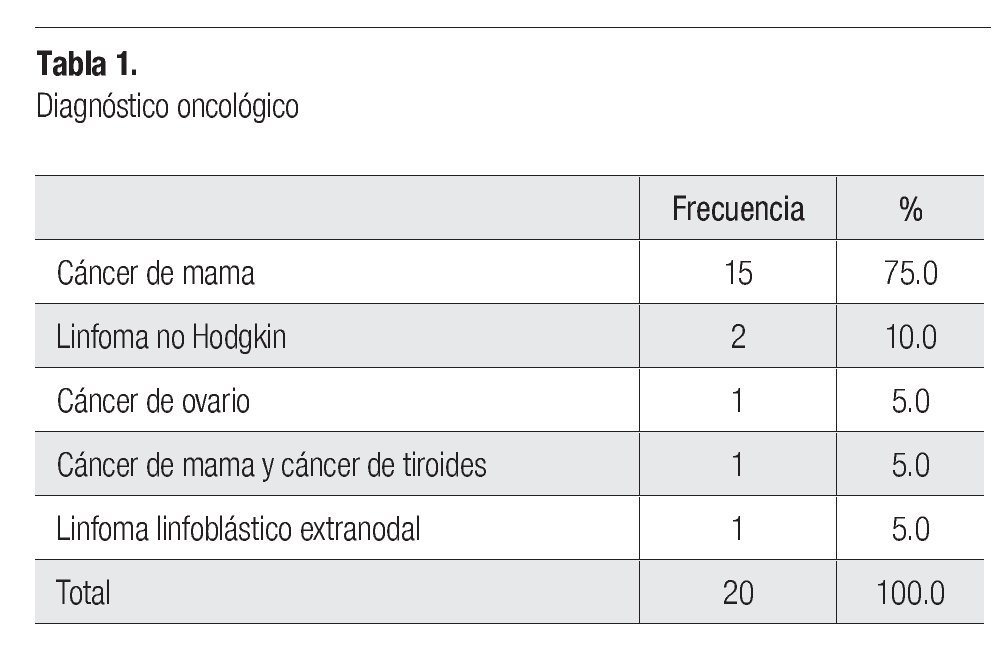
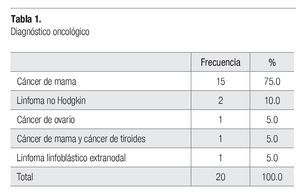
El diagnóstico oncológico que se presentó con mayor frecuencia fue el cáncer de mama en un 75% (15 pacientes), seguido del linfoma no Hodgkin con 10% (dos pacientes), cáncer de ovario, cáncer de mama con cáncer de tiroides y linfoma linfoblástico extranodal con 5% (un paciente) cada uno (Tabla 1).
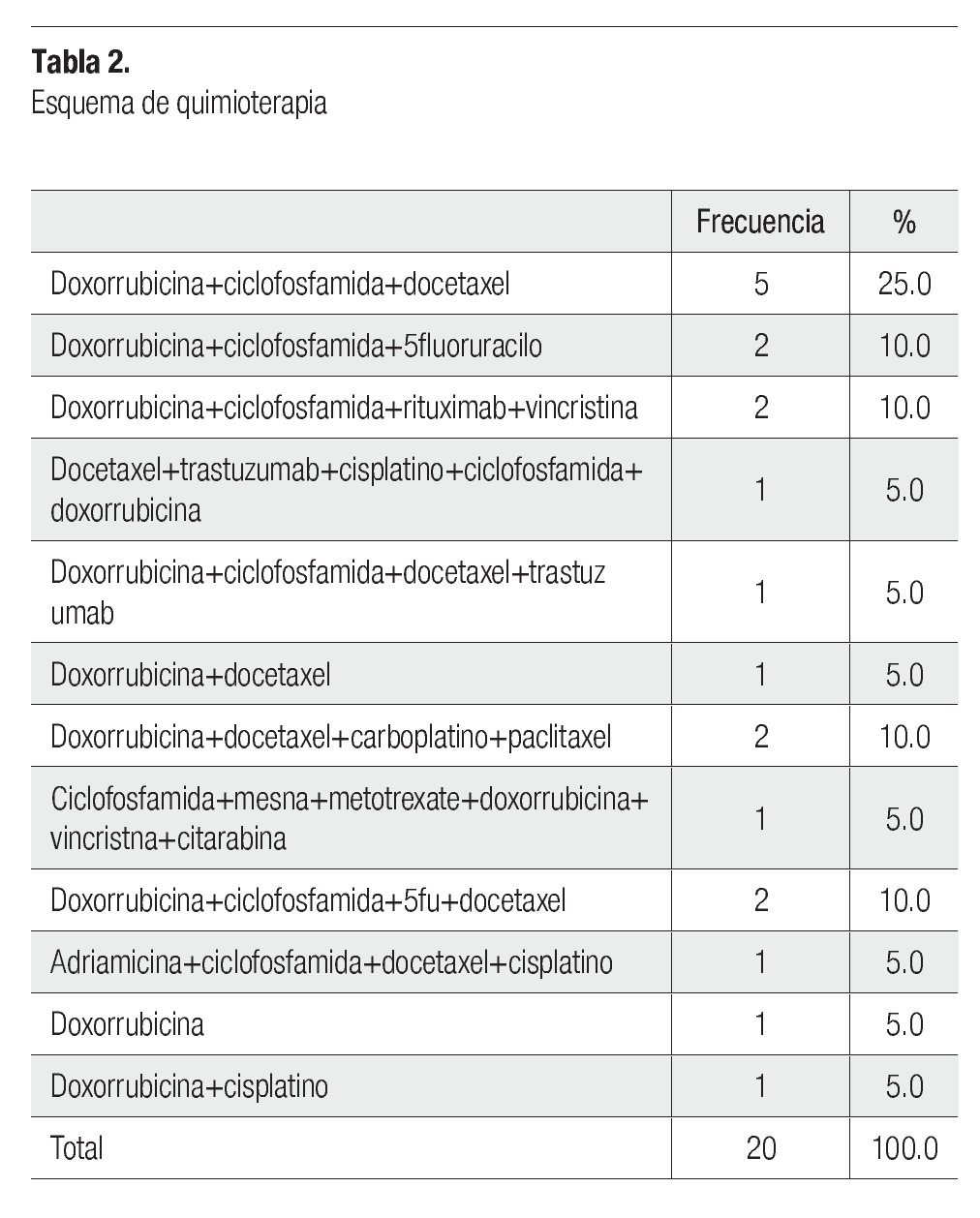
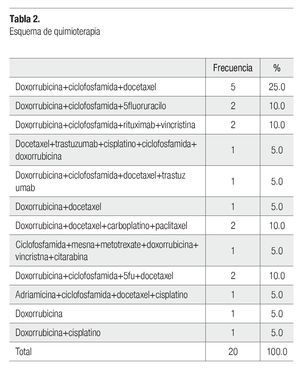
La combinación doxorrubicina + ciclofosfamida + docetaxel fue el esquema de quimioterapia que se presentó con mayor frecuencia con 25% (cinco pacientes), seguido doxorrubicina + ciclofosfamida + 5fluoruracilo, doxorrubicina + ciclofosfamida + rituximab + vincristina, doxorrubicina + docetaxel + carboplatino + paclitaxel y doxorrubicina + ciclofosfamida + 5 fluoruracilo + docetaxel en 10% (dos pacientes), el resto de los esquemas se presentaron en un 5% (un paciente) (Tabla 2).
El dolor fue evaluado mediante la escala verbal numérica, con un mínimo de dolor de tres y un máximo de 10, la media fue de 6.88 y desviación estándar de 1.763, siendo la moda seis con 21.2%, seguida por los valores cinco y ocho con 18.2% y siete y nueve con 15.2%.
El 30.3% de los pacientes presentaron alguna enfermedad sistémica, siendo la diabetes mellitus tipo 2 la más frecuente al presentarse en tres pacientes (15%).
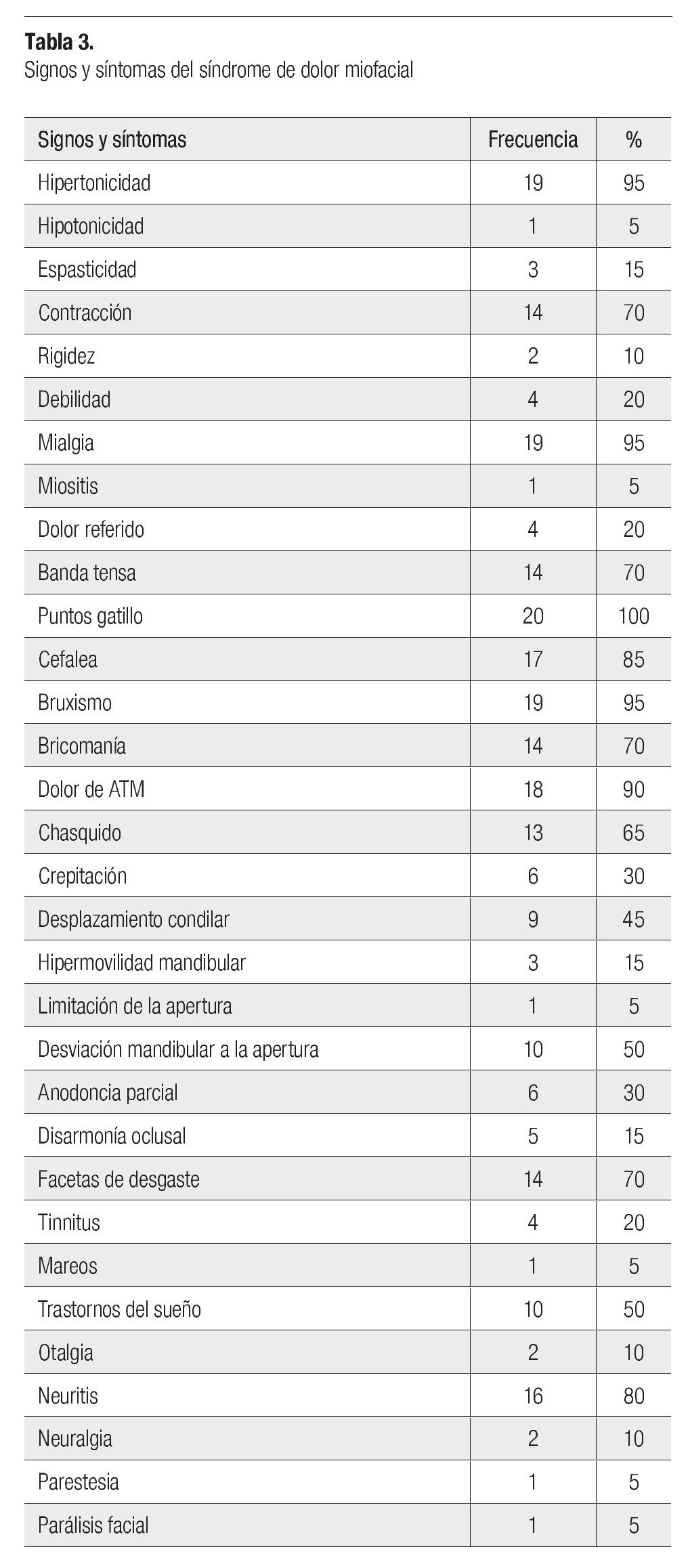
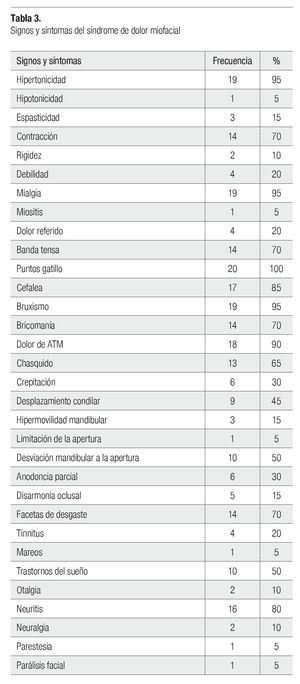
Dentro de los signos y síntomas musculares, la presencia puntos gatillo fue el signo más frecuente, ya que se presentó en 20 pacientes (100%), en seguida la mialgia e hipertonicidad presentes en 19 pacientes (95%), en tercer lugar se encontró la cefalea al estar presente en 17 pacientes (85%); 14 pacientes (70%) presentaron contracción y una banda tensa palpable, en 4 pacientes (20%) hubo debilidad muscular y dolor referido, 3 pacientes (15%) tuvieron espasticidad muscular (Tabla 3).
Dentro de los hábitos parafuncionales, estuvieron presentes el bruxismo en un 95% (19 pacientes) y bricomanía en 70% (14 pacientes) (Tabla 3).
El dolor de la articulación temporomandibular fue manifestado por 18 pacientes (90%), siendo el síntoma articular con mayor presencia, en seguida el chasquido en 13 pacientes (65%), 10 pacientes (50%) presentaron desviación mandibular al realizar movimiento de apertura mandibular, nueve pacientes (45%) cursaron con desplazamiento condilar, seis pacientes (30%) tuvieron crepitación y tres pacientes (15%) hipermovilidad mandibular (Tabla 3).
La alteración dental que se presentó con mayor frecuencia fue la presencia de facetas de desgaste en 14 pacientes (70%), seguida de anodoncia parcial en seis pacientes (30%) y disarmonía oclusal en cinco pacientes (15%) (Tabla 3).
Otros síntomas que manifestaron los pacientes fueron trastornos del sueño 10 pacientes (50%), tinnitus cuatro pacientes (20%), otalgia fue referido por dos pacientes (10%) y mareos fue manifestado por un paciente (5%) (Tabla 3).
La neuritis fue la alteración neurológica mas frecuente, se presentó en 80% (16 pacientes), neuralgia en 10% (dos pacientes), 5% (un pacientes) tuvieron parestesia y parálisis facial (Tabla 3).
Los puntos gatillo evaluados fueron occipitofrontal, supraorbitario, lacrimopalpebral, infraorbitario, base de la nariz, mentoniano, ATM, esternocleidomastoideo en su origen, región media e inserción, occipital, trapecio, masetero en su origen región media e inserción, temporal en su región anterior, media y posterior y el pterigoideo lateral. En las siguientes gráficas, se muestra la frecuencia de cada punto gatillo del lado derecho, izquierdo, ambos lados y ninguno.
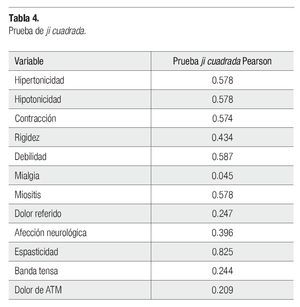
Para probar la independencia entre las variables agentes citotóxicos y los signos y síntomas del SDM se utilizó la prueba ji cuadrada, con lo cual se concluye que los agentes citotóxicos y la presencia de mialgia si tienen relación, ya que el valor fue de 0.045 (p<0.05), en tanto que el resto de las variables muestran independencia con los agentes citotóxicos pues el valor fue mayor que 0.05 (Tabla 4).
¿ DISCUSIÓN
La frecuencia del SDM en este estudio realizado en el Centro Oncológico Estatal ISSEMYM fue de 22.72%, en contraste con lo reportado en la literatura (Forteza,20 Pereda y colaboradores,44 Gómez Pombo y colaboradores,23 Vázquez Gallego,24 Ketenci y colaboradores27) que es de 25-85%, sin embargo la muestra de pacientes es corta, por lo que este estudio marca la pauta para realizar estudios posteriores.
La literatura indica (La O Salazón y colaboradores,45 Forteza,20 Vázquez Gallego,24 Grau León y colaboradores,36) que este trastorno se presenta con mayor frecuencia en personas jóvenes, cuya edad oscila entre 20 y 40 años, en nuestra serie la edad oscila entre 34 y 65 años, con una media de edad de 52.3, mediana de 51.5 y moda de 50 años.
Según diversos reportes (Forteza,20 La O Salazón y colaboradores,45 Vázquez Gallego,24 Barnet y colaboradores,45 Grau León y colaboradores,36 Oviedo-Montes y colaboradores,45) el SDM es más habitual en la población femenina, lo cual coincide con los datos arrojados por este estudio, ya que el 95% (19 pacientes) fueron del sexo femenino y 5% (un paciente) del sexo masculino.
Se apoya que el SDM tiene una etiología multifactorial, entre los factores que destacan son desarmonía oclusal, maloclusión, factores psicológicos o emocionales (ansiedad, depresión, tensión, estrés, frustración, etc.), traumas extrínsecos, masticación unilateral, hábitos parafuncionales, lesiones de una raíz nerviosa, neuralgia o compresión nerviosa, procesos neuropáticos, inflamaciones articulares y trastornos de sueño.
Los factores que se presentaron en los pacientes de este estudio fueron hábitos parafuncionales como bruxismo 95%, trastornos psicofisiológicos como estrés (55%), ansiedad (60%) y depresión (55%), los cuales se han encontrado comúnmente asociados al síndrome.
Las lesiones nerviosas que tuvieron los pacientes fueron neuritis (80%), neuralgia (10%), parestesia (5%) y parálisis facial (5%), considerando que fueron secundarias a la neurotoxicidad de los agentes de quimioterapia y que pueden ser causa del desarrollo de SDM. Sin embargo no se han publicado estudios al respecto.
El SDM muestra un cuadro clínico multivariado, dado que existe una diversidad entre los signos y síntomas que pueden presentarse. A nivel muscular la presencia de puntos gatillo, estuvo presente en el 100% de los pacientes, mialgia en un 95%, hipertonicidad 95%, cefalea 85%, presencia de una banda tensa y contracción 70%, siendo los signos y síntomas que se presentaron con mayor frecuencia en los pacientes del estudio.
A nivel articular el dolor (90%), chasquido (65%), desviación mandibular a la apertura (50%) y desplazamiento condilar (45%) fueron los que más frecuentes en el estudio, siendo estos indicativos de patología articular.
Los síntomas otológicos comúnmente se presentan, cuando existe alteración en la articulación temporomandibular, los que estuvieron presentes en nuestro estudio fueron tinnitus (20%), mareos y otalgia (5%).
La teoría que se propone para explicar la asociación de la neurotoxicidad con el SDM, es la siguiente, tras la administración de los agentes de quimioterapia se produce una lesión neurológica secundaria a la toxicidad de los mismos, este proceso lesivo produce una respuesta inflamatoria, que provoca la liberación de neuropéptidos y la aparición de células inflamatorias. Los neuropéptidos excitan las fibras nerviosas sensitivas y simpáticas y se producen metabolitos comprometidos en la inflamación, dolor y la toxicidad celular tales como potasio, serotonina, bradicinina histamina, cininas y prostaglandinas que sensibilizarían a los nociceptores locales y provocan espasmo muscular. El aumento sostenido de lo productos nocivos de desechos del metabolismo oxidativo contribuyen al inicio de la musculodistrofia. Si la longitud normal del músculo no se restablece, el dolor continúa, aunado a alteraciones posturales, conductuales y funcionales pueden alargar e incrementar el SMD.
El cáncer de mama (75%) fue el más comúnmente asociado con el SDM en este estudio.
El esquema de quimioterapia que se presentó con mayor frecuencia fue la combinación doxorrubicina + ciclofosfamida + docetaxel con 25% (cinco pacientes).
En la mayoría de los casos el dolor es uno de los principales motivos de consulta. En este estudio, el dolor fue evaluado mediante la escala verbal numérica, cuyos datos obtenidos fueron con un mínimo de dolor de cuatro y un máximo de 10, la media fue de 6.95, con una desviación estándar de 1.701; la moda fue 6 y la mediana 6.5.
El tratamiento del SDM es multidisciplinario y multimodal, por lo que es importante trabajar en equipo para poder ofrecerle al paciente una mejor calidad de vida, y así asegurar una mejor respuesta al tratamiento. Dado que hay una gran variedad de tratamientos, es importante conocer la causa del padecimiento para incidir en dichos factores.
¿ CONCLUSIONES
La neurotoxicidad de los agentes de quimioterapia podría ser considerado como un factor etiológico del SDM, por lo que este estudio es la base para realizar futuros estudios, a fin de determinar los principales agentes de quimioterapia que desencadenan la presentación de este síndrome. De esta forma, se busca establecer medidas preventivas y terapéuticas eficaces, ya que este padecimiento afecta la calidad de vida de los pacientes oncológicos.
Correspondencia: P.M.F. Karla Gabriela Ocampo García.
Av. Solidaridad Las Torres 101 Esq. Colonia Del Parque Toluca, CP 50180, Estado de México, México.
Teléfono: 01 (722) 276 6820. Celular: 722 394 1848. Fax: (722) 217 2074.
Correo electrónico: pmfcoe@hotmail.com