El absceso del músculo psoasilíaco es una entidad poco común y suele estar relacionada con enfermedad del tracto gastrointestinal. Sus manifestaciones clínicas suelen ser inespecíficas, por lo que el diagnóstico se ve demorado con frecuencia. En España, la enfermedad de Crohn es la enfermedad que se asocia más a menudo a esta complicación séptica; a pesar de esto, también es una rareza dentro de la evolución de la enfermedad. Se presentan 3 casos de pacientes con enfermedad de Crohn, en los que se desarrolló absceso del músculo psoasilíaco como complicación en distintos momentos evolutivos de la enfermedad (al diagnóstico, en el primer año y tras una larga evolución de la enfermedad de Crohn). Se revisa la literatura médica al respecto, con especial atención a los factores clínicos asociados a la aparición de esta complicación y al tratamiento terapéutico tanto del absceso como de la enfermedad de base.
El absceso del músculo psoasilíaco (AP) es un proceso poco común y de difícil diagnóstico debido a su presentación clínica inespecífica (dolor abdominal, fiebre, dificultad para la deambulación). Su etiología más frecuente es la secundaria a enfermedades de las estructuras retroperitoneales contiguas. Los AP primarios tienen una patogenia hematógena, por inmunosupresión, uso de drogas por vía parenteral o virus de la inmunodeficiencia humana, y Staphylococcus aureus es el agente causal más frecuente1. Aproximadamente el 50% de los AP secundarios son de origen gastrointestinal2, principalmente la enfermedad de Crohn (EC) (en el 23 al 73% de los casos)2,3, pero también otros procesos como diverticulitis, apendicitis o neoplasia de colon. Otros orígenes pueden ser las infecciones del tracto urinario, osteomielitis vertebral, artritis séptica, sacroileitis piógena o tuberculosa1. Por esta razón, en España y siempre que no haya un contexto epidemiológico que aumente la posibilidad de otras etiologías como la tuberculosis, la EC debe considerarse como la causa más probable del absceso.
El proceso inflamatorio transmural propio de la EC, que a menudo se acompaña de la formación de úlceras profundas de la mucosa, puede evolucionar hacia la perforación de la pared intestinal, la formación de trayectos fistulosos y la adherencia inflamatoria entre asas intestinales cercanas. Este proceso deriva a menudo en la formación de abscesos intraabdominales que, típicamente, se desarrollan entre asas de intestino delgado o entre éstas y las estructuras anatómicas adyacentes. El músculo psoasilíaco se encuentra adyacente al íleon terminal, lo que explicaría la asociación entre el AP y la EC. Se presenta una serie de 3 pacientes con EC que desarrollaron AP y se revisa la literatura médica al respecto.
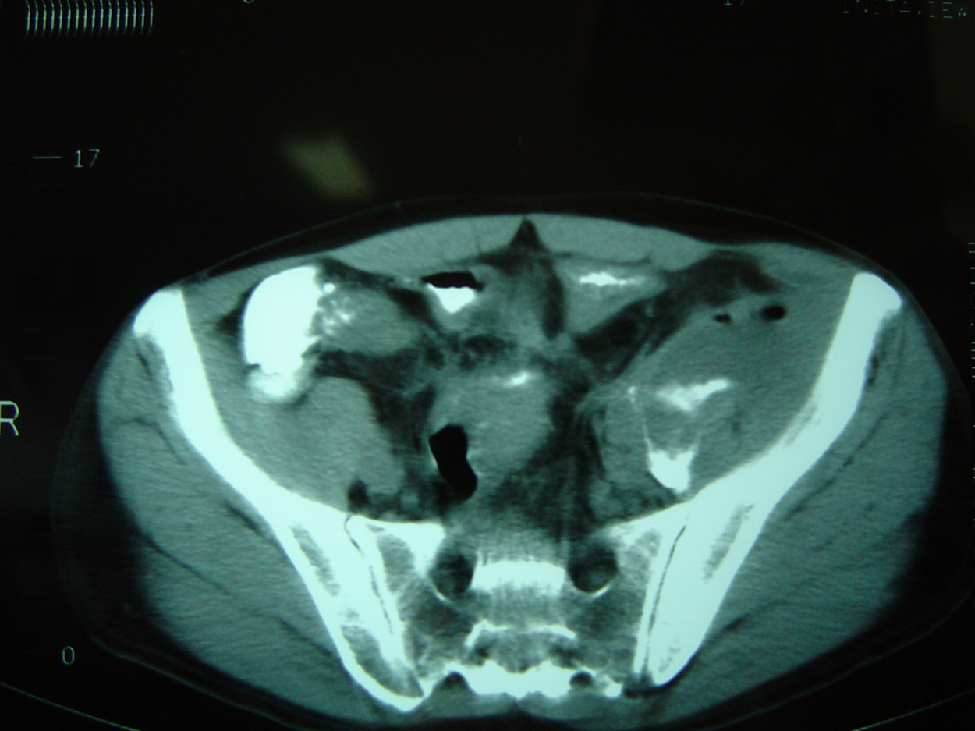
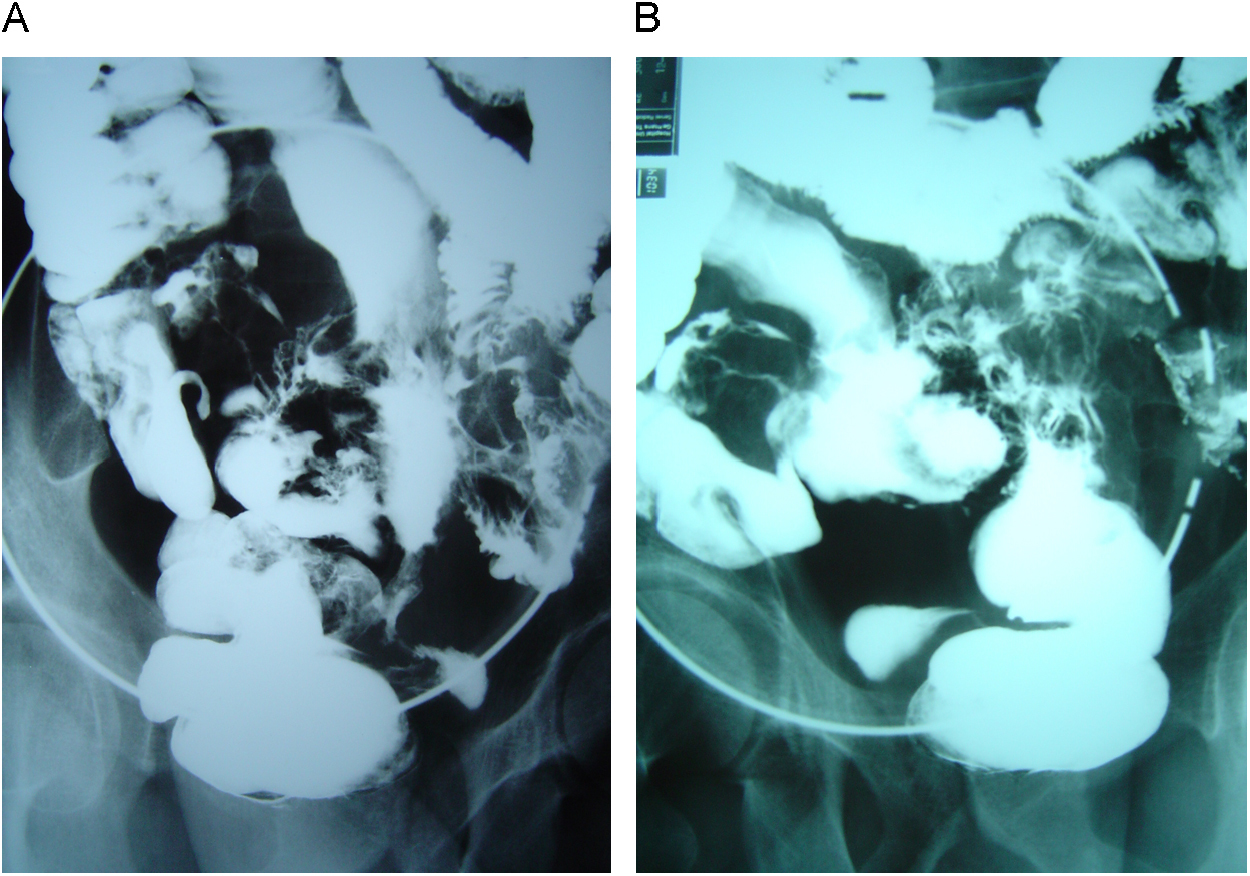
Caso clínico 1Varón de 45 años, fumador de 20 cigarrillos por día hasta 7 meses antes de la consulta, con antecedentes familiares de EC en un hermano, diagnosticado en otro centro de EC de localización ileal y cólica (sigma) 7 años antes y en tratamiento con azatioprina (AZA) por dependencia a los corticoides desde hacía 2 años. Unos meses antes, el paciente recibió 3 infusiones de infliximab como tratamiento de una fístula enterovesical que se constató mediante cistoscopia, sin mejoría clínica. Desde entonces presentaba infecciones de orina de repetición. Remitido a nuestro centro para estudio y tratamiento de la fístula; el paciente refería al ingreso fiebre de varios meses de evolución (a pesar del tratamiento antibiótico), junto con dolor en muslo e ingle izquierda y dificultad para la deambulación. En ese momento, el paciente seguía tratamiento con AZA (125mg/día), mesalazina (1,5g/día) y 5mg de prednisona. En la exploración física se evidenciaba dolor a la palpación abdominal en fosa ilíaca y flanco izquierdos, así como dolor a la rotación y flexión de pierna izquierda. En la analítica destacaba la elevación de reactantes de fase aguda (433.000 × 109/l de plaquetas, 789mg/dl de fibrinógeno) sin otras alteraciones. Bajo la sospecha de absceso intraabdominal, se inició cobertura antibiótica de amplio espectro y se realizó tomografía computarizada (TC) abdominal que demostró la existencia de una colección en músculo psoasilíaco izquierdo, con niveles hidroaéreos (figura 1), así como fístula enterovesical y engrosamiento concéntrico de asas de intestino delgado. El tránsito baritado de intestino delgado constató fístulas ileoileal, ileosigmoidea e ileovesical (figura 2). Se decidió tratamiento quirúrgico electivo, y se realizó resección de 20cm de íleon y ciego con anastomosis ileocólica, sigmoidectomía con anastomosis terminoterminal, cierre de las fístulas y drenaje del absceso. El paciente evolucionó favorablemente y siguió un tratamiento de mantenimiento con AZA sin presentar recidiva clínica ni recurrencia endoscópica en neoíleon terminal en los controles anuales efectuados en los 10 años siguientes.
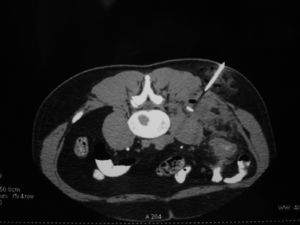
Figura 1. Tomografía computarizada abdominal en la que se aprecia absceso de músculo psoasilíaco con imágenes aéreas en su interior.
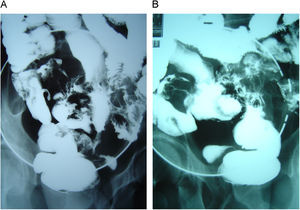
Figura 2. Tránsito intestinal baritado que muestra múltiples trayectos fistulosos originados en íleon terminal (A) con paso de contraste a sigma y vejiga urinaria (B).
Caso clínico 2Varón de 18 años, fumador de 20 cigarrillos por día, sin antecedentes patológicos de interés, que ingresó en nuestro centro por síndrome febril de 3 semanas de evolución junto con dolor en región inguinocrural derecha que impedía la deambulación. En la analítica al ingreso únicamente destacaban un recuento de leucocitos de 12.700 × 109/l y una velocidad de sedimentación globular (VSG) de 33mm en la primera hora. Con la intención de descartar artritis de cadera, se realizó ecografía con punción que obtuvo contenido purulento y cuyo cultivo resultó positivo para Streptococcus milleri y Escherichia coli. Se realizó drenaje quirúrgico y se inició tratamiento antibiótico empírico por posible infección de partes blandas. Tras descartarse lesión osteoarticular mediante gammagrafía ósea se solicitó TC abdominal que mostró AP derecho con engrosamiento mural circunferencial de íleon terminal. En el tránsito intestinal se evidenció afectación de los últimos 25cm de íleon con estenosis y ulceración compatible con EC. La colonoscopia no mostró alteraciones, salvo fijación y rigidez de válvula ileocecal que impedía la ileoscopia. Se decidió abordaje quirúrgico, en el que se constató estenosis de íleon terminal y AP mantenido por fístula en íleon terminal; se practicó resección ileal de 35cm con anastomosis ileocecal y legrado de fístula. La pieza quirúrgica confirmó el diagnóstico de EC. Tras un postoperatorio correcto, se inició tratamiento de mantenimiento con tiopurinas. El paciente se mantuvo en remisión clínica y endoscópica durante los 5 años.
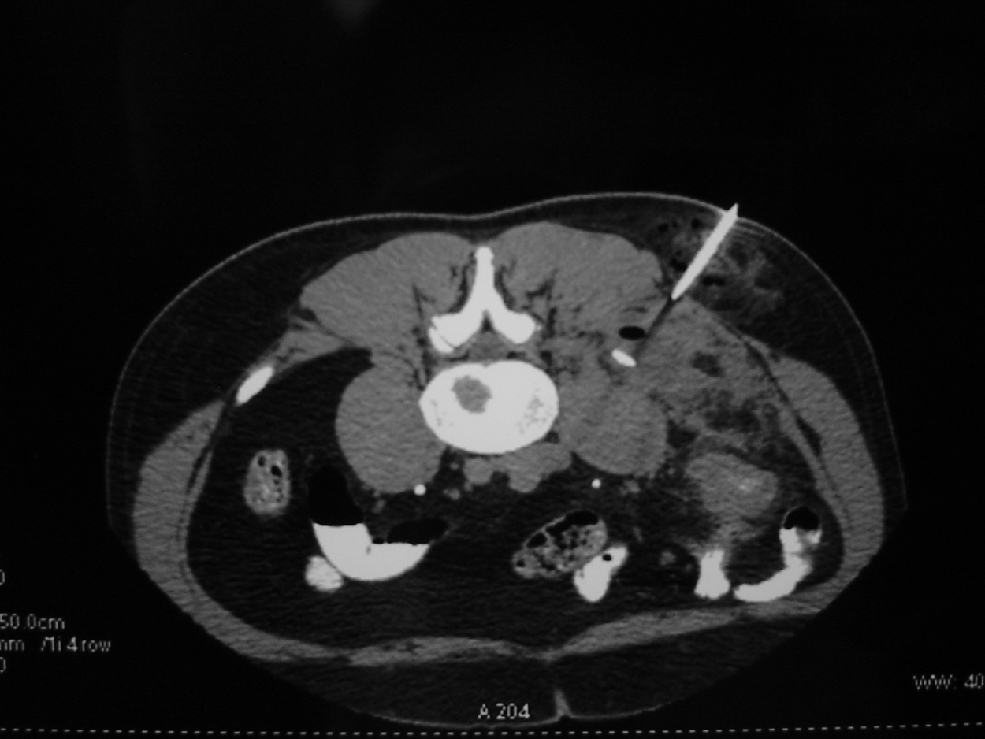
Caso clínico 3Varón de 45 años, con antecedente de absceso perianal fistulizado un año antes del diagnóstico de la EC, con afectación exclusiva ileal y patrón inflamatorio. Se inició tratamiento con esteroides y tiopurinas que el paciente no toleró, por lo que se pautó mesalazina en dosis de 4g/día. A los 7 meses del diagnóstico el paciente presentó recidiva clínica con TC abdominal que descartaba masa inflamatoria o absceso, y se inició un nuevo curso de esteroides asociados a metotrexato. Dos meses más tarde ingresó por un cuadro de aumento del número de deposiciones, dolor abdominal de predominio en fosa ilíaca derecha, fiebre y dolor en zona lumbar derecha que dificultaba la deambulación. En la exploración física destacaba la palpación de masa dolorosa en fosa ilíaca derecha. En la analítica presentaba un recuento de leucocitos de 16.600 × 109/l, 525.000×109/l de plaquetas, VSG de 67mm en la primera hora, 670mg/dl de fibrinógeno y proteína C reactiva de 91,37ng/ml. La TC abdominal evidenció engrosamiento mural difuso del íleon terminal con infiltración de la grasa adyacente y presencia de una colección multiseptada que afectaba a los músculos ilíaco, psoas e ileopsoas derechos, compatible con absceso. Se realizó drenaje percutáneo guiado por TC (figura 3), tras la cual presentó mejoría clínica y analítica. Posteriormente, se decidió tratamiento quirúrgico con resección ileocecal y anastomosis ileocólica laterolateral y desbridamiento del músculo psoas derecho.
Figura 3. Drenaje percutáneo dirigido por tomografía computarizada de un absceso de psoas.
DiscusiónEl diagnóstico de AP como complicación de la EC puede no resultar fácil y, en muchos casos, su diagnóstico puede verse demorado por una presentación clínica inespecífica. En los casos comentados la sintomatología dominante fue la fiebre, el dolor abdominal de predominio en fosa ilíaca derecha y la dificultad para la deambulación con flexión dolorosa de la cadera, clínica que según la literatura médica está presente en menos del 50% de los casos2,4,5,6. Se estima que la incidencia del AP que complica la EC es del 10 al 30%7, y éste es extremadamente raro en el inicio de la EC3,8,9,10. Se ha demostrado una incidencia más elevada en pacientes con más de 7 años de evolución de la enfermedad11, aunque en la mayoría de las series revisadas el absceso aparece tras un tiempo variable desde el diagnóstico de EC, que va desde 10 meses a 20 años11. En uno de los casos presentados, el AP fue el proceso que condujo al diagnóstico de la EC, mientras que en los 2 restantes el AP se desarrolló tras uno y 7 años del diagnóstico de EC, respectivamente. En la evolución de la EC de los pacientes en los que se desarrolla AP es frecuente el antecedente de dependencia precoz a los corticoides o de cursos de esteroides anteriores7,11, tal y como ocurrió en 2 de estos casos. Cabe tener en cuenta la existencia de varios factores en relación con la propia EC que pueden facilitar la aparición de abscesos intraabdominales. El más frecuente de ellos en el caso del AP es la localización ileocecal de la enfermedad7; para la formación de abscesos en otras localizaciones pueden desempeñar un papel importante la existencia de masa inflamatoria, la aparición de fístulas enteroentéricas o con otras vísceras vecinas o incluso el desarrollo de estenosis ileal. La existencia de estos factores se da en cada uno de los 3 casos presentados. En el primero de ellos, el patrón penetrante de la EC con presencia de fístulas, en el segundo una estenosis ileal que condicionó también una fístula y, en el último de ellos, la presencia de una masa inflamatoria intraabdominal.
El diagnóstico definitivo en los 3 casos presentados se realizó mediante TC abdominal, técnica diagnóstica de elección según la literatura médica2,11,12,13,14,15. La TC facilita información acerca de la extensión del absceso, la implicación del tracto gastrointestinal y la posible infiltración de la grasa colindante2. Además, la presencia de gas en el interior del absceso indica la existencia de tractos fistulosos que orienta hacia el diagnóstico de EC12.
Una vez obtenido el diagnóstico debe iniciarse tratamiento antibiótico, y se considera que el espectro microbiológico por cubrir es el de origen gastrointestinal. Siempre debe asociarse el drenaje del absceso, ya sea percutáneo o quirúrgico. La decisión de elegir entre uno u otro debe ser individualizada. Anteriormente, se creía que el drenaje o la aspiración mediante aguja podía resultar incluso contraproducente, ya que se pensaba que podían producirse nuevos trayectos fistulosos o la recurrencia del absceso16. Mediante el drenaje percutáneo guiado por TC o ecografía, además de la maniobra terapéutica, puede obtenerse contenido del absceso para cultivo. Según algunos autores, el drenaje quirúrgico es de elección, especialmente en el caso de abscesos secundarios a enfermedad gastrointestinal2,4,5, lo que deja la opción del drenaje percutáneo para pacientes inestables o sépticos (en espera de estabilización clínica para la cirugía)7 o como opción menos radical en pacientes con enfermedades neoplásicas en estadios avanzados. En la EC hay pocos datos que faciliten la decisión sobre la estrategia más adecuada en cada situación. Se acepta que el drenaje percutáneo no es el idóneo cuando el absceso es multiloculado, el acceso a la cavidad del absceso es difícil o peligroso o en presencia de fístula clara7,12, ya que en estos casos el drenaje es insuficiente y se requiere la resección del intestino afectado y el cierre de los orificios fistulosos11. De los casos presentados, sólo en uno de ellos se realizó drenaje percutáneo guiado por TC, y posteriormente se requirió resección intestinal a pesar de la mejoría sintomática. En los 2 casos restantes se optó directamente por la cirugía, con desbridamiento quirúrgico del músculo, resección de la zona ileocecal y legrado de fístula en uno de ellos.
Finalmente, es importante recordar que el desarrollo de un absceso intraabdominal conlleva la toma de otras decisiones terapéuticas en pacientes con EC, puesto que su aparición determina lo que se ha definido como patrón «penetrante» de la enfermedad, es decir, una de las formas más agresivas de la EC. Este patrón clínico es una indicación aceptada de tratamiento inmunosupresor; por otra parte, la necesidad de resección intestinal puede ser, asimismo, un argumento añadido para iniciar tratamiento con tiopurinas. En los 3 casos comentados, tras realizarse la resección quirúrgica del intestino afectado se inició tratamiento inmunosupresor de mantenimiento, con AZA o con MTX. Aunque desde hace unos años se dispone de agentes anti-TNF (tumor necrosis factor 'factor de necrosis tumoral') (fármacos tanto o más potentes que los inmunosupresores convencionales) para el tratamiento de la EC17, no se dispone de ningún estudio controlado que evalúe su eficacia en el tratamiento inicial de fístulas enteroorgánicas o enteroentéricas18,19, por lo que la cirugía sigue siendo el tratamiento de elección de éstas. Desde un punto de vista teórico, el tratamiento de una complicación tal como una fístula enterovesical con un agente anti-TNF (como ocurrió en uno de los pacientes comentados) podría incluso facilitar el desarrollo de infecciones del tracto urinario, por lo que no debería considerarse como el tratamiento de elección. Sin embargo, en pacientes en los que se desarrollan complicaciones penetrantes de la EC cuando están bajo tratamiento inmunosupresor convencional (tiopurinas, metotrexato), los agentes biológicos pueden ser un tratamiento de mantenimiento que hay que tener en cuenta tras la cirugía.
Como conclusión, se puede afirmar que el AP que complica la EC es una entidad poco frecuente, de difícil sospecha diagnóstica dada su presentación clínica inespecífica. Su diagnóstico se basa en la TC abdominal y el aspecto más controvertido es su abordaje terapéutico. La decisión de realizar drenaje percutáneo o quirúrgico debe tener en cuenta las características del absceso, del paciente y de la enfermedad de base. Cuando el AP complica una EC (criterio de patrón penetrante de la enfermedad) se debe pensar que el drenaje percutáneo es casi siempre insuficiente, y se debe tener en cuenta que suele coexistir con una fístula intestinal. Estos pacientes requerirán resección intestinal y cierre de las fístulas en la mayoría de los casos. El desarrollo de esta complicación en la EC indica un curso agresivo de la enfermedad, y es un criterio aceptado de tratamiento inmunosupresor, ya sea convencional (tiopurinas, metotrexato) o con agentes anti-TNF, una vez solucionada.
FinanciaciónEste trabajo lo ha financiado, en parte, el CIBERehd, Fondo de Investigación Sanitaria del Instituto de Salud Carlos III, Ministerio de Sanidad.
Autor para correspondencia. edomenech.germanstrias@gencat.cat