La amilodosis constituye un conjunto de enfermedades derivadas de la acumulación de distintas proteínas en diferentes órganos, alterando su función. La amiloidosis secundaria, derivada de la acumulación de proteína sérica A (un reactante de fase aguda), aparece clásicamente en procesos inflamatorios crónicos como las enfermedades reumatológicas, la fiebre mediterránea familiar o la tuberculosis. La enfermedad inflamatoria intestinal (EII) también se halla entre las posibles etiologías de amiloidosis secundaria. Existen pocos datos sobre cuál es la verdadera prelavencia, los factores de riesgo y el curso evolutivo de la amiloidosis en estos pacientes. Las escasas series publicadas hasta ahora señalan una mayor prevalencia en enfermedad de Crohn, especialmente en aquellos pacientes con afectación intestinal extensa, patrón penetrante y larga evolución. En el presente artículo se revisan los datos disponibles de amiloidosis secundaria a EII en cuanto a su prevalencia, formas de presentación clínica, pronóstico y medidas terapéuticas potenciales.
Systemic amyloidosis comprises a group of diseases that develop as a consequence of an abnormal accumulation of different proteins in several organs, altering their function. Secondary amyloidosis develops after the accumulation of serum amyloid A protein (an acute phase reactant), mainly in the course of chronic inflammatory conditions such as rheumatologic diseases, familial Mediterranean fever, or tuberculosis. Inflammatory bowel disease (IBD) may also cause secondary amyloidosis. However, little is known about the true prevalence, risk factors, and clinical outcomes of amyloidosis among IBD patients. A few studies suggest that amyloidosis is more prevalent in Crohn's disease than in ulcerative colitis, mainly occurring in patients with an extensive, long-lasting, and penetrating disease pattern. In this article we review the available data on secondary amyloidosis and IBD, focusing on prevalence, risk factors, clinical presentation and therapeutic measures.
La amiloidosis es una entidad clínico-patológica que se produce como consecuencia del plegamiento anormal de proteínas humanas que se depositan a modo de fibrillas insolubles en el tejido extracelular de diferentes órganos, alterando su función. La composición química del amiloide consiste en fibrillas de proteínas no ramificadas en un 95%, estando formado el 5% restante por el componente P y otras glucoproteínas. En la actualidad, la amiloidosis se considera como un grupo heterogéneo de enfermedades que se caracterizan por el depósito de una de 25 proteínas distintas, en forma de estos agregados fibrilares tan característicos, de gran afinidad por la tinción de rojo Congo y con alta resistencia a la desnaturalización. Al microscopio electrónico su estructura es idéntica en todos los tipos de amiloidosis. La cristalografía con rayos X y la espectroscopia con infrarrojos demuestran una conformación característica en láminas cruzadas y de plegamiento β (responsable de su birrefringencia); al microscopio óptico y con tinciones estándar, el amiloide se presenta como una sustancia extracelular de aspecto amorfo, eosinófila e hialina, que tras acumularse de manera progresiva, invade y atrofia, por presión, las células subyacentes. Para diferenciar el amiloide de otros depósitos hialinos (por ejemplo, colágeno, fibrina) se utilizan diferentes técnicas histoquímicas, entre las que destaca la tinción con rojo Congo con la que los depósitos adquieren un color rosa o rojo, que resalta todavía más al ser visualizados con microscopio de luz polarizada, ya que adquiere una llamativa birrefringencia verde1. Se han descrito diversas variantes bioquímicas de amiloide, entre las que destacan 2 formas principales por ser las más comunes y en función de las cuales suele clasificarse esta enfermedad: a) el amiloide AL (cadena ligera de amiloide), que deriva de células plasmáticas y contiene cadenas ligeras de las inmunoglobulinas y que define la amiloidosis primaria. Habitualmente esta forma de amiloidosis se considera idiopática o asociada a mieloma múltiple; y b) el amiloide AA (asociado a amiloide), que da lugar a la amiloidosis secundaria y deriva de un precursor considerado un reactante de fase aguda de síntesis hepática llamado «amiloide sérico A» (SAA). La amiloidosis secundaria (AAA) suele desarrollarse en individuos con enfermedades inflamatorias crónicas como enfermedades reumatológicas, tuberculosis, algunas neoplasias, fiebre mediterránea familiar o enfermedad inflamatoria intestinal (EII), entre otras2,3. El propósito del presente artículo es describir cuáles son la prevalencia, las características clínicas de la AAA asociada a la EII y revisar las medidas terapéuticas disponibles en la actualidad.
Razones para el desarrollo de amiloidosis secundaria en la enfermedad inflamatoria intestinalEn cualquiera de sus formas fenotípicas (enfermedad de Crohn [EC], colitis ulcerosa [CU] o colitis inclasificable [CI]), la EII se considera una enfermedad de curso crónico, fundamentalmente en forma de brotes de actividad inflamatoria intercalados con períodos variables de remisión clínica. El número y gravedad de estos brotes es variable en cada sujeto. Hasta hace tan solo unas décadas, el tratamiento de la EII se basaba en el control sintomático de los pacientes de forma que el objetivo terapéutico era la desaparición o mejora de los síntomas principales (diarrea, dolor abdominal, pérdida de peso, hematoquecia). El mejor conocimiento de la historia natural de la EII ayudó a entender el carácter inflamatorio y crónico de estas entidades. Esto es especialmente cierto en el caso de la EC, en la que la cronicidad del proceso inflamatorio da lugar al desarrollo de complicaciones características de la enfermedad como los abscesos, las fístulas o las estenosis. En las últimas décadas, los avances tanto en el conocimiento de los mecanismos fisiopatológicos implicados, como de los distintos fenotipos de la EII, así como la disponibilidad de fármacos cada vez más eficaces a largo plazo, han originado un cambio conceptual y progresivo en el objetivo terapéutico que ha pasado a ser el control absoluto de la actividad inflamatoria, ya sea evaluado mediante la normalización de marcadores biológicos como la proteína C reactiva o la desaparición de las lesiones evaluada mediante técnicas de imagen como la endoscopia o la RM intestinal. Sin embargo, un porcentaje no despreciable de pacientes continúan presentando una enfermedad agresiva y de difícil manejo, como así lo demuestra la elevada proporción de pacientes con EII que desarrolla dependencia a los corticoides4 o el hecho de que hasta el 70% de los pacientes con EC desarrolle complicaciones penetrantes o estenóticas de la enfermedad en los primeros 10 años desde el diagnóstico inicial5. Además, hay que tener en cuenta que la EII suele presentarse con mayor frecuencia en individuos jóvenes (entre la segunda y la cuarta décadas de la vida), con una esperanza de vida similar a la de la población general6,7.
Partiendo de estas premisas cabría esperar una considerable prevalencia de AAA en pacientes con EII. Las primeras descripciones de asociación entre AAA y EII de las que se tiene constancia datan de la primera mitad de siglo xx como las publicadas por Moschkowitz en 19368 y Oslan en 19489. Aunque desde entonces se han publicado numerosas observaciones clínicas aisladas, solo existen 3 estudios de cohortes más o menos amplias que evalúen específicamente esta asociación10–12 y a las que podríamos añadir un cuarto estudio publicado solo en forma de abstract y presentado en el último congreso de la Asociación Española de Gastroenterología13. Como se verá más adelante, en estas series la AAA se ha vinculado casi con exclusividad a la EC, con una prevalencia siempre inferior al 3%. Al igual que en otras formas de AAA, la asociada a la EII estaría relacionada con el aumento de síntesis hepática de SAA, que sería el precursor del amiloide que finalmente se deposita en los tejidos. Sin embargo, la baja prevalencia de esta asociación hace pensar en la necesidad de otros factores para el desarrollo de la enfermedad, por lo que algunos autores abogan por la existencia de defectos enzimáticos en la fragmentación del SAA o bien de anomalías estructurales en la propia molécula de SAA que la harían resistente a la degradación1,14.
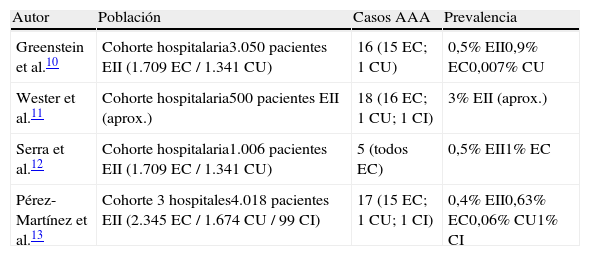
Prevalencia de amiloidosis secundaria en la enfermedad inflamatoria intestinalUn estudio reciente sobre historia natural y avances en AAA puso de manifiesto que, sobre un total de 374 pacientes estudiados, solo el 5% de los casos (17 pacientes) se desarrollaron en pacientes con EII (todos ellos con EC). La gran mayoría de casos correspondieron a pacientes con procesos inflamatorios articulares crónicos (60%), procesos infecciosos crónicos (15%) o síndromes febriles crónicos (9%)15. Existen muy pocos estudios que hayan evaluado la prevalencia de AAA en pacientes con EII cuyas características y resultados principales se resumen en la tabla 1. Greenstein et al., en el primer estudio de prevalencia de amiloidosis en EII, evaluaron un total de 3.050 pacientes con EII (1.709 EC y 1.341 CU) ingresados en el hospital Mount Sinai durante un período de 25 años (1960-1985). Entre todos ellos se identificaron un total de 15 casos de AAA con EC y un único caso con CU, correspondiendo a una prevalencia del 0,9 y 0,07%, respectivamente. A estos 16 pacientes, los autores añadieron 5 pacientes con EC previamente publicados por Werther et al. en 196016 y otros 4 pacientes (2 con EC y 2 con CU) diagnosticados con posterioridad a 1985, con lo que constituye la serie más amplia publicada a día de hoy10. Posteriormente, Wester et al. describieron 18 casos de AAA (16 pacientes con EC, un paciente con CU, un paciente con CI) diagnosticados en un periodo de 36 años (1962-1998) provenientes de una base de datos de aproximadamente 500 pacientes con EII11. Recientemente, nuestro grupo evaluó todos los casos de AAA en pacientes con EII atendidos en nuestro centro. Partiendo de una cohorte hospitalaria de 1.006 pacientes con EII, solo se registró el diagnóstico de AAA en 5 casos (todos ellos asociados a EC), lo que representa una prevalencia de 0,5% para EII y del 1% para EC, cifras muy similares a las descritas en la serie americana12. Un interesante estudio español reunió todos los casos de AAA y EII en 4 centros del norte de España, hallándose 17 casos (15 con EC, uno con CU y uno con CI) de un total de 4.018 pacientes con EII, lo que representa una prevalencia de 0,63% para EC, 0,06% para CU y 1% para CI13. Por lo tanto, los datos disponibles señalan una prevalencia cercana al 0,5% en el global de pacientes con EII (a excepción de la serie noruega), correspondiendo la mayoría de casos a pacientes con EC entre los que esta prevalencia se situaría en torno al 0,7-1%. Sin embargo, es importante señalar que existen claras limitaciones metodológicas en los estudios mencionados. En primer lugar, en todos los casos se trata de series hospitalarias (no poblacionales) donde se concentran aquellos pacientes con enfermedad más agresiva (y, por tanto, con mayores probabilidades de desarrollar complicaciones derivadas de un proceso inflamatorio crónico); este aspecto cobra todavía mayor relevancia si se tiene en cuenta que la mayoría de centros participantes eran centros de referencia para EII. En segundo lugar, todos estos estudios son retrospectivos, de forma que el diagnóstico de amiloidosis vino dado por una elevada sospecha clínica, infravalorando su prevalencia a expensas de aquellos pacientes potencialmente afectados pero todavía con escasa traducción clínica o con formas de presentación atípica. Lamentablemente, hasta la fecha solo se ha desarrollado un estudio prospectivo destinado a evaluar la prevalencia de AAA en pacientes con EII. Lodwell et al.17 estudiaron de forma prospectiva 174 pacientes con EII de más de 5 años de evolución (77 con EC y 97 con CU). Cada paciente fue evaluado mediante biopsia rectal y estudio de la función renal, sin que se produjera el hallazgo de ningún nuevo caso de amiloidosis.
Prevalencia de amiloidosis secundaria en estudios de cohortes de pacientes con enfermedad inflamatoria intestinal
| Autor | Población | Casos AAA | Prevalencia |
| Greenstein et al.10 | Cohorte hospitalaria3.050 pacientes EII (1.709 EC / 1.341 CU) | 16 (15 EC; 1 CU) | 0,5% EII0,9% EC0,007% CU |
| Wester et al.11 | Cohorte hospitalaria500 pacientes EII (aprox.) | 18 (16 EC; 1 CU; 1 CI) | 3% EII (aprox.) |
| Serra et al.12 | Cohorte hospitalaria1.006 pacientes EII (1.709 EC / 1.341 CU) | 5 (todos EC) | 0,5% EII1% EC |
| Pérez-Martínez et al.13 | Cohorte 3 hospitales4.018 pacientes EII (2.345 EC / 1.674 CU / 99 CI) | 17 (15 EC; 1 CU; 1 CI) | 0,4% EII0,63% EC0,06% CU1% CI |
AAA: amiloidosis secundaria; CI: colitis inclasificada; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal.
A tenor de los datos expuestos, es evidente el claro predominio de la AAA en pacientes con EC respecto a la CU. Partiendo de la base que la AAA se produce como consecuencia de la acumulación de un reactante de fase aguda como la SAA, es razonable pensar que se desarrolle en aquellos pacientes con un curso clínico más crónico y con un menor control de la actividad inflamatoria. Esta situación se da más a menudo en la EC que en la CU, por distintas razones. En primer lugar, el propio curso clínico de la enfermedad es más tórpido e indolente en la EC (siendo frecuente el hallazgo de lesiones endoscópicas graves en pacientes asintomáticos), mientras que la CU suele cursar más frecuentemente en forma de brotes agudos. Por otro lado, el tratamiento de mantenimiento con aminosalicilatos ha demostrado ser eficaz en la CU, es una práctica de aplicación universal en todos estos pacientes y se halla fuertemente implantado desde hace décadas, lo que permite el control de la actividad inflamatoria a largo plazo en la mayoría de pacientes con CU. Esto no es extrapolable a la EC, en la que los únicos tratamientos efectivos a largo plazo (tiopurinas y anti-TNF) se instauraban únicamente cuando los pacientes ya habían presentado complicaciones de la enfermedad, y solo en los últimos años se están introduciendo de forma precoz en aquellos pacientes con un mayor riesgo de presentar una enfermedad más agresiva. Finalmente, en el caso de la CU resistente al tratamiento médico la cirugía (proctocolectomía) acaba definitivamente con el proceso inflamatorio, no siendo así en el caso de la EC.
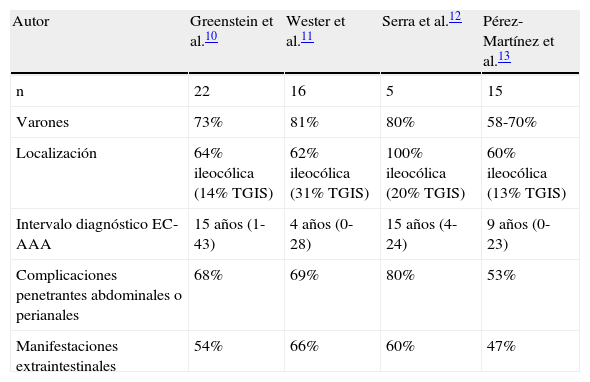
Además de desarrollarse casi 10 veces más en pacientes con EC respecto a pacientes con CU, existen otras circunstancias que parecen asociarse al desarrollo de AAA entre los pacientes con EC (tabla 2). De forma similar a lo que ocurre con la amiloidosis asociada a otras enfermedades, en los casos de EII existe una mayor frecuencia en el sexo masculino, de forma que casi 3 cuartas partes de los casos con EC y AAA descritos en los 4 estudios de cohortes anteriormente mencionados corresponden a varones10-13. En relación con las características de la propia EC, también existe un claro predominio de formas agresivas y extensas de la enfermedad. Más de dos tercios de los casos descritos presentaban afectación ileal y cólica (mayoritariamente pancólica), con afectación del tracto gastrointestinal superior en el 15-30% (tasa muy superior a la del global de pacientes con EC). En este mismo sentido, el curso evolutivo de la EC seguía un patrón «penetrante», con desarrollo de fístulas y/o abscesos intraabdominales y/o perianales, en el 70-80% de los pacientes. En todas las series también llama la atención la elevada proporción de pacientes que han presentado manifestaciones extraintestinales a lo largo del curso evolutivo de la enfermedad con tasas que se sitúan entre el 50 y el 60%, muy por encima de lo habitual. Por último, la AAA suele aparecer tras un largo tiempo de evolución de la EII en clara relación con la cronicidad del proceso inflamatorio, de forma que el diagnóstico de AAA no suele acontecer antes de los 10-15 años de haberse diagnosticado la EII. Es importante no olvidar que en pacientes con EII pueden coexistir otras enfermedades que también se asocian a AAA como la artritis reumatoide10, la poliartritis juvenil11 o la fiebre mediterránea familiar12, siendo especialmente importante descartar este supuesto en aquellos casos en los en que el diagnóstico de AAA preceda o se realice poco después del diagnóstico de EII.
Características clínicas de los pacientes con enfermedad de Crohn y amiloidosis secundaria
| Autor | Greenstein et al.10 | Wester et al.11 | Serra et al.12 | Pérez-Martínez et al.13 |
| n | 22 | 16 | 5 | 15 |
| Varones | 73% | 81% | 80% | 58-70% |
| Localización | 64% ileocólica (14% TGIS) | 62% ileocólica (31% TGIS) | 100% ileocólica (20% TGIS) | 60% ileocólica (13% TGIS) |
| Intervalo diagnóstico EC-AAA | 15 años (1-43) | 4 años (0-28) | 15 años (4-24) | 9 años (0-23) |
| Complicaciones penetrantes abdominales o perianales | 68% | 69% | 80% | 53% |
| Manifestaciones extraintestinales | 54% | 66% | 60% | 47% |
AAA: amiloidosis secundaria; EC: enfermedad de Crohn; TGIS: tracto gastrointestinal superior (proximal a íleon terminal).
Por tanto, de forma general, podríamos decir que la AAA suele aparecer en pacientes varones con una EC con clara repercusión sistémica (extensa, con manifestaciones extraintestinales) y curso agresivo (complicaciones penetrantes). A pesar de que no se dispone todavía de datos al respecto. El concepto emergente de curación de mucosa como objetivo terapéutico y la aplicación de estrategias más agresivas para el control de la enfermedad (introducción temprana de inmunomoduladores y/o fármacos biológicos), podrían suponer un cambio en la prevalencia y el pronóstico de ciertas complicaciones secundarias a la cronicidad del proceso inflamatorio de la EII (entre las que se encuentra la AAA) en un futuro próximo.
Presentación clínica de la amiloidosis secundaria en la enfermedad inflamatoria intestinalLa AAA relacionada con EII había sido clásicamente un diagnóstico necrópsico18. Los primeros casos de asociación entre EC y AAA estaban basados en estudios autópsicos16 y no fue hasta las series publicada con posterioridad a 1980 en que la mayoría de pacientes fueron diagnosticados en vida10-13. La sintomatología de la AAA dependerá de la magnitud de los depósitos y de los órganos afectados. Al inicio las manifestaciones suelen ser inespecíficas (debilidad, pérdida de peso, cefalea o síncope), pero cuando la enfermedad se encuentra en fases más avanzadas aparecen signos y síntomas órgano-específicos. La afectación renal es la más común en la AAA asociada a EII y suele manifestarse por la existencia de proteinuria (a menudo de rango nefrótico); en los casos avanzados, la obliteración progresiva de los glomérulos conduce a una insuficiencia renal y uremia. Una característica distintiva de la insuficiencia renal por AAA es el tamaño normal de los riñones y la tendencia a la hipotensión en lugar de hipertensión19. De hecho, de las 4 cohortes previamente mencionadas, la proteinuria y/o la insuficiencia renal constituyeron la forma clínica de presentación del 86% de los casos10-13. La afectación gastrointestinal es la segunda forma de presentación clínica en frecuencia en las series de AAA asociada a EII, aunque este hecho pudiera venir sesgado por una mayor sospecha diagnóstica por parte del gastroenterólogo. A pesar de ello, solo el 6% de los pacientes descritos en las 4 cohortes presentaron sintomatología intestinal. Esta puede cursar de forma completamente asintomática o bien como malabsorción grave. En la AAA la afectación cardiaca suele ser rara y, de estar presente, puede manifestarse en forma de insuficiencia cardíaca congestiva insidiosa, trastornos de la conducción y/o arritmias. La macroglosia suele estar ausente en la AAA, dato que la diferencia de la amiloidosis AL. Otros órganos que pueden verse afectados por el depósito de amiloide son el hígado, bazo o tiroides1.
Dadas las connotaciones del diagnóstico de AAA, la sospecha clínica de AAA en pacientes con EII debe surgir ante todo paciente con proteinuria o insuficiencia renal, o en aquellos con una malabsorción desproporcionada no atribuible a su EII. Para confirmar el diagnóstico es necesario demostrar la presencia de amiloide en los tejidos. Las biopsias de riñón o hígado, proporcionan un alto rendimiento diagnóstico (cercano al 90%) aunque no están exentas de complicaciones. Por este motivo se han evaluado biopsias alternativas menos invasivas. Las más utilizadas en la actualidad son las de grasa abdominal (con una sensibilidad diagnóstica del 60-80%) y las biopsias de mucosa rectal (con una sensibilidad en torno al 50-70%)20; sin embargo, la negatividad de estas biopsias en un contexto de sospecha clínica elevada no debería evitar la realización de biopsia del órgano diana.
Pronóstico y tratamiento de la amiloidosis secundaria en la enfermedad inflamatoria intestinalComo se ha comentado anteriormente, la AAA en pacientes con EII ha pasado de diagnosticarse en las necropsias a constituir una complicación de ciertas situaciones clínicas determinadas. Esto da idea de cómo ha cambiado el pronóstico de estos pacientes por distintas razones entre las que se hallan el mejor tratamiento médico y quirúrgico de la propia EII, el alto índice de sospecha diagnóstica de AAA o el cuidado de fenómenos paralelos a la enfermedad intestinal como el estado nutricional o la prevención y diagnóstico precoz de complicaciones relacionadas con los tratamientos o el propio curso evolutivo de la EII. En esta línea, un estudio de mortalidad realizado en Leiden por Weterman et al.21 evidenció que la amiloidosis prácticamente ha desaparecido como causa de muerte en las últimas décadas en pacientes con EC, un hecho que los autores atribuyen a una mayor eficacia del tratamiento médico o quirúrgico de la EII. La variable que mejor se correlaciona con la supervivencia de estos pacientes es el nivel sérico de creatinina y, por lo tanto, el grado de insuficiencia renal22. El trasplante renal puede constituye la mejor opción terapéutica en pacientes con insuficiencia renal crónica terminal secundaria a amiloidosis23 y es probablemente uno de los factores que mayor impacto ha tenido sobre la reducción de la mortalidad en estos pacientes.
A pesar de todo ello, los pacientes con EII que desarrollan AAA presentan una mortalidad más elevada respecto a aquellos que no presentan esta complicación, siendo las infecciones y los fenómenos hemorrágicos (especialmente tras cirugía abdominal) las principales causas de muerte después de la insuficiencia renal terminal10,21,24. Existen pocos datos en cuanto a la supervivencia de estos pacientes, habiéndose estimado en torno al 89% a los 5 años y 60% a los 15 años de seguimiento11.
El abordaje terapéutico de estos pacientes debe abarcar 2 pilares fundamentales. En primer lugar, parece lógico pensar que el control del proceso inflamatorio subyacente debería llevar a una reducción de la producción de la proteína precursora de amiloide (SAA) y, por tanto, evitar el empeoramiento de la amiloidosis. Un tema controvertido ha sido el papel de la cirugía en estos pacientes. Si bien se ha descrito la mejora de la amiloidosis en algunos pacientes con EII después de la resección quirúrgica de los segmentos afectados25–28, el hecho de que una considerable proporción de los casos de AAA se diagnostican tras una resección intestinal indica que la cirugía por sí sola no es suficiente para prevenir o revertir esta complicación a largo plazo. Además, algunos autores apuntan que la mejora de la AAA raramente ocurre tras la cirugía y existe una mayor mortalidad post-operatoria en este grupo de pacientes10,29. En general, los pacientes con EII y AAA suelen considerarse de alto riesgo quirúrgico, dado que en el periodo post-operatorio pueden producirse un rápido deterioro de la función renal, episodios hemorrágicos o infecciones10,17,28–30. En la actualidad y con los datos disponibles, parece recomendable apurar el tratamiento médico utilizando los fármacos más potentes disponibles para el control de la EII, reservando la cirugía para aquellas situaciones sin opciones médicas (estenosis sintomáticas, complicaciones penetrantes) y optimizando siempre el estado nutricional y reduciendo el riesgo de infecciones con todas las medidas a nuestro alcance.
En segundo lugar, sería deseable introducir aquellos tratamientos encaminados a revertir o frenar el progreso de la propia amiloidosis. La colchicina ha sido el fármaco más ampliamente utilizado y evaluado. La eficacia de este fármaco se basa en resultados obtenidos en la AAA asociada a otros procesos como la fiebre mediterránea familiar, habiendo demostrado su capacidad para disminuir la proteinuria, estabilizar la función renal y, en algunos casos, incluso mejorar la supervivencia de los pacientes10,31–33. Actualmente se recomienda su utilización en fases precoces de la enfermedad, incluso antes de que se detecte insuficiencia renal. Otro fármaco que ha sido probado es el dimetilsulfóxido, también basándose en experiencias de AAA secundaria a otro tipo de enfermedades, habiendo demostrado mejorar el aclaramiento de creatinina y la proteinuria de forma mantenida tras un año de tratamiento34.
Cada vez son más los casos descritos de pacientes con amiloidosis y EII tratados con fármacos anti-TNF, lo cual sugiere su eficacia para mejorar la proteinuria y estabilizar la función renal en este grupo de pacientes35-46. Algunos estudios sugieren su capacidad para disminuir los niveles de SAA, probablemente debido a que la síntesis de este precursor de amiloide parece estar regulada por ciertas citocinas proinflamatorias como el TNF-α46. Teniendo en cuenta la eficacia de estos fármacos tanto en el control de la EII como en la mejoría de la AAA, podrían constituir el tratamiento de elección en estos pacientes. La mayor experiencia del tratamiento de la AAA con fármacos anti-TNF proviene de pacientes con enfermedades reumatológicas; los esperanzadores resultados obtenidos en las primeras series retrospectivas publicadas47,48 se han visto confirmados en un interesante estudio prospectivo realizado en el seno de la Sociedad Española de Reumatología y recientemente publicado49. Este estudio incluyó 36 pacientes con AAA (94% con afectación renal) tratados con fármacos anti-TNF y seguidos prospectivamente, que fueron comparados con una cohorte apareada de pacientes sin AAA también tratados con anti-TNF. Al final del seguimiento, se constató la mejoría renal en el 54% de los casos, con estabilización del proceso en el 44% y empeoramiento solo en el 17%. Los niveles de reactantes de fase aguda se redujeron notablemente pero sin llegar a su normalización. La supervivencia actuarial a los 10 años se situó en el 78,5%, siendo el nivel de proteinuria el único factor predictivo independiente de mortalidad. Uno de los datos más relevantes del estudio fue que la existencia de AAA incrementó por 3 el riesgo de infecciones en los pacientes tratados con anti-TNF, lo que sin duda alguna debe tenerse en cuenta.
Otro apartado interesante lo constituyen los fármacos en fase de investigación, entre los que destaca el desarrollo de un compuesto con capacidad de unión al componente P del amiloide, con el objetivo de reducir los valores séricos de este componente P, impidiendo su unión con el resto del amiloide, promoviendo de esta manera la disociación, favoreciendo la eliminación de los depósitos50-52. Recientemente se han producido avances a través de estudios in vitro y observaciones clínicas que sugieren que las proteínas precursoras amiloidogénicas y las fibrillas de amiloide contribuyen de distinta forma a la disfunción renal. Apoyan esta teoría los resultados obtenidos con el tratamiento con el eprodisato. Este fármaco ha demostrado un efecto beneficioso sobre la función renal, pero no sobre la excreción de proteínas. Teniendo en cuenta que este fármaco no modifica los niveles de SAA y que no tiene efecto sobre la proteinuria, aumenta la interesante posibilidad de que el SAA podría ser el responsable de la proteinuria en la amiloidosis53. Para los pacientes con enfermedad renal avanzada o terminal queda reservada la hemodiálisis y el trasplante renal, que suelen ser los únicos tratamientos eficaces23,54.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.