La infección crónica por el virus de la hepatitis C (VHC) es la principal causa de cirrosis hepática y hepatocarcinoma en los países occidentales. Existe evidencia para afirmar que el aclaramiento del VHC inducido por la terapia antiviral proporciona beneficio con incremento de la supervivencia y disminución de las complicaciones derivadas de la cirrosis. La triple terapia con boceprevir o telaprevir asociados a interferón pegilado y ribavirina ha incrementado las tasas de respuesta viral sostenida tanto en pacientes no tratados previamente como en aquellos en los que ha fallado una pauta previa de tratamiento. El manejo del tratamiento con estas nuevas moléculas requiere familiarizarse con las indicaciones y pautas a emplear, así como con los eventos adversos y la monitorización del desarrollo de resistencias. Los objetivos fundamentales son una selección cuidadosa del paciente y del régimen terapéutico que se va a emplear, así como lograr una adherencia adecuada que permita obtener óptimos resultados de eficacia.
Chronic hepatitis C virus (HCV) infection is the main cause of liver cirrhosis and liver carcinoma in western countries. There is evidence that HCV clearance induced by antiviral therapy is beneficial, increasing survival and reducing the complications of cirrhosis. Triple therapy with boceprevir or telaprevir associated with pegylated interferon and ribavirin has increased rates of sustained viral response both in treatment-naïve patients and in those failing previous regimens. Before treating patients with these new molecules, physicians should be familiar with their indications and the regimens to be used. Furthermore, both adverse events and the development of resistances must be monitored. The main aims are careful selection of patients and of the regimen to be used, and achieving adequate adherence to obtain optimal results.
Los pacientes infectados de forma crónica por el virus de la hepatitis C (VHC), más de 170 millones en el mundo, se encuentran en riesgo de desarrollar fibrosis hepática progresiva hasta alcanzar un estadio de cirrosis, con el consiguiente desarrollo de hipertensión portal, deterioro de la función hepática y/o aparición de un hepatocarcinoma1–3. La enfermedad hepática terminal y el hepatocarcinoma injertado sobre un hígado cirrótico por VHC son las principales indicaciones de trasplante hepático en los países occidentales4.
Durante la última década el tratamiento de elección en pacientes con hepatitis crónica por VHC ha sido el empleo de interferón pegilado (PEG-IFN) y ribavirina ajustada por peso durante 48 semanas (genotipos 1, 4, 5 y 6) o 24 semanas (genotipos 2 y 3)5–10. La aplicación de estos regímenes de tratamiento induce respuesta viral sostenida (RVS) en un 40-50% de los pacientes infectados por el genotipo 1, del 65-85% en los genotipos 4, 5 y 6, y del 75-85% en el caso de los genotipos 2 y 3 que no han recibido tratamiento previo (naïve)11. Esta pauta de tratamiento puede acortarse a 24 semanas en pacientes con genotipo 1, baja carga viral y respuesta viral rápida no tratados previamente, a 16 semanas en pacientes con genotipos 2 y 3 y respuesta viral rápida, ajustando la dosis por peso en estos últimos, o prolongarse a 72 semanas en pacientes con genotipo 1 y respuesta viral lenta (primera negativización del ARN viral en la semana 24) sin disminuir la tasa de RVS12. La consecución de la erradicación de replicación viral tras 24 semanas de haberse finalizado el tratamiento (RVS) es duradera en el tiempo y conlleva un descenso de la morbilidad y mortalidad y mejora en la calidad de vida. Por el contrario, aquellos pacientes sin respuesta al tratamiento probablemente sufrirán una progresión de la enfermedad13.
Aproximadamente un 50-60% de los pacientes con genotipo 1 no tratados previamente no conseguirán una RVS tras 48 semanas de tratamiento con PEG-IFN y ribavirina14,15, siendo más probable la ausencia de respuesta en aquellos con fibrosis avanzada, de raza afroamericana, presencia de diabetes mellitus, coinfección con el virus de la inmunodeficiencia humana (VIH) o recidiva de la infección tras un trasplante hepático16–19. Estos pacientes con ausencia de respuesta al tratamiento pueden categorizarse según el comportamiento de la replicación viral durante el mismo en 3 grupos distintos: no respondedores al tratamiento, definidos por la reducción del RNA-VHC en menos de 2 log a las 12 semanas de tratamiento o 1 log a la cuarta semana, respondedores parciales, definidos por la reducción del RNA-VHC en más de 2 log en la semana 12 pero sin negativizar la replicación durante el tratamiento, y recaedores, aquellos que presentando un RNA viral indetectable al finalizar el tratamiento, sufren una reaparición ulterior del virus20.
Las elevadas tasas de ausencia de respuesta en pacientes con genotipo 1 han llevado a una constante búsqueda de incremento de la eficacia a través de la investigación de factores predictivos de respuesta y de nuevas dianas terapéuticas que permitan el desarrollo de fármacos con una mayor eficacia en la erradicación viral. El conocimiento del ciclo vital del VHC y de sus proteínas estructurales ha permitido el desarrollo de fármacos antivirales directos que han conseguido dicho objetivo. La serinproteasa NS3/4A es necesaria para la replicación del RNA del VHC y para el ensamblaje de los viriones21–23. Dos péptidos lineales inhibidores de esta serinproteasa, boceprevir y telaprevir, administrados junto a PEG-IFN y ribavirina, han demostrado en sus diferentes fases de desarrollo un marcado incremento en la tasa de RVS tanto en pacientes previamente tratados como en los no tratados24–31. Este aumento de la RVS, de un 70-75% frente a un 40-45% con PEG-IFN y ribavirina en näive, y del 60% frente a un 15% en los previamente tratados, ha llevado a la rápida inclusión de estos fármacos en el protocolo terapéutico de la infección por genotipo 1 del VHC32. El objetivo de esta revisión es resumir las indicaciones y pautas de esta triple terapia antiviral en los diferentes grupos de pacientes clasificados según la existencia o no de tratamiento previo y su respuesta al mismo.
Factores predictivos de respuesta viralUno de los principales avances en el campo de la infección por VHC de la pasada década ha sido el conocimiento de factores virales y del huésped que influyen en la respuesta virológica. Estos han ayudado a la toma de decisiones con respecto al tratamiento y al diseño de pautas personalizadas que optimizasen, en la medida de lo posible, las tasas de RVS33–37.
Entre los factores favorables del huésped se incluyen la edad (≤40 años), peso (≤75 kg) o índice de masa corporal (<30 kg/m2), ausencia de fibrosis avanzada, de esteatosis y de resistencia a la insulina o la raza no afroamericana15,38,39. La mayor contribución en este campo ha sido la descripción de varios polimorfismos de nucleótidos simples, próximos al gen que codifica la interleucina 28B (IL-28B) en el cromosoma 19, presentes en pacientes respondedores al tratamiento antiviral40–42. La asociación de la RVS con uno de estos polimorfismos que detecta alelos C o T en la posición rs12979860 ha sido ampliamente validada en diferentes cohortes de pacientes infectados por genotipo 1 pertenecientes a diferentes etnias43–45. Esta asociación se ha mostrado también aplicable a otros genotipos virales y a grupos de pacientes con tasas de respuesta claramente inferiores, como aquellos pacientes coinfectados con el VIH o tras la recidiva de la infección por VHC en trasplantados hepáticos46–49. La presencia de un polimorfismo favorable (CC) antes del inicio del tratamiento ha demostrado ser el factor con mayor poder predictivo de respuesta50.
Se han identificado también factores virales pretratamiento asociados a la respuesta virológica, como son la infección por genotipo no 1 y una baja replicación viral14,15. Es, sin embargo, el tiempo de negativización del RNA del VHC, expresado como respuesta viral rápida (RVR, RNA indetectable a las 4 semanas del tratamiento) y respuesta viral temprana (RVT, descenso de RNA>2 log U/ml en semana 12) el factor predictivo clave de respuesta al tratamiento. De ambos, la RVR se ha demostrado como el factor de mayor potencia predictiva de todos los conocidos, asociándose a una tasa de RVS de aproximadamente el 90%51,52. Si bien se ha demostrado una asociación entre un polimorfismo de la IL-28B favorable (CC) y la negativización precoz del RNA viral, una vez conseguida esta última se convierte en el factor predictivo de respuesta más relevante, independientemente del polimorfismo de la IL-28B del paciente50. Adicionalmente, los diferentes tipos de respuesta a un ciclo previo de terapia antiviral son el principal factor predictivo de respuesta frente a una nueva pauta de tratamiento20. Las diferentes definiciones de respuesta virológica se categorizan en la tabla 1.
Definiciones de respuesta virológica
| Abreviatura | Término | Definición |
| RVR | Respuesta virológica rápida | RNA-VHC indetectable a las 4 semanas de inicio del tratamiento |
| RVRe | Respuesta virológica rápida extendida | RNA-VHC indetectable a las 4 y 12 semanas de tratamiento |
| RVT | Respuesta virológica temprana | RNA-VHC indetectable a las 12 semanas de inicio del tratamiento o reducción de la carga viral en >2 log |
| RVTc | Respuesta virológica temprana completa | RNA-VHC indetectable a las 12 semanas de inicio del tratamiento |
| RVTp | Respuesta virológica temprana parcial | Reducción de la carga viral en >2 log, sin obtener RVTc |
| RFT | Respuesta a fin de tratamiento | RNA-VHC indetectable al finalizar el tratamiento |
| RVS | Respuesta viral sostenida | RNA-VHC indetectable al final del tratamiento y 24 semanas después del mismo |
| NR | No respuesta | RNA-VHC nunca se reduce >2 log en semana 24 |
| RP | Respuesta parcial | RNA-VHC se reduce >2 log en semana 24 pero nunca indetectable |
| Recaída virológica | Respuesta viral a final de tratamiento pero reaparición ulterior del RNA-VHC | |
| Rebote viral | RNA-VHC detectable en cualquier momento durante el tratamiento después de haber sido indetectable |
Probablemente el aumento de eficacia de las nuevas pautas antivirales atenuará la influencia en la respuesta al tratamiento de los diferentes factores predictivos de respuesta conocidos, aunque el valor de cada uno está todavía por determinar.
Indicaciones y eficacia de la triple terapia según poblacionesPacientes no tratados previamenteSegún las guías clínicas vigentes todos los pacientes con una enfermedad hepática compensada secundaria a la infección por el VHC que no hayan sido tratados previamente deberían considerarse para recibir terapia antiviral. Dicho tratamiento debería iniciarse sin demora en los pacientes con fibrosis avanzada (puntuación de METAVIR F3-F4) y se debería considerar firmemente en los pacientes con fibrosis moderada (puntuación de METAVIR F2). En los pacientes con una enfermedad menos grave, la indicación para tratamiento debe individualizarse32.
Los resultados publicados de los ensayos de fase 3 con boceprevir y telaprevir han motivado que ambos se hayan incluido recientemente como pauta de elección en aquellos pacientes infectados con genotipo 1 del VHC que se consideren subsidiarios de tratamiento. Ambos deben administrarse de forma conjunta con PEG-IFN y ribavirina debido al rápido desarrollo de resistencias cuando ambos se aplican en monoterapia32.
La triple terapia en pacientes con genotipo 1 está contraindicado en las mismas situaciones en los que esté contraindicado el tratamiento con PEG-IFN y ribavirina: enfermedad depresiva no controlada, psicosis o epilepsia, anemia no tratada con valores de hemoglobina inferiores a 12g/dl, trasplante renal, de corazón o pulmón, hepatitis autoinmune u otras afecciones autoinmunes en las que se haya demostrado su exacerbación con interferón, enfermedad tiroidea no controlada, embarazo o falta de disposición para cumplir con una anticoncepción adecuada, cualquier enfermedad médica grave simultánea o hipersensibilidad conocida a fármacos empleados para tratar el VHC53,54. Además debe considerarse contraindicado el tratamiento en caso de la administración conjunta con determinados fármacos, inductores potentes de CYP3A4/5 o que dependan en gran medida de la misma para su aclaramiento debido a las potenciales interacciones entre ambos32.
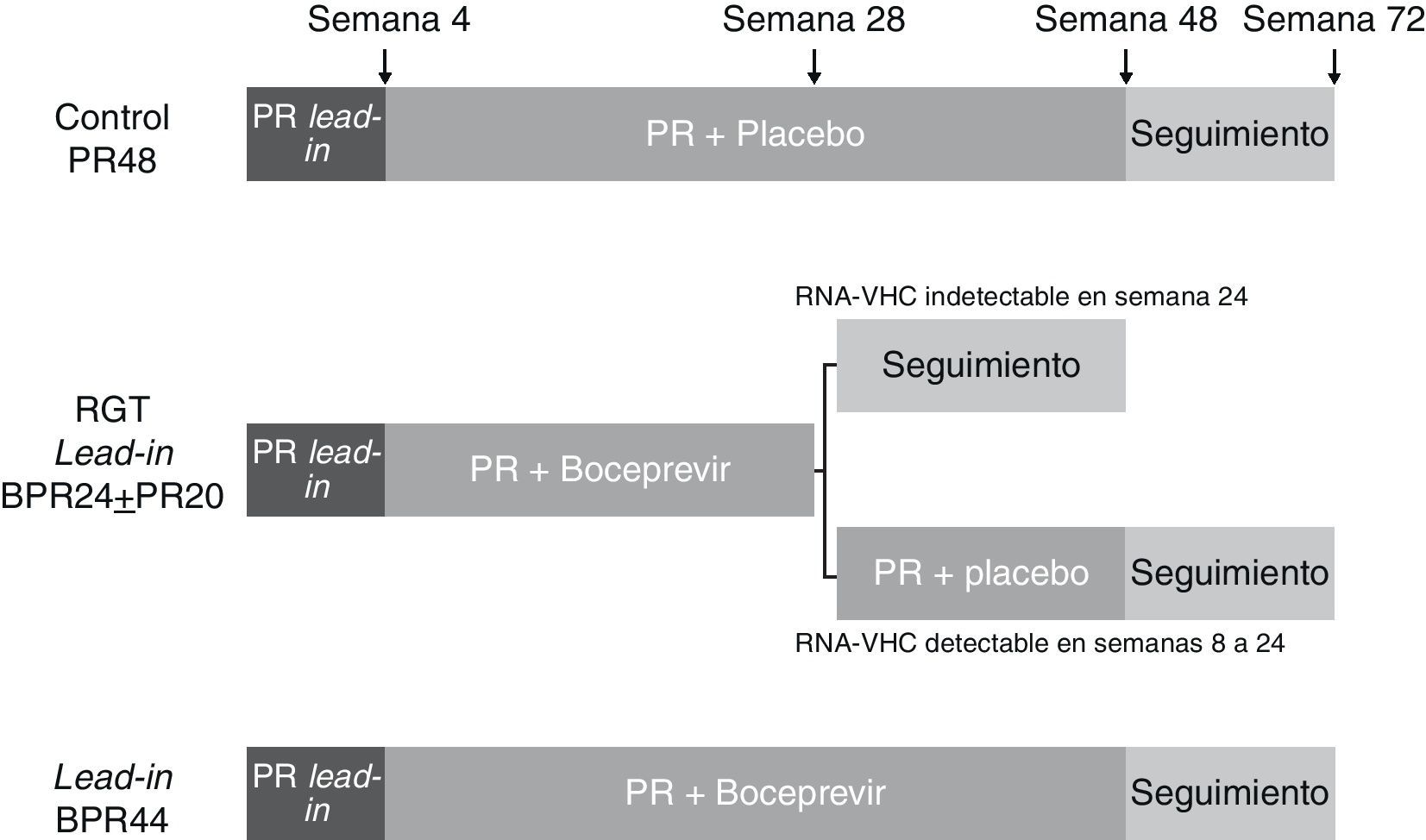
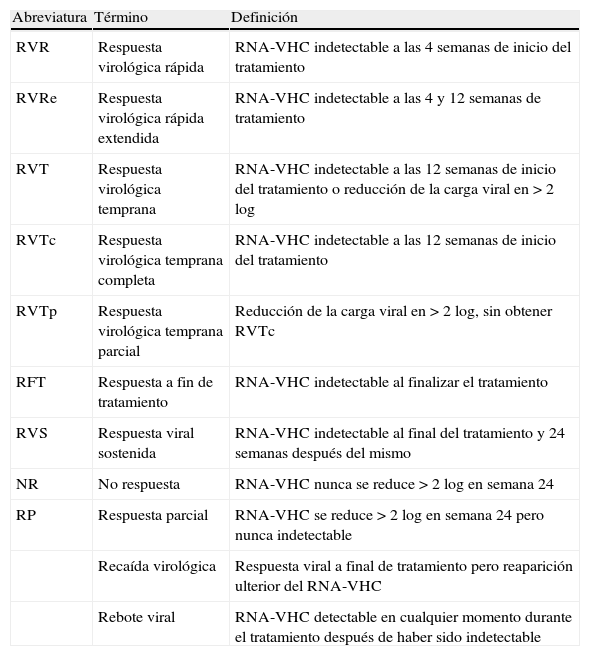
BoceprevirLa eficacia y seguridad del boceprevir, una ketoamida peptidomimética lineal biodisponible por vía oral, han sido evaluadas en el ensayo clínico SPRINT-255, un estudio de fase 3 aleatorizado y controlado con placebo. En este estudio el boceprevir fue administrado en una dosis de 800mg cada 7-9 h por vía oral junto a PEG-IFN α-2b (1,5μg/kg/semana) y ribavirina ajustada según peso corporal (800-1.400mg/día). Los pacientes fueron aleatorizados en 3 brazos (1:1:1) que comparten una fase inicial de 4 semanas de tratamiento de PEG-IFN α-2b y ribavirina (lead-in). Esta fase se continúa en un primer brazo de una pauta de tratamiento con PEG-IFN α-2b y ribavirina más placebo durante 44 semanas (PR48); un segundo brazo consiste en una pauta de tratamiento guiado por respuesta (RGT) con boceprevir más PEG-IFN α-2b y ribavirina durante 24 semanas, añadiendo 20 semanas de PEG-IFN α-2b y ribavirina si el RNA-VHC es detectable entre las semanas 8 y 24 (lead-in RGT BPR24±PR20); el tercer brazo consiste en tratamiento con boceprevir más PEG-IFN α-2b y ribavirina durante 44 semanas (lead-in BPR44). En los 3 brazos el tratamiento fue interrumpido en caso de detectar un RNA positivo en semana 24 (fig. 1). Fueron incluidos 1.097 pacientes naïve, 159 de ellos de raza afroamericana. La RVS fue significativamente superior en los brazos en los que se administró boceprevir frente al control, sin diferencias significativas entre el brazo de terapia guiada por respuesta y la pauta fija con boceprevir durante 44 semanas (37, 66 y 63% en brazo control PR48, lead-in RGT BPR24±PR20 y lead-in BPR44 en no afroamericanos, respectivamente). Estos resultados se observan, aunque a menor escala, en pacientes afroamericanos (23, 53 y 42%, respectivamente). Aproximadamente dos tercios de los pacientes obtienen RVR y mantienen el RNA-VHC indetectable hasta la semana 24, beneficiándose de una reducción del tratamiento a 24 semanas55.
Esquema del diseño del estudio SPRINT-255. Los pacientes fueron aleatorizados en 3 brazos que comparten una fase inicial de 4 semanas de tratamiento de PEG-IFN α-2b y ribavirina (lead-in). Esta fase se continúa en un primer brazo de una pauta de tratamiento con PEG-IFN α-2b y ribavirina más placebo durante 44 semanas (PR48); un segundo brazo consiste en una pauta guiada por respuesta (RGT) con boceprevir más PEG-IFN α-2b y ribavirina durante 24 semanas, añadiendo 20 semanas de PEG-IFN α-2b y ribavirina si el RNA-VHC es detectable entre las semanas 8 y 24 (lead-in RGT BPR24±PR20); el tercer brazo consiste en tratamiento con boceprevir más PEG-IFN α-2b y ribavirina durante 44 semanas (lead-in BPR44).
La inclusión de una fase lead-in en el diseño de este ensayo se apoya teóricamente en la posibilidad de un aumento de la tasa de RVS y la disminución de recaídas y/o rebotes virales al disminuir la carga viral antes de la introducción del inhibidor de la proteasa. La comparación directa con los resultados de los estudios en fase 2 no mostró sin embargo un aumento de la RVS, observándose únicamente una tendencia a una menor tasa de rebote viral, aunque sin diferencias significativas entre los brazos con y sin lead-in30. Esta fase de 4 semanas de PEG-IFN y ribavirina presenta otras ventajas, como el hecho de permitir conocer aquellos pacientes con RVR en los que probablemente añadir un antiviral directo no aumente de forma significativa la RVS, con el consiguiente ahorro en eventos adversos y costes. Es además un potente factor predictivo de respuesta viral al tratamiento, de tal forma que aquellos pacientes en los que la carga viral desciende 1 log en la semana 4 obtienen unas tasas respectivas de RVS del 52, 82 y 82% frente al 5, 29 y 39% en aquellos en los que no se produce dicho descenso. Esta fase de lead-in refleja la sensibilidad al PEG-IFN, de tal forma que cuando no se produzca el descenso de 1 log en semana 4 podemos considerar que el paciente se encuentra funcionalmente bajo monoterapia con el inhibidor de proteasa. Quizás en ello subyace el aumento de la tasa de resistencias observada en los pacientes en los que no se produce un descenso de 1 log en la fase de lead-in frente a aquellos en los que se logra dicho descenso (4 frente a 47% en el brazo de RGT)30,55.
En el estudio, además de la RVR y el descenso de 1 log en la fase de lead-in, se observaron como factores predictivos de respuesta la edad inferior a 40 años, raza no negra, RNA-VHC inferior a 400.000 U/ml, la ausencia de cirrosis, la administración de estatinas y el haber recibido boceprevir. La aparición de anemia fue un factor predictivo de respuesta viral con tasas significativamente mayores de RVS en aquellos pacientes con hemoglobina inferiores a 10g/dl (60, 72 y 79% frente a 33, 64 y 59% respectivamente). Los análisis preliminares indican que el polimorfismo de la IL-28B mantiene esta capacidad predictiva en el tratamiento con triple terapia. Así, en el SPRINT-2 la RVS en el brazo lead-in BPR44 fue de 80, 71 y 59% de pacientes con genotipos CC, CT y TT, respectivamente. El polimorfismo IL-28B también predice la posibilidad de acortar la duración del tratamiento al relacionarse el genotipo CC con una mayor probabilidad de negativizar de forma precoz el RNA viral. El RNA-VHC fue negativo en semana 8 en el 89 y 52% de los pacientes con genotipos CC y CT/TT, respectivamente. De todas formas, debe tenerse en cuenta que aunque la tasa de RVS en pacientes con RVR (tras lead-in), más frecuente en genotipo CC, no va a ser significativamente diferente en pacientes tratados con terapia doble con PEG-IFN y ribavirina frente a triple terapia, va a ser posible acortar el tratamiento en este último caso, lo cual significa una ventaja en pacientes con carga viral elevada. También se debe observar que aunque el polimorfismo TT se asocia a menor tasa de RVS, esta se produce en casi la mitad de pacientes, por lo que no es un factor suficiente para la restricción del tratamiento55.
TelaprevirEl telaprevir es el segundo inhibidor de la proteasa NS3/4A aprobado en el tratamiento de la infección por genotipo 1 del VHC. Es también un péptido de la familia ketoamida biodisponible por vía oral que demostró buena tolerancia y eficacia en los estudios de fases 1 y 224,27,28. Esta eficacia y seguridad ha sido evaluada clínicamente en 2 ensayos de fase 3, el ADVANCE y el ILLUMINATE, recientemente publicados. En ambos el telaprevir fue administrado en dosis de 750mg cada 7-9 h acompañado de comida junto a PEG-IFN α-2a y ribavirina ajustada a peso (1.000mg si <75 kg o 1.200mg si≥75 kg).
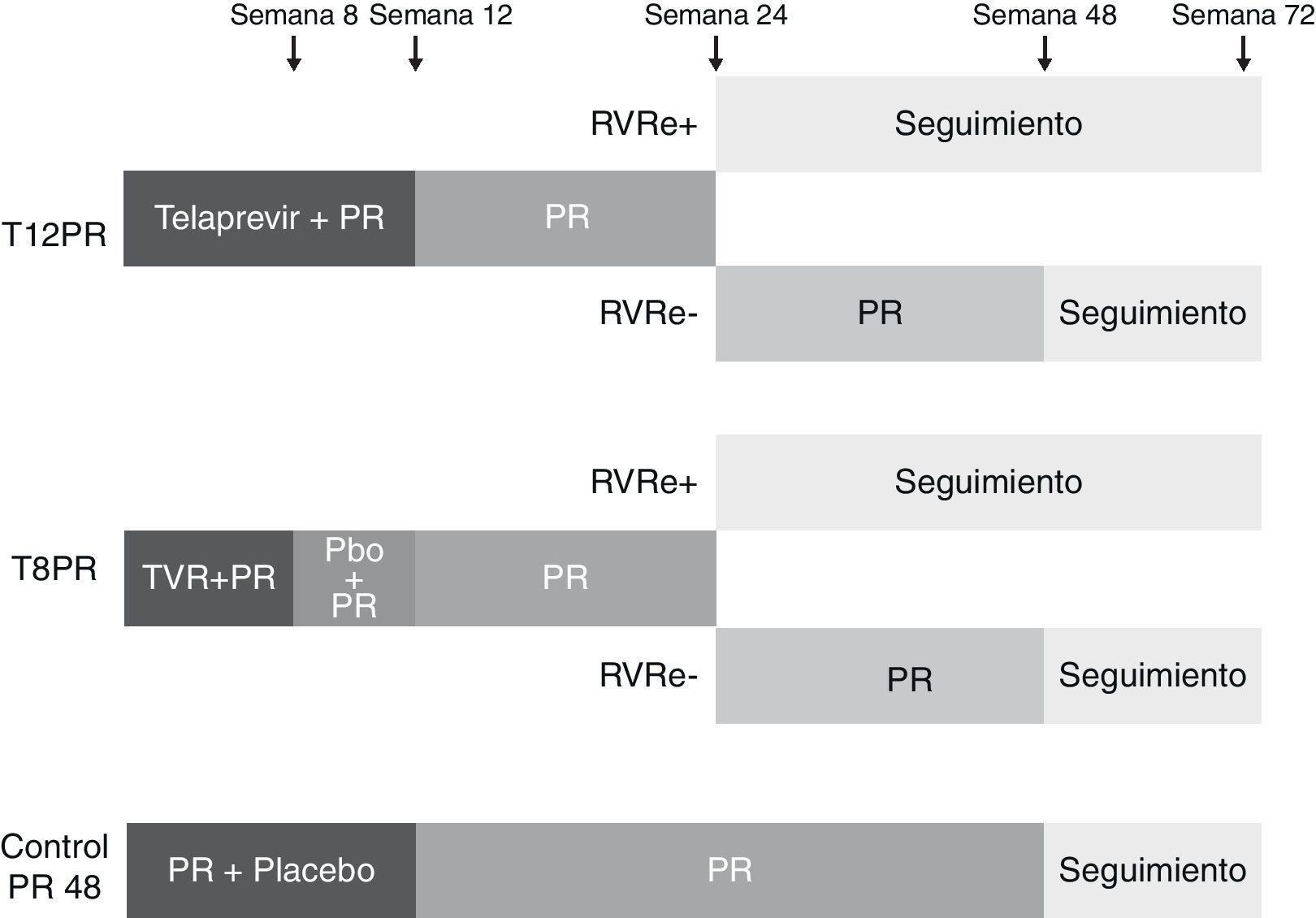
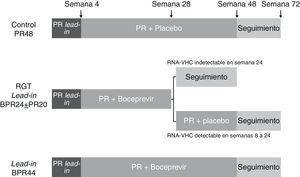
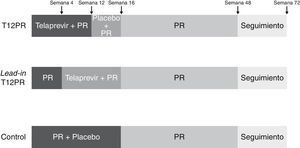
En el estudio ADVANCE56, 1.095 pacientes infectados por genotipo 1 del VHC fueron aleatorizados en 3 brazos de tratamiento (1:1:1), los 2 primeros con 12 y 8 semanas de triple terapia (T12PR y T8PR, respectivamente) y el tercero de control con placebo, PEG-IFN y ribavirina durante 12 semanas seguido de PEG-IFN y ribavirina hasta la semana 48 (PR48). En el brazo T8PR, tras la semana 8 se continúa el tratamiento hasta semana 12 con placebo, PEG-IFN y ribavirina. La duración de los 2 primeros brazos varió en función de la respuesta viral (RGT): en caso de presentar un RNA-VHC negativo en semanas 4 y 12 de tratamiento (respuesta viral rápida extendida, RVRe) se continúa el tratamiento hasta la semana 24, mientras que si este es positivo en algún momento entre las semanas 4 y 12 se continúa hasta la semana 48 con PEG-IFN y ribavirina (fig. 2). Los pacientes que recibieron telaprevir suspendieron el tratamiento en caso de presentar un RNA-VHC superior a 1.000 U/ml en la semana 4, cuando no se observaba una disminución mayor de 2 log de la carga viral en la semana 12 o cuando era detectable en cualquier momento entre las semanas 24 y 40 de tratamiento. La tasa global de RVS fue superior en los brazos T8PR y T12PR (69 y 75%, respectivamente) comparado con el grupo control (44%). El 58 y 57% de los pacientes en los respectivos brazos que emplearon telaprevir consiguieron una RVRe, permitiendo por consiguiente un acortamiento del tratamiento, logrando en estos casos unas tasas respectivas de RVS del 89 y 83%56.
Esquema del diseño del estudio ADVANCE56. Los pacientes fueron aleatorizados en 3 brazos de tratamiento, los 2 primeros con 12 y 8 semanas de triple terapia (T12PR y T8PR, respectivamente) y el tercero de control con placebo, PEG-IFN y ribavirina durante 12 semanas seguido de PEG-IFN y ribavirina hasta la semana 48 (PR48). En el brazo T8PR, tras la semana 8 se continúa el tratamiento hasta semana 12 con placebo, PEG-IFN y ribavirina. La duración de los 2 primeros brazos varió en función de la respuesta viral (RGT): en caso de presentar un RNA-VHC negativo en semanas 4 y 12 de tratamiento (respuesta viral rápida extendida, RVRe) se continúa el tratamiento hasta la semana 24, mientras que si este es positivo en algún momento entre las semanas 4 y 12 se continúa hasta la semana 48 con PEG-IFN y ribavirina. TVR: telaprevir; pbo: placebo.
El ILLUMINATE es un estudio de fase 3 aleatorizado y abierto cuya objetivo consistía en evaluar diferentes duraciones de tratamiento en pacientes que consiguen una RVRe57. Quinientos cuarenta pacientes infectados con genotipo 1 del VHC fueron tratados inicialmente durante 12 semanas con telaprevir, PEG-IFN y ribavirina. Tras la semana 20 de tratamiento aquellos pacientes que consiguieron negativizar el RNA-VHC en las semanas 4 y 12 (RVRe) fueron aleatorizados a recibir tratamiento con PEG-IFN y ribavirina hasta la semana 24 o 48 (T12PR24 y T12PR48), mientras que aquellos que no conseguían RVRe mantuvieron tratamiento hasta la semana 48 con PEG-IFN y ribavirina. El tratamiento fue suspendido en todos los pacientes que presentaban RNA-VHC superior a 1.000 U/ml en semanas 4 o 12 y en aquellos con RNA superior a 10-15 U/ml en la semana 24. La RVS global fue del 72%, similar a la obtenida en el estudio ADVANCE55. Lograron una RVRe 352 pacientes (62,5%) y fueron susceptibles de aleatorización para cumplir 24 o 48 semanas de tratamiento, logrando tasas de RVS del 92 y 88% respectivamente, frente al 64% en aquellos pacientes que no consiguieron una RVRe. Estos datos señalan por tanto que es posible acortar la duración del tratamiento tras 12 semanas de administración de telaprevir en aproximadamente dos tercios de los pacientes con genotipo 1 que no han recibido terapia previa (RVRe+) sin afectar la tasa de respuesta, al menos en los enfermos sin cirrosis.
Tanto en el ADVANCE como en el ILLUMINATE lograr una RVRe es el principal factor predictivo de RVS. En el ILLUMINATE57 no se observaron diferencias significativas en la RVS en aquellos pacientes con los clásicos factores predictivos de mala respuesta, como el RNA-VHC basal superior a 800.000 U/ml, subgenotipo 1a o raza afroamericana, una vez se ha logrado la negativización del RNA en semanas 4 y 12. Por su parte, en el ADVANCE56 se ha detectado una tasa elevada de RVS aun en aquellos pacientes con factores predictivos negativos de respuesta a PEG-IFN y ribavirina como pacientes con puentes de fibrosis o cirrosis, alta carga viral, edad avanzada, diabetes o raza afroamericana. De forma análoga al SPRINT-255, el polimorfismo de la IL-28B se mantiene como un factor predictivo de respuesta al tratamiento, consiguiéndose respectivas tasas de RVS del 90, 71, y 73% en los pacientes con genotipos CC, CT y TT. Además, el polimorfismo de la IL-28B proporcionará información sobre la posibilidad de acortar el tratamiento a las 24 semanas al conseguir con mayor frecuencia una RVRe en aquellos con genotipo favorable (78, 57 y 45% de pacientes con genotipos CC, CT y TT, respectivamente).
Pacientes tratados previamenteEn los últimos años se han evaluado diferentes estrategias de tratamiento en los pacientes infectados por el VHC en los que han fallado uno o varios esquemas previos de terapia antiviral. Entre ellas destaca el retratamiento con dosis más elevadas de PEG-IFN o ribavirina, prolongar el régimen de tratamiento hasta las 72 semanas o identificar y modificar factores predictivos de mala respuesta (baja adherencia, resistencia a la insulina). A pesar de ello, la RVS tras el retratamiento continúa siendo pobre, con una tasa del 20-33% en pacientes recaedores y de 6,3-10,7% en respondedores nulos a un tratamiento previo35–37,58. En los ensayos de fase 3 realizados en estos pacientes con regímenes que incluyen los nuevos inhibidores de proteasa recientemente aprobados se observa un aumento de la tasa de RVS. En estos estudios en fase 3 se ha observado también la importancia de una correcta caracterización del tipo de respuesta al tratamiento previo, ya que además de ser el principal factor predictivo de respuesta, puede influir en la pauta de tratamiento elegida.
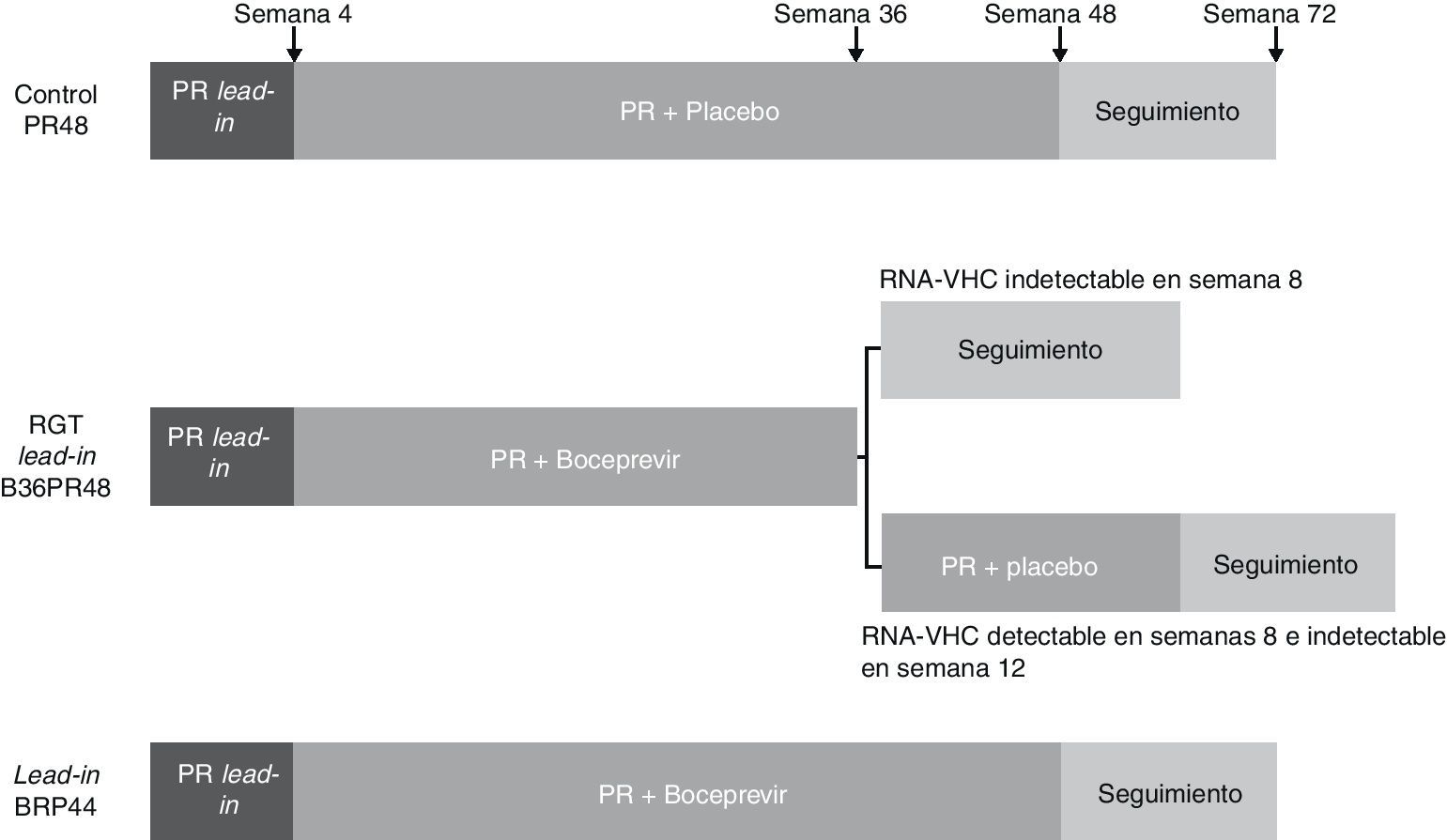
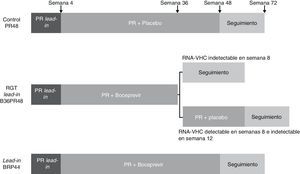
BoceprevirEl RESPOND-259 es un estudio de fase 3 aleatorizado y controlado con placebo, diseñado con el objetivo de evaluar la RVS tras 2 pautas de tratamiento con boceprevir (800mg cada 7-9 horas), PEG-IFN α-2b (1,5μg/kg semanal) y ribavirina ajustada a peso (600-1.400mg/día), frente a una pauta de PEG-IFN α-2b y ribavirina en pacientes recaedores y respondedores parciales a un tratamiento previo con PEG-IFN y ribavirina. En este estudio no se incluyeron pacientes respondedores nulos a terapia previa con PEG-IFN y ribavirina. 403 pacientes fueron aleatorizados en 3 brazos de tratamiento (1:2:2). Todos recibieron inicialmente una pauta de 4 semanas con PEG-IFN α-2b y ribavirina (lead-in). En el primer brazo dicha pauta se continuó con la administración de placebo asociado al PEG-IFN y ribavirina durante 48 semanas (PR48, brazo control). En un segundo brazo la pauta de lead-in se continuó con triple terapia con boceprevir, PEG-IFN y ribavirina de una duración variable en función de la respuesta viral (RGT): en aquellos con RNA-VHC negativo en las semanas 8 y 12 se mantuvo triple terapia hasta la semana 36 de tratamiento, mientras que aquellos con RNA-VHC detectable en alguno de estos momentos se le añadió una pauta de 12 semanas de PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento (B36PR48). En el tercer brazo de tratamiento se administró una pauta de triple terapia de 44 semanas tras la fase de lead-in (fig. 3). El tratamiento fue interrumpido en todos los grupos cuando el RNA-VHC no se negativizó en semana 12, como se había definido en las pautas de retratamiento con PEG-IFN y ribavirina evaluadas en la pasada década60,61. Globalmente la tasa de RVS fue significativamente mayor en los 2 brazos de tratamiento con boceprevir (59 y 66% en los brazos 2 y 3, respectivamente) que en el brazo control (21%). Aquellos pacientes que obtuvieron un RNA-VHC indetectable en semanas 8 y 12 de tratamiento consiguieron una tasa de RVS del 86 y 88% tras 32 y 44 semanas, respectivamente. El 52% de los pacientes consiguieron negativizar la carga viral en semana 8, cinco veces más que aquellos pacientes en el grupo control (9%). Las respectivas tasas de RVS en los 102 pacientes que no lograron un descenso de 1 log con respecto al basal tras la fase de lead-in fueron del 0, 33 y 34%. Además de este valor predictivo, la fase de lead-in permitió conocer el tipo de respuesta al tratamiento con PEG-IFN y ribavirina antes de iniciar el inhibidor de la proteasa, hecho importante en aquellos pacientes en los que la cinética viral a terapias previas se desconoce o en los que puede variar el tipo de respuesta al iniciarse un nuevo régimen terapéutico, como se ha comprobado en este estudio y en previos con PEG-IFN y ribavirina60,61.
Esquema del diseño del estudio RESPOND-259. Todos los pacientes incluidos recibieron una pauta de 4 semanas con PEG-IFN α-2b y ribavirina (lead-in). En el primer brazo dicha pauta se continuó con la administración de placebo asociado al PEG-IFN y ribavirina durante 48 semanas (PR48, brazo control). En un segundo brazo la pauta de lead-in se continuó con triple terapia con boceprevir, PEG-IFN y ribavirina de una duración variable en función de la respuesta viral (RGT): en aquellos con RNA-VHC negativo en semanas 8 y 12 se mantuvo triple terapia hasta la semana 36 de tratamiento, mientras que aquellos con RNA-VHC detectable en alguno de estos momentos se le añadió una pauta de 12 semanas de PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento (B36PR48). En el tercer brazo de tratamiento se administró una pauta de triple terapia de 44 semanas tras la fase de lead-in.
En este estudio el principal factor predictivo de respuesta viral fue el tipo de respuesta previa al tratamiento, de tal forma que las respectivas tasas de RVS en pacientes recaedores fueron del 29, 69 y 75% frente al 7, 40 y 52% en respondedores parciales. Esta excelente tasa de RVS, similar a la de pacientes no tratados previamente, resulta lógica si se tiene en cuenta que estos pacientes han presentado una cinética viral favorable en una pauta de tratamiento previo, factor también predictivo de respuesta viral en este estudio. Así, el descenso de más de 1 log en la semana 4 y la negativización precoz del virus al introducir el boceprevir son otros factores relevantes para predecir la respuesta viral. Hasta el momento se dispone de pocos datos acerca del papel predictivo del polimorfismo de la IL-28B en este grupo de pacientes. Se ha objetivado un aumento de la tasa de RVS en los pacientes CC que reciben triple terapia con boceprevir en cualquiera de sus brazos (79 y 61-73%, respectivamente) frente al grupo control (46 y 17%, respectivamente). En pacientes con polimorfismo TT, la pauta con boceprevir durante 44 semanas ofrece una tasa de RVS superior a aquellos con una pauta de RGT o aquellos del brazo control. Como en aquellos pacientes no tratados, un polimorfismo favorable se asocia a una cinética viral también favorable con una elevada tasa de descenso de más de 1 log del RNA viral en la fase de lead-in. Es en cambio en el polimorfismo TT, como en otros grupos con peor tasa de RVS, donde esta fase de lead-in muestra una mayor capacidad de predicción de respuesta59.
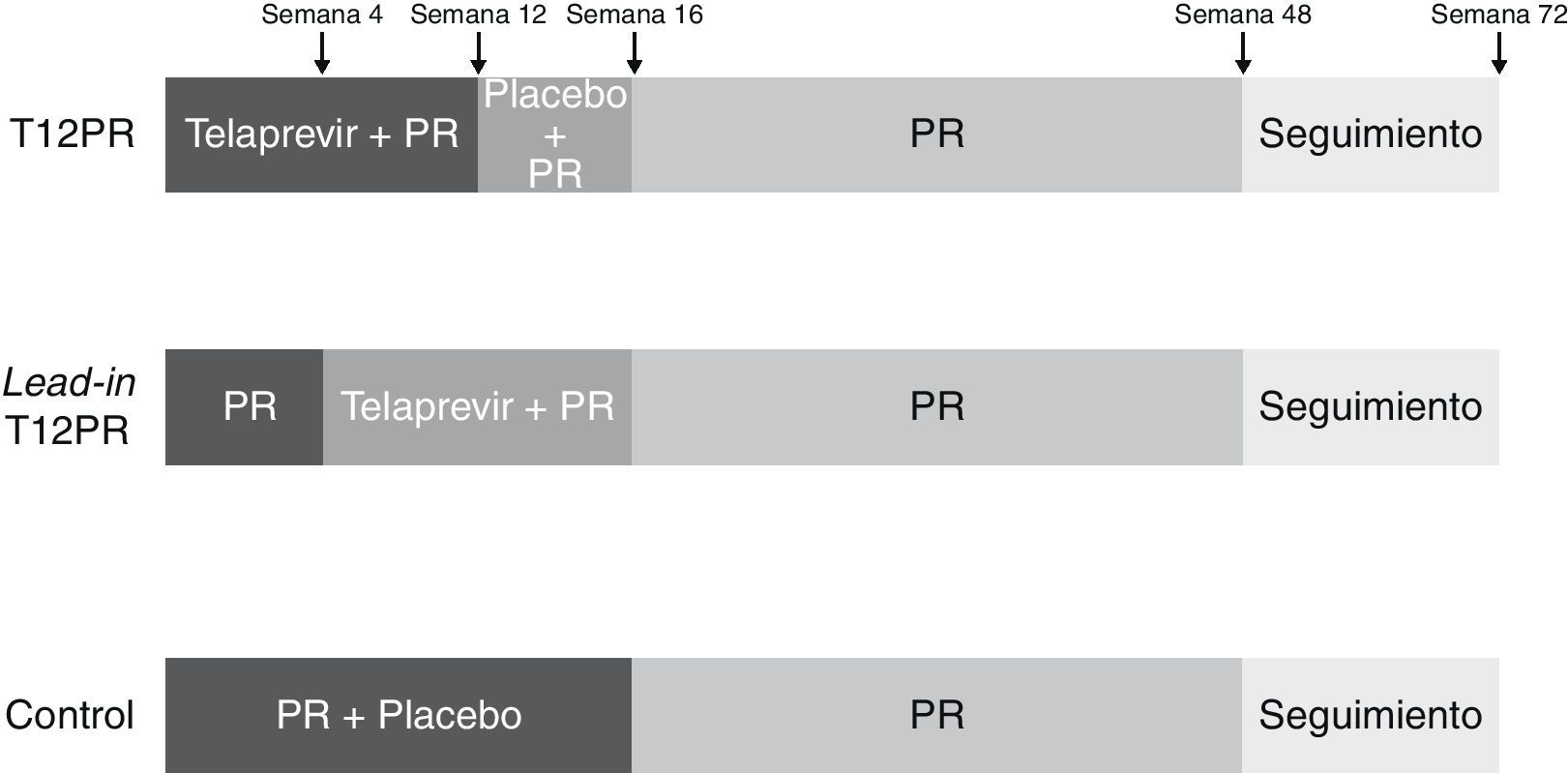
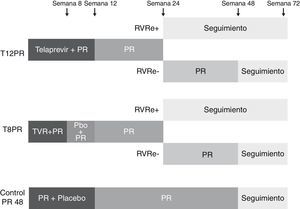
TelaprevirLa eficacia y seguridad de este fármaco, además de la utilidad de la pauta de lead-in, fueron evaluadas en un estudio de fase 3 a doble ciego, aleatorizado y controlado con placebo (REALIZE)62, en el que se incluyeron 662 pacientes que no habían conseguido respuesta tras al menos una pauta de tratamiento con PEG-IFN y ribavirina. En este estudio, a diferencia del RESPOND-2, además de recaedores y respondedores parciales, se incluyeron pacientes con nula respuesta a un tratamiento antiviral previo después de que un ensayo de fase 2 demostrara resultados favorables en este grupo de pacientes28. El telaprevir fue administrado en una dosis de 750mg cada 7-9 h asociado a PEG-IFN α-2a a dosis de 180μg semanal y ribavirina ajustada a peso (1.000 o 1.200mg según el peso sea menor o mayor de 75 kg, respectivamente). Los pacientes fueron aleatorizados en 3 grupos de tratamiento, 2 con telaprevir y uno control con placebo (2:2:1). Los pacientes incluidos en el primer brazo recibieron una pauta de triple terapia con telaprevir durante 12 semanas, seguida de 4 semanas con placebo, PEG-IFN y ribavirina y posteriormente PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento. El segundo brazo evalúa la pauta de lead-in y en él se inició el tratamiento con placebo, PEG-IFN y ribavirina durante 4 semanas, seguido de triple terapia con telaprevir durante 12 semanas y de PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento. En el tercer brazo de tratamiento los pacientes recibieron placebo, PEG-IFN y ribavirina durante 16 semanas continuando con PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento (brazo control) (fig. 4). El telaprevir fue suspendido cuando los niveles de RNA viral fueron superiores a 100 U/ml en semanas 4, 6 y 8 tras el inicio de telaprevir, pudiendo continuar con PEG-IFN y ribavirina en ese caso. Se interrumpió todo el tratamiento cuando se observaba un descenso inferior a 2 log del RNA-VHC a las 12 semanas (brazos 1 y 3) o 16 semanas (brazo 2) o cuando el RNA-VHC resultó detectable en semanas 24 o 36 en dichos grupos64.
Esquema del diseño del estudio REALIZE62. Los pacientes incluidos en el primer brazo recibieron una pauta de triple terapia con telaprevir durante 12 semanas, seguida de 4 semanas con placebo, PEG-IFN y ribavirina y posteriormente PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento. El segundo brazo evalúa la pauta de lead-in y en él se inició el tratamiento con placebo, PEG-IFN y ribavirina durante 4 semanas, seguido de triple terapia con telaprevir durante 12 semanas y de PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento. En el tercer brazo de tratamiento los pacientes recibieron placebo, PEG-IFN y ribavirina durante 16 semanas continuando con PEG-IFN y ribavirina hasta cumplir 48 semanas de tratamiento (brazo control).
Las tasas globales de RVS en este estudio fueron del 64 y 66% en los brazos con telaprevir, respectivamente, frente al 17% en el grupo control. No se observó beneficio en la tasa de respuesta durante el tratamiento, rebote viral o RVS en aquellos pacientes que recibieron una pauta de lead-in previa a la introducción del telaprevir. No obstante, esta fase de lead-in demostró otras ventajas, como el constituirse como un importante factor predictivo de respuesta viral, obteniéndose una tasa de RVS global del 81% en aquellos pacientes que consiguen un descenso de más de 1 log tras el lead-in frente al 33% en aquellos que no lo consiguen.
Si se considera la tasa de aclaramiento viral en función del tipo de respuesta a una pauta previa, de nuevo el grupo de recaedores fue el que obtuvo una tasa mayor de RVS. Esta fue del 83, 88 y 24% en los brazos 1, 2 y 3, respectivamente. Entre los pacientes recaedores, el 76% logró negativizar el RNA-VHC en semanas 4 y 12 de tratamiento (RVRe), lográndose en estos una RVS en el 95% de los casos. Estos resultados, similares a los obtenidos en pacientes previamente no tratados, apoyan la posibilidad de acortamiento del tratamiento en este grupo de pacientes. En los respondedores parciales las tasas de RVS fueron del 59, 54 y 15%, respectivamente, disminuyendo a 29, 33 y 5% en respondedores nulos. Ambos grupos de pacientes se beneficiarán, por tanto, de una prolongación del tratamiento hasta 48 semanas para aumentar la tasa de RVS.
De forma análoga al estudio RESPOND-259 son factores predictivos de RVS el tipo de respuesta a una pauta de tratamiento previo y la negativización rápida de la carga viral (RVRe). El grado de fibrosis fue también un factor predictivo negativo de respuesta, menos relevante en los pacientes recaedores, probablemente por una cinética viral más favorable en este grupo de pacientes. No se dispone de datos que aclaren el papel del polimorfismo de la IL-28B en pacientes previamente tratados que reciben un régimen terapéutico con telaprevir62.
Como se ha comentado previamente, es conocido el cambio del tipo de respuesta al tratamiento en cada pauta administrada, y así en el estudio REALIZE, un 40% de pacientes clasificados como respondedores parciales y el 10% de los recaedores no lograron la disminución de 1 log en la semana 4, definiéndose como respondedores nulos. De igual manera, un 41% de los pacientes previamente catalogados como respondedores nulos lograron un descenso de más de 1 log en la fase de lead-in. Se han descrito hallazgos similares en el estudio RESPOND-259, donde el 40% de los respondedores parciales y el 18% de los recaedores obtuvieron una pobre respuesta tras la fase de lead-in. De esta forma, esta fase de 4 semanas con PEG-IFN y ribavirina permite actualizar el tipo de respuesta, importante factor predictivo de aclaramiento viral, en aquellos pacientes en los que no se conoce previamente o en aquellos grupos con pobre respuesta al tratamiento donde se precisa el apoyo de otros factores predictivos62.
Indicaciones de triple terapia en grupos especialesCirrosis hepáticaEl riesgo de desarrollo de una cirrosis hepática tras 20 años de infección crónica por el VHC se ha estimado en un 10-20%. Extrapolando datos de estudios epidemiológicos se ha evaluado en 7,8 millones el número de infectados por el VHC en todo el mundo que se encuentran actualmente en fase de cirrosis. Adicionalmente, se estima que este número se incrementará en un 77% en los próximos 15 años. Ello conducirá a incrementos significativos en la incidencia de cáncer hepático, de la mortalidad por enfermedad hepática y de las indicaciones de trasplante de hígado. De particular interés es el hecho de que la situación de cirrosis hepática compensada (pacientes sin historia de complicaciones clínicas de su enfermedad hepática y con función hepatocelular conservada, clase A de la clasificación de Child-Pugh) no es completamente estable, y estos sujetos continúan en riesgo de progresión de la enfermedad. En sujetos con cirrosis hepática compensada el riesgo de desarrollo de descompensaciones de la cirrosis, de aparición de un hepatocarcinoma o de muerte es del 3,6-6; 1,4-3,3, y 2,6-4% al año, respectivamente3,63–68. Tras la aparición de la primera descompensación de la cirrosis asociada al VHC, la supervivencia se reduce al 50% a los 5 años65. Por su parte, la mediana de supervivencia tras la detección de un hepatocarcinoma en un hígado cirrótico es inferior a los 2 años69.
En los últimos años hemos asistido a un incremento de la evidencia a favor de que la consecución de RVS en enfermos con infección por VHC y cirrosis hepática reduce el riesgo de descompensación, de la necesidad de trasplante, de desarrollo de hepatocarcinoma y de muerte derivada de la enfermedad hepática11,70,71. Los cambios histológicos observados en pacientes que alcanzan RVS muestran una reducción significativa en el grado de fibrosis (−0,59-1 puntos)72,73. Existe evidencia reciente de que la RVS se asocia a una reducción del gradiente de presión venosa hepática, con el consiguiente impacto en la incidencia y las consecuencias de las complicaciones derivadas de la hipertensión portal74. Adicionalmente, el aclaramiento del RNA-VHC durante la terapia antiviral en sujetos en lista de espera para trasplante hepático parece reducir el riesgo de recidiva de la infección tras el trasplante (19-21-Forns)75–77. De todo ello resulta obvio que la población infectada por el VHC en fase de cirrosis constituye un objetivo prioritario para la aplicación de fármacos antivirales. Los potenciales beneficios derivados de la RVS en enfermos cirróticos infectados por el VHC se resumen en la tabla 2.
Potenciales beneficios asociados a la respuesta viral sostenida en cirrosis asociada a virus de la hepatitis C
▪ Reducción en el grado histológico de fibrosis e inflamación |
▪ Reducción del gradiente de presión venosa hepática |
▪ Disminución del riesgo de descompensación de la enfermedad hepática |
▪ Reducción del riesgo de desarrollo de carcinoma hepatocelular |
▪ Disminución del riesgo de muerte derivada de la enfermedad hepática |
▪ Disminución de la necesidad de trasplante hepático |
▪ Reducción del riesgo de recidiva viral postrasplantea |
Sin embargo, el tratamiento de los pacientes con infección por VHC y cirrosis hepática plantea una serie de dificultades entre las que se incluyen la presencia de citopenias, la susceptibilidad incrementada a las infecciones, el riesgo de descompensación y la posibilidad de aparición de eventos adversos, incluso graves, relacionados con la terapia antiviral. Además, a la hora de evaluar la eficacia de los distintos regímenes terapéuticos ensayados en sujetos cirróticos infectados por el VHC nos encontramos con una llamativa escasez de información, toda vez que el porcentaje de sujetos con fibrosis avanzada incluida en los ensayos clínicos de referencia es relativamente escaso. Además, se trata de pacientes en condiciones clínicas y analíticas «excelentes» (por ejemplo, con medias de recuentos plaquetarios normales), lo cual dificulta la extrapolación de resultados a la práctica clínica habitual. No obstante, se acepta que los sujetos con fibrosis más avanzada presentan tasas de RVS un 5-10% inferior a las obtenidas con el mismo régimen terapéutico en pacientes con menor grado de fibrosis. La respuesta fue más baja en cirróticos infectados por el genotipo 1 y con elevada carga viral.
En cuanto a los resultados de la terapia con inhibidores de las proteasas en enfermos cirróticos con VHC, en el estudio SPRINT-255, las elevadas tasas de RVS en los brazos de tratamiento con triple terapia en pacientes näives se mantuvieron, aunque en menor grado, incluso en sujetos con variables pretratamiento de mala respuesta, como la raza, la carga viral elevada o la fibrosis avanzada. Aunque el pequeño número de pacientes con fibrosis avanzada incluidos en el estudio impide sacar conclusiones firmes, se observó un aumento de la respuesta en el brazo de tratamiento con triple terapia durante 48 semanas (52%) frente al brazo de RGT (41%), siendo ambas superiores a la RVS conseguida en el brazo control con PEG-IFN y ribavirina durante 48 semanas (38%)55. De forma análoga, en el RESPOND-2, se observó una disminución de la tasa de RVS en pacientes con fibrosis avanzada frente aquellos con fibrosis leve-moderada que no parece afectar, sin embargo, al brazo largo de tratamiento con triple terapia (13, 44 y 68% versus 23, 66 y 68%, en los brazos 1, 2 y 3, respectivamente). A pesar del pequeño número de pacientes, lo que dificulta las conclusiones, si se analiza en función del tipo de respuesta previa y el grado de fibrosis, parece que ésta no afecta a la tasa de RVS entre pacientes recaedores si se usan pautas de triple terapia de 44 semanas (20, 50 y 83% en F3-F4 versus 30, 75 y 75% en F1-F2). Similares resultados se observaron en sujetos respondedores parciales (0, 30 y 46% frente a 9, 47 y 55%, respectivamente)59. Como puede comprobarse, tanto en pacientes näive como previamente tratados, la triple terapia de 44 semanas tras el lead-in presenta una tasa de RVS superior a la de aquellos pacientes con pautas de triple terapia de duración variable en función de la cinética viral (RGT).
Con respecto al telaprevir, se obtuvieron resultados similares, con mantenimiento del beneficio obtenido con la terapia triple sobre la convencional incluso en enfermos con fibrosis avanzada en el estudio ADVANCE (62% en T12PR y 53% en T8PR frente al 33% en el grupo control)56. En pacientes previamente tratados, se observó de forma global una disminución de la frecuencia de aclaramiento viral en aquellos pacientes con fibrosis avanzada. Valorada la tasa de RVS en función del tipo de respuesta previa, no se observaron diferencias significativas en el grupo de recaedores tratados con triple terapia con telaprevir (84 frente a 86% en el brazo 1). En los grupos de respondedores parciales y en el de respondedores nulos se observó un descenso en la tasa de RVS en los pacientes con cirrosis frente a aquellos con lesión leve-moderada (34 versus 72%, 14 versus 41%, respectivamente). A pesar del escaso número de pacientes, en el grupo de no respondedores con cirrosis no se observó un claro beneficio en la RVS al añadir telaprevir a la pauta de PEG-IFN y ribavirina (14 frente al 10%).
Otros grupos especiales: trasplante hepático y coinfección VHC-VIHLos escasos resultados disponibles en otros grupos especiales que obtendrían un especial beneficio del aclaramiento de la replicación viral, como en aquellos con reinfección del injerto por el VHC tras trasplante hepático, la cirrosis descompensada o pacientes coinfectados con el VIH dificultan o impiden las recomendaciones a realizar en estos grupos32. Hay que tener en cuenta, no obstante, que ambos fármacos inhibidores de la proteasa inhiben enzimas implicadas en el metabolismo de numerosos fármacos como el citocromo P450 2C (CYP2C), CYP3A4 o CYP1A. La coadministración con fármacos que dependan en gran medida de estas enzimas para su aclaramiento, como los agentes inmunosupresores inhibidores de la calcineurina (tacrolimus y, en menor medida, ciclosporina) y antirretrovirales podría incrementar de forma tan intensa los niveles plasmáticos de estos últimos que lleguen a producirse episodios adversos importantes e incluso riesgo vital. Ello contraindicaría el empleo de los inhibidores de proteasas en caso de administración conjunta con estos fármacos78,79.
Pautas de tratamientoPacientes no tratados previamenteEl boceprevir debe administrarse en dosis de 800mg cada 7-9 h acompañado de comida junto a PEG-IFN y ribavirina, precedidos de la administración de PEG-IFN y ribavirina durante 4 semanas (lead-in). Aunque la administración de un inhibidor de proteasa en aquellos pacientes en los que se logra la negativización del RNA-VHC en semana 4 (RVR) no aumenta la tasa de RVS, permite el acortamiento del tratamiento a 28 semanas, aunque se necesitan más datos acerca del coste-efectividad de esta estrategia. En pacientes en los que se consigue la indetectabilidad del RNA-VHC a las 8 y 24 semanas de tratamiento, es posible el acortamiento de la triple terapia a 28 semanas sin afectar la tasa de RVS. Aunque un polimorfismo favorable de la IL-28B no permite la selección de la pauta a emplear, es un factor predictivo de aclaramiento rápido del virus y bien de posible acortamiento del tratamiento, o bien de evitar la introducción del inhibidor de proteasa. En caso de que el RNA-VHC sea positivo en alguno de estos momentos la triple terapia debe prolongarse hasta las 48 semanas de tratamiento. El tratamiento debe ser interrumpido en caso de presentar un RNA-VHC > 100 U/ml en la semana 12, detectable en semana 24 o cuando tenga que ser suspendido el PEG-IFN y/o la ribavirina por cualquier motivo32,55.
La dosis recomendada de telaprevir es de 750mg 3 veces al día acompañada de comida grasa y de la administración de PEG-IFN y ribavirina. El telaprevir debe administrarse durante 12 semanas, seguido PEG-IFN y ribavirina durante un tiempo variable en función de la respuesta viral. En aquellos pacientes en los que se logra negativizar el RNA-VHC en semanas 4 y 12 es necesario administrar PEG-IFN y ribavirina durante solo 12 semanas más, mientras que si este es positivo en alguno de estos momentos debe prolongarse dicho tratamiento hasta la semana 48. El tratamiento debe ser interrumpido en caso de presentar un RNA-VHC > 1.000 U/ml en semanas 4, 12 o 24, así como cuando deba ser suspendido el PEG-IFN y/o la ribavirina por cualquier motivo32,56,57.
Los pacientes con cirrosis hepática deben ser tratados durante un total de 48 semanas. En aquellos en los que se administre boceprevir, este debe administrarse asociado a PEG-IFN y ribavirina durante 44 semanas tras la fase de lead-in. En aquellos pacientes en los que los eventos adversos dificulten la administración del boceprevir este puede ser suspendido durante las últimas 12 semanas, manteniendo durante estas únicamente PEG-IFN y ribavirina. El telaprevir debe ser administrado durante 12 semanas en forma de triple terapia con PEG-IFN y ribavirina seguido de 36 semanas de doble terapia con PEG-IFN y ribavirina. Las normas de suspensión son equivalentes a las descritas para cada fármaco33,55–57.
Con ambos inhibidores de proteasa la carga viral debe ser monitorizada con frecuencia durante el tratamiento y en caso de aumento de 1 log desde el nadir (rebote viral) debería ser interrumpido debido al riesgo de desarrollo de variantes asociadas a resistencia. Aquellos sujetos en los que se produce un fallo de respuesta no deberían ser tratados con el otro inhibidor de proteasa debido a la presencia de resistencias cruzadas32,55–57.
Pacientes tratados previamenteCuando los pacientes recaedores sean tratados con boceprevir, su administración debe ir precedida de una pauta de 4 semanas de PEG-IFN y ribavirina, seguido por una triple terapia asociando boceprevir en dosis de 800mg cada 7-9 h administrado con comida hasta cumplir 36 semanas de tratamiento, y continuando con PEG-IFN y ribavirina hasta completar 48 semanas. Si bien los resultados de los estudios apoyan un acortamiento del tratamiento a 36 semanas en aquellos pacientes con RNA-VHC indetectable en semanas 8 y 12, dicha pauta no ha sido aprobada por la Agencia Europea del Medicamento (EMEA). El tratamiento con boceprevir debe ser interrumpido en aquellos pacientes que presenten un RNA-VHC superior a 100 U/ml en la semana 12, o en aquellos pacientes en los que se produzca un rebote viral32,59. En pacientes recaedores tratados con telaprevir se recomienda la administración durante las primeras 12 semanas de una triple terapia de telaprevir en dosis de 750mg cada 7-9 h acompañado de comida grasa, PEG-IFN y ribavirina. Dicha fase debe continuarse de una pauta de PEG-IFN y ribavirina de duración variable en función de la respuesta viral, hasta 24 semanas en aquellos con RVRe y de 48 semanas si esta no se obtiene. El tratamiento con telaprevir debe interrumpirse en caso de presentar un RNA-VHC > 1.000 U/ml en las semanas 4 y 12 y cuando se produzca un rebote viral32,62.
En pacientes respondedores parciales y respondedores nulos las pautas con boceprevir o telaprevir deben tener una duración de 48 semanas. La pauta de boceprevir debe ir precedida de una fase de lead-in y en aquellos pacientes en los que los eventos adversos dificulten la adherencia podrían sustituirse las últimas 12 semanas de triple terapia por una pauta de PEG-IFN y ribavirina sin boceprevir32,59,62. Esta misma pauta es la recomendada en todos los pacientes con cirrosis. Aunque en pacientes recaedores que reciben triple terapia la presencia de fibrosis avanzada no influye en la tasa de RVS, en grupos con menor probabilidad de RVS se deberían considerar otros factores que permitan predecir la probabilidad de respuesta. La fase de lead-in permitiría conocer en estos grupos la sensibilidad al interferón antes de la introducción del inhibidor de la proteasa, así como actualizar el tipo de respuesta del paciente a la nueva pauta de tratamiento. Ello es particularmente útil en pacientes respondedores nulos con fibrosis avanzada en los que añadir el inhibidor de la proteasa no logra un aumento de la tasa de RVS32,59,60.
ConclusionesLa asociación de los inhibidores de la proteasa NS3/4a del genotipo 1 del VHC, boceprevir y telaprevir, al PEG-IFN y ribavirina ha permitido aumentar la tasa de RVS de menos del 50% a más del 70%, tanto en pacientes no tratados previamente como en pacientes no respondedores al tratamiento previo. Ello ha llevado a su rápida incorporación como pauta de elección en el tratamiento de pacientes infectados por genotipo 1 con daño significativo, debiéndose individualizar la indicación en pacientes sin lesión avanzada. La efectividad de estos tratamientos, principalmente en pacientes con cinética viral favorable, permite el acortamiento de las pautas con triple terapia a 24 semanas sin afectar las tasas de RVS. En aquellos pacientes con factores de mala respuesta al tratamiento, como la fibrosis avanzada, deben individualizarse las decisiones apoyándose en diferentes factores predictivos como la sensibilidad al interferón, definida tras una fase de lead-in previa a la introducción de inhibidores de la proteasa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.