La endoscopia es la herramienta diagnóstica y terapéutica más eficaz para la prevención secundaria y terciaria del cáncer colorrectal (CCR), ya que no solo permite identificar los pólipos–lesiones precursoras del cáncer–sino que también permite extirparlos. Esto cobra especial importancia cuando nos centramos en los pacientes con alto riesgo de CCR. A pesar de la evidencia científica que demuestra que este subgrupo de pacientes se beneficia de una endoscopia más especializada y dedicada, esto no se suele aplicar en la práctica clínica habitual. Esta revisión técnica pretende aportar información práctica y básica para la implementación de la endoscopia avanzada en los pacientes con alto riesgo de CCR.
El paciente de alto riesgoEl CCR es el segundo tumor más frecuente en nuestro país con cerca de 30.000 casos cada año. Esto contrasta con el hecho de que este tumor constituye el paradigma de las neoplasias susceptibles de prevención. Es importante resaltar que el riesgo de padecer CCR no es homogéneo entre toda la población y por tanto, en función del riesgo de CCR, las estrategias de prevención recomendadas (cribado y vigilancia) son más o menos intensivas:
- -
Riesgo medio: este grupo lo forman los individuos mayores de 50 años sin antecedentes personales ni familiares de neoplasia colorrectal. Este subgrupo es susceptible de medidas de cribado poblacional, que en nuestro país se basa en la determinación de sangre oculta en heces inmunológica bienal.
- -
Riesgo alto: este grupo lo forman los individuos con antecedentes personales o familiares de neoplasia colorrectal, y los pacientes con enfermedad inflamatoria intestinal. Diferentes estrategias de prevención han demostrado ser altamente eficaces en disminuir la incidencia y la mortalidad por CCR en este subgrupo, y estos pacientes requieren de una evaluación especializada en unidades de alto riesgo de CCR.
Los individuos de alto riesgo de CCR se clasifican fundamentalmente en los siguientes subgrupos1:
- 1)
Síndrome de Lynch. Este síndrome está causado por mutaciones en los genes reparadores del ADN (MLH1/MSH2/MSH6/PMS2) y predispone principalmente al desarrollo de CCR (riesgo acumulado 60-80%) y cáncer de endometrio (riesgo acumulado 40-50%). A diferencia de otras enfermedades hereditarias, en este síndrome la carcinogénesis se encuentra acelerada, lo que condiciona el tipo de cribado/vigilancia endoscópica (tablas 1 y 2).
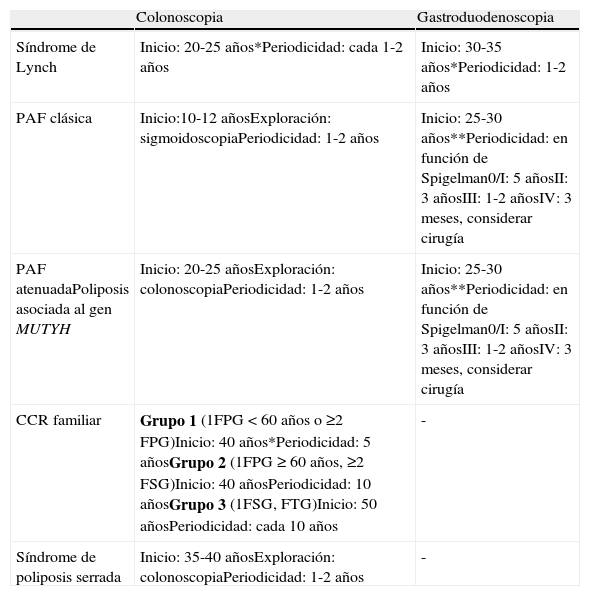
Tabla 1.Estrategias de cribado en población de alto riesgo
Colonoscopia Gastroduodenoscopia Síndrome de Lynch Inicio: 20-25 años*Periodicidad: cada 1-2 años Inicio: 30-35 años*Periodicidad: 1-2 años PAF clásica Inicio:10-12 añosExploración: sigmoidoscopiaPeriodicidad: 1-2 años Inicio: 25-30 años**Periodicidad: en función de Spigelman0/I: 5 añosII: 3 añosIII: 1-2 añosIV: 3 meses, considerar cirugía PAF atenuadaPoliposis asociada al gen MUTYH Inicio: 20-25 añosExploración: colonoscopiaPeriodicidad: 1-2 años Inicio: 25-30 años**Periodicidad: en función de Spigelman0/I: 5 añosII: 3 añosIII: 1-2 añosIV: 3 meses, considerar cirugía CCR familiar Grupo 1 (1FPG<60 años o ≥2 FPG)Inicio: 40 años*Periodicidad: 5 añosGrupo 2 (1FPG≥60 años, ≥2 FSG)Inicio: 40 añosPeriodicidad: 10 añosGrupo 3 (1FSG, FTG)Inicio: 50 añosPeriodicidad: cada 10 años - Síndrome de poliposis serrada Inicio: 35-40 añosExploración: colonoscopiaPeriodicidad: 1-2 años - CCR: cáncer colorrectal; FSG: familiar de segundo grado; FTG: familiar de tercer grado; FPG: familiar de primer grado; PAF: Poliposis adenomatosa familiar.
*o 10 años antes del caso más joven en la familia; ** considerar el uso de duodenoscopia de visión lateral.
Tabla 2.Estrategias de vigilancia en población de alto riesgo
Colonoscopia Síndrome de Lynch Vigilancia de adenomas: 1-2 añosVigilancia tras resección colónica por CCR:- Si colectomía total con anastomosis ileorectal: rectoscopia anual- Si colectomía segmentaria: colonoscopia anual PAF clásica Vigilancia tras resección colónica:- Si proctocolectomía total: exploración endoscópica del reservorio cada 6-12 meses.- Si colectomía con anastomosis ileorectal: rectoscopia cada 6-12 meses. PAF atenuada y Poliposis asociada al gen MUTYH Vigilancia de adenomas en pacientes en los que se consigue un buen control endoscópico: anualVigilancia tras resección colónica:- Si proctocolectomía total: exploración endoscópica del reservorio cada 6-12 meses.- Si colectomía con anastomosis ileorectal: rectoscopia cada 6-12 meses. Síndrome de poliposis serrada Vigilancia de pólipos serrados en pacientes en los que se consigue un buen control endoscópico: anualVigilancia tras resección colónica:- Si proctocolectomía total: exploración endoscópica del reservorio cada 6-12 meses.- Si colectomía con anastomosis ileorectal: rectoscopia cada 6-12 meses. - 2)
Poliposis adenomatosa familiar (PAF). Este síndrome hereditario está causado por mutaciones en los genes APC y MUTYH, aunque en un número significativo de casos desconocemos la causa genética (especialmente en la forma atenuada). En la forma clásica, caracterizada por el desarrollo de cientos de adenomas, el riesgo de CCR es del 100% si no se realiza una colectomía. En la forma atenuada, en la que aparecen <100 pólipos, el riesgo de CCR es menor, y en algunos de ellos el seguimiento endoscópico podría ser suficiente (tablas 1 y 2).
- 3)
Síndrome de poliposis serrada. Este síndrome de reciente descripción se caracteriza por el desarrollo de pólipos serrados múltiples o grandes en el colon y recto en el que existe un riesgo del 20-50% de desarrollar CCR. Los pólipos serrados constituyen un espectro de lesiones que comparten una misma característica anatomopatológica que es el aserramiento de las criptas. Estos se dividen en pólipos hiperplásicos, pólipos/adenomas serrados sésiles, y adenomas serrados tradicionales, y se consideran lesiones precursoras de CCR a través de la vía serrada de carcinogénesis (tablas 1 y 2).
- 4)
CCR familiar. Este grupo lo constituyen los casos en que existen antecedentes familiares de CCR y se ha descartado un síndrome hereditario. El riesgo de desarrollar CCR en esta situación depende el número de familiares afectos, del grado de parentesco, y de la edad al diagnóstico del más joven (tabla 1).
- 5)
Adenomas colorrectales. Está bien establecido que los pacientes que han presentado adenomas colorrectales tienen un riesgo incrementado de desarrollar CCR en el seguimiento. Este riesgo depende fundamentalmente del tamaño (>1cm), presencia de displasia de alto grado, componente velloso o el número de adenomas.
- 6)
Enfermedad inflamatoria intestinal cólica de larga duración.
Los pacientes con enfermedad inflamatoria intestinal (EII) de larga evolución presentan un riesgo más elevado que la población general de desarrollar CCR, siendo el riesgo relativo en la colitis ulcerosa de 3,7 y en la enfermedad de Crohn de 2,5 de forma global. Se cree que el estrés oxidativo puede afectar la regulación de procesos y genes que previenen la carcinogénesis. Los pacientes con EII que deben entrar en un programa de cribado y vigilancia son aquellos que presentan una colitis ulcerosa con afectación proximal al recto de más de 8-10 años de evolución, enfermedad de Crohn con afectación de 1/3 de la superficie del colon de más de 8 años de evolución, colangitis esclerosante y portadores de reservorio.
El cribado de CCR en este subgrupo se basa en la detección endoscópica precoz de su lesión precursora, la displasia o neoplasia intraepitelial. Es una tarea difícil, ya que se trata en muchos casos de lesiones planas y sutiles, además de multicéntricas2,3. Histológicamente estas lesiones se clasifican en: indefinida para displasia (cuando no es posible decidir si existe o no displasia), displasia de bajo grado y displasia de alto grado. El tratamiento se basa en la apariencia y posibilidad de resección endoscópica de la lesión displásica. Debido a la heterogeneidad en el diseño y resultados de los estudios disponibles hasta la fecha no hay suficiente evidencia para establecer el manejo de estos pacientes de forma incuestionable. Diferentes sociedades científicas han publicado las guías que proponen las estrategias de vigilancia4–7.
Evidencias sobre el papel de las técnicas de endoscopia diagnóstica avanzada en el pacientes con alto riesgo de CCRLos pacientes con alto riesgo de CCR se benefician de estrategias de cribado y vigilancia dirigidas a disminuir la probabilidad de desarrollar un cáncer y contribuir a mejorar la supervivencia. Existen algunas circunstancias en las que la evidencia científica demuestra que la utilización de técnicas de endoscopia avanzada puede permitir un mejor manejo de estos pacientes.
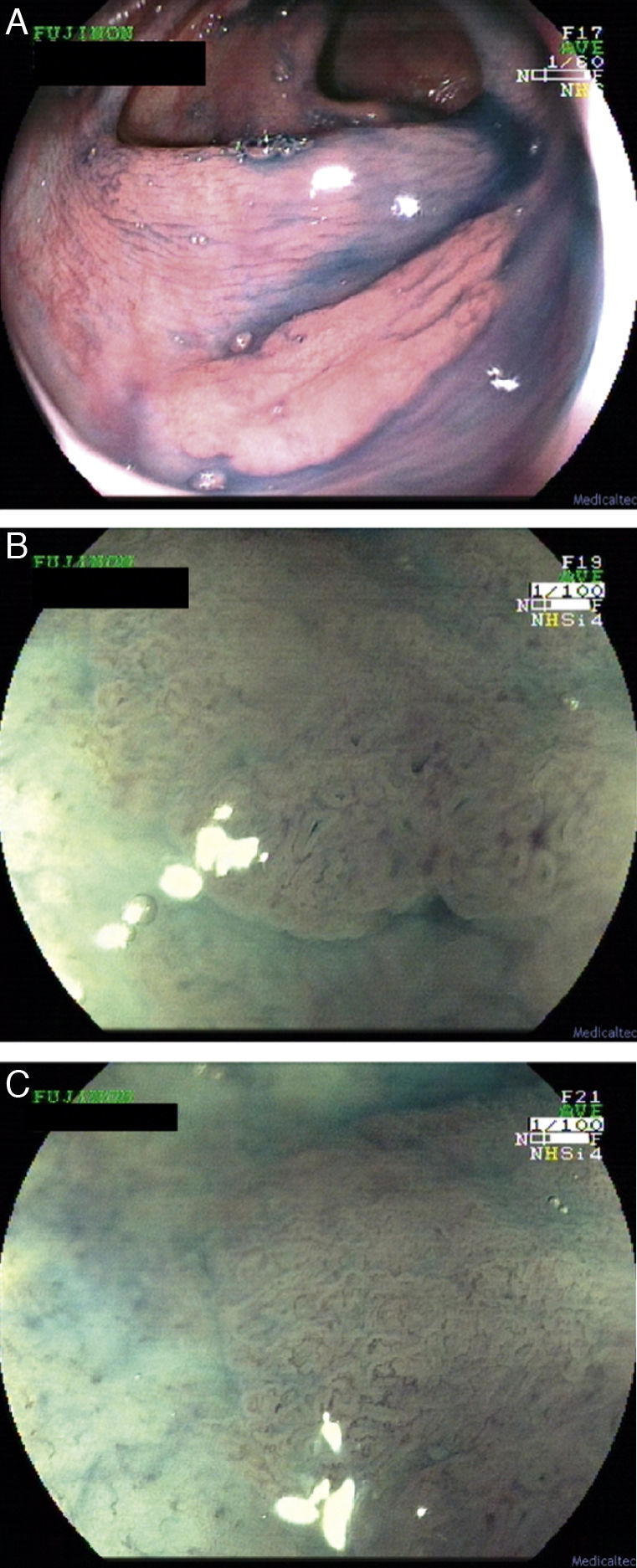
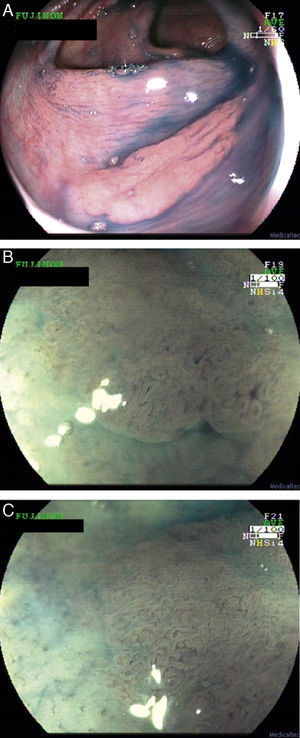
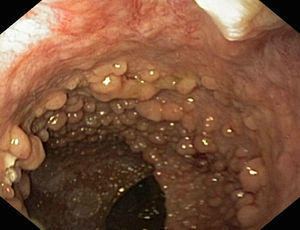
Síndrome de LynchEn el síndrome de Lynch, la progresión adenoma–carcinoma se encuentra acelerada pudiendo aparecer, según algunos autores, en tan solo 2 años. Por otra parte, las lesiones precursoras suelen hallarse en el colon derecho (fig. 1) y frecuentemente presentan una histología avanzada. Por tanto, la detección precoz y resección de estas lesiones tan agresivas es fundamental en estos sujetos. No identificarlas podría explicar una parte de los cánceres que aparecen durante el seguimiento (CCR de intervalo). Así pues, en este subgrupo de pacientes es imprescindible una limpieza adecuada del colon y una exploración exhaustiva de toda la mucosa8–11.
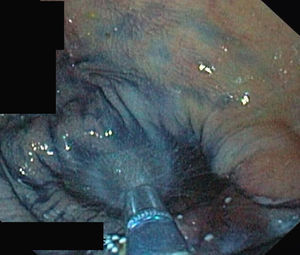
a. Pólipo de extensión lateral no granular (lateral spreading tumor–no granular o LST-NG) en colon transverso con histología de adenoma tubular en paciente con mutación germinal en MSH-2.
b. Detalle del patrón de criptas del borde izquierdo de la misma lesión, con magnificación y cromoendoscopia virtual (FICE 4).
c. Detalle del patrón vascular alrededor de las criptas en el borde izquierdo de la misma lesión, con magnificación y cromoendoscopia virtual (FICE 4). La morfología tortuosa y arrosariada de los vasos sugiere lesión neoplásica.
En una revisión sistemática reciente, se ha demostrado que la pancromoendoscopia (panCE) incrementa el número de pacientes en los que se observa al menos una lesión neoplásica en el colon en más de un 50% (OR: 1,67; IC 95%: 1,29–2,15) y el número de pacientes con al menos tres lesiones, en más del doble (OR: 2,55; IC 95%: 1,49–4,36), en población de riesgo medio12. Si bien los estudios que incluían pacientes en seguimiento por síndrome de Lynch se excluyeron del metaanálisis, parece razonable sostener la hipótesis de que la panCE en estos pacientes de alto riesgo también podría incrementar la detección de pólipos respecto a la endoscopia convencional. En efecto, existen algunos estudios que corroboran que en pacientes con criterios clínicos y/o genéticos de síndrome de Lynch, la utilización de técnicas de panCE incrementa la detección de los adenomas cuando se compara con endoscopia estándar con luz blanca y parece ser equivalente a una exploración realizada con un tiempo de retirada de al menos 20 minutos13–15. El Narrow Band Imaging (NBI) ha sido evaluado en dos estudios preliminares y ha demostrado ser superior a la luz blanca aunque no equiparable a la panCE16,17. Otras técnicas, más novedosas, como la endoscopia con autofluorescencia, también han mostrado identificar un mayor número de adenomas, respecto a la endoscopia estándar con luz blanca, en pacientes de alto riesgo de CCR18. En conclusión, la escasa evidencia actual sugiere que la panCE es la técnica con mayor rendimiento a la hora de detectar lesiones precursoras en pacientes con síndrome de Lynch, aunque ninguna guía ha establecido todavía que se trate de la técnica de elección.
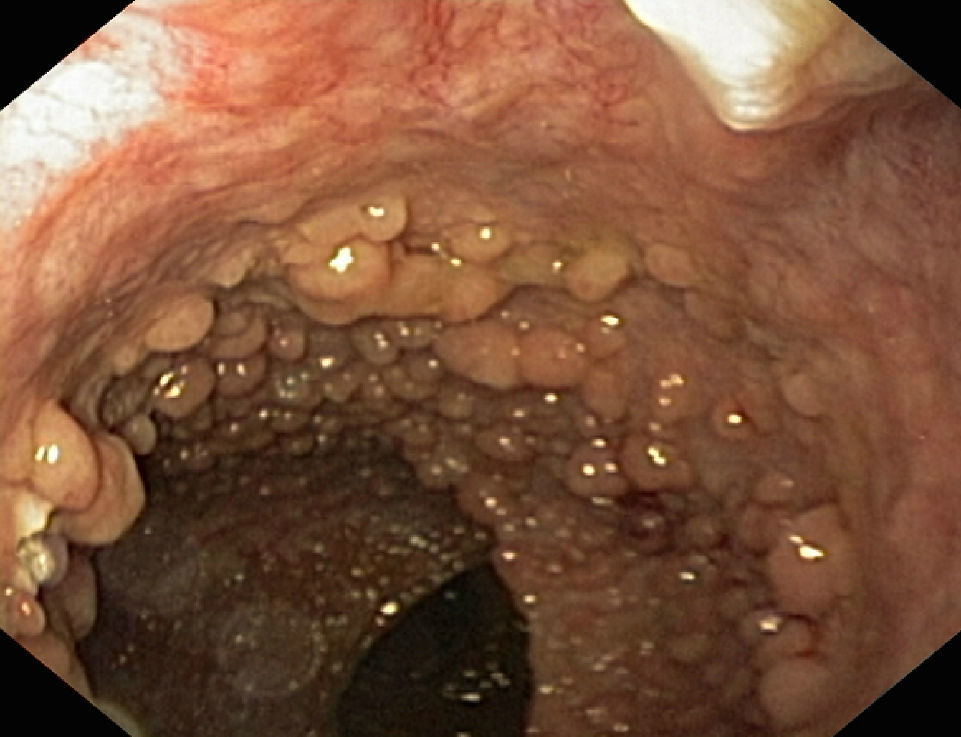
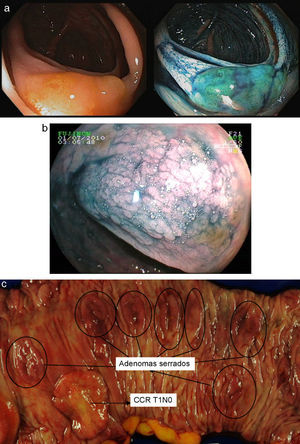
Poliposis adenomatosa familiar (PAF)La evaluación endoscópica de los pacientes con PAF incluye el diagnóstico no solo de la afectación cólica (fig. 2), sino también el manejo de la enfermedad duodenal, presente en cerca del 90% de los pacientes a lo largo de la vida y que se asocia a un riesgo acumulado de adenocarcinoma del 4-4,5% a los 60 años19.
Enfermedad colónica: como se ha comentado, el uso de panCE en población general aumenta el número de pacientes en los que detectan lesiones adenomatosas. En el subgrupo de pacientes con PAF, esta modalidad podría tener un menor impacto clínico, dado el alto número de lesiones identificables con endoscopia estándar, y la necesidad en muchos casos de hacer colectomía profiláctica a edad temprana. La CE parece detectar un número significativamente mayor de lesiones que las restantes técnicas (luz blanca, autofluorescencia, NBI) en pacientes con PAF, de forma particular en el colon izquierdo. Las formas de PAF atenuada pueden ser subsidiarias de seguimiento endoscópico, siendo recomendable en esos casos usar la panCE para mejorar el cribado de lesiones. En algunos casos la adición de esta técnica puede identificar un número adicional tal de adenomas que conduzca a reclasificar enfermos en verdaderas formas clásicas de PAF20–22.
En el caso de pacientes sometidos a proctocolectomía total con reservorio ileal, es particularmente importante la vigilancia del reservorio por el alto riesgo de desarrollar adenomas y neoplasias avanzadas23,24. El uso de panCE en dicha situación parece aumentar la detección de adenomas. En conclusión, la evidencia actual sugiere que el uso de panCE en la PAF podría ser de utilidad en la vigilancia de pacientes con PAF atenuada, y la vigilancia del remanente rectal o reservorio en pacientes intervenidos quirúrgicamente. Hacen falta más estudios para determinar el valor añadido de esta técnica en esta enfermedad.
Adenomas duodenales/yeyunales/ileales: La clasificación de Spigelman marca el pronóstico, actitud terapéutica y la vigilancia ante un paciente con PAF y afectación duodenal (tabla 3). Esta clasificación tiene en cuenta el número de adenomas, su tamaño e histología. Es importante que el endoscopista la tenga presente a la hora de realizar la exploración y describir los hallazgos. Las guías clínicas recomiendan realizar una exploración complementaria con el duodenoscopio de visión lateral para poder observar la papila correctamente en los pacientes con estadios de Spigelman III y IV. En caso de afectación de la papila, se recomienda realizar una ecoendoscopia para el estudio de extensión locorregional. El uso de panCE con índigo carmín parece aumentar de forma significativa el número de adenomas detectados, aunque no parece modificar el estadio de Spigelman final24–27. El NBI no ha demostrado presentar ninguna utilidad en la detección de lesiones ni en su caracterización. En conclusión, pese a que la CE detecta más lesiones duodenales en pacientes con PAF, su impacto en el manejo de estos pacientes parece ser limitado. Se ha descrito la potencial utilidad de la CE con la enteroscopia de doble balón para la detección de adenomas planos. El uso de CE con endoscopia de alta resolución y magnificación en ileon terminal puede permitir la detección de lesiones adenomatosas en estadio muy incipiente28.
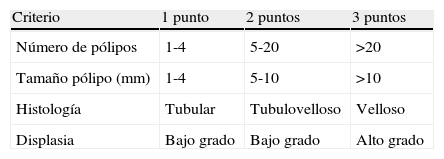
Clasificación de Spigelman para los pólipos duodenales en la PAF
| Criterio | 1 punto | 2 puntos | 3 puntos |
| Número de pólipos | 1-4 | 5-20 | >20 |
| Tamaño pólipo (mm) | 1-4 | 5-10 | >10 |
| Histología | Tubular | Tubulovelloso | Velloso |
| Displasia | Bajo grado | Bajo grado | Alto grado |
Estadio 0, 0 puntos; estadio I, 1-4 puntos; estadio ii, 5-6 puntos; estadio iii, 7-8 puntos; estadio iv, 9-12 puntos.
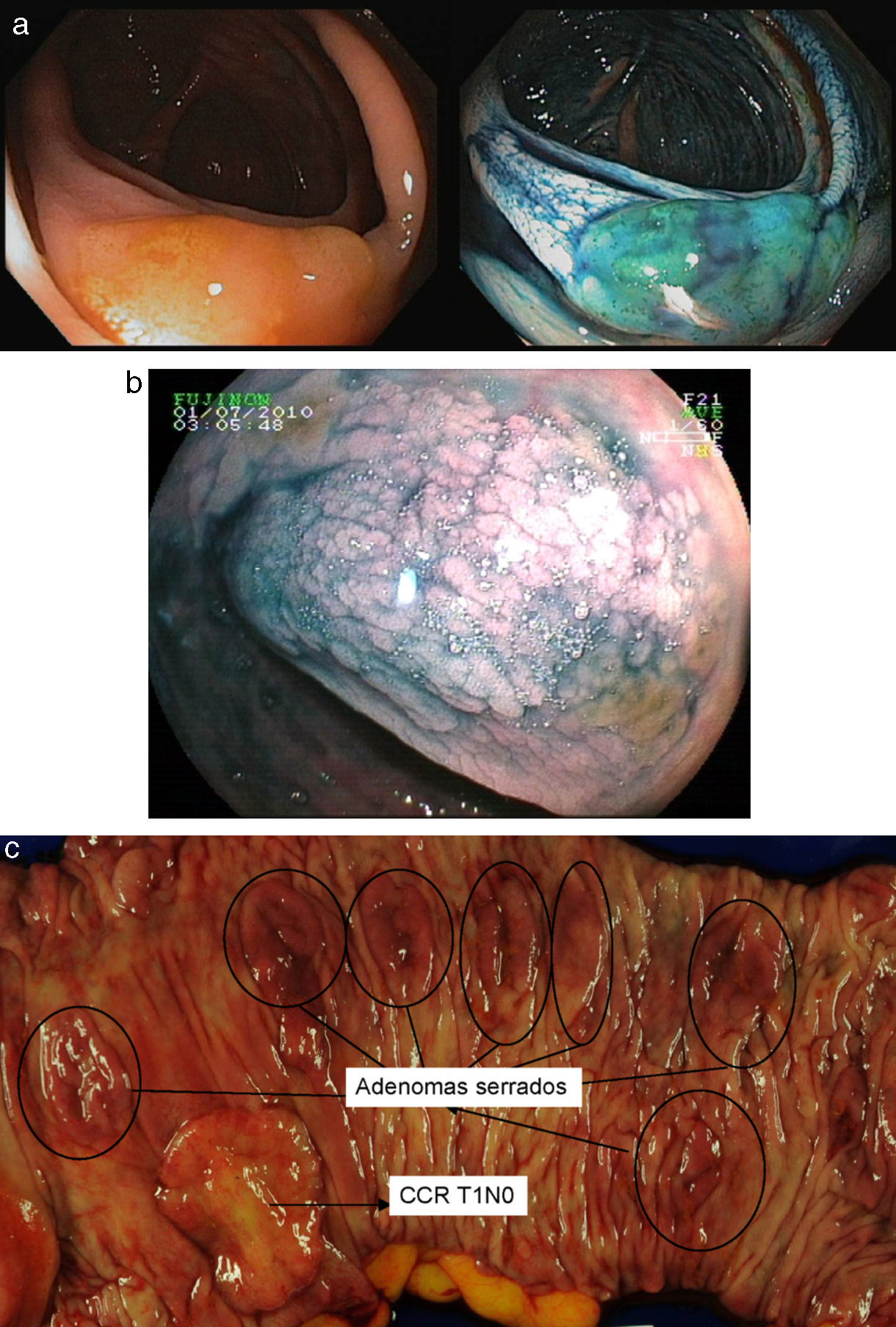
Recientemente se ha sugerido que el NBI aumenta la detección de pólipos en el síndrome de poliposis serrada en comparación con la luz blanca29. Pese a que hacen falta más estudios, el uso de CE o NBI podría ser de utilidad en el diagnóstico y vigilancia de esta forma de alto riesgo (fig. 3).
Adenomas serrados.
a. Adenoma serrado visualizado con endoscopia de alta resolución. Destaca la presencia de mínimos restos de heces y moco sobre una lesión plana y sutil.
b. Adenoma serrado sesil en ángulo hepático visualizado con índigo carmín.
c. Pieza de colectomía de una paciente con un cáncer precoz en el contexto de un síndrome de poliposis serrada.
La detección de displasia y de cáncer asociado a colitis durante el seguimiento endoscópico es difícil ya que a menudo estas lesiones asientan sobre mucosa de aspecto normal con endoscopia convencional. Por ello, hasta la fecha, las guías de práctica clínica recomiendan tomar biopsias de forma aleatoria cada 10cm, lo que implica que se necesitan un mínimo de unas 40-50 biopsias en total para poder descartar displasia con un margen de seguridad adecuado.
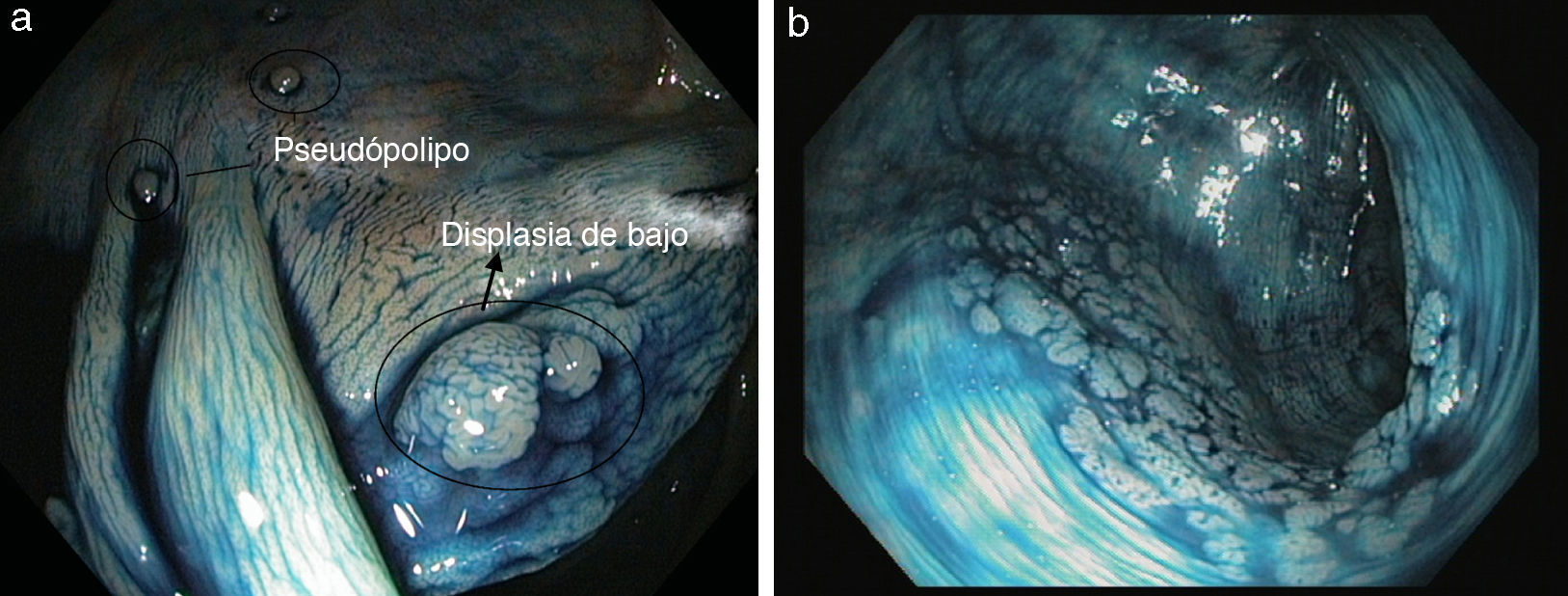
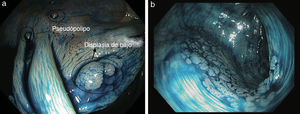
En los últimos años varios estudios han demostrado que la panCE con biopsias dirigidas es el método más eficaz y rentable para la detección de focos de displasia en pacientes con EII de larga evolución30–34 (fig. 4a). De hecho, en la actualidad la guía británica6 y la reciente guía europea de la European Crohn's and Colitis Organization (ECCO)5 consideran que la técnica de elección para el cribado de los pacientes con EII cólica de larga evolución es la panCE con biopsias dirigidas siempre y cuando se haga por endoscopistas expertos. De forma alternativa, en caso de no tener experiencia en CE, se recomienda realizar una endoscopia convencional con toma de biopsias aleatorias (40 a 50 biopsias) y biopsias dirigidas de cualquier lesión visible.
Para poder realizar una colonoscopia de cribado en condiciones, es importante que el paciente se encuentre en remisión clínica, ya que es difícil discriminar la inflamación de la displasia. Además, se debe requerir una preparación del colon adecuada, tomar biopsias o resecar todas las lesiones sospechosas en caso de que sea posible y tomar muestras de la mucosa circundante en los casos en que se sospeche que exista displasia. Se debe realizar una panCE y se puede emplear el índigo carmín (fig. 4b) o el azul de metileno de forma indiferente. En este sentido, un grupo de expertos publicó una guía para la correcta utilización de la CE en el cribado de los pacientes con colitis ulcerosa de larga evolución denominada SURFACE3.
Las demás técnicas como el NBI o la CE electrónica podrían suponer una buena alternativa a la CE en el contexto que nos ocupa ya que son menos engorrosas y pueden tener mayor aceptación entre los profesionales35. Sin embargo, hasta la fecha, carecemos de evidencias que permitan aconsejarlas como técnica de cribado en la práctica clínica habitual.
Conceptos básicos y requisitos mínimos para una endoscopia de calidadLa neoplasia colorrectal superficialEl término neoplasia colorrectal superficial incluye aquellas lesiones que no infiltran más allá de la submucosa. Su excelente pronóstico, derivado de su menor riesgo de metástasis ganglionares regionales y a distancia, permite que en la mayoría de los casos puedan ser tratadas endoscópicamente y las convierte en el objetivo prioritario de los programas de cribado del CCR.
En las últimas dos décadas se han experimentado importantes progresos en el diagnóstico y tratamiento de estas neoplasias. En este sentido la clasificación de Viena36 (tabla 4) ha supuesto un avance considerable en un intento por unificar las diferencias en la nomenclatura histopatológica japonesa y occidental, sustituyendo los términos adenoma/displasia por «neoplasia intraepitelial» (categorías 3 y 4) y reconociendo el papel pronóstico de la infiltración de la submucosa (categoría 5). Recientemente, las «guías Europeas de calidad en el cribado y diagnóstico del cáncer colorrectal»37 proponen una adaptación de está clasificación de Viena para las lesiones colónicas en las que se incluye el carcinoma no invasivo en la misma categoría que la displasia de alto grado (tabla 5).
Clasificación de Viena revisada
| Categoría | Diagnóstico |
| 1 | Negativo para neoplasia |
| 2 | Cambios indefinidos para neoplasia |
| 3 | Neoplasia mucosa de bajo gradoAdenoma/displasia de bajo grado |
| 4 | Neoplasia mucosa de alto grado4,1 adenoma/displasia de alto grado4,2 carcinoma no invasivo (carcinoma in situ)4.3 sospecha de carcinoma invasivo4.4 carcinoma intramucoso |
| 5 | Carcinoma con invasión submucosa |
Adaptación de la clasificación de Vienna revisada según la «Guía Europea para el cribado y diagnóstico del cáncer colorrectal»37
| 1. NO NEOPLASIA: |
| Categoría de Viena 1 (negativo para neoplasia) |
| 2. NEOPLASIA MUCOSA DE BAJO GRADO |
| Categoría de Viena 3 (neoplasia de bajo grado; adenoma de bajo grado; displasia de bajo grado) |
| Otra terminología común |
| Displasia moderada; OMS: neoplasia intraepitelial de bajo grado |
| 3. NEOPLASIA MUCOSA DE ALTO GRADO |
| Categoría de Viena 4.1-4.4 (neoplasia con displasia de alto grado; adenoma con displasia de alto grado; carcinoma no invasivo; carcinoma in situ; carcinoma intramucoso) |
| Otra terminología común: |
| Displasia severa; OMS: neoplasia intraepitelial de alto grado; TNM: pTis |
| 4. CARCINOMA INVASIVO: |
| a. Carcinoma confinado a la submucosa |
| Categoría 5 de Viena (invasión submucosa por carcinoma) |
| TNM: pT1 |
| b. Carcinoma más allá de la submucosa |
| TNM: pT2-4 |
Tradicionalmente los gastroenterólogos occidentales han basado sus decisiones terapéuticas en la evaluación del tamaño de las lesiones y los resultados de su estudio histopatológico. Sin embargo el reconocimiento creciente del papel de las neoplasias no protruidas, la posible interferencia de la toma de biopsias en intentos posteriores de mucosectomía y la necesidad de un diagnóstico rápido que evite demoras diagnósticas y el tratamiento endoscópico de lesiones de mal pronóstico, han desplazado el enfoque hacia el diagnóstico «in situ» basado en las características endoscópicas de las lesiones.
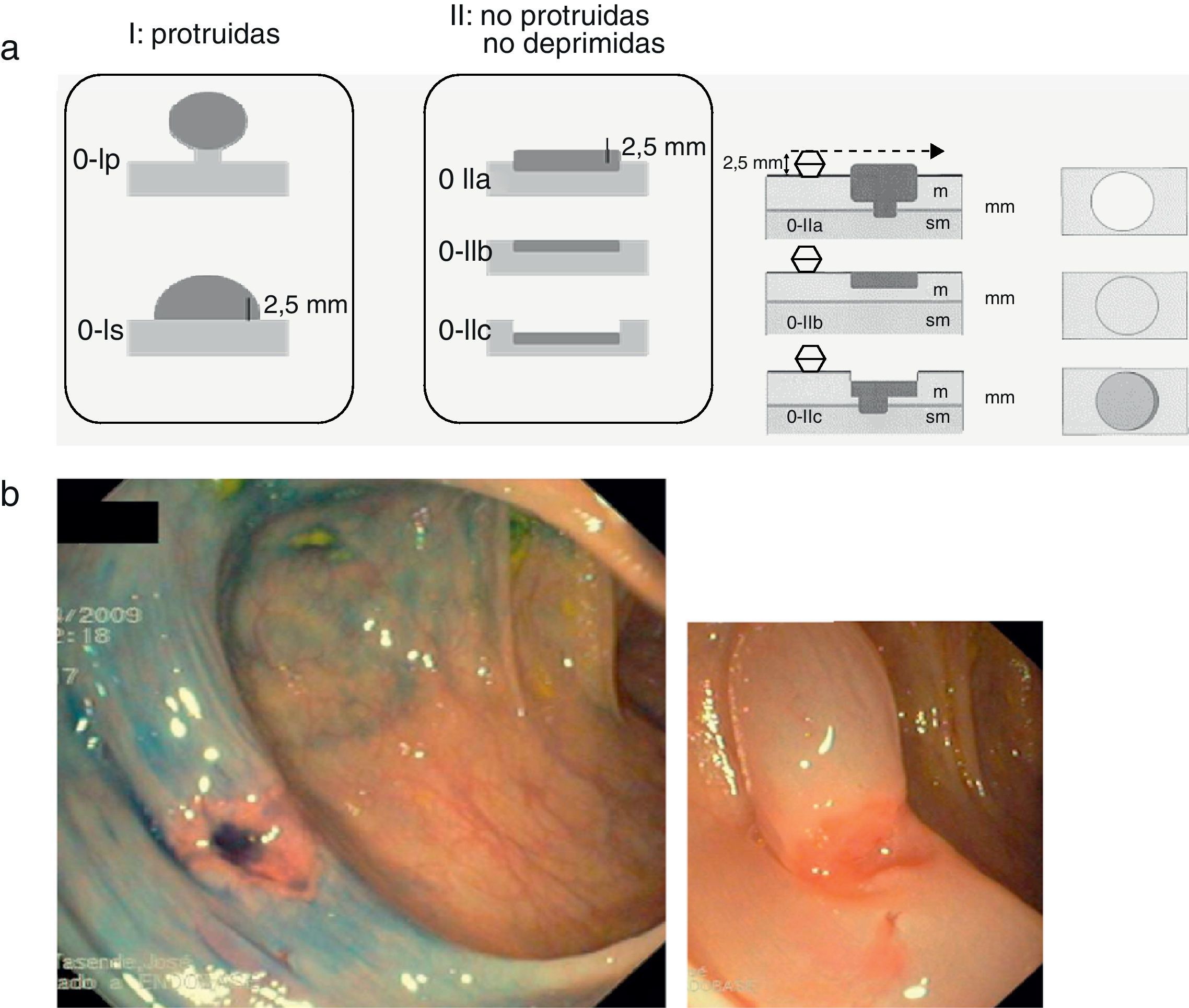
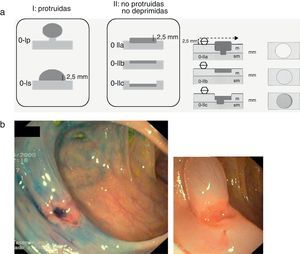
Desde el punto de vista morfológico, la clasificación de París38 (fig. 5a) se ha consolidado como la nomenclatura estándar para la descripción y tipificación de las neoplasias superficiales (tipo 0). Macroscópicamente las lesiones superficiales pueden ser divididas en tres grupos: lesiones protruidas (0-I), planas (0-IIa: planas elevadas, 0-IIb: totalmente planas, y 0-IIC: planas deprimidas) y excavadas (0-III). En el caso de las neoplasias superficiales del colon esta última categoría no se contempla ya que las lesiones excavadas o ulceradas no ocurren. Estudios recientes han confirmado el valor pronóstico de la clasificación de París, demostrando el diferente comportamiento biológico y mayor riesgo de neoplasia invasiva asociado a las lesiones plano-deprimidas (0-IIc) (fig. 5b).
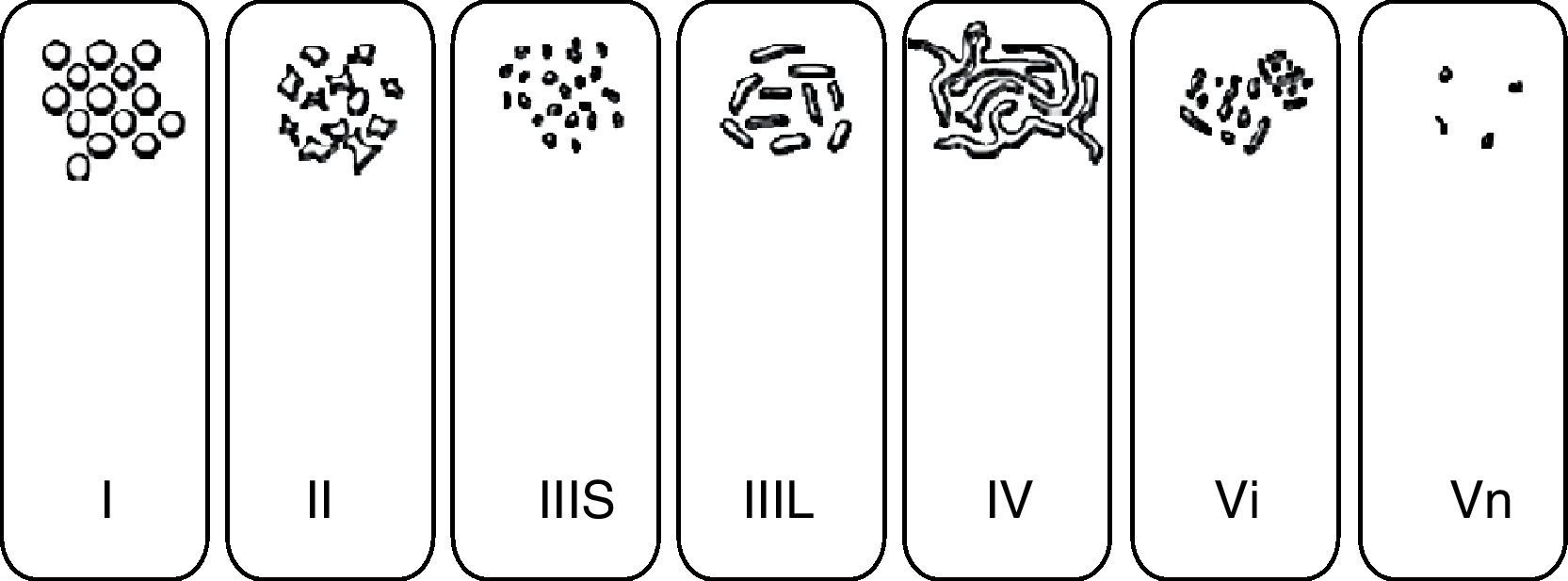
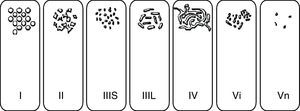
El estudio del patrón de criptas mucoso mediante endoscopios de magnificación y técnicas de CE descrito por Kudo et al.39 (fig. 6), ha permitido un mayor grado de precisión diagnóstica, dada su buena correlación con el estudio histopatológico. En primer término permite diferenciar la mucosa normal (patrón i) o con cambios hiperplásicos (patrón ii) de las lesiones mucosas con cambios displásicos (patrones III, IV y V). Por otra parte proporciona información sobre el riesgo de carcinoma con infiltración submucosa, presente en la mayoría de las lesiones que muestran un patrón v no estructural (Vn). Es importante resaltar que esta clasificación se basa en el empleo de endoscopios de magnificación óptica, y no se ha estudiado su utilidad y exactitud diagnóstica empleando visión convencional o magnificación electrónica. Esto es especialmente importante a la hora de evaluar los patrones más difíciles de caracterizar que son precisamente, los invasivos. En Japón se utiliza otra clasificación que pretende ser más sencilla y se conoce como «clasificación clínica»40. Esta clasificación diferencia los patrones en: no neoplásico, neoplásico no invasivo, y neoplásico invasivo. El patrón neoplásico invasivo consiste en una estructura irregular o ausencia de criptas en un área demarcada y se asocia a una zona con irregularidad en la morfología o en el color visualizado mediante endoscopia convencional.
En conjunto el estudio morfológico de la mucosa permite elaborar hipótesis diagnósticas acerca de la naturaleza de las lesiones, estimar el riesgo de infiltración profunda y definir una actitud terapéutica razonada.
Preparación intestinal en el paciente de alto riesgoLa eficacia diagnóstica de la colonoscopia depende fundamentalmente de la capacidad para visualizar las lesiones mucosas. Una inadecuada limpieza del colon lleva a no detectar algunas lesiones, prolongar la duración de la exploración y repetir el procedimiento en intervalos inferiores a los recomendados. Por otra parte, la capacidad de la técnica para proteger frente al CCR parece menor en la prevención de las lesiones localizadas en el colon derecho (proximal a la flexura esplénica). La frecuente mala preparación de esa zona del colon desempeña un papel fundamental en este hecho. En algunos pacientes de alto riesgo esta situación es particularmente importante. Así, en el síndrome de Lynch, los precursores adenomatosos suelen localizarse en el colon derecho y frecuentemente son de morfología plana. Una situación similar acontece en los pacientes con formas atenuadas de PAF o en los pacientes con síndrome de poliposis serrada.
Si bien no existen recomendaciones específicas para la limpieza del colon en los pacientes de alto riesgo, parece razonable aplicar la evidencia científica disponible en otros grupos de pacientes41–43: 1.) Las preparaciones con volúmenes reducidos de PEG (2 litros) complementadas con adyuvantes como el bisacodilo son tan eficaces como el uso de PEG a dosis estándar (4 litros) y parecen ser mejor toleradas; 2.) Las preparaciones de fosfato sódico no deberían utilizarse en pacientes con riesgo potencial asociado al desarrollo de trastornos hidroelectrolíticos secundarios al preparado como es el caso de aquellos con insuficiencia renal, hepática o cardíaca; 3.) Recientemente han aparecido nuevos preparados que combinan PEG con ácido ascórbico (Moviprep®) o citrato de magnesio con picosulfato sódico (Citrafleet®). El primero de ellos parece mejorar la limpieza del ciego y colon ascendente mientras que el sabor y la facilidad para llevar a cabo la preparación se perciben mejores con el último de los preparados; 4.) El tiempo transcurrido entre la última dosis y el inicio de la exploración no debe superar las 6–8 horas44 para lograr una adecuada limpieza del colon; 5.) Independientemente de la preparación utilizada, se ha demostrado que debe administrarse al menos parte de la preparación pocas horas antes de la colonoscopia, bien dividiendo las tomas entre el día previo al procedimiento y el mismo día de la exploración, o administrándola toda el mismo día de la colonoscopia. De esta forma el grado de limpieza es superior (especialmente en el colon derecho), se detectan más lesiones neoplásicas, e incluso aumenta la tasa de detección de adenomas; 6.) La toma de la preparación en dosis divididas y cercanas al procedimiento no se ha asociado a la presencia de un mayor volumen de residuo gástrico, una medida indirecta del riesgo de broncoaspiración45; 7). Este dato confirma la recomendación hecha por la Sociedad Americana de Anestesiología de que resulta seguro para los pacientes la ingesta de líquidos claros hasta las 2 horas anteriores al procedimiento46; 8) El grado de limpieza del colon debe figurar en el informe endoscópico, para lo cual se pueden utilizar diversas escalas validadas, y 9) En este subgrupo de pacientes se debe considerar inadecuada una preparación regular o mala, por lo que se debe repetir la exploración en estos casos.
Sedación y citación del paciente de alto riesgoEl paciente de alto riesgo suele someterse a colonoscopias repetidas en el tiempo y especialmente prolongadas, tanto por la utilización de técnicas de CE como por la frecuente necesidad de llevar a cabo maniobras terapéuticas inherentes a la detección de lesiones. El uso de sedación durante la colonoscopia mejora significativamente la experiencia del paciente frente a una prueba que le puede provocar malestar y dolor así como las condiciones en las que el endoscopista realiza el procedimiento. La sedación juega un papel fundamental para lograr un seguimiento adecuado de los programas de cribado en estos pacientes. No existen en la actualidad recomendaciones específicas para la sedación en los procedimientos endoscópicos que se realizan en pacientes de alto riesgo. Sin embargo, existen múltiples documentos de consenso y guías de práctica clínica sobre sedoanalgesia en endoscopia digestiva así como recomendaciones específicas para el uso de propofol en este tipo de procedimientos, cuando se utiliza por no anestesiólogos47–54.
Es imprescindible tener en cuenta en la citación de estas exploraciones, la necesidad de disponer de un tiempo mayor al de las endoscopias diagnósticas en pacientes de riesgo medio. Como ejemplo, el tiempo requerido para una panCE en un paciente con EII es de una hora.
Informe endoscópico, registro y documentación de las imágenesRecientemente se ha publicado la primera «Guía de Calidad en Colonoscopia de Cribado» en nuestro medio que recoge los estándares de calidad de la colonoscopia de cribado en individuos de riesgo medio43. Aunque de momento no se dispone de evidencias científicas al respecto, resulta razonable pensar que el cumplimiento de estos estándares es más crítico si cabe en la población de alto riesgo. Como ya se ha comentado previamente, algunas características de los pólipos en los síndromes de alto riesgo de CCR como la preferencia en la localización en el colon derecho o la morfología de las lesiones (con mayor frecuencia planas) hace suponer que indicadores de calidad tales como la tasa de detección de adenomas, la tasa de intubación cecal, y el tiempo de retirada del endoscopio deban de redefinirse en el futuro para este grupo de pacientes. Por otra parte, el elevado riesgo de lesiones metacrónicas en esta población hace que el seguimiento del protocolo de vigilancia sea fundamental para una prevención eficaz. Especial importancia merece el informe endoscópico como se expone a continuación.
Definición del informe endoscópicoEl informe endoscópico es el documento donde se reflejan los hallazgos del procedimiento y su interpretación. Constituye la fuente de donde se van a extraer los datos a evaluar en un programa de mejora continua de la calidad y, sin duda, la forma en la que el informe está redactado es en sí misma una medida de la calidad.
Elementos del informe endoscópicoEl informe endoscópico debe incluir una descripción completa de la exploración con detalles de todas las anomalías detectadas. En particular, se deben detallar las lesiones extirpadas–número, tamaño, localización-, el método de extirpación, si ha sido posible su resección completa y las complicaciones si las hubiere. En la tabla 6 se resume la información que debería figurar en el informe endoscópico de estos pacientes. Para que el informe sea completo debe incluir fotografías de las lesiones encontradas y de aquellas estructuras anatómicas que permitan confirmar que la exploración ha sido completa. Dado que la intubación del ciego en pacientes de alto riesgo es especialmente relevante, en el informe debe de constar una imagen del polo cecal.
Información que debe constar en el informe endoscópico
| Nombre del paciente | |
| Antecedentes familiares de cáncer | Número de familiares diagnosticados de cáncer de colonGrado de parentescoEdad al diagnóstico del tumor |
| Nombre del endoscopista | |
| Información del endoscopio utilizado | Marca, modelo y número de serie |
| Medicación utilizada durante el procedimiento | Fármacos y dosis |
| Indicación del procedimiento | Cribado por antecedentes familiaresCribado paciente sindrómico (S. Lynch, PAF, etc.)Vigilancia pospolipectomía, etc. |
| Detalles de la limpieza intestinal | Medicación recibida para la limpiezaTolerancia a la preparaciónGrado de limpieza por tramos |
| Detalles de la intubación | Especificar si se alcanzó el ciego y por qué no fue posible en las colonoscopias incompletasTiempo de retirada del endoscopio |
| Detalles de la patología encontrada | Número de lesiones encontradasLocalización de cada lesiónTamaño de cada lesiónMorfología de la lesión (Clasificación de París)Patrón de criptas de cada lesión (Clasificación de Kudo)Diagnóstico endoscópico de cada lesiónDetalles de la actitud tomada con cada lesión (extirpación y recuperación)Éxito y complicaciones en la extirpación de cada lesiónTatuaje de lesiones sospechosasEspecificar afectación rectal (número de pólipos <10, 10-20, >20) en las poliposis. |
PAF: poliposis adenomatosa familiar.
En los síndromes de poliposis adenomatosa el número de pólipos rectales en el momento de la cirugía se ha utilizado como uno de los elementos de decisión en la selección de la técnica quirúrgica (proctocolectomía total con reservorio ileal o colectomía con anastomosis ileorrectal). La selección de una u otra técnica se ha relacionado con el riesgo de cáncer en el remanente rectal, por lo que debería de ser mandatorio hacer una descripción del número de pólipos en la ampolla rectal, documentarlo de forma adecuada mediante imágenes, extirparlos si es posible en previsión de cirugía, tatuando el margen proximal de la ampolla rectal que ha quedado libre de pólipos. Cuanto más detallada sea la descripción de los pólipos del recto–número, tamaño, distancia del margen anal, etc.- más facilitará la toma de decisiones sobre la preservación del recto.
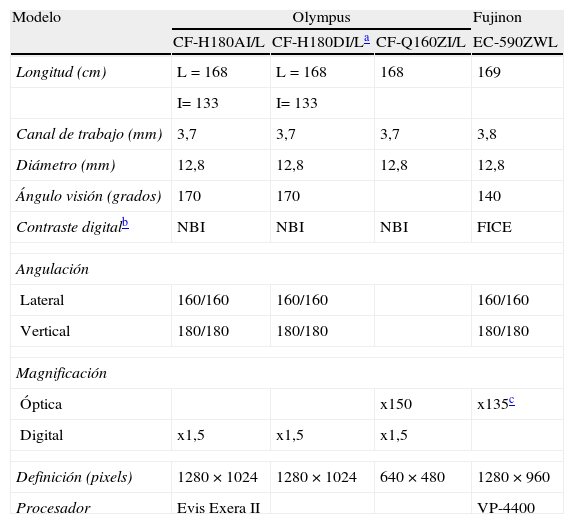
Introducción a las técnicas de endoscopia diagnóstica avanzadaMagnificación y alta definiciónLa definición, resolución o nitidez y la magnificación son cualidades que intervienen en la calidad de la imagen endoscópica y son herramientas que permiten incrementar la identificación de lesiones y la rentabilidad diagnóstica. La resolución se refiere a la discriminación y se define como la capacidad de diferenciar dos puntos muy próximos entre sí. Está en función de la densidad de píxel. Por el contrario la magnificación se refiere a la amplificación de la imagen. Los endoscopios de alta definición (HD) y magnificación tienen las mismas funciones básicas que los endoscopios convencionales y pueden ser utilizados bajo visión convencional. Sin embargo, mientras que los videoendoscopios convencionales están equipados con un chip de color (CCD) de 300.000 a 410.000 píxel, en los de HD este oscila entre 850.000 y 106 píxel. Es preciso resaltar que para obtener una imagen en HD no es suficiente un endoscopio HD sino que todos los componentes (procesador, monitor y cables de transmisión) deben de ser compatibles con este sistema. Los endoscopios convencionales y de alta definición son capaces de amplificar la imagen entre 30 y 35 veces. Además, según el fabricante y modelo, algunos endoscopios de HD poseen un zoom digital el cual simplemente amplifica la imagen (los píxel) entre 1,5-2 veces y conlleva una pérdida de resolución (tabla 7). La magnificación óptica consiste en el movimiento mecánico de lentes en el extremo distal del endoscopio que se controla mediante un botón o elevador situado en el mando. En este caso, la amplificación de la imagen es de hasta 150 veces y sin pérdida de nitidez (tabla 7)55,56. La endoscopia de HD y magnificación asociadas en muchos casos a técnicas cromoendoscópicas, se han utilizado tanto en la detección como en la caracterización de lesiones neoplásicas o preneoplásicas del tracto gastrointestinal superior y del colon (tabla 8).
Características de colonoscopios de alta definición y magnificación según fabricante y modelo
| Modelo | Olympus | Fujinon | ||
| CF-H180AI/L | CF-H180DI/La | CF-Q160ZI/L | EC-590ZWL | |
| Longitud (cm) | L=168 | L=168 | 168 | 169 |
| I= 133 | I= 133 | |||
| Canal de trabajo (mm) | 3,7 | 3,7 | 3,7 | 3,8 |
| Diámetro (mm) | 12,8 | 12,8 | 12,8 | 12,8 |
| Ángulo visión (grados) | 170 | 170 | 140 | |
| Contraste digitalb | NBI | NBI | NBI | FICE |
| Angulación | ||||
| Lateral | 160/160 | 160/160 | 160/160 | |
| Vertical | 180/180 | 180/180 | 180/180 | |
| Magnificación | ||||
| Óptica | x150 | x135c | ||
| Digital | x1,5 | x1,5 | x1,5 | |
| Definición (pixels) | 1280×1024 | 1280×1024 | 640×480 | 1280×960 |
| Procesador | Evis Exera II | VP-4400 | ||
| Modelo | Pentax | |||
| EC-3490Li | EC-3890Li | EC-3430LZ | EC-3872LZK | |
| Longitud (cm) | 170 | 170 | 168 | 170 |
| Canal de trabajo (mm) | 3,2 | 3,8 | 2,8 | 3,8 |
| Diámetro (mm) | 11,6 | 13,2 | 11,7 | 13,2 |
| Ángulo visión (grados) | 140 | 140 | 120 | 140 |
| Contraste digital | i-Scan | i-Scan | ||
| Angulación | ||||
| Lateral | 160/160 | 160/160 | 160/160 | |
| Vertical | 180/180 | 180/180 | 180/180 | |
| Magnificación | ||||
| Óptica | x105 | x80 | ||
| Digital | x2 | x2 | ||
| Definición (pixels) | 1280×1024 | 1280×1024 | 640×480 | 640×480 |
| Procesador | EPK-i | |||
Indicaciones en las que la endoscopia de alta resolución y/o la endoscopia de magnificación ha resultado eficaz
| Esófago |
| Cribado de carcinoma escamoso |
| Detección de metaplasia intestinal |
| Detección de displasia en esófago de Barrett |
| Sospecha de esofagitis por reflujo |
| Estómago |
| Evaluación de cáncer precoz gástrico |
| Metaplasia intestinal |
| Gastritis crónica por Helicobacter Pylori |
| Intestino delgado |
| Detección de atrofia vellositaria |
| Colon |
| Diagnóstico in vivo de pólipos neoplásicos y no neoplásicos |
| Predicción de la invasión en neoplasia colónica precoz |
| Cribado de neoplasia colónica en colitis ulcerosa de larga evolución |
| Cribado de neoplasia colónica |
Las técnicas de tinción o cromoendoscopia se basan en la aplicación tópica durante la endoscopia de colorantes o tinciones sobre la mucosa gastrointestinal con el objetivo de aumentar el rendimiento diagnóstico de la endoscopia convencional al aumentar la capacidad de identificar los detalles de los tejidos57–61.
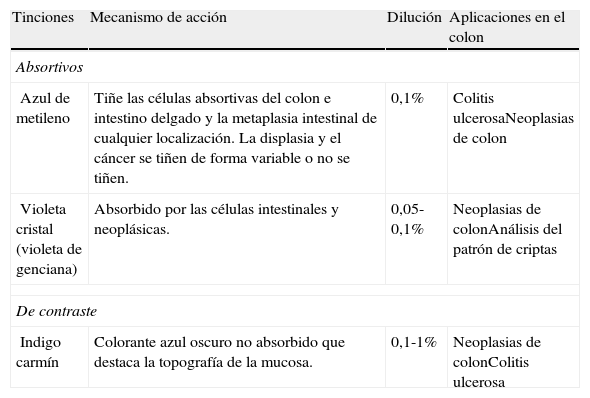
Clasificación de las tincionesLos colorantes aplicados en el colon son básicamente de dos tipos: vitales o absortivos y de contraste (tabla 9). Los colorantes absortivos identifican las células intestinales por su diferente capacidad de absorción o de difusión a través de la membrana celular. Las tinciones de contraste se depositan en las irregularidades de la mucosa resaltándolas.
Clasificación de las tinciones aplicadas en el colon
| Tinciones | Mecanismo de acción | Dilución | Aplicaciones en el colon |
| Absortivos | |||
| Azul de metileno | Tiñe las células absortivas del colon e intestino delgado y la metaplasia intestinal de cualquier localización. La displasia y el cáncer se tiñen de forma variable o no se tiñen. | 0,1% | Colitis ulcerosaNeoplasias de colon |
| Violeta cristal (violeta de genciana) | Absorbido por las células intestinales y neoplásicas. | 0,05-0,1% | Neoplasias de colonAnálisis del patrón de criptas |
| De contraste | |||
| Indigo carmín | Colorante azul oscuro no absorbido que destaca la topografía de la mucosa. | 0,1-1% | Neoplasias de colonColitis ulcerosa |
Los agentes para tinción suelen ser fórmulas magistrales, en general baratas y fáciles de obtener. Las dos formas más frecuentes de aplicar los colorantes son: directamente por el canal de trabajo del endoscopio mediante una jeringuilla cuando queremos teñir áreas pequeñas; y mediante un catéter spray específico, usado para aplicar de forma uniforme la tinción sobre grandes superficies. Los catéteres más habituales son de la casa Wilson-Cook (Glo-Tip), de un solo uso y de Olympus (PW-5V-1), reutilizable (fig. 7).
En ciertos casos puede ser necesaria la aplicación previa a la tinción de un agente mucolítico para eliminar el exceso de moco en la superficie mucosa del colon (N-acetilcisteína al 10%, vg. Flumil®) que debe dejarse actuar durante unos dos minutos antes de aplicar el colorante. Cuando hay muchas burbujas en la superficie del colon es útil el empleo previo de un antiespumante (vg. Aero Red®). Las bombas de agua de gran potencia son de especial utilidad ya que permiten eliminar la capa de moco o heces que muchas veces recubre la mucosa e impide una correcta tinción y evaluación del patrón mucoso.
Modo de utilizaciónComo norma general, para el empleo de técnicas de tinción es imprescindible una buena preparación del colon ya que la tinción sobre restos dificulta la exploración y disminuye su rendimiento.
El modo de utilización varía ligeramente según el tipo de colorante:
- 1.
Colorantes de contraste:
- -
Índigo-carmín es el colorante más empleado en colon ya que es útil en aumentar la detección de lesiones neoplásicas, caracterizar su morfología y poner de manifiesto sus límites con vistas a una posible extirpación endoscópica. Además, interfiere menos que las tinciones de absorción en el desarrollo de la colonoscopia (vg. identificación de lesiones vasculares, realización de polipectomía). Se puede aplicar con el catéter spray o con una jeringuilla a través del canal de trabajo del endoscopio (3-5ml seguido de 10-15ml de aire) según el área a teñir, seguido de la observación inmediata de las irregularidades de la mucosa o de los patrones de criptas. Para la tinción de grandes superficies utilizando catéter (vg. detección de lesiones en el colon derecho en el S. de Lynch) suelen emplearse diluciones menores (0,1%). Desde el ciego se exploraría el colon en retirada en segmentos de 20-30cm, primero sin el uso de colorantes para no dificultar la detección de lesiones de otro tipo (vg. angiodisplasias), y luego inmediatamente tras la instilación del índigo-carmín.
- -
- 2.
Colorantes de absorción:
- -
Azul de metileno: tanto si se usa con jeringuilla para la caracterización de lesiones o se usa el catéter para tinción de grandes superficies (vg. valoración de la displasia en la colitis ulcerosa o de los focos de criptas aberrantes en el recto), se emplea la dilución al 0,1% de la forma antes referida, pero dejando reposar el colorante 1 minuto y posteriormente succionando el colorante sobrante. El azul de metileno tiñe la mucosa absortiva normal del colon, de tal manera que las zonas sin teñir pueden indicar cambios inflamatorios o neoplásicos.
- -
Violeta cristal (o violeta de genciana): El principal uso de esta tinción es poner de manifiesto el patrón de las criptas especialmente en lesiones con sospecha de invasión. Se debe emplear un endoscopio de magnificación para poder valorar este patrón. De hecho, probablemente no esté justificado su uso si no se dispone de este tipo de endoscopios. Antes de teñir, debe aplicarse siempre un agente mucolítico para evitar falsos positivos de patrón invasivo en zonas donde no se absorbe el colorante. Para aplicar el colorante se suele utilizar un catéter especial no disponible en nuestro medio (catéter no traumático, Olympus PW5V-1). En caso de no disponer de este, puede emplearse un catéter tipo spray aplicando la tinción gota a gota sobre la lesión. El motivo de limitar la cantidad de esta tinción es su posible toxicidad (potencialmente carcinogénico).
- -
Aumento de la capacidad de detección de lesiones
- •
Síndrome de Lynch: índigo-carmín
- •
Detección de displasia en la colitis ulcerosa: azul de metileno o índigo-carmín
- •
Detección de foco de criptas aberrantes en recto: azul de metileno
- •
Identificación como lesiones de zonas dudosas (vg. placas eritematosas): índigo-carmín
Caracterización de las lesiones neoplásicas
- •
Clasificación de Paris: índigo-carmín
- •
Estudio del patrón de criptas (Clasificación de Kudo): azul de metileno, índigo-carmín, violeta cristal (junto con magnificación)
Tratamiento endoscópico de las lesiones
- •
Evaluación de la lesión para mucosectomía: límites, morfología
- •
Valoración de la existencia de restos de la lesión una vez resecada
Los métodos a continuación descritos facilitan la función de CE sin emplear colorantes, sino mediante la manipulación de los controles del endoscopio62.
La cromoendoscopia óptica-digital se refiere al Narrow Band Imaging (NBI), de Olympus (y también a la endoscopia de autofluorescencia, que no será revisada). Con dicha función, y accionando un botón del cabezal del endoscopio, la luz emitida pasa de ser blanca a una luz con el espectro modificado, optimizado para lograr un realce de las estructuras vasculares, y los patrones de la superficie de la mucosa. Al ojo humano esta luz es azulada. Es recomendable emplearlos con endoscopios de alta definición. Existen varias clasificaciones, y otros sistemas más intuitivos, pero la más empleada es la Clasificación original de Sano (patrón i normal o hiperplasia, patrón II neoplasia, patrón iii neoplasia invasiva).
La cromoendoscopia digital se refiere a los sistemas Fujinon Intelligent Chromoendoscopy (FICE) de Fujifilm, y i-Scan de Pentax. Ambos emplean protocolos de posprocesamiento de la imagen para resaltar los patrones vasculares y mucosos, sin modificación real en las características de la luz emitida. El FICE tiene 10«filtros» preconfigurados de fábrica, pero pueden modificarse a voluntad del explorador. El filtro 4 parece el más adecuado para el estudio de los pólipos colónicos. El FICE puede emplearse con endoscopios de resolución estándar o de alta resolución. La capacidad diagnóstica para predecir la histología de la lesión es superior cuando se emplea con magnificación óptica (disponible en algunos de los endoscopios de alta resolución). El sistema i-Scan está disponible con el sistema de alta resolución EPK-i. Existe un mando para accionar una función llamada SE (realce de la estructura, efecto similar al obtenido con la aplicación de ácido acético) que puede graduarse, y otro para accionar la función CE (realce del contraste), que proporciona diferentes filtros de fábrica: p (patrón de superficie), v (patrón vascular), e (esófago), b (Barrett), g (gástrico), c (colon). Las funciones SE y CE pueden emplearse simultáneamente. Los filtros descritos no están validados en estudios comparativos.
Indicaciones: teóricamente los métodos revisados pueden emplearse en el colon para aumentar la detección de lesiones, facilitar la observación del margen y relieve de los pólipos, y predecir la histología de las lesiones (no neoplásicas, neoplásicas, neoplásicas invasivas). En la práctica, ningún sistema ha podido demostrar rotundamente un aumento en la detección de lesiones, el margen de las lesiones sí se observa mejor con ellos (aunque no tanto como con índigo carmín), y todos pueden ayudar a predecir la histología, especialmente si se emplean endoscopios de magnificación óptica. Se requieren más investigaciones para determinar el papel de estos equipos en la endoscopia a pacientes de alto riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.