Análisis coste-efectividad de una estrategia basada en antivirales de acción directa (AAD) a partir de la comercialización de simeprevir y sofosbuvir (post-AAD) frente a otra previa (pre-AAD), en pacientes con hepatitis C crónica, desde la perspectiva del Sistema Nacional de Salud.
MétodosSe realizó un árbol de decisión combinado con un modelo de Markov para estimar los costes directos sanitarios (€, 2016) y resultados en salud (años de vida ajustados por calidad, AVAC), a lo largo de toda la vida del paciente, con una tasa de descuento anual del 3%. La respuesta virológica sostenida, el porcentaje de pacientes tratados o no en cada estrategia, las características clínicas de los pacientes, las probabilidades anuales de transición, los costes del tratamiento y manejo de la enfermedad, y las utilidades se obtuvieron de la literatura. El análisis coste-efectividad se expresó como relación coste-efectividad incremental (coste incremental por AVAC ganado). Se realizaron análisis de sensibilidad determinísticos y probabilístico.
ResultadosLa estrategia post-AAD mostró mayores costes sanitarios por paciente (30.944€ vs. 23.707€) que la estrategia pre-AAD. Sin embargo, se asoció con un aumento de la ganancia de AVAC (15,79 vs. 12,83), mostrando una relación coste-efectividad incremental de 2.439€ por AVAC. Los análisis de sensibilidad mostraron la consistencia de los resultados siendo la estrategia post-AAD, frente a pre-AAD, coste-efectiva en el 99% de los casos.
ConclusionesLa estrategia post-AAD, en comparación con la pre-AAD, es eficiente para el tratamiento de la hepatitis C crónica en España, obteniéndose un coste por AVAC muy inferior al umbral de eficiencia utilizado en España (30.000€ por AVAC).
To evaluate the cost-effectiveness of a strategy based on direct-acting antivirals (DAAs) following the marketing of simeprevir and sofosbuvir (post-DAA) versus a pre-direct-acting antiviral strategy (pre-DAA) in patients with chronic hepatitis C, from the perspective of the Spanish National Health System.
MethodsA decision tree combined with a Markov model was used to estimate the direct health costs (€, 2016) and health outcomes (quality-adjusted life years, QALYs) throughout the patient's life, with an annual discount rate of 3%. The sustained virological response, percentage of patients treated or not treated in each strategy, clinical characteristics of the patients, annual likelihood of transition, costs of treating and managing the disease, and utilities were obtained from the literature. The cost-effectiveness analysis was expressed as an incremental cost-effectiveness ratio (incremental cost per QALY gained). A deterministic sensitivity analysis and a probabilistic sensitivity analysis were performed.
ResultsThe post-DAA strategy showed higher health costs per patient (€30,944 vs. €23,707) than the pre-DAA strategy. However, it was associated with an increase of QALYs gained (15.79 vs. 12.83), showing an incremental cost-effectiveness ratio of €2,439 per QALY. The deterministic sensitivity analysis and the probabilistic sensitivity analysis showed the robustness of the results, with the post-DAA strategy being cost-effective in 99% of cases compared to the pre-DAA strategy.
ConclusionsCompared to the pre-DAA strategy, the post-DAA strategy is efficient for the treatment of chronic hepatitis C in Spain, resulting in a much lower cost per QALY than the efficiency threshold used in Spain (€30,000 per QALY).
La infección por el virus de la hepatitis C (VHC) se caracteriza por la dificultad del sistema inmune para eliminar el virus en la fase aguda, lo que conlleva el desarrollo de hepatitis C crónica (HCC) en un porcentaje mayor del 70% de los pacientes1. Entre ellos, en función de diversos factores, el daño crónico del hígado puede desembocar en el desarrollo de cirrosis hepática en hasta un 25% de los pacientes2. En la mayoría de los pacientes esta progresión es lenta y completamente asintomática, pero una vez desarrollada la cirrosis hepática, la probabilidad anual de desarrollar descompensaciones clínicas de la cirrosis es del 4% y de desarrollar hepatocarcinoma del 1,5%3, lo que eventualmente puede conducir a la necesidad de recibir un trasplante hepático (TH) o a causar la muerte del paciente.
La prevalencia real de la HCC en España no es bien conocida, pero se estima que en el año 2013 en España la HCC afectaba a 473.000 personas4. La magnitud de estas cifras revelan que la HCC es un problema sociosanitario de gran magnitud en España, que implica un importante consumo de recursos económicos para los sistemas de salud, tanto por las necesidades evidentes de tratamientos que curen la infección por el VHC como por los costes derivados del tratamiento de las complicaciones de la enfermedad hepática5.
La respuesta virológica sostenida (RVS) que permiten obtener los tratamientos para la infección por el VHC evita la progresión de la enfermedad, reduce la mortalidad hepática y la mortalidad por todas la causas y aumenta la calidad de vida de los pacientes6,7. El tratamiento de la enfermedad ha cambiado de forma radical en los últimos años debido a la disponibilidad de antivirales de acción directa (AAD) que, actuando de modo combinado sobre diferentes dianas terapéuticas claves para la replicación del virus, permiten obtener tasas de RVS superiores al 95% en la mayoría de los pacientes. Estos regímenes de tratamiento, en su mayoría libres de interferón, son administrados oralmente y tienen una menor duración que las alternativas utilizadas previamente, un mejor perfil de tolerabilidad y una mayor adherencia al tratamiento8–11.
Como contrapartida, el uso de estos nuevos regímenes de AAD está asociado a un incremento del impacto económico en el presupuesto sobre los sistemas de salud a corto plazo. Dicho incremento está relacionado fundamentalmente con el aumento significativo del número de pacientes elegibles para recibir tratamiento debido a su excelente perfil de seguridad, y con el coste asociado de los propios fármacos.
Por este motivo, en España y otros países12–14 se han establecido políticas sanitarias, como el Plan Estratégico para el Abordaje de la Hepatitis C (PEACH)15 que, basadas en la limitación de los recursos económicos disponibles y en la necesidad de establecer la adecuada estrategia terapéutica dando prioridad en una primera fase a los pacientes con un mayor grado de fibrosis y, por tanto, con mayor riesgo de evolución de la enfermedad, puedan conseguir beneficios a corto o largo plazo, en forma de curación de la enfermedad y de complicaciones clínicas evitadas derivadas de la enfermedad hepática o de manifestaciones extrahepáticas del VHC16.
Estas mejoras en salud también llevan asociados costes futuros relacionados con la enfermedad y su evolución, y es por ello que se hace necesario aportar evidencias clinicoeconómicas sobre los resultados a largo plazo que supone el cambio en el manejo de los pacientes con HCC en nuestro país, es decir, analizar cómo sería la evolución de la enfermedad con y sin la utilización de estos nuevos AAD. El objetivo del presente análisis farmacoeconómico es evaluar la relación coste-efectividad incremental de una estrategia terapéutica basada en la combinación de los nuevos agentes antivirales de acción directa (post-AAD) durante el primer año (2015) de aplicación del plan PEACH frente a los regímenes disponibles previamente basados en doble o triple terapia con peginterferón más ribavirina, con telaprevir o boceprevir (pre-AAD), en pacientes con HCC con diferentes grados de fibrosis.
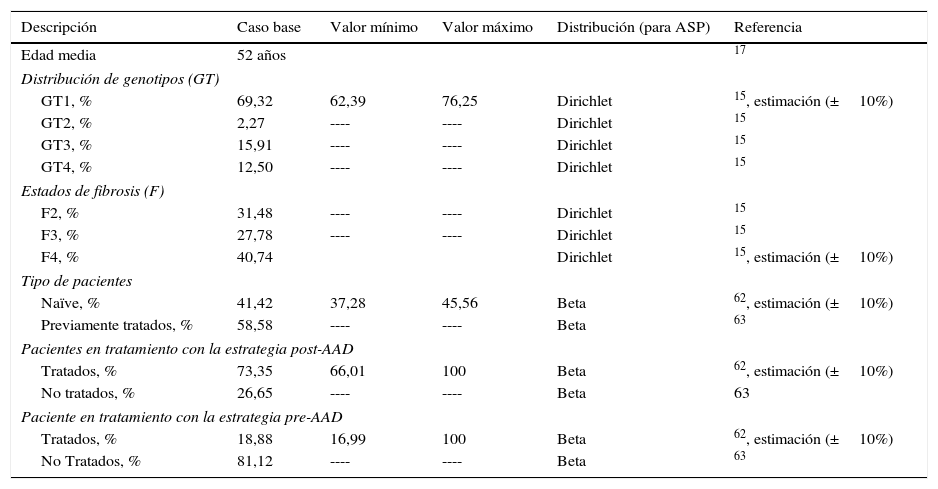
Material y métodosEn el análisis se comparó una cohorte de 51.900 pacientes (población de pacientes candidatos a recibir tratamiento estimada por el PEACH) con una edad media de 52 años17, con fibrosis≥F2 (escala METAVIR), tratada con los nuevos regímenes de AAD de alta eficacia definidos en el PEACH (estrategia post-AAD, tabla 1) frente a una cohorte con las mismas características tratada con los regímenes basados en la doble o triple terapia con peginterferón más ribavirina y boceprevir o telaprevir (estrategia pre-AAD, tabla 1), desde la perspectiva del Sistema Nacional de Salud. Se aplicó una tasa de descuento del 3% a los costes y resultados en salud18.
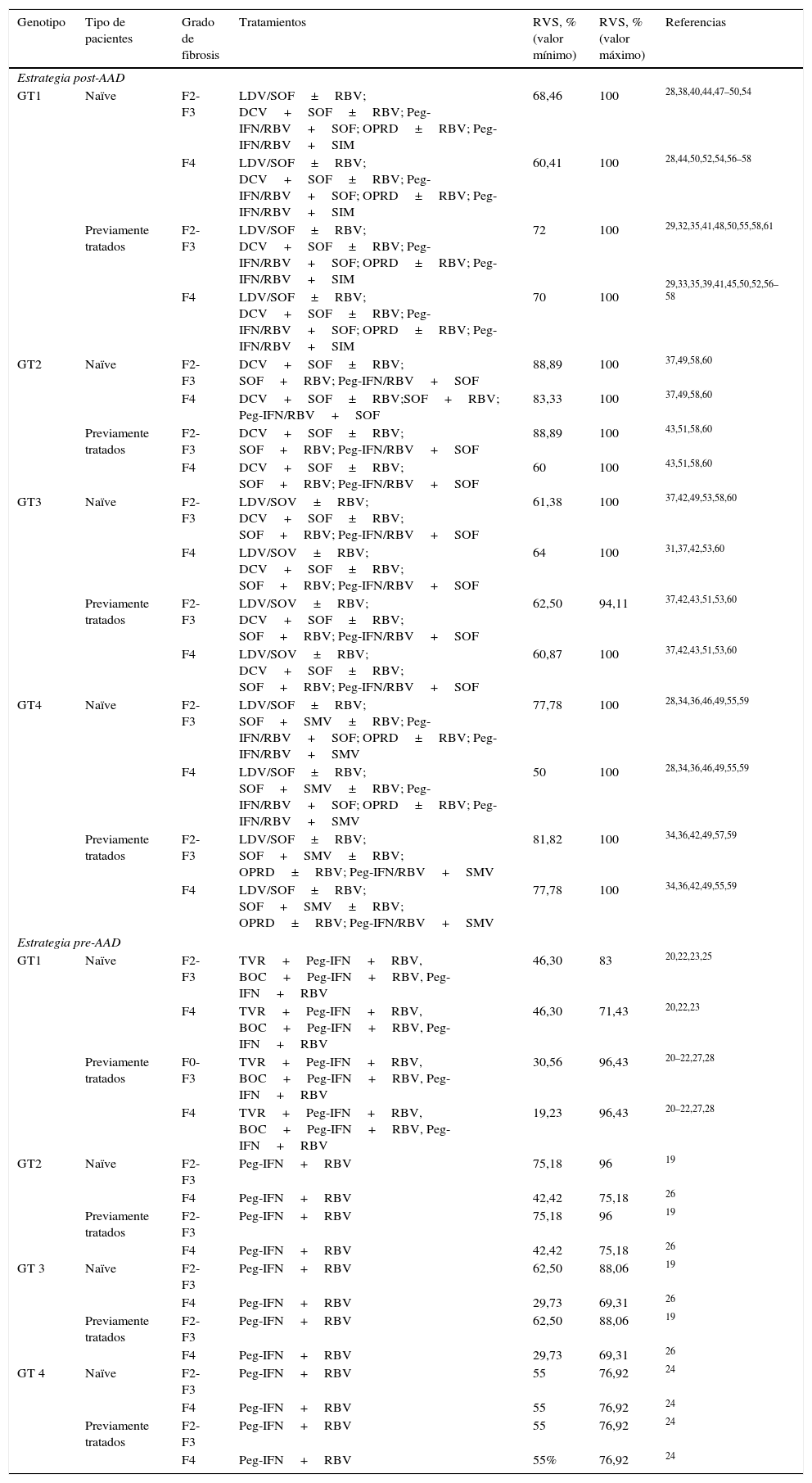
Respuesta virológica sostenida de los tratamientos evaluados, en función del genotipo, tipo de pacientes y grado de fibrosis
| Genotipo | Tipo de pacientes | Grado de fibrosis | Tratamientos | RVS, % (valor mínimo) | RVS, % (valor máximo) | Referencias |
|---|---|---|---|---|---|---|
| Estrategia post-AAD | ||||||
| GT1 | Naïve | F2-F3 | LDV/SOF±RBV; DCV+SOF±RBV; Peg-IFN/RBV+SOF; OPRD±RBV; Peg-IFN/RBV+SIM | 68,46 | 100 | 28,38,40,44,47–50,54 |
| F4 | LDV/SOF±RBV; DCV+SOF±RBV; Peg-IFN/RBV+SOF; OPRD±RBV; Peg-IFN/RBV+SIM | 60,41 | 100 | 28,44,50,52,54,56–58 | ||
| Previamente tratados | F2-F3 | LDV/SOF±RBV; DCV+SOF±RBV; Peg-IFN/RBV+SOF; OPRD±RBV; Peg-IFN/RBV+SIM | 72 | 100 | 29,32,35,41,48,50,55,58,61 | |
| F4 | LDV/SOF±RBV; DCV+SOF±RBV; Peg-IFN/RBV+SOF; OPRD±RBV; Peg-IFN/RBV+SIM | 70 | 100 | 29,33,35,39,41,45,50,52,56–58 | ||
| GT2 | Naïve | F2-F3 | DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 88,89 | 100 | 37,49,58,60 |
| F4 | DCV+SOF±RBV;SOF+RBV; Peg-IFN/RBV+SOF | 83,33 | 100 | 37,49,58,60 | ||
| Previamente tratados | F2-F3 | DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 88,89 | 100 | 43,51,58,60 | |
| F4 | DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 60 | 100 | 43,51,58,60 | ||
| GT3 | Naïve | F2-F3 | LDV/SOV±RBV; DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 61,38 | 100 | 37,42,49,53,58,60 |
| F4 | LDV/SOV±RBV; DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 64 | 100 | 31,37,42,53,60 | ||
| Previamente tratados | F2-F3 | LDV/SOV±RBV; DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 62,50 | 94,11 | 37,42,43,51,53,60 | |
| F4 | LDV/SOV±RBV; DCV+SOF±RBV; SOF+RBV; Peg-IFN/RBV+SOF | 60,87 | 100 | 37,42,43,51,53,60 | ||
| GT4 | Naïve | F2-F3 | LDV/SOF±RBV; SOF+SMV±RBV; Peg-IFN/RBV+SOF; OPRD±RBV; Peg-IFN/RBV+SMV | 77,78 | 100 | 28,34,36,46,49,55,59 |
| F4 | LDV/SOF±RBV; SOF+SMV±RBV; Peg-IFN/RBV+SOF; OPRD±RBV; Peg-IFN/RBV+SMV | 50 | 100 | 28,34,36,46,49,55,59 | ||
| Previamente tratados | F2-F3 | LDV/SOF±RBV; SOF+SMV±RBV; OPRD±RBV; Peg-IFN/RBV+SMV | 81,82 | 100 | 34,36,42,49,57,59 | |
| F4 | LDV/SOF±RBV; SOF+SMV±RBV; OPRD±RBV; Peg-IFN/RBV+SMV | 77,78 | 100 | 34,36,42,49,55,59 | ||
| Estrategia pre-AAD | ||||||
| GT1 | Naïve | F2-F3 | TVR+Peg-IFN+RBV, BOC+Peg-IFN+RBV, Peg-IFN+RBV | 46,30 | 83 | 20,22,23,25 |
| F4 | TVR+Peg-IFN+RBV, BOC+Peg-IFN+RBV, Peg-IFN+RBV | 46,30 | 71,43 | 20,22,23 | ||
| Previamente tratados | F0-F3 | TVR+Peg-IFN+RBV, BOC+Peg-IFN+RBV, Peg-IFN+RBV | 30,56 | 96,43 | 20–22,27,28 | |
| F4 | TVR+Peg-IFN+RBV, BOC+Peg-IFN+RBV, Peg-IFN+RBV | 19,23 | 96,43 | 20–22,27,28 | ||
| GT2 | Naïve | F2-F3 | Peg-IFN+RBV | 75,18 | 96 | 19 |
| F4 | Peg-IFN+RBV | 42,42 | 75,18 | 26 | ||
| Previamente tratados | F2-F3 | Peg-IFN+RBV | 75,18 | 96 | 19 | |
| F4 | Peg-IFN+RBV | 42,42 | 75,18 | 26 | ||
| GT 3 | Naïve | F2-F3 | Peg-IFN+RBV | 62,50 | 88,06 | 19 |
| F4 | Peg-IFN+RBV | 29,73 | 69,31 | 26 | ||
| Previamente tratados | F2-F3 | Peg-IFN+RBV | 62,50 | 88,06 | 19 | |
| F4 | Peg-IFN+RBV | 29,73 | 69,31 | 26 | ||
| GT 4 | Naïve | F2-F3 | Peg-IFN+RBV | 55 | 76,92 | 24 |
| F4 | Peg-IFN+RBV | 55 | 76,92 | 24 | ||
| Previamente tratados | F2-F3 | Peg-IFN+RBV | 55 | 76,92 | 24 | |
| F4 | Peg-IFN+RBV | 55% | 76,92 | 24 | ||
AAD: agentes antivirales de acción directa; BOC: boceprevir; DCV: daclatasvir; GT: genotipo; LDV: ledipasvir; OPRD: ombitasvir/paritaprevir/ritonavir/dasbuvir; Peg-IFN: peginterferón; RBV: ribavirina; SIM: simeprevir; SMV: simeprevir; RVS: respuesta virológica sostenida; SOF: sofosbuvir; TVR: telaprevir.
Para la estimación de los costes y resultados en salud obtenidos a largo plazo con cada una de las estrategias evaluadas, se utilizó un árbol de decisión combinado con un modelo de Markov.
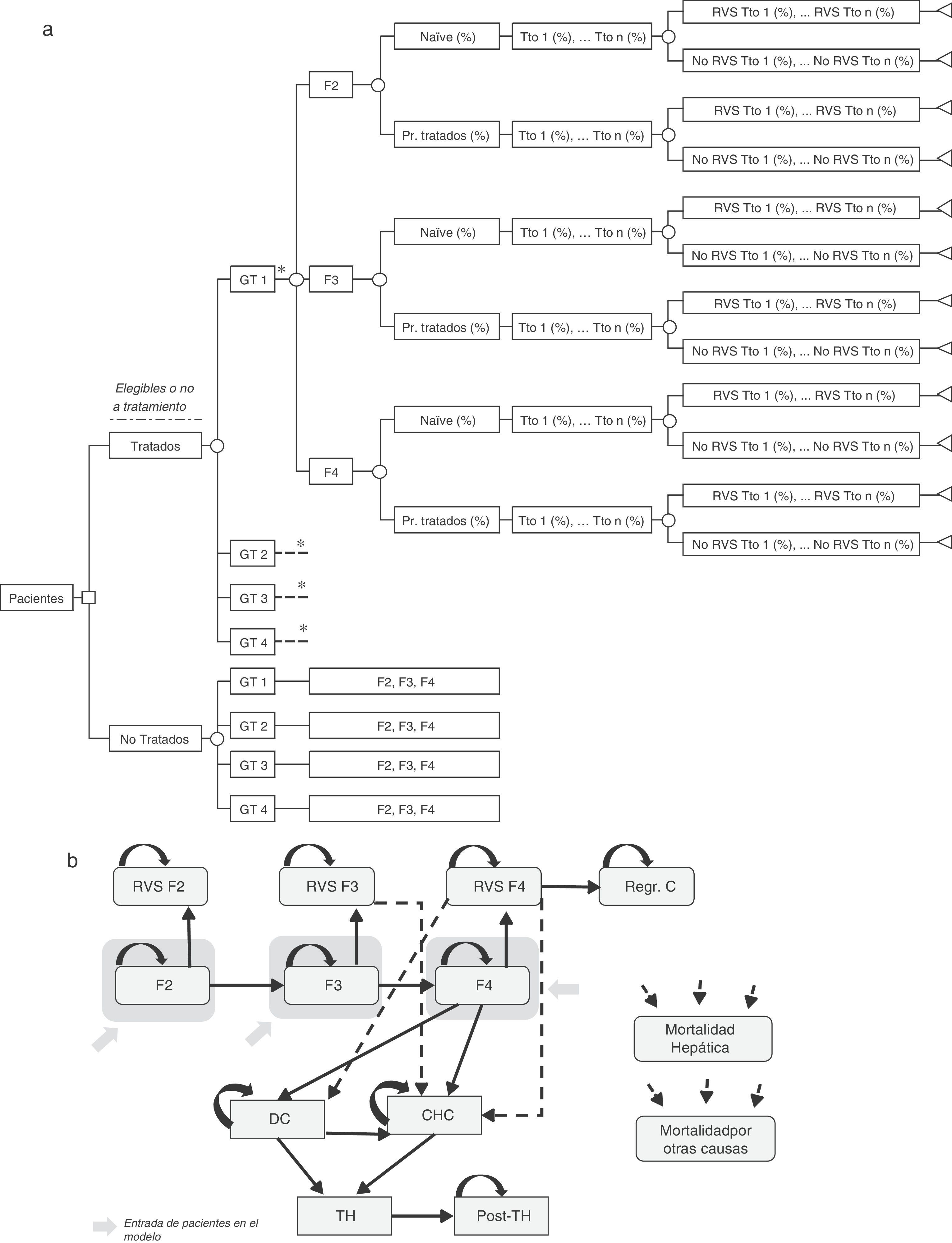
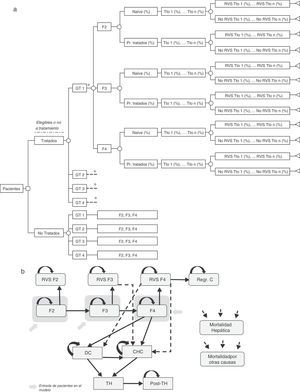
Árbol de decisiónSe realizó un árbol de decisión para estimar las tasas de RVS globales de las dos estrategias incluidas en el análisis (pre-AAD y post-AAD). Estas respuestas fueron el producto de la proporción de pacientes tratados o no tratados, genotipo, nivel de fibrosis, estado del tratamiento (naïve o tratados previamente), porcentaje de utilización de cada tratamiento y tasas de RVS asociadas a cada tipo de paciente (fig. 1a)19–61.
(a) Árbol de decisión de los pacientes tratados o no tratados en función de sus características clínicas, opciones de tratamiento y tasas de RVS. (b) Diagrama del modelo de Markov representado la progresión de la hepatitis C crónica. * Rama similar para GT2, GT 3 y GT4 diferenciando los tratamientos asociados a cada genotipo (tabla 1) y el porcentaje de utilización de cada uno de ellos en función de las características del paciente. CD: cirrosis descompensada; CHC: carcinoma hepatocelular; GT: genotipo; Pr. Tratados: previamente tratados; Post-TH: post-trasplante hepático; Regr. CH: regresión de la cirrosis; RVS: Respuesta Virológica Sostenida; TH: trasplante hepático; Tto: tratamiento.
En el caso base del análisis se consideró la administración del tratamiento a un 73,4% (38.067)62 de pacientes en la estrategia post-AAD frente a un 18,9% (9.800)4 de pacientes en la estrategia pre-AAD (tabla 2).
Características de la cohorte de pacientes con HCC
| Descripción | Caso base | Valor mínimo | Valor máximo | Distribución (para ASP) | Referencia |
|---|---|---|---|---|---|
| Edad media | 52 años | 17 | |||
| Distribución de genotipos (GT) | |||||
| GT1, % | 69,32 | 62,39 | 76,25 | Dirichlet | 15, estimación (±10%) |
| GT2, % | 2,27 | ---- | ---- | Dirichlet | 15 |
| GT3, % | 15,91 | ---- | ---- | Dirichlet | 15 |
| GT4, % | 12,50 | ---- | ---- | Dirichlet | 15 |
| Estados de fibrosis (F) | |||||
| F2, % | 31,48 | ---- | ---- | Dirichlet | 15 |
| F3, % | 27,78 | ---- | ---- | Dirichlet | 15 |
| F4, % | 40,74 | Dirichlet | 15, estimación (±10%) | ||
| Tipo de pacientes | |||||
| Naïve, % | 41,42 | 37,28 | 45,56 | Beta | 62, estimación (±10%) |
| Previamente tratados, % | 58,58 | ---- | ---- | Beta | 63 |
| Pacientes en tratamiento con la estrategia post-AAD | |||||
| Tratados, % | 73,35 | 66,01 | 100 | Beta | 62, estimación (±10%) |
| No tratados, % | 26,65 | ---- | ---- | Beta | 63 |
| Paciente en tratamiento con la estrategia pre-AAD | |||||
| Tratados, % | 18,88 | 16,99 | 100 | Beta | 62, estimación (±10%) |
| No Tratados, % | 81,12 | ---- | ---- | Beta | 63 |
AAD: agentes antivirales de acción directa; ASP: análisis de sensibilidad probabilístico; HCC: hepatitis C crónica.
Las características clínicas sobre la distribución de los pacientes según genotipo, grado de fibrosis y estado de tratamiento (naïve o previamente tratados), fueron iguales en ambas estrategias, y se obtuvieron de estudios basados en población española (tabla 2).
Para establecer los fármacos incluidos en una u otra estrategia, se tuvo en cuenta la fecha de comercialización de simeprevir y sofosbuvir. De esta forma, las terapias incluidas en la estrategia pre-AAD se basan en telaprevir y boceprevir en triple terapia con interferón pegilado e interferón pegilado más ribavirina para genotipo 1, e interferón pegilado más ribavirina para el resto de genotipos. Las terapias incluidas en la estrategia post-AAD, en función de las recomendaciones de las guías clínicas actuales, se basan en el tratamiento con los nuevos antivirales de acción directa con o sin ribavirina11,15,63. La utilización de cada tratamiento en función de las características clínicas de los pacientes fue estimada a partir de datos de estudios de mercado64. Estos parámetros se muestran en la tabla 2.
Las tasas de RVS de los tratamientos incluidos en el estudio en cada una de las estrategias para los diferentes genotipos, grados de fibrosis, en base a si el paciente había recibido o no tratamiento previamente, se obtuvieron de los estudios clínicos con mayor relevancia para cada uno de ellos19–61. Además de la tasa de RVS global, el árbol de decisión permitió calcular los valores mínimos y máximos de RVS utilizados en los análisis de sensibilidad (tabla 1).
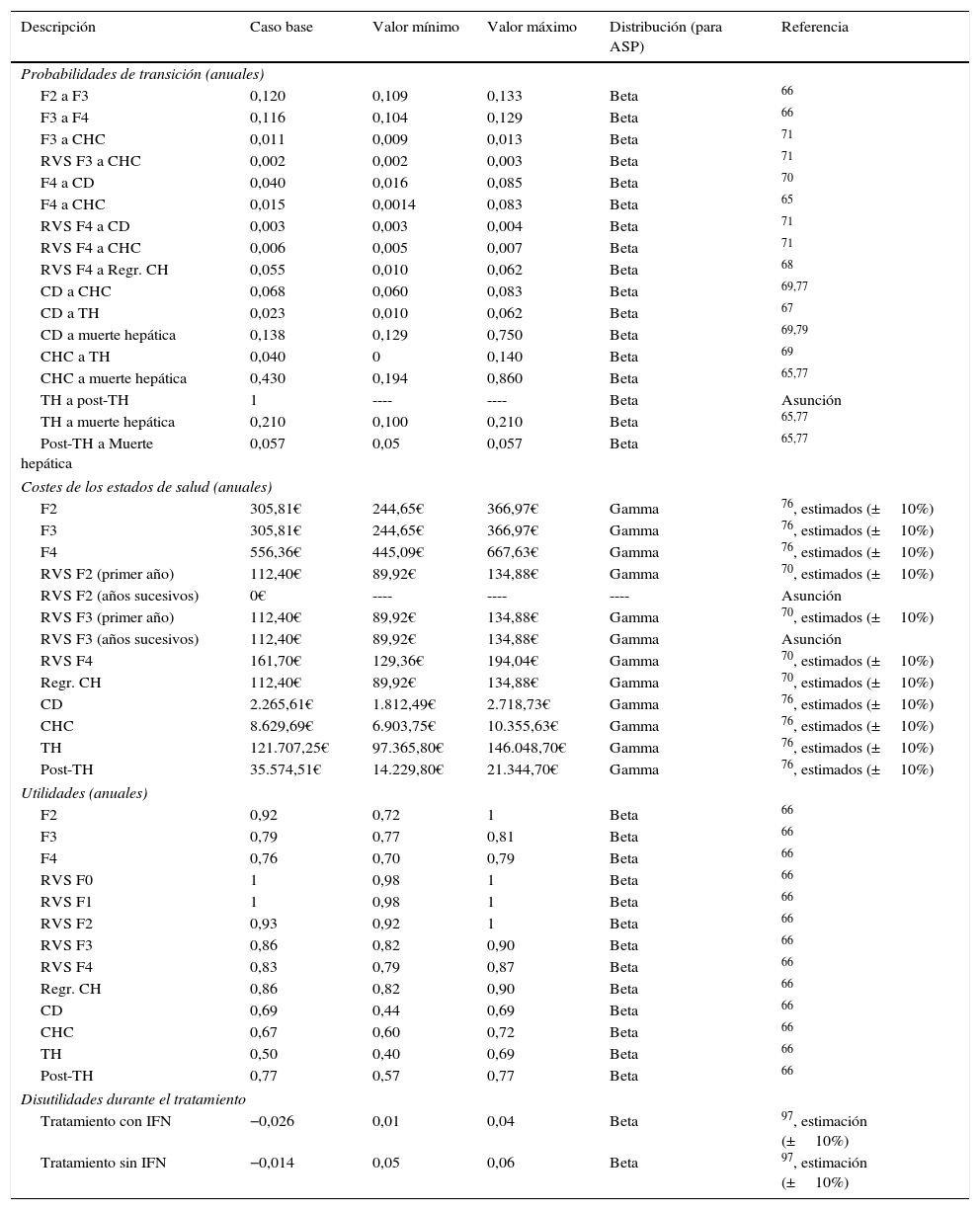
Modelo de MarkovSe diseñó un modelo de Markov de novo que simula la progresión de la enfermedad, a lo largo de toda la vida para 2 cohortes de pacientes, en función de las 2 estrategias de tratamiento descritas anteriormente (fig. 1b). La simulación se realizó en ciclos anuales y las probabilidades de transición para cada estado de salud se obtuvieron de la literatura65–71(tabla 3). Los pacientes se diferenciaron en tratados o no tratados. A partir de ese momento, empezaban a evolucionar en el modelo, en función de su estado de fibrosis. Los pacientes tratados transitaban a los estados de RVS en función de las tasas de respuesta global calculadas previamente en el árbol de decisión. Los pacientes en RVS F2 se consideraban pacientes curados, y permanecían en ese estado hasta la muerte por causas no hepáticas. Los pacientes en RVS F3, aunque obtenían una mejoría en la enfermedad, mantienen un riesgo de desarrollar carcinoma hepatocelular (CHC). Los pacientes en RVS F4 podían conseguir una estabilización o regresión de la cirrosis, o por el contrario, desarrollar complicaciones relacionadas con la cirrosis transitando a los estados de cirrosis descompensada (CD) o CHC. Los pacientes que no obtenían RVS permanecían en el estado de fibrosis o evolucionaban en su enfermedad hacia otros estados de salud de igual forma que los pacientes no tratados. Los pacientes en los estados de CD y CHC eran susceptibles de recibir un TH. Los pacientes receptores de un TH permanecían solo un ciclo en este estado y transitaban al estado de post-TH donde permanecían hasta la muerte (fig. 1b).
Parámetros utilizados en el modelo: Probabilidades de transición, utilidades, costes unitarios
| Descripción | Caso base | Valor mínimo | Valor máximo | Distribución (para ASP) | Referencia |
|---|---|---|---|---|---|
| Probabilidades de transición (anuales) | |||||
| F2 a F3 | 0,120 | 0,109 | 0,133 | Beta | 66 |
| F3 a F4 | 0,116 | 0,104 | 0,129 | Beta | 66 |
| F3 a CHC | 0,011 | 0,009 | 0,013 | Beta | 71 |
| RVS F3 a CHC | 0,002 | 0,002 | 0,003 | Beta | 71 |
| F4 a CD | 0,040 | 0,016 | 0,085 | Beta | 70 |
| F4 a CHC | 0,015 | 0,0014 | 0,083 | Beta | 65 |
| RVS F4 a CD | 0,003 | 0,003 | 0,004 | Beta | 71 |
| RVS F4 a CHC | 0,006 | 0,005 | 0,007 | Beta | 71 |
| RVS F4 a Regr. CH | 0,055 | 0,010 | 0,062 | Beta | 68 |
| CD a CHC | 0,068 | 0,060 | 0,083 | Beta | 69,77 |
| CD a TH | 0,023 | 0,010 | 0,062 | Beta | 67 |
| CD a muerte hepática | 0,138 | 0,129 | 0,750 | Beta | 69,79 |
| CHC a TH | 0,040 | 0 | 0,140 | Beta | 69 |
| CHC a muerte hepática | 0,430 | 0,194 | 0,860 | Beta | 65,77 |
| TH a post-TH | 1 | ---- | ---- | Beta | Asunción |
| TH a muerte hepática | 0,210 | 0,100 | 0,210 | Beta | 65,77 |
| Post-TH a Muerte hepática | 0,057 | 0,05 | 0,057 | Beta | 65,77 |
| Costes de los estados de salud (anuales) | |||||
| F2 | 305,81€ | 244,65€ | 366,97€ | Gamma | 76, estimados (±10%) |
| F3 | 305,81€ | 244,65€ | 366,97€ | Gamma | 76, estimados (±10%) |
| F4 | 556,36€ | 445,09€ | 667,63€ | Gamma | 76, estimados (±10%) |
| RVS F2 (primer año) | 112,40€ | 89,92€ | 134,88€ | Gamma | 70, estimados (±10%) |
| RVS F2 (años sucesivos) | 0€ | ---- | ---- | ---- | Asunción |
| RVS F3 (primer año) | 112,40€ | 89,92€ | 134,88€ | Gamma | 70, estimados (±10%) |
| RVS F3 (años sucesivos) | 112,40€ | 89,92€ | 134,88€ | Gamma | Asunción |
| RVS F4 | 161,70€ | 129,36€ | 194,04€ | Gamma | 70, estimados (±10%) |
| Regr. CH | 112,40€ | 89,92€ | 134,88€ | Gamma | 70, estimados (±10%) |
| CD | 2.265,61€ | 1.812,49€ | 2.718,73€ | Gamma | 76, estimados (±10%) |
| CHC | 8.629,69€ | 6.903,75€ | 10.355,63€ | Gamma | 76, estimados (±10%) |
| TH | 121.707,25€ | 97.365,80€ | 146.048,70€ | Gamma | 76, estimados (±10%) |
| Post-TH | 35.574,51€ | 14.229,80€ | 21.344,70€ | Gamma | 76, estimados (±10%) |
| Utilidades (anuales) | |||||
| F2 | 0,92 | 0,72 | 1 | Beta | 66 |
| F3 | 0,79 | 0,77 | 0,81 | Beta | 66 |
| F4 | 0,76 | 0,70 | 0,79 | Beta | 66 |
| RVS F0 | 1 | 0,98 | 1 | Beta | 66 |
| RVS F1 | 1 | 0,98 | 1 | Beta | 66 |
| RVS F2 | 0,93 | 0,92 | 1 | Beta | 66 |
| RVS F3 | 0,86 | 0,82 | 0,90 | Beta | 66 |
| RVS F4 | 0,83 | 0,79 | 0,87 | Beta | 66 |
| Regr. CH | 0,86 | 0,82 | 0,90 | Beta | 66 |
| CD | 0,69 | 0,44 | 0,69 | Beta | 66 |
| CHC | 0,67 | 0,60 | 0,72 | Beta | 66 |
| TH | 0,50 | 0,40 | 0,69 | Beta | 66 |
| Post-TH | 0,77 | 0,57 | 0,77 | Beta | 66 |
| Disutilidades durante el tratamiento | |||||
| Tratamiento con IFN | −0,026 | 0,01 | 0,04 | Beta | 97, estimación (±10%) |
| Tratamiento sin IFN | −0,014 | 0,05 | 0,06 | Beta | 97, estimación (±10%) |
ASP: análisis de sensibilidad probabilístico; CD: cirrosis descompensada; CHC: carcinoma hepatocelular; IFN: interferón; Regr. CH: regresión de la cirrosis; Post-TH: postrasplante hepático; RVS: respuesta virológica sostenida; TH: trasplante hepático.
En el análisis se consideraron tres tipos de mortalidad en función de cada estado de salud. En aquellos pacientes que se encontraban en los estados de RVS, regresión de la cirrosis y los estados de fibrosis independientemente de su grado, se consideró la mortalidad por todas las causas según la edad72. A los pacientes en estados más avanzados de la enfermedad, tales como CD, CHC, TH y post-TH, se les asoció la tasa de mortalidad por causa hepática del propio estado y la mortalidad no hepática. Esta última fue calculada a partir de la tasa de la mortalidad por todas las causas menos la mortalidad hepática73, todas ellas por rango de edad.
CostesTodos los costes incluidos en el modelo son costes directos sanitarios y se expresaron en euros (€) del año 2016.
El coste farmacológico por paciente para la estrategia post-AAD (28.738€) se calculó a partir del coste global de todos los pacientes con HCC tratados con las nuevas terapias en el año 201574 dividido entre el número de pacientes tratados con las nuevas terapias en el mismo año62. En la estrategia pre-AAD, el coste farmacológico promedio por paciente (15.003€) se calculó a partir del coste de los medicamentos para el Sistema Nacional Sanitario75 utilizados en esta estrategia, ajustados según diferentes deducciones. Como premisas, se asumieron que el coste de ribavirina es 0€, que los pacientes son tratados una única vez y que todos finalizan la terapia, no existiendo discontinuación del tratamiento por ninguna causa.
Los costes de monitorización fueron calculados como un promedio de los costes asociados a la administración del tratamiento, en base a datos previamente publicados76, según las diferentes duraciones, considerando 8-24 semanas para la estrategia post-AAD (1.257,52€) y 24-48 semanas para la estrategia pre-AAD (2.371,39€).
Los costes sanitarios asociados a cada estado de salud fueron obtenidos de diferentes estudios publicados y actualizados al año 201670,76 (tabla 3). En los estados de RVS F2 y regresión de la cirrosis, se asume la curación de los pacientes después del primer año, por lo que no se generaría ningún consumo de recursos, y, por tanto, no se considera ningún coste del estado de salud en el segundo año y sucesivos. Por el contrario, se considera que los pacientes en estadios F3 y F4 con RVS y que permanecen en ella durante los siguientes años de la simulación, tienen un coste, debido al riesgo de progresión de la enfermedad (tabla 3).
Utilidades. Análisis coste-efectividadEl término utilidad se refiere a la calidad percibida por los pacientes en los diferentes estados de salud de una enfermedad. Las utilidades asociadas en este análisis para cada estado de salud del modelo de Markov se obtuvieron de la literatura66 (tabla 3). El impacto de la toxicidad de los fármacos, diferenciando tratamientos que contienen o no peginterferón, se consideró como una disminución de la calidad de vida o desutilidad durante el tratamiento (tabla 3).
Los resultados en salud se midieron en términos de supervivencia media por paciente, medida como años de vida ganados al final de la simulación de la progresión de la enfermedad, a lo largo de toda la vida de los pacientes. Posteriormente, este valor se ajustó con los valores de utilidades correspondientes, y se expresaron como años de vida ajustados por calidad de vida (AVAC) ganados por paciente con cada una de las dos estrategias de tratamiento evaluadas.
La eficiencia o relación entre costes y resultados en salud se expresó como relación coste-efectividad incremental, es decir, coste incremental por paciente de la estrategia post-AAD versus la estrategia pre-AAD dividido por el número de AVAC incrementales por paciente, obtenidos con la estrategia post-AAD frente a la estrategia pre-AAD.
Análisis de sensibilidadSe realizaron análisis de sensibilidad determinísticos (ASD) univariantes y un análisis de sensibilidad probabilístico (ASP) para evaluar la solidez de los resultados variando los parámetros más relevantes en el análisis.
En el ASD las variables evaluadas fueron: las tasas de RVS entre el valor mínimo y máximo calculados previamente, la proporción de pacientes con GT1, pacientes en F4 y pacientes tratados o no tratados, las probabilidades de transitar desde RVS F3 o RVS F4 a CHC, la probabilidad desde RVS F4 a CD, y las probabilidades desde CD o CHC a TH y las utilidades asociadas a los estados de RVS (tablas 2 y 3)
En el ASP se realizaron 10.000 simulaciones de Monte Carlo. Se asignó una distribución beta para los parámetros asociados a la proporción de pacientes tratados y no tratados, las características de los pacientes (genotipos, estados de fibrosis, estado de tratamiento), las probabilidades de transición y las utilidades, y una distribución gamma para los costes. Los rangos de valores fueron estimados de los valores mínimos y máximos calculados y de la literatura77 (tablas 2 y 3).
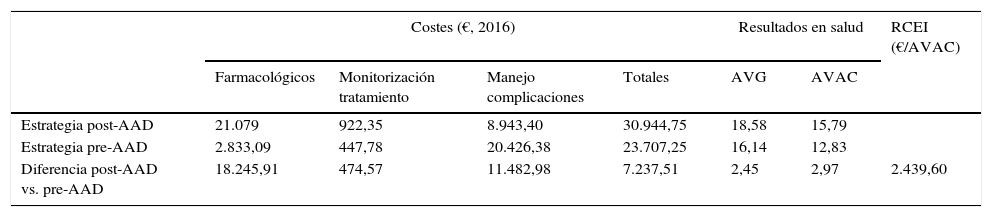
ResultadosCaso baseEn los 50 años de simulación de la historia natural de la HCC, la estrategia post-AAD resultó ser más efectiva que la pre-AAD, consiguiendo un incremento de 2,45 años de vida ganados y 2,97 AVAC por paciente (18,58 frente 16,14 y 15,79 frente 12,83, respectivamente). El coste total promedio para conseguir estas ganancias en resultados en salud fue de 30.944€ y 23.707€ por paciente, con las estrategias post-AAD y pre-AAD, respectivamente. Las partidas de coste con mayor impacto en estos valores fueron el coste farmacológico (21.079€, 68% del coste total) en la estrategia post-AAD, y el coste del manejo de las complicaciones asociadas a la evolución de la enfermedad (20.426€, 86% del coste total) en la estrategia pre-AAD (tabla 4).
Resultados del análisis coste-efectividad. Caso base
| Costes (€, 2016) | Resultados en salud | RCEI (€/AVAC) | |||||
|---|---|---|---|---|---|---|---|
| Farmacológicos | Monitorización tratamiento | Manejo complicaciones | Totales | AVG | AVAC | ||
| Estrategia post-AAD | 21.079 | 922,35 | 8.943,40 | 30.944,75 | 18,58 | 15,79 | |
| Estrategia pre-AAD | 2.833,09 | 447,78 | 20.426,38 | 23.707,25 | 16,14 | 12,83 | |
| Diferencia post-AAD vs. pre-AAD | 18.245,91 | 474,57 | 11.482,98 | 7.237,51 | 2,45 | 2,97 | 2.439,60 |
AAD: agentes antivirales de acción directa; AVAC: años de vida ajustados por calidad; AVG: años de vida ganados; RCEI: relación coste-efectividad incremental (coste incremental de la estrategia post-AAD vs. la estrategia pre-AAD dividido por el número de AVAC incrementales obtenidos con la estrategia post-AAD vs. la estrategia pre-AAD).
La relación coste-efectividad incremental de la estrategia post-AAD frente a la estrategia pre-AAD fue de 2.439€ por cada AVAC adicional (tabla 4).
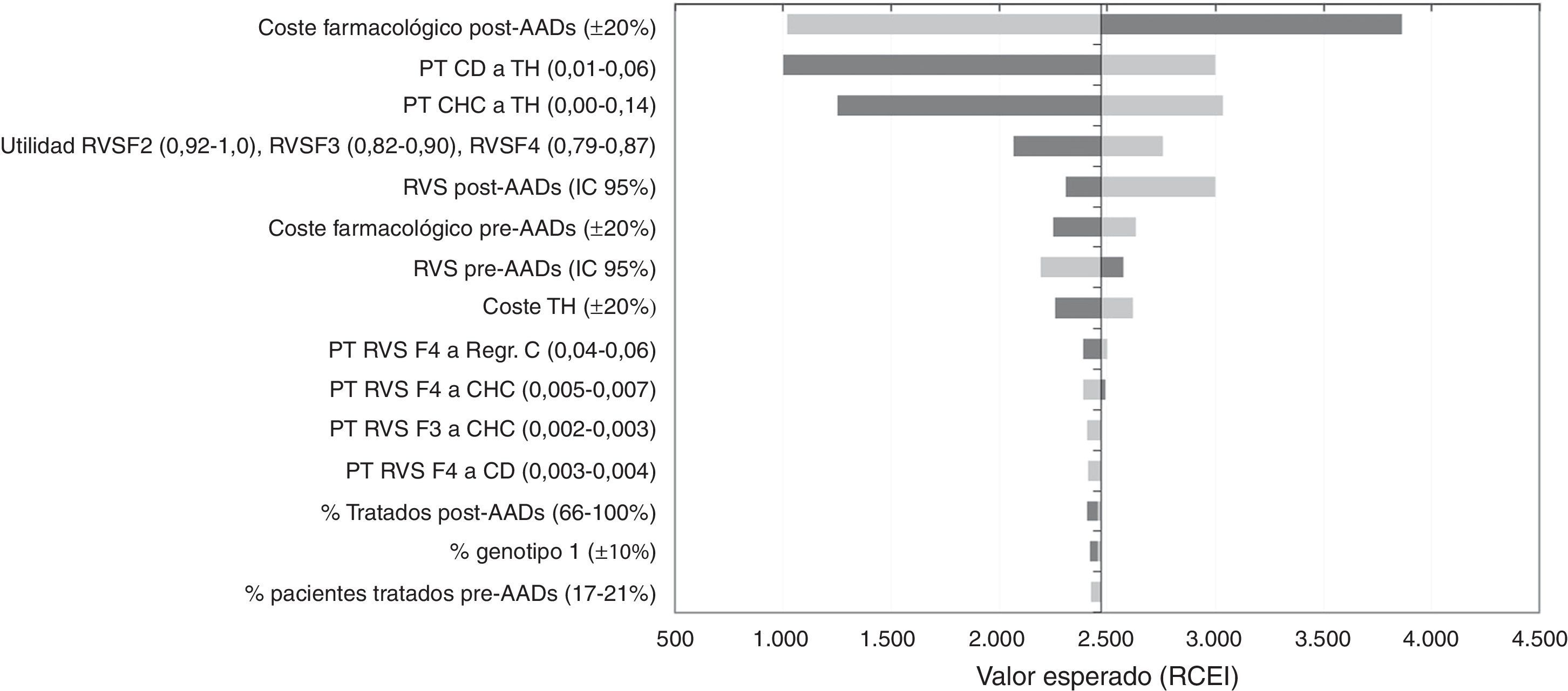
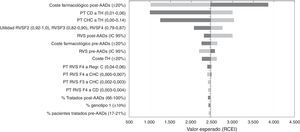
Análisis de sensibilidadEn el ASD, los valores de la RCEI oscilaron entre 1.002€ y 3.860€ por cada AVAC adicional conseguido con la estrategia post-AAD frente a pre-AAD. La representación de este análisis se realizó mediante un diagrama de tornado, en el que los parámetros que producen una mayor variación en los resultados del análisis del caso base se sitúan en la parte superior y los de menor influencia en la parte inferior (fig. 2). Los parámetros con mayor relevancia en el análisis fueron el coste farmacológico y el porcentaje de pacientes tratados o no tratados en la estrategia post-AAD. Una disminución del coste farmacológico del tratamiento en la estrategia post-AAD provoca una disminución del RCEI a 1.019€; por el contrario, un aumento provoca un incremento del RCEI a valores de 3.860€. Las modificaciones en las probabilidades de transición desde CD o CHC a TH hacen que los resultados sean sensibles a este parámetro provocando una variación de 3.032€ a 1.250€ en el RCEI, lo que muestra que es un parámetro que influye en el resultado del análisis. Cuando se variaron las tasas de RVS con los valores mínimos o máximos, el RCEI varió entre 2.997€ y 2.193€. Cuando se consideró que el 100% de los pacientes son tratados en la estrategia post-AAD el RCEI no sufrió una gran variación debido a que el aumento en la diferencia incremental en los costes totales con respecto al caso base (de 7.237€ a 10.237€) fue compensada con el aumento en la diferencia incremental en los AVAC (2,97 a 4,25 AVAC).
Resultados del análisis coste-efectividad. Análisis de sensibilidad determinístico (ASD). Diagrama tornado.
AAD: antivirales de acción directa; CD: cirrosis descompensada; CHC: carcinoma hepatocelular; Regr. CH: regresión de la cirrosis; RVS: respuesta virológica sostenida; TH: trasplante hepático.
En la figura 2 el color gris oscuro representa una variación del RCEI con los valores máximos de cada parámetro y el color gris claro representa las variaciones del RCEI con los valores mínimos.
Finalmente, variaciones en el resto de parámetros incluidos en el ASD no tienen una influencia en los resultados del análisis.
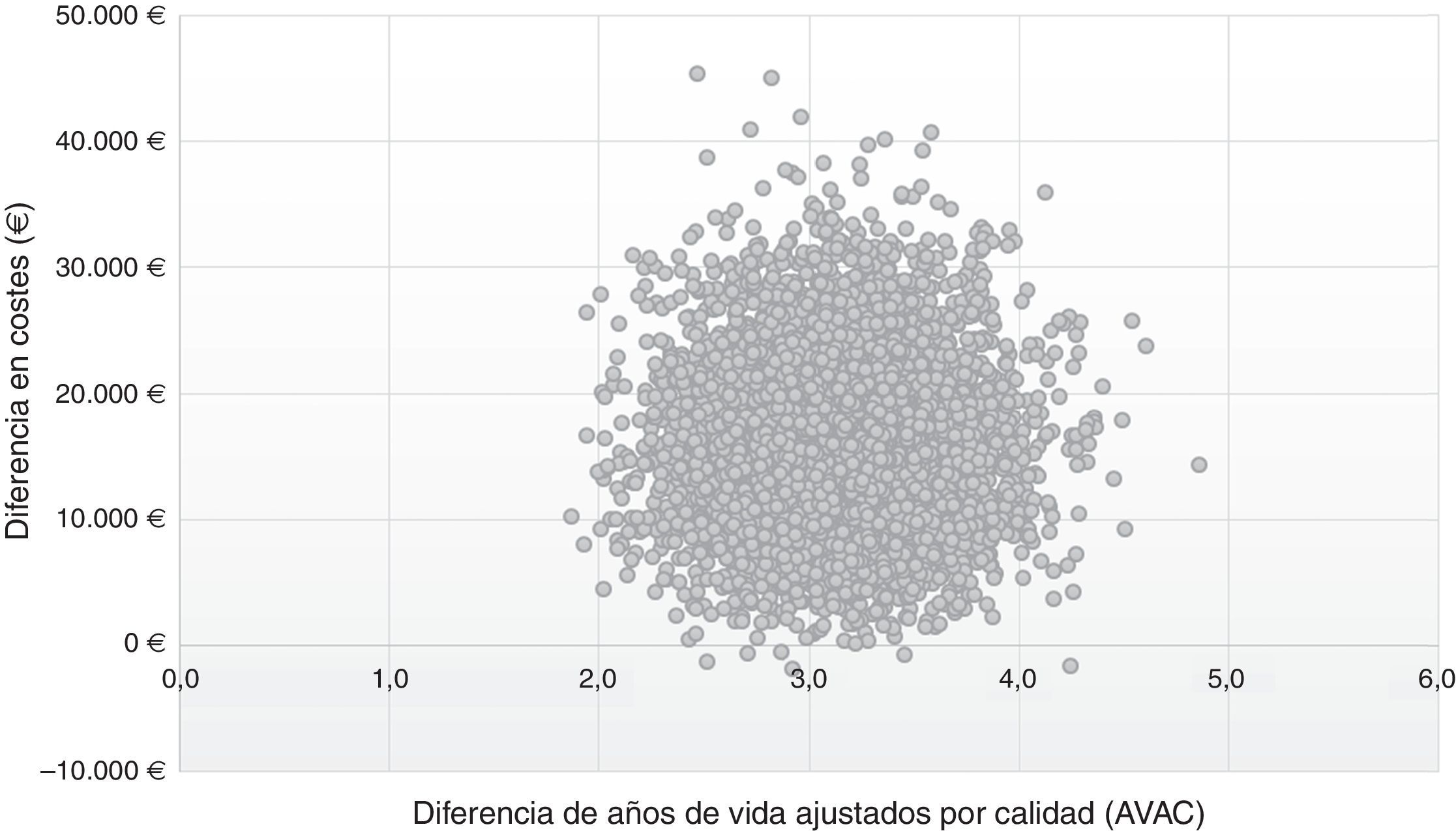
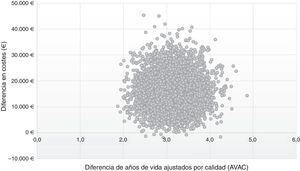
En el plano coste-efectividad (fig. 3) se muestran los resultados de los 10.000 remuestreos realizados en el ASP. En el 99% de los casos, los valores se sitúan en el cuadrante i, lo que muestra que la estrategia post-AAD es coste-efectiva, más efectiva, aunque con un mayor coste promedio por paciente que la estrategia pre-AAD; mientras que en el 1% se situó en el cuadrante ii, en el que la estrategia post-AAD es coste-efectiva y además supone un menor coste, que la estrategia pre-AAD.
DiscusiónEl presente análisis coste-efectividad muestra que las nuevas alternativas terapéuticas basadas en AAD consiguen incrementar los resultados en salud y la calidad de vida de los pacientes con HCC de una forma eficiente. Es decir, la inversión adicional realizada para garantizar el acceso de los pacientes a estos nuevos fármacos, analizada a largo plazo, está muy por debajo de la disponibilidad a pagar o umbral de eficiencia del Sistema Nacional de Salud en España cuando se compara con las estrategias anteriores, basadas en doble o triple terapia con peginterferón, ribavirina, telaprevir o boceprevir.
La inclusión de nuevos tratamientos en el arsenal terapéutico mejora los resultados en salud para los pacientes, pero se acompaña generalmente de un aumento del gasto farmacéutico directamente asociado al tratamiento. En el presente análisis, la estrategia post-AAD, en comparación con los tratamientos utilizados anteriormente, supone un incremento en el coste global asociado al manejo de la HCC. Dicho incremento se deriva de un mayor coste farmacológico así como por el importante incremento en el número de pacientes que han tenido acceso al tratamiento como consecuencia de la introducción de las nuevas estrategias terapéuticas con una mayor efectividad y tolerabilidad (el 19% de los pacientes tratados con la estrategia pre-AAD frente al 73% con la post-AAD)4,62. Sin embargo, cualquier evaluación económica del tratamiento de una enfermedad basada únicamente en los costes farmacológicos es incompleta y cortoplacista. Los pacientes no tratados también generan costes sanitarios directos asociados al consumo de recursos sanitarios necesarios para el tratamiento de las complicaciones derivadas de la progresión de la enfermedad hepática78. El coste promedio de un paciente no tratado en nuestro estudio, durante toda la simulación de la evolución de la HCC, representa aproximadamente 22.600€.
La relación coste-efectividad incremental de los AAD utilizados en el tratamiento de la HCC ha sido evaluada en numerosos estudios recientes, y la mayoría de ellos concluyen que los nuevos AAD son tratamientos coste-efectivos79–84. Sin embargo, son pocos los estudios publicados que analizan lo que supone la incorporación de los nuevos AAD desde un punto de vista de impacto económico y política sanitaria/salud pública85–87, y hasta la fecha no hay estudios publicados que se hayan realizado en el contexto español. Este análisis presenta una novedad respecto a los análisis coste-efectividad de AAD previamente publicados en nuestro país, ya que evalúa el impacto económico y clínico del primer año de implantación de la estrategia incluida en el PEACH para el tratamiento de los pacientes con HCC (≥F2) y su viabilidad o proyección a largo plazo. Aunque no podamos comparar directamente nuestro estudio con otros previamente publicados debido a las diferencias en la metodología, y sobre todo por tratarse de estudios realizados en otros países donde los costes tanto farmacológicos como sanitarios son diferentes y no comparables, sí podemos establecer algunas similitudes con relación al impacto que suponen los nuevos AAD en lo referente a la carga de la enfermedad y al gasto sanitario (coste promedio por paciente). En este sentido, los resultados de nuestro estudio son acordes al resto de análisis reflejando la eficiencia de los AAD frente a las antiguas terapias.
Los nuevos regímenes de AAD se caracterizan por su elevada efectividad con tasas de RVS superiores al 95% en la mayoría de los pacientes, y un excelente perfil de seguridad que permite que, en la práctica, cualquier paciente sea candidato a recibir tratamiento antiviral para eliminar la infección por el VHC88. Es evidente que la cuestión sobre qué pacientes deberían tener acceso a los nuevos AAD y cuándo es el momento idóneo para tratar a los pacientes con HCC genera controversia. El PEACH prioriza la administración del tratamiento en pacientes con fibrosis significativa (≥F2), pero contempla el acceso a pacientes con fibrosis leve (F0 o F1) en diversas situaciones. Varios estudios que evalúan la efectividad de los nuevos fármacos administrados en estados iniciales de fibrosis frente a fibrosis avanzada concluyen que el tratamiento precoz es más coste-efectivo y tiene mayores beneficios en salud en comparación a tratar en estados más avanzados de fibrosis66,83,85,86,89–91. Garantizar el acceso a los nuevos AAD a un mayor número de pacientes permitiría reducir con mayor rapidez la prevalencia de la infección por VHC en nuestra población, con el beneficio adicional que supondría la reducción de la transmisión de la infección por VHC debido a una disminución de nuevos casos de contagio de la enfermedad a nivel poblacional demostrada en un estudio reciente92,93.
Nuestro estudio tiene algunas limitaciones. En primer lugar, los parámetros utilizados en la modelización han sido extraídos de diferentes fuentes. Sin embargo, todas las variables están basadas en fuentes oficiales publicadas por el Ministerio de Sanidad, Servicios Sociales e Igualdad o en publicaciones con un elevado nivel de evidencia clínica.
En segundo lugar, por falta de disponibilidad de datos, se consideró que todos los pacientes tratados finalizan su tratamiento y tampoco se incluyó la posibilidad de que los pacientes que fracasaran pudieran recibir un eventual retratamiento. En la práctica real, algunos de estos pacientes podrían no finalizar la terapia debido a la aplicación de reglas de parada basadas en una escasa respuesta virológica (escenario pre-AAD) o a la aparición de efectos adversos. Ambas situaciones son más frecuentes en el escenario pre-AAD en el que globalmente un 13-21%21,23,28,94,95 de los pacientes no completaban el tratamiento, en comparación con el 0-2% con las combinaciones actuales29,30,38,39,47,56. Si esto se hubiera tenido en cuenta, el coste farmacológico podría haber disminuido pero, al ser pacientes con peor estado de salud, el coste del manejo de la enfermedad podría verse incrementado96. Desde el punto de vista de las conclusiones del estudio, esta aproximación conservadora favorece a la estrategia pre-AAD e infraestima, en cierta, medida la RCEI favorable a la estrategia post-AAD. Por otro lado, en el análisis no se han considerado directamente los acontecimientos adversos de las distintas estrategias terapéuticas evaluadas, aunque en el modelo se han incluido las desutilidades97 para analizar los cambios en el estado de salud de los pacientes a causa de tener más o menos efectos adversos.
En tercer lugar, el estudio se ha realizado desde la perspectiva del Sistema Nacional de Salud y no de la perspectiva social, por tanto, no se ha considerado la pérdida de productividad en pacientes con HCC y los costes futuros no relacionados con la enfermedad. Estos pacientes, debido al manejo clínico de la enfermedad, se ausentan numerosas horas de sus puestos de trabajo. Diversos estudios manifiestan que el absentismo y el presentismo laboral de un paciente con HCC en España supondría un coste anual total98 significativo de 2.395€. La mayor efectividad y seguridad de los nuevos AAD supone una mejoría en la productividad laboral de estos pacientes, reduciendo con ello los costes relacionados con la pérdida de productividad desde el punto de vista de la sociedad española98,99. La inclusión de la perspectiva social en el modelo previsiblemente incrementaría el coste promedio por paciente de la estrategia pre-AAD, aunque sería necesario un estudio específicamente diseñado desde la perspectiva social para cuantificar las diferencias entre ambas estrategias de tratamiento.
En cuarto lugar, por falta de datos de eficacia en cohortes de vida real desglosados para todos los tratamientos, y para cada genotipo y estado de fibrosis, las tasas de RVS asociadas al análisis provienen de ensayos clínicos. A pesar de ello, los resultados de las tasas de RVS globales obtenidos en el árbol de decisión para pacientes con fibrosis≥F2 son similares a los resultados de revisiones sistemáticas publicadas o metaanálisis que evalúan la respuesta en función de diferentes genotipos y grado de fibrosis8,88,100,101.
En quinto lugar, en nuestro análisis, para el cálculo del coste del tratamiento se consideraron dos fuentes públicas con datos estimados del coste farmacológico global generado por los AAD en el año 2015 y el número de pacientes tratados en el mismo año. Para evaluar la sensibilidad del análisis a este parámetro, se realizó un ASD aumentando y disminuyendo el coste farmacológico de ambas estrategias. Los resultados mostraron que si el precio de los fármacos fuera menor se reduciría el RCEI, lo que supondría una reducción del coste global generado por el manejo de la enfermedad.
A pesar de las limitaciones descritas, los resultados de los análisis de sensibilidad confirmaron que la incertidumbre asociada a los parámetros utilizados en la modelización no supuso una desviación importante respecto a los resultados obtenidos en el caso base, siendo la estrategia post-AAD una opción coste-efectiva en todas las simulaciones con ratios por debajo del umbral de eficiencia102,103 utilizado entre 20.000-30.000€ en España, lo que avala la conclusión de que la estrategia basada en el tratamiento con AAD (post-AAD) es una opción muy eficiente en comparación con la estrategia pre-AAD en España. Estudios previos han demostrado que curar la HCC en etapas tempranas es más coste-efectiva y tiene mayores beneficios para la salud a nivel poblacional en comparación con las estrategias basadas en el tratar solo en fases más avanzadas. Junto con los resultados de este análisis, la evidencia indica que el acceso universal al tratamiento, independientemente del grado de fibrosis, podría ser una estrategia más eficiente que la práctica actual. Deberían hacerse estudios adicionales para confirmar esta teoría.
Conflicto de interesesJuan Turnes ha recibido una financiación no condicionada a resultados de Gilead Sciences, para el desarrollo del proyecto.
Raquel Domínguez-Hernández y Miguel Ángel Casado son empleados de Pharmacoeconomics & Outcomes Research Iberia (PORIB), una consultora especializada en Evaluación Económica de Intervenciones Sanitarias que ha recibido una financiación no condicionada a resultados de Gilead Sciences, para el desarrollo del proyecto.