La anemia ferropénica es la forma más frecuente de anemia. Puede causar astenia, deterioro cognitivo y funcional y descompensar las enfermedades de base. No es una enfermedad, sino la consecuencia de un problema médico potencialmente grave, por lo que siempre debe investigarse la causa subyacente; en varones y mujeres posmenopáusicas es la pérdida digestiva y la malabsorción de hierro. En este grupo se aconseja una gastroscopia, una colonoscopia y una serología de celiaquía. Si los resultados son negativos deberá valorarse la repetición de exploraciones y se acepta una pauta de tratamiento con hierro. En caso de refractariedad o recidiva de la anemia debe ser investigado el intestino delgado. En este caso la cápsula endoscópica es la exploración de elección. En todos los casos debe tratarse la anemia ferropénica hasta la normalización de los depósitos, para lo cual disponemos de una gran variedad de formas de hierro oral y parenteral.
Iron deficiency anemia is the most common type of anemia and can cause asthenia, cognitive and functional impairment, and decompensation of underlying diseases. Iron deficiency anemia is not a disease but is the result of a potentially serious medical problem. Consequently, patients should always undergo investigation of the underlying cause. In men and postmenopausal women, the condition is caused by gastrointestinal loss and malabsorption of iron. In this group, recommended procedures are gastroscopy, colonoscopy and serological testing for celiac disease. If the results of these tests are negative, repeat examinations and iron therapy should be considered. In treatment-refractory or recurrent anemia, the small intestine should be investigated. In this case, the procedure of choice is capsule endoscopy. Iron deficiency anemia should always be treated until iron deposits have returned to normal levels. A wide variety of preparations are available, in both oral and parental formulations.
La anemia ferropénica (AF) es la causa de anemia más frecuente en el mundo. Su prevalencia presenta una enorme variación geográfica, siendo menor del 10% en el norte de América y Europa y mayor del 50% en África y el sur de Asia. En nuestro medio se observa en el 2 al 5% de la población 1. En individuos mayores de 65 años entre un 36 a 70% de los diagnósticos de anemia crónica se deben a ferropenia2. En las áreas de hospitalización por causa digestiva la prevalencia de AF es de hasta un 60%3. Así mismo, la AF es una causa frecuente de derivación al especialista de gastroenterología por ser el indicio de una enfermedad potencialmente grave4.
ClínicaLa AF, con frecuencia, es asintomática y puede ser detectada en una analítica rutinaria. Puede manifestarse como astenia, descompensación de las enfermedades de base del paciente (insuficiencia cardíaca, bronquitis crónica) o un deterioro cognitivo (especialmente en población anciana). La ferropenia, incluso sin anemia, se ha relacionado con un menor rendimiento físico y mental5,6. También se ha asociado con la aparición de membranas esofágicas, trastornos de la conducta alimentaria (pica) o el síndrome de las piernas inquietas.
Definición y diagnóstico de ferropenia y anemia ferropénica (tabla 1)La Organización Mundial de la Salud define anemia como una concentración de hemoglobina inferior a 130g/l en varones, 120g/l en mujeres no embarazadas y 110g/l en mujeres embarazadas1.
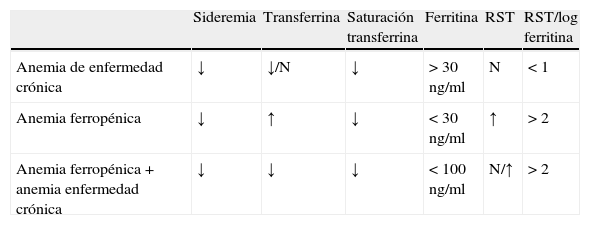
Diagnóstico diferencial de la anemia ferropénica
| Sideremia | Transferrina | Saturación transferrina | Ferritina | RST | RST/log ferritina | |
| Anemia de enfermedad crónica | ↓ | ↓/N | ↓ | >30 ng/ml | N | <1 |
| Anemia ferropénica | ↓ | ↑ | ↓ | <30 ng/ml | ↑ | >2 |
| Anemia ferropénica+anemia enfermedad crónica | ↓ | ↓ | ↓ | <100 ng/ml | N/↑ | >2 |
RST: receptor soluble de la transferrina
Ferropenia es un déficit del hierro corporal total. Existe AF cuando la ferropenia es lo suficientemente intensa y prolongada como para disminuir la eritropoyesis y causar un defecto en la síntesis de hemoglobina produciendo unos eritrocitos más pequeños (microcitosis) y con menor cantidad de Hb (hipocromos).
El patrón oro para el diagnóstico de ferropenia se establece mediante la determinación del hierro en la médula ósea. La presencia <10% de normoblastos teñidos mediante el azul de Prusia es diagnóstico de ferropenia7. Se trata de una prueba invasiva, hecho que limita su utilidad en la práctica clínica.
La microcitosis y la hipocromía son indicadores sensibles de ferropenia en ausencia de enfermedad crónica o coexistencia de un déficit de B12 o folatos. No obstante, debe hacerse el diagnóstico diferencial con la talasemia, la anemia sideroblástica y la anemia por enfermedad crónica.
Un nivel bajo de saturación de transferrina, sideremia y ferritina también se asocia a la AF. El dato más específico de AF es la ferritina. La concentración de ferritina es proporcional a los niveles de hierro corporal y se considera el mejor test no invasivo para detectar ferropenia. Unos niveles menores de entre 12 y 15mg/l se consideran patognomónicos de ferropenia8,9. Sin embargo, su sensibilidad es baja, especialmente en población anciana. La síntesis de ferritina puede verse aumentada por el efecto de algunas citoquinas, como la IL-1, actuando como un reactante de fase aguda. Así, en presencia de una neoplasia, una infección o inflamación, el punto de corte de ferritina en sangre para definir ferropenia podría ser de 50mg/l o incluso mayor. En estas circunstancias se ha sugerido calcular el cociente entre la concentración del receptor soluble de la transferrina y el logaritmo de la ferritina sérica, cuya sensibilidad para la detección de AF es del 88%7,10. Un resultado <1 sugiere anemia de la enfermedad crónica sin ferropenia, mientras que una proporción >2 indica ferropenia con o sin anemia de la enfermedad crónica11.
Como alternativa en situaciones dudosas se aconseja un ensayo con hierro oral o intravenoso (en caso de mala tolerancia o sospecha de mala adherencia) durante 3 semanas. Un aumento de la hemoglobina corpusular media en los siguientes 7 días apoyaría el diagnóstico de AF.
Metabolismo del hierroEn condiciones normales la eritropoyesis precisa 25mg diarios de hierro12. La mayor fuente de hierro es proporcionada por los macrófagos que reciclan el hierro procedente de los eritrocitos destruidos. Por otro lado, a diario consumimos alrededor de 10mg de hierro en la dieta. De estos solo el 10% es absorbido a través de los enterocitos. El hierro dietético se encuentra en forma ferrosa y, mayoritariamente, en forma férrica. Este último debe ser reducido a hierro ferroso para poder ser absorbido. De este modo, podrá atravesar el borde en cepillo de los enterocitos a través del transportador Divalent Metal Iron Transporter 1 (DMT1), proteína con un dominio transmembrana que transporta metales divalentes como el hierro, el cobalto, el manganeso o el cinc13. La transferrina, una glucoproteína de 79,6KDa, será la responsable de su transporte en el plasma. El exceso de hierro se almacenará en su proteína de almacenaje, la ferritina. La ferritina es una glucoproteína formada por 24 subunidades unidas entre sí por enlaces no covalentes, de forma esferoidal. En su interior caben hasta 4.500 átomos de hierro. Cuando el hierro es necesario para la eritropoyesis será transferido a través de la membrana basolateral del enterocito mediante la ferroportina13 y entregado a los eritroblastos a través del receptor de la transferrina. En situaciones de ferropenia se produce una disminución de la síntesis de hemoglobina, un aumento del número de mitosis de eritroblastos que conducen a la microcitosis e hipocromía14.
La hepcidina es una hormona de síntesis hepática15 cuya misión es inhibir la absorción intestinal del hierro y bloquear las reservas del hierro macrofágico para prevenir la sobrecarga férrica del organismo. La hepcidina se une a la ferroportina induciendo su degradación y disminuyendo el hierro a transferir desde los enterocitos, macrófagos y el hierro almacenado de los hepatocitos al plasma sanguíneo. Así, la hepcidina actuaría como un controlador negativo. La producción de hepcidina depende de los niveles de sideremia y las necesidades de eritropoyesis. La producción de hepcidina disminuye en la AF, en una anemia aguda por hemorragia o en la anemia hemolítica. Al disminuir la hepcidina se incrementa la absorción intestinal de hierro y la liberación de hierro desde los depósitos.
Déficit funcional de hierroEn la anemia de las enfermedades crónicas (artritis reumatoide, enfermedad inflamatoria intestinal, etc.), debido al estímulo de algunas citoquinas (IL-6) se produce una sobreexpresión de la hepcidina16. Ello conduce a un secuestro del hierro hepatocitario y macrofágico y a una disminución de la absorción intestinal de hierro. Se produce, por lo tanto, una AF funcional, ya que la reserva de hierro no está disponible para la eritropoyesis16.
Estudio etiológico de la Anemia FerropénicaHistoria clínica y exploración físicaEn primer lugar debe realizarse una adecuada anamnesis dirigida a detectar una dieta pobre en hierro, investigar el consumo de anticoagulantes, antiinflamatorios no esteroideos o antiagregantes; antecedentes familiares de enfermedad inflamatoria intestinal, neoplasias del tracto gastrointestinal, enfermedad celiaca, talasemia, Rendu Osler Weber, etc. Debe descartarse la presencia de masas abdominales o lesiones cutáneas (por ejemplo telangiectasias).
La presencia de determinados síntomas guía evidentes, como la rectorragia, el dolor epigástrico, la hematuria macroscópica, las metrorragias, etc. implicarán dirigir el estudio hacia ese signo guía. Esta revisión se centrará en aquellos pacientes que tienen como signo guía la AF.
Sedimento de orinaSe considerará la realización de un sedimento de orina para descartar un origen urinario que es la causa del 1% de todas la AF (fundamentalmente tumores del tracto urinario)17.
Serología de enfermedad celiacaLa probabilidad de presentar una enfermedad celiaca en pacientes con AF como único signo en pacientes asintomáticos es del 5%. Por ello, se aconseja realizar una determinación de anticuerpos antitransglutaminasa9.
En caso de serología negativa, si no existen otros síntomas abdominales (diarrea crónica, distensión abdominal), la probabilidad de padecer una enfermedad celiaca es muy baja (en torno al 0,3%)18, por lo que se desaconseja realizar biopsias duodenales por su baja rentabilidad.
En caso de serología positiva se realizará una endoscopia alta para tomar biopsias duodenales y confirmar el diagnóstico. En este caso no se investigarán otras causas de anemia, a excepción de si existen factores de riesgo adicionales (por ejemplo edad superior a los 50 años, antecedentes familiares de primer grado de cáncer colorrectal).
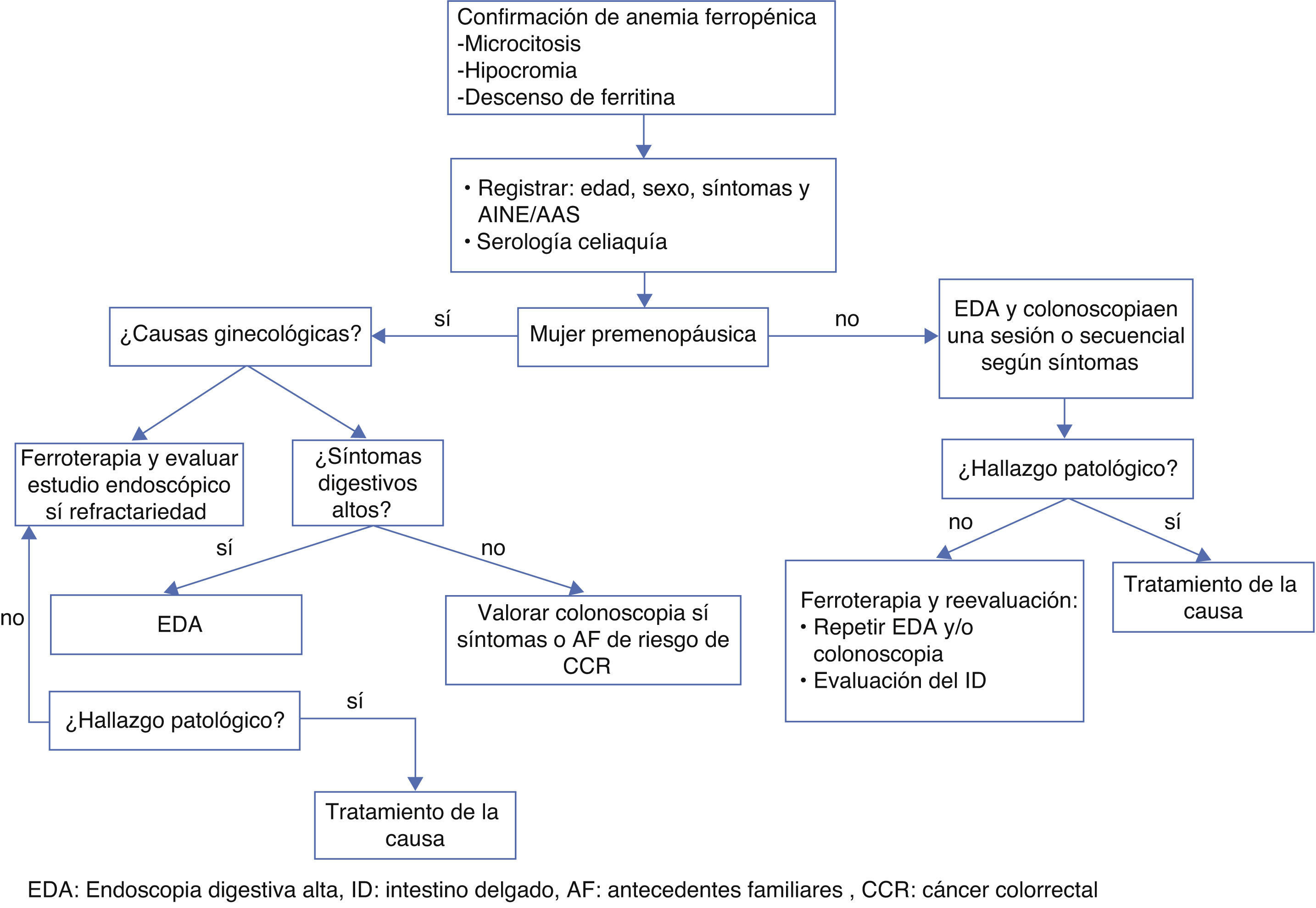
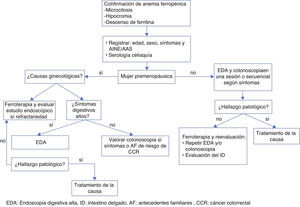
Estudio de anemia ferropénica en mujeres premenopáusicas (fig. 1)La AF se produce en un 5-12% de mujeres premenopáusicas19, fundamentalmente debida a las pérdidas menstruales, el déficit nutricional o el incremento de la demanda durante el embarazo y la lactancia20. Las pérdidas por causas gastrointestinales son infrecuentes (13-30%) y la tasa de tumores malignos (gástrico o colorrectal) es <3%.
En los casos de AF de origen gastrointestinal las causas más frecuentes son del tracto digestivo alto: infección por Helicobacter pylori (9-47%), la gastritis por AINE y la gastritis atrófica (10%) y la enfermedad celiaca (2-17%). Otras causas menos frecuentes son la esofagitis (1-7%) y el cáncer gástrico (0-3%). Entre las lesiones colónicas destaca la enfermedad inflamatoria intestinal y los pólipos, siendo muy infrecuente el cáncer colorrectal21.
El rendimiento diagnóstico de las diferentes exploraciones en mujeres premenopáusicas no ha sido adecuadamente evaluado. Por este motivo, actualmente, no existe consenso sobre qué exploraciones realizar y en qué orden deben solicitarse. Las guías clínicas9 recomiendan realizar a las mujeres premenopáusicas con AF una serología de enfermedad celiaca y una evaluación de los síntomas.
Se considerará realizar una endoscopia digestiva alta en caso de presentar factores de riesgo adicionales, como una edad >40 años, ausencia de una pérdida de sangre menstrual abundante, hemoglobina <10g/dl, demostración de pérdidas de sangre en las heces (test del guayaco), síntomas abdominales, pérdida de peso o la falta de respuesta a la suplementación con hierro22,23.
La colonoscopia debe reservarse a mujeres con síntomas colónicos y antecedentes familiares de primer grado de cáncer colorrectal24, o en casos de AF persistente después de la suplementación de hierro y corrección de las posibles pérdidas.
Estudio de anemia ferropénica en mujeres posmenopáusicas y varones (fig. 1)En este grupo la causa más frecuente de AF es la pérdida crónica a través del tubo digestivo y la malabsorción del hierro de la dieta (enfermedad celiaca, gastrectomizados, gastritis atrófica)25 (tabla 2). En estos casos, además del despistaje de la enfermedad celiaca se deberán realizar estudios adicionales.
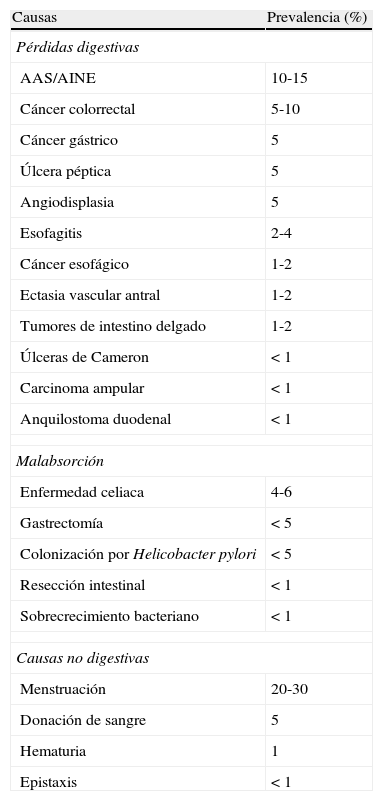
Causas de anemia ferropénica
| Causas | Prevalencia (%) |
| Pérdidas digestivas | |
| AAS/AINE | 10-15 |
| Cáncer colorrectal | 5-10 |
| Cáncer gástrico | 5 |
| Úlcera péptica | 5 |
| Angiodisplasia | 5 |
| Esofagitis | 2-4 |
| Cáncer esofágico | 1-2 |
| Ectasia vascular antral | 1-2 |
| Tumores de intestino delgado | 1-2 |
| Úlceras de Cameron | <1 |
| Carcinoma ampular | <1 |
| Anquilostoma duodenal | <1 |
| Malabsorción | |
| Enfermedad celiaca | 4-6 |
| Gastrectomía | <5 |
| Colonización por Helicobacter pylori | <5 |
| Resección intestinal | <1 |
| Sobrecrecimiento bacteriano | <1 |
| Causas no digestivas | |
| Menstruación | 20-30 |
| Donación de sangre | 5 |
| Hematuria | 1 |
| Epistaxis | <1 |
AAS aspirina; AINE antiinflamatorios no esteroideos.
Adaptado de Goddard et al.9
La endoscopia digestiva alta y la colonoscopia son las exploraciones de referencia para el estudio de AF. Tiene ventajas sobre la radiología, ya que permite identificar lesiones superficiales (erosiones o angiodisplasias), tomar biopsias y, en algunos casos, realizar el tratamiento (polipectomía, coagulación con argón, etc.). La combinación de endoscopia alta y colonoscopia permite identificar el origen de la AF en un 60 a 70%26–28. Las lesiones altas son más frecuentes que las bajas26. La presencia de una neoplasia digestiva en pacientes con AF varía entre el 10-17%26,27,29 (tabla 1).
La coexistencia de lesiones altas y bajas es poco frecuente. No obstante, dado que no disponemos de parámetros fiables para guiar el estudio endoscópico, en general, se aconseja realizar una endoscopia digestiva alta y una colonoscopia como exploraciones de primera línea, a menos que exista una causa clara de pérdidas extradigestivas (por ejemplo metrorragia abundante, hematuria, etc.)9. En caso de ausencia de síntomas guía parece adecuado realizar ambas exploraciones en una misma sesión endoscópica para acelerar el proceso diagnóstico y reducir el tiempo hospitalario. En el momento de la endoscopia digestiva alta, si la serología para enfermedad celiaca ha sido positiva (o si no disponemos de ella) se realizarán biopsias duodenales. La infección por H. pylori se ha asociado a una reducción de la absorción del hierro y a un incremento de las pérdidas del mismo30,31 y su erradicación podría revertir algunos casos de AF32. Por ello, podría aprovecharse el momento de la endoscopia para realizar un test rápido de ureasa para la detección de la infección por Helicobacter pylori. Por último, dado que la gastritis autoinmune puede cursar con anemia ferropénica hasta en el 25% de los casos33,34, sería útil realizar biopsias gástricas durante la exploración para descartar este diagnóstico.
El test de sangre oculta en heces mediante la reacción del guayaco (test químico) ha sido evaluado como estrategia para dirigir el estudio endoscópico sin obtener beneficios debido a su baja sensibilidad y especificidad2,35,36. No obstante, recientemente hemos evaluado el valor de la concentración de hemoglobina fecal mediante un test de sangre oculta en heces inmunológico cuantitativo (TSI). Se trata de un anticuerpo específico dirigido contra la globina humana. Esta proteína es digerida por las enzimas digestivas, por lo que los sangrados ocultos procedentes del tracto superior no son detectados por el TSI, a diferencia de los sangrados procedentes del colon. Rodríguez-Alonso evaluó una población de 124 varones y mujeres posmenopáusicas mediante un TSI, una endoscopia digestiva alta y una colonoscopia. La práctica de una endoscopia alta+TSI y supeditar la práctica de la colonoscopia a la demostración de una concentración de hemoglobina fecal >50ugHb/g de heces permitía diagnosticar el 100% de las neoplasias, el 91% del total de lesiones con una reducción del coste por lesión detectada del 50% a expensas del ahorro en colonoscopias26. La validación de estos resultados podría ayudar a dirigir el estudio endoscópico inicial.
En caso de que las exploraciones endoscópicas hayan resultado negativas, una estrategia aceptada sería corregir los déficits dietéticos, suspender (si es posible) el tratamiento con AINE o antiagregantes, realizar una pauta de tratamiento con hierro y monitorizar los niveles de hemoglobina y ferritina. Si el paciente presenta una respuesta adecuada, sin recidiva de la AF, parece seguro no realizar nuevas exploraciones37–40. En caso de una respuesta inadecuada o rápida recidiva de la AF deberá plantearse el estudio del intestino delgado41,42, que consideramos en el contexto de la evaluación de una hemorragia digestiva de origen oscuro oculta.
Hemorragia digestiva de origen oscuro ocultaEn caso de no obtener el diagnóstico mediante el estudio endoscópico alto y bajo nos enfrentamos a un desafío clínico que denominamos hemorragia digestiva de origen oscuro (HDOO) oculta. Se trata de la existencia de pérdidas digestivas sin exteriorizar sangre de forma evidente, es decir, sin episodios de melenas ni hematoquecia; en contraposición de la HDOO clínicamente manifiesta. La repetición de exploraciones podría identificar hasta un 10% de lesiones adicionales en el tracto gastrointestinal superior, y hasta un 7% en el colon43,44 aunque podría depender de la calidad de las exploraciones. Las lesiones más frecuentemente inadvertidas son las de origen vascular. Un estudio demostró que la repetición de las exploraciones solo identificaba una posible causa de la AF en el 4% de los casos45. Teniendo en cuenta esto debe considerarse cuidadosamente la necesidad de repetir exploraciones, especialmente si no se realizaron en condiciones óptimas. En caso contrario, debería valorarse el estudio del intestino delgado.
Exploraciones radiológicasLa enterografía TC y la entero RMN permiten visualizar la totalidad de la pared intestinal y no solo la superficie de la mucosa, por lo que resultan útiles en el caso de sospecha de enfermedad inflamatoria intestinal o para detectar tumores del intestino delgado. Sin embargo, la mayor parte de las lesiones del intestino delgado que causan AF asintomática son lesiones mucosas o lesiones planas, no detectables mediante las exploraciones radiológicas. Un estudio prospectivo mostró que el rendimiento diagnóstico de la entero TC en pacientes con HDOO fue del 26,7%46. No obstante, solo resultó útil en aquellos casos de HDOO clínicamente manifiesta (que habían presentado melenas o hematoquecia) y no aportó ningún diagnóstico en los casos de HDOO oculta46.
EnteroscopiaActualmente disponemos de enteroscopia de pulsión y con balón. La enteroscopia de pulsión permite identificar el origen de las pérdidas hemáticas en el 30-50% de los pacientes con una EDA y colonoscopia previa normal47. Sin embargo, la enteroscopia es un procedimiento invasivo, requiere sedación profunda, y rara vez explora más de un tercio de la longitud total del intestino delgado. Los enteroscopios con uno o 2 balones permiten la exploración de parte o el total del intestino delgado. Se puede realizar por vía anal u oral. Su rendimiento diagnóstico es mayor que el del enteroscopio de pulsión. La principal ventaja de la enteroscopia es la posibilidad de un diagnóstico histológico (toma de biopsias) y de realizar tratamiento en el mismo procedimiento (argón plasma, polipectomía, etc.). Por otro lado, un estudio retrospectivo observó que el tratamiento de las lesiones detectadas durante la enteroscopia se asociaba a la ausencia de recidiva de la AF en el 71% de los pacientes48. Por otro lado, aquellos individuos con enteroscopia normal no presentaban reaparición de la AF, por lo que se aconsejaba no realizar nuevas exploraciones48.
Cápsula endoscópicaLa cápsula endoscópica (CE) tiene un rendimiento diagnóstico del 63%49 en la HDOO, aunque existen grandes diferencias si el estudio se realiza por una HDOO clínicamente manifiesta (92,3%) o una HDOO oculta (44,2%)50. La CE tiene la ventaja de no ser invasiva. Sin embargo, con frecuencia la detección de una lesión no implica un beneficio terapéutico (especialmente si la indicación es AF)51. Las lesiones más habitualmente identificadas por la CE son las angiodisplasias (29-40%) y las úlceras (7%); menos frecuentemente tumores, divertículo de Meckel y varices intestinales52,53. Un estudio que comparó la CE y la enteroscopia obtuvo que la primera tenía mayor rendimiento diagnóstico54.
En caso de que la CE sea normal no se ha demostrado que la enteroscopia aporte ningún beneficio adicional. Por ello, en pacientes con endoscopia digestiva alta y colonoscopia normales se recomienda realizar una CE como primera exploración y solo realizar la enteroscopia para buscar lesiones detectadas por la CE55.
Pacientes con comorbilidad significativaCon frecuencia, los pacientes con comorbilidades tienen anemia de origen multifactorial. Esta se relaciona con sus enfermedades de base y, a su vez, la anemia causa el deterioro de las mismas56. Por otro lado, los pacientes frágiles deben ser evaluados de forma individualizada. Debe considerase la gravedad de la anemia y su respuesta al tratamiento médico, la posibilidad de tolerar estudios endoscópicos y si van a ser tributarios de tratamientos agresivos en caso del diagnóstico de una enfermedad neoplásica. En pacientes frágiles o de edad muy avanzada con sospecha de neoplasia digestiva podrían beneficiarse de una TC abdominopélvica como exploración inicial.
Anemia ferropénica de causa genéticaSe trata de una rara enfermedad autosómica recesiva que afecta a <1/1.000.000 individuos. La llamada iron-refractory iron deficiency anaemia (IRIDA) se caracteriza por presentar parámetros de anemia ferropénica sin poder demostrar pérdidas hemáticas ni malabsorción de hierro. Se produce por la mutación del gen TMPRSS6 que codifica una serinproteasa transmembrana tipo ii de síntesis hepática que regula la expresión de la hepcidina. Ello conduce a una sobreproducción de hepcidina que causa un defecto en la absorción y utilización del hierro57. En este caso los suplementos de hierro oral no son útiles y el hierro parenteral es parcialmente efectivo.
Tratamiento de la anemia ferropénicaEl abordaje terapéutico de la AF debe basarse en el tratamiento de la causa desencadenante y en los suplementos de hierro. El tratamiento de la causa subyacente evitará pérdidas adicionales de hierro (por ejemplo aplicación de argón plasma en las angiodisplasias, erradicación de Helicobacter pylori, polipectomía endoscópica de adenomas, etc.). En segundo lugar, sea cual sea la causa, deberán administrarse suplementos de hierro para corregir las cifras de hemoglobina y los índices eritrocitarios y normalizar los depósitos corporales. Para calcular el déficit de hierro se utiliza la fórmula de Ganzoni: déficit de hierro (mg)=peso corporal (kg)×(hemoglobina objetivo–hemoglobina real)(g/dl)×2,4+ferritina (mg)58.
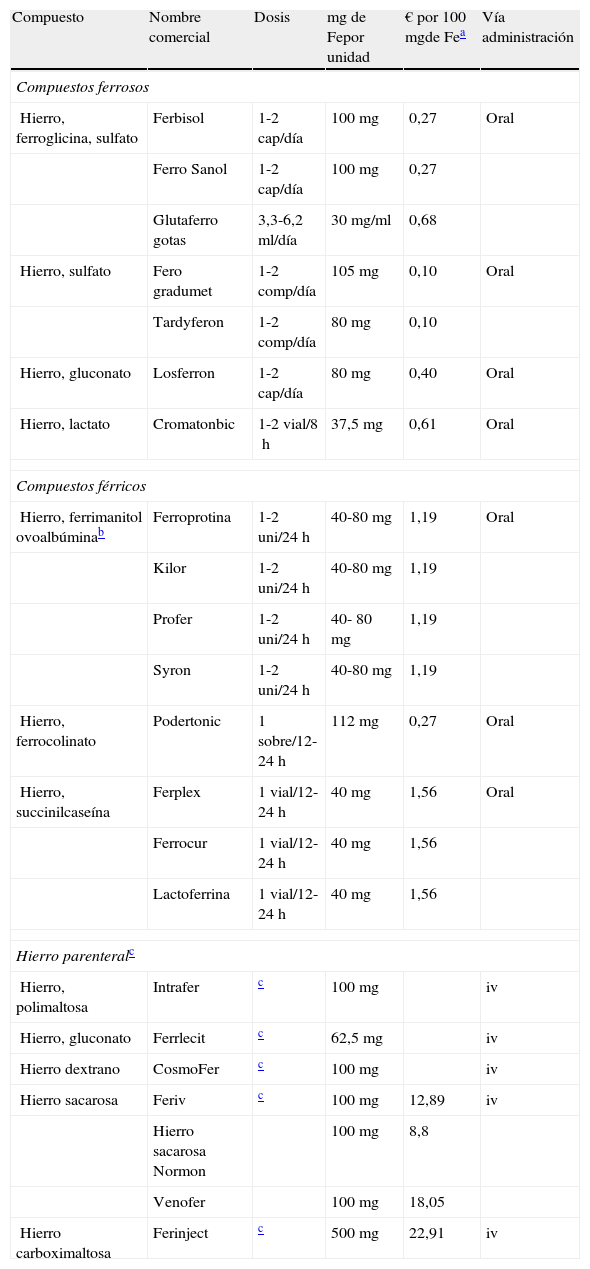
Suplementos de hierro oral (tabla 3)Es el tratamiento de elección, el más fácil y económico. Las sales ferrosas se consideran como los fármacos de primera línea. Estas se absorben mejor, disponen de más hierro elemental y son más económicas que las sales férricas. Un metaanálisis reciente halla que el sulfato ferroso con mucoproteasa (Tardyferon®) es el preparado con menores efectos secundarios gastrointestinales59. Se desaconseja la administración rutinaria de hierro asociado a otras sustancias (por ejemplo B12, polivitamínicos), ya que pueden dificultar la interpretación de la respuesta terapéutica, son más caros y la cantidad de hierro elemental puede ser insuficiente.
Tratamiento con hierro oral e intravenoso
| Compuesto | Nombre comercial | Dosis | mg de Fepor unidad | € por 100mgde Fea | Vía administración |
| Compuestos ferrosos | |||||
| Hierro, ferroglicina, sulfato | Ferbisol | 1-2 cap/día | 100mg | 0,27 | Oral |
| Ferro Sanol | 1-2 cap/día | 100mg | 0,27 | ||
| Glutaferro gotas | 3,3-6,2 ml/día | 30mg/ml | 0,68 | ||
| Hierro, sulfato | Fero gradumet | 1-2 comp/día | 105mg | 0,10 | Oral |
| Tardyferon | 1-2 comp/día | 80mg | 0,10 | ||
| Hierro, gluconato | Losferron | 1-2 cap/día | 80mg | 0,40 | Oral |
| Hierro, lactato | Cromatonbic | 1-2 vial/8h | 37,5mg | 0,61 | Oral |
| Compuestos férricos | |||||
| Hierro, ferrimanitol ovoalbúminab | Ferroprotina | 1-2 uni/24h | 40-80mg | 1,19 | Oral |
| Kilor | 1-2 uni/24h | 40-80mg | 1,19 | ||
| Profer | 1-2 uni/24h | 40- 80mg | 1,19 | ||
| Syron | 1-2 uni/24h | 40-80mg | 1,19 | ||
| Hierro, ferrocolinato | Podertonic | 1 sobre/12-24h | 112mg | 0,27 | Oral |
| Hierro, succinilcaseína | Ferplex | 1 vial/12-24h | 40mg | 1,56 | Oral |
| Ferrocur | 1 vial/12-24h | 40mg | 1,56 | ||
| Lactoferrina | 1 vial/12-24h | 40mg | 1,56 | ||
| Hierro parenteralc | |||||
| Hierro, polimaltosa | Intrafer | c | 100mg | iv | |
| Hierro, gluconato | Ferrlecit | c | 62,5mg | iv | |
| Hierro dextrano | CosmoFer | c | 100mg | iv | |
| Hierro sacarosa | Feriv | c | 100mg | 12,89 | iv |
| Hierro sacarosa Normon | 100mg | 8,8 | |||
| Venofer | 100mg | 18,05 | |||
| Hierro carboximaltosa | Ferinject | c | 500mg | 22,91 | iv |
Los precios por cada 100mg de hierro elemental son aproximados. No debe realizarse una comparación directa entre preparados orales y endovenosos, dado que su biodisponibilidad es diferente.
Se recomiendan 2-3mg de hierro elemental/kg peso al día. Un tratamiento adecuado incrementará las cifras de hemoglobina alrededor de 2g/dl a las 3-4 semanas hasta normalizarse a las 8-10 semanas. La suplementación de hierro debe continuarse 3 meses más tras la normalización de las cifras de hemoglobina.
La administración conjunta con 250 a 500mg de ácido ascórbico mejora la absorción de hierro, aunque se desconoce su eficacia en el tratamiento de la anemia ferropénica y puede aumentar la intolerancia gástrica60. Clásicamente se administra en ayunas (una o 2h tras la ingesta), ya que numerosos alimentos interfieren en su absorción. Debe informarse a los pacientes que el hierro oral oscurece las heces.
La adherencia al tratamiento con hierro oral es relativamente baja debido a que su administración se ha asociado a efectos adversos hasta en un 20% de los pacientes. El efecto adverso más frecuente es la intolerancia digestiva en forma de náuseas, dolor abdominal, diarrea o estreñimiento. En estos casos debe ensayarse dosis menores, ya que mejoran la tolerancia y, por lo tanto, la adherencia al tratamiento61,62. En modelos animales de colitis experimental el hierro induce inflamación de la mucosa y la administración de hierro en pacientes con enfermedad inflamatoria intestinal se ha relacionado con un empeoramiento de los índices de actividad clínica63. Los efectos adversos son proporcionales a la cantidad de hierro elemental y no al tipo de preparado. Para mejorar la adherencia al tratamiento puede iniciarse en dosis menores (80-100mg) e incrementarse si existe una buena tolerancia. En caso contrario puede indicarse su administración con las comidas, asumiendo una menor absorción y, en consecuencia, un tratamiento más prolongado con el fin de mejorar la adherencia y evitar la administración parenteral.
Recientemente se ha comercializado una forma de hierro liposomal. Es un preparado de pirofosfato férrico revestido de una membrana fosfolipídica. Los escasos datos disponibles en la literatura sugieren una mayor biodisponibilidad y menor incidencia de efectos secundarios gastrointestinales64, si bien es pronto para poder realizar recomendaciones.
Hierro intravenosoEs la vía de administración reservada para casos de intolerancia o refractariedad al hierro oral. Los primeros preparados de hierro dextrano intravenoso eran capaces de restituir las concentraciones de hemoglobina y hierro en una sola infusión. Sin embargo, se comunicaron reacciones infusionales graves hasta en un 0,6-0,7%, con resultado de muerte en 31 casos entre el 1976 y 199665,66, hecho que motivó su retirada del mercado.
En España están comercializadas 2 formulaciones de hierro intravenoso. La más utilizada es el hierro sacarosa (Venofer) administrado en dosis de 200mg en una infusión de 150min. Es un fármaco bien tolerado, con una tasa de efectos adversos potencialmente graves muy baja (de 6 de cada 10 millones de dosis)67. La carboximaltosa férrica (Ferinject) tiene la ventaja de un tiempo de infusión muy corto (15min) y permite la administración de hasta 1g en 15min una vez por semana. La respuesta al tratamiento con carboximaltosa férrica es más rápida que con el sulfato ferroso oral. En pacientes con enfermedad inflamatoria intestinal la suplementación con carboximaltosa férrica endovenosa fue superior al tratamiento oral con preparados de sulfato ferroso, con una mayor tasa de respuesta, mayor rapidez en la recuperación de la anemia68, mejor tolerancia y mayor calidad de vida69. Así mismo, la carboximaltosa férrica ha demostrado su superioridad frente a los preparados orales en pacientes con insuficiencia renal crónica y en la recuperación tras hemorragias uterinas durante el parto70. En pacientes en programa de hemodiálisis se aconseja el tratamiento de la anemia con eritropoyetina y hierro intravenoso si la ferritina es <500μg/l71, debido a que existe un déficit funcional de hierro. No obstante, en pacientes en hemodiálisis la administración de hierro intravenoso se ha asociado a bacteriemia, disfunción endotelial, a un empeoramiento de la función cardiovascular72–74 y a un aumento del riesgo de hemocromatosis secundaria75. Un reciente metaanálisis76 evaluó la eficacia y seguridad de la administración de hierro intravenoso en pacientes en hemodiálisis con anemia por déficit funcional en 2.658 pacientes. No se demostró un mayor riesgo de eventos adversos, incluyendo infecciones, eventos cardíacos y mortalidad, si bien se identificó un incremento de marcadores de estrés oxidativo, cuyo valor clínico es incierto, por lo que deberá ser objeto de análisis futuros. Por todo ello el hierro intravenoso debe utilizarse con precaución en la población en hemodiálisis y es preciso revalorar periódicamente las reservas de hierro para confirmar que está justificada su administración.
Otro aspecto a tener en cuenta es que el hierro intravenoso permite una rápida respuesta inicial de las cifras de hemoglobina77, pero a las 12 semanas es similar a la observada con el tratamiento con hierro oral68,78, por lo que siempre que sea posible se preferirá la administración oral.
Transfusión sanguíneaDebe reservarse para pacientes con anemia sintomática, especialmente en los casos con alto riesgo de descompensación cardiovascular. La transfusión sanguínea68 se realizará con el objetivo de conseguir unos niveles seguros de hemoglobina (no niveles normales) y siempre se seguirá de tratamiento con hierro para normalizar los niveles de hemoglobina y los depósitos de hierro.
Seguimiento del paciente con anemia ferropénicaTras conseguir el objetivo de normalizar las cifras de hemoglobina el paciente debe ser monitorizado. La guía británica9 propone controles trimestrales durante un año, posteriormente al año y en adelante si reaparecen los síntomas. En caso de recidiva de la anemia deberá revalorarse el caso y considerar estudios adicionales.
ConclusiónLa AF es la causa más frecuente de anemia en nuestro medio. Además de suponer un deterioro de la calidad de vida de los pacientes que la padecen, puede ser el único signo guía para identificar una enfermedad potencialmente grave. Actualmente disponemos de gran cantidad de herramientas diagnósticas que deben ser utilizadas de forma racional para conseguir un adecuado balance entre la necesidad de conseguir un diagnóstico y la posibilidad de ofrecer un tratamiento. Por último, la AF debe ser tratada en todos los casos con suplementos de hierro oral o intravenoso, en función de la situación clínica y la tolerancia del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.