La administración intravenosa de albúmina humana es uno de los tratamientos más utilizados en las últimas décadas en pacientes con una cirrosis hepática descompensada. Inicialmente, su indicación fundamental fue el tratamiento de la ascitis tensa ya que se consideraba que la hipoalbuminemia era un factor fundamental en la génesis de la ascitis y, por otra parte, es un hecho bien conocido que la expansión del volumen plasmático potencia el efecto de la furosemida y la espironolactona. Actualmente, la indicación fundamental de la administración de albúmina es el tratamiento y la prevención de la disfunción circulatoria grave y del síndrome hepatorrenal, complicaciones que aparecen frecuentemente en pacientes cirróticos tratados con paracentesis terapéuticas o con infecciones bacterianas, especialmente la peritonitis bacteriana espontánea1.
La albúmina humana es una proteína de 585 aminoácidos y 66kDa de peso molecular que atraviesa difícilmente la mayoría de capilares sanguíneos. Por ello, se mantiene en el torrente circulatorio y contribuye de manera fundamental a mantener la presión oncótica del plasma. Previene, por tanto, la salida de líquido del territorio intravascular al tejido intersticial y favorece su reabsorción desde el espacio intersticial. La microcirculación hepática está compuesta por unos capilares especiales, los sinusoides, con amplios poros y elevada permeabilidad. Los sinusoides hepáticos son permeables a la albúmina y a otras proteínas de elevado peso molecular como el fibrinógeno. La albúmina es sintetizada por las células hepáticas, pasa a la circulación a través de los sinusoides y permanece en el torrente circulatorio durante aproximadamente 21 días2.
La albúmina participa de forma muy significativa en el proceso de transporte de sustancias procedentes del catabolismo celular desde su lugar de producción a los órganos excretores, fundamentalmente el hígado y el riñón. Interviene asimismo en el transporte y eliminación de sustancias tóxicas que se acumulan en enfermedades agudas y crónicas como la sepsis, el cáncer, la insuficiencia renal y la diabetes. Finalmente, participa en el transporte de hormonas y fármacos a las células diana3–6. La hipoalbuminemia, por tanto, puede limitar la capacidad del organismo para eliminar sustancias tóxicas, el transporte de sustancias con efectos fisiológicos esenciales y la farmacocinética de los medicamentos. Por otra parte, posee una importante capacidad antioxidante6,7. Teniendo en cuenta la alta concentración de albúmina en sangre, esta proteína constituye el más poderoso mecanismo antioxidante extracelular. Es capaz de fijar radicales libres y una vez oxidada es rápidamente eliminada de la circulación. Los radicales libres tienen efectos perjudiciales sobre las membranas de las células y de las organelas intracelulares y afectan al funcionamiento celular. Es posible por tanto que el estrés oxidativo tenga importantes efectos sobre el funcionamiento de numerosos órganos y sistemas, incluyendo la capacidad antibacteriana de los granulocitos y macrófagos8 y la homeostasia de la microcirculación9.
El desarrollo de hipoalbuminemia es uno de los hechos más característicos de la insuficiencia hepática crónica. Tradicionalmente se consideró que dicha hipoalbuminemia tenía un papel muy importante en la fisiopatología de la ascitis. La hipertensión portal y el descenso de la presión oncótica del plasma determinarían una alteración del equilibrio de Starling en la microcirculación hepática y esplácnica que favorecería el escape de líquido a la cavidad peritoneal. La administración intravenosa de albúmina se utilizaba para corregir este proceso. Investigaciones posteriores demostraron que la formación de ascitis es un proceso ligado a una disminución de las resistencias vasculares esplácnicas10, lo cual redujo el protagonismo de la hipoalbuminemia en la fisiopatología de las complicaciones relacionadas con la cirrosis. La vasodilatación arterial esplácnica produce 2 tipos de procesos. Por una parte, induce un importante aumento del volumen de sangre que circula a alta presión por la circulación esplácnica, hecho que favorece el escape de líquido a la cavidad peritoneal. Por otra parte, determina una hipovolemia arterial efectiva, la activación de sistemas estimuladores de la reabsorción renal sodio y agua (sistema renina-angiotensina-aldosterona, sistema nervioso simpático y hormona antidiurética) y la retención de líquido, el cual que se acumula en la cavidad peritoneal perpetuando la formación de ascitis10,11.
El uso de la albúmina en la cirrosis se reactivó nuevamente tras la reintroducción de la paracentesis terapéutica. Si se realiza sin expansión del volumen plasmático, este tratamiento se asocia con el desarrollo de una disfunción circulatoria que persiste en el tiempo, conduce al desarrollo de insuficiencia renal en aproximadamente el 15-20% de los pacientes, y puede acortar su supervivencia12,13. La expansión del volumen plasmático con albúmina reduce la incidencia de disfunción circulatoria posparacentesis del 75 al 15%, aproximadamente13,14.
La efectividad de la albúmina en la prevención de la disfunción circulatoria posparacentesis animó a los investigadores a evaluar otras indicaciones potenciales, hecho que condujo a la utilización de la albúmina en el manejo de la cirrosis descompensada. En primer lugar se demostró que la infusión de albúmina en el momento del diagnóstico de la infección reduce la incidencia de síndrome hepatorrenal tipo 1 y la mortalidad hospitalaria en más del 60% en pacientes con peritonitis bacteriana espontánea15. En segundo lugar, la combinación de albúmina y vasoconstrictores es capaz de revertir la disfunción circulatoria y la insuficiencia renal en pacientes con síndrome hepatorrenal tipo 11,11,16–18.
Actualmente se están realizando estudios controlados en amplias series de pacientes en España e Italia en busca de una nueva indicación para el uso de la albúmina en la cirrosis descompensada. Estos estudios tratan de demostrar que la mejoría persistente de la disfunción circulatoria en la cirrosis, secundaria a la administración semanal o bisemanal de albúmina, reduce la incidencia de otras complicaciones como la encefalopatía hepática, la hemorragia digestiva por hipertensión portal y las infecciones bacterianas.
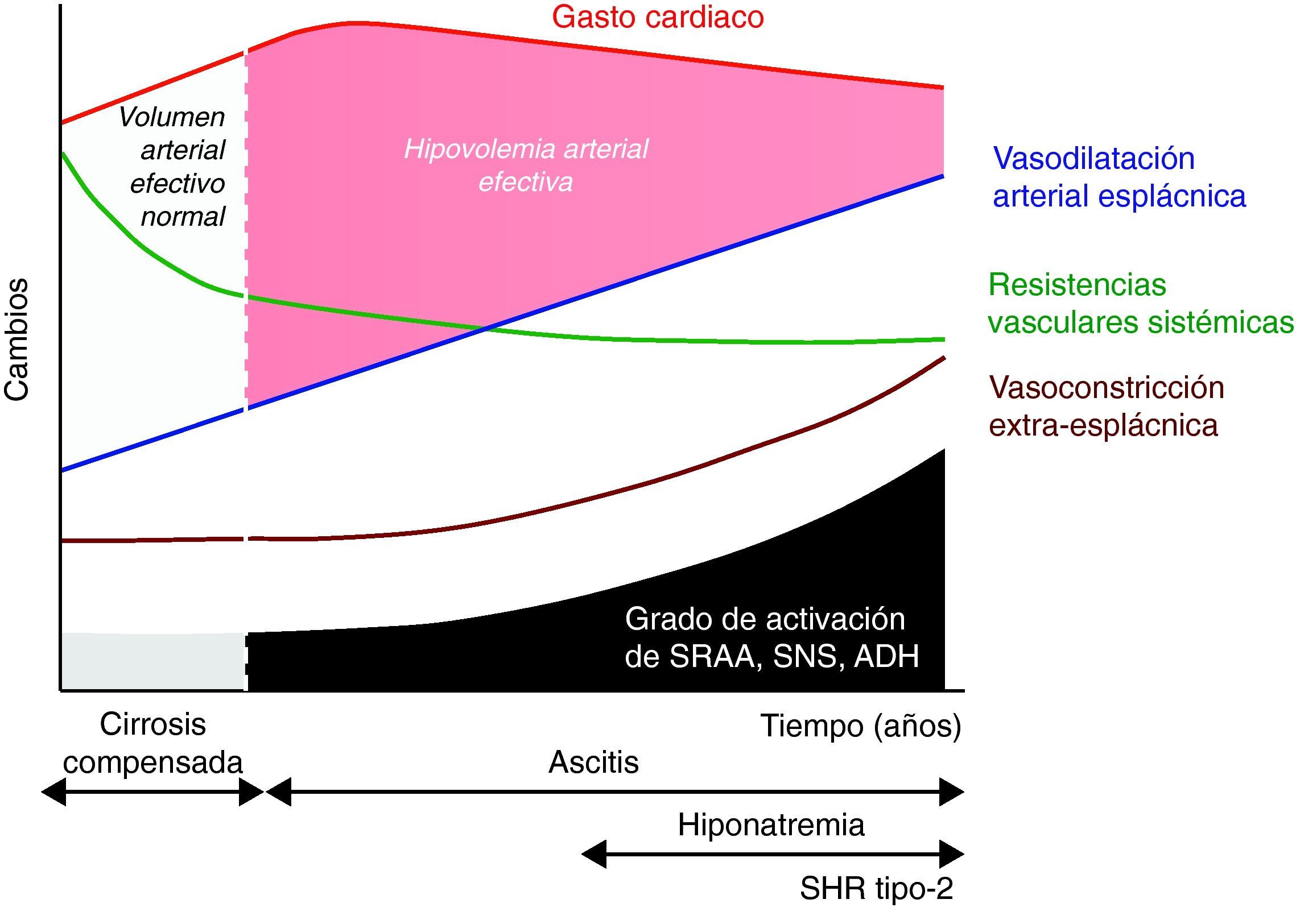
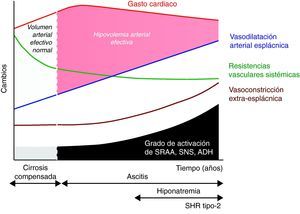
Disfunción circulatoria espontánea en la cirrosisTradicionalmente, la disfunción circulatoria de la cirrosis descompensada se ha considerado un trastorno secundario a la vasodilatación arterial (fig. 1)10. Posteriormente, se demostró que esta vasodilatación ocurre preferentemente en el área esplácnica y existen evidencias que indican que puede estar en relación con la liberación masiva de sustancias vasodilatadoras como consecuencia de la hipertensión portal. Numerosos estudios han demostrado que el óxido nítrico podría ser importante19,20. Sin embargo, el criterio más extendido es que el mecanismo es probablemente multifactorial y que otros vasodilatadores como las prostaglandinas21, la sustancia P22, el monóxido de carbono23, el gen relacionado con la calcitonina24 y los endocannabinoides25 podrían también estar involucrados. Dos hallazgos recientes han venido a demostrar que la fisiopatología de la disfunción circulatoria en la cirrosis en mucho más compleja.
Teoría de la vasodilatación arterial periférica como causa de disfunción renal en la cirrosis. El mecanismo principal es una reducción progresiva de la resistencias vasculares esplácnicas debido a la vasodilatación arterial. Inicialmente es compensada por un aumento del gasto cardiaco. Sin embargo, de manera progresiva se produce un deterioro de la función cardiaca que disminuye el gasto cardiaco y contribuye finalmente a la reducción del volumen arterial efectivo. ADH: hormona antidiurética; SNS: sistema nervioso simpático; SRAA: sistema renina-angiotensina-aldosterona.
En primer lugar, estudios experimentales han demostrado la existencia de una intensa neoformación vascular en el hígado y en el territorio esplácnico en la cirrosis en relación con la presencia de concentraciones elevadas de sustancias con actividad proangiogénica26,27. La cantidad total de vasos sanguíneos es mucho más alta en ratas cirróticas que en animales sanos. El descenso de resistencias vasculares en el área esplácnica sería por tanto consecuencia no solo de una vasodilatación arteriolar sino también de un aumento en el número de vasos sanguíneos. La demostración de que la utilización de fármacos con actividad antiangiogénica mejora la función circulatoria en modelos de cirrosis experimental confirma la importancia patogénica de este último mecanismo28.
En segundo lugar, estudios realizados en pacientes con una cirrosis hepática descompensada han demostrado que durante el curso de la enfermedad, y de forma paralela a la reducción progresiva de las resistencias vasculares esplácnicas, existe también un deterioro sostenido de la función cardiaca que se manifiesta por una desaparición progresiva de la circulación hiperdinámica y un descenso del gasto cardiaco29,30. La disfunción circulatoria espontánea de la cirrosis es por tanto la consecuencia de un descenso de resistencias vasculares esplácnicas y de una disminución de la función cardiaca, fenómenos que progresan durante el curso de la enfermedad. Varios factores intervienen en el deterioro de la función cardiaca. Es posible que exista un descenso del retorno venoso. Por otra parte, existen evidencias de la existencia de una miocardiopatía cirrótica caracterizada por la presencia de una disfunción diastólica que puede afectar a la función inotropa del corazón en situaciones clínicas de estrés. Finalmente, la función cronotropa del corazón está muy deteriorada y los pacientes no aumentan la frecuencia cardiaca a pesar de tener una intensa actividad nerviosa simpática31,32.
Una de las características más importantes de la función circulatoria en la cirrosis es su extrema labilidad, su enorme sensibilidad ante sucesos que producen hipovolemia arterial. Este hecho se manifiesta fundamentalmente por el desarrollo de insuficiencia renal. La administración de diuréticos, las paracentesis terapéuticas sin administración concomitante de albúmina12,13 y las infecciones bacterianas15,33 se asocian a insuficiencia renal en aproximadamente el 15-30% de los pacientes. En condiciones fisiológicas la regulación de la presión arterial y de la volemia efectiva se realiza fundamentalmente en el área esplácnica y renal. Cuando se produce una hipovolemia efectiva, ya sea como consecuencia de una pérdida de volumen o por vasodilatación, se activan sistemas vasoconstrictores que mantienen la presión arterial a través de una vasoconstricción en estos territorios vasculares34. En la cirrosis, el efecto regulador de la presión arterial, sin embargo, ocurre preferentemente en el riñón, debido a que la vasculatura esplácnica es muy resistente al efecto de los vasoconstrictores endógenos por la liberación masiva de sustancias vasodilatadoras que se produce en este territorio vascular19–25. Es posible también que los vasos neoformados en el área esplácnica no respondan con la intensidad requerida. Los pacientes cirróticos están, por tanto, predispuestos a desarrollar vasoconstricción renal, descenso de perfusión e insuficiencia renal ante agresiones que afectan a la volemia11.
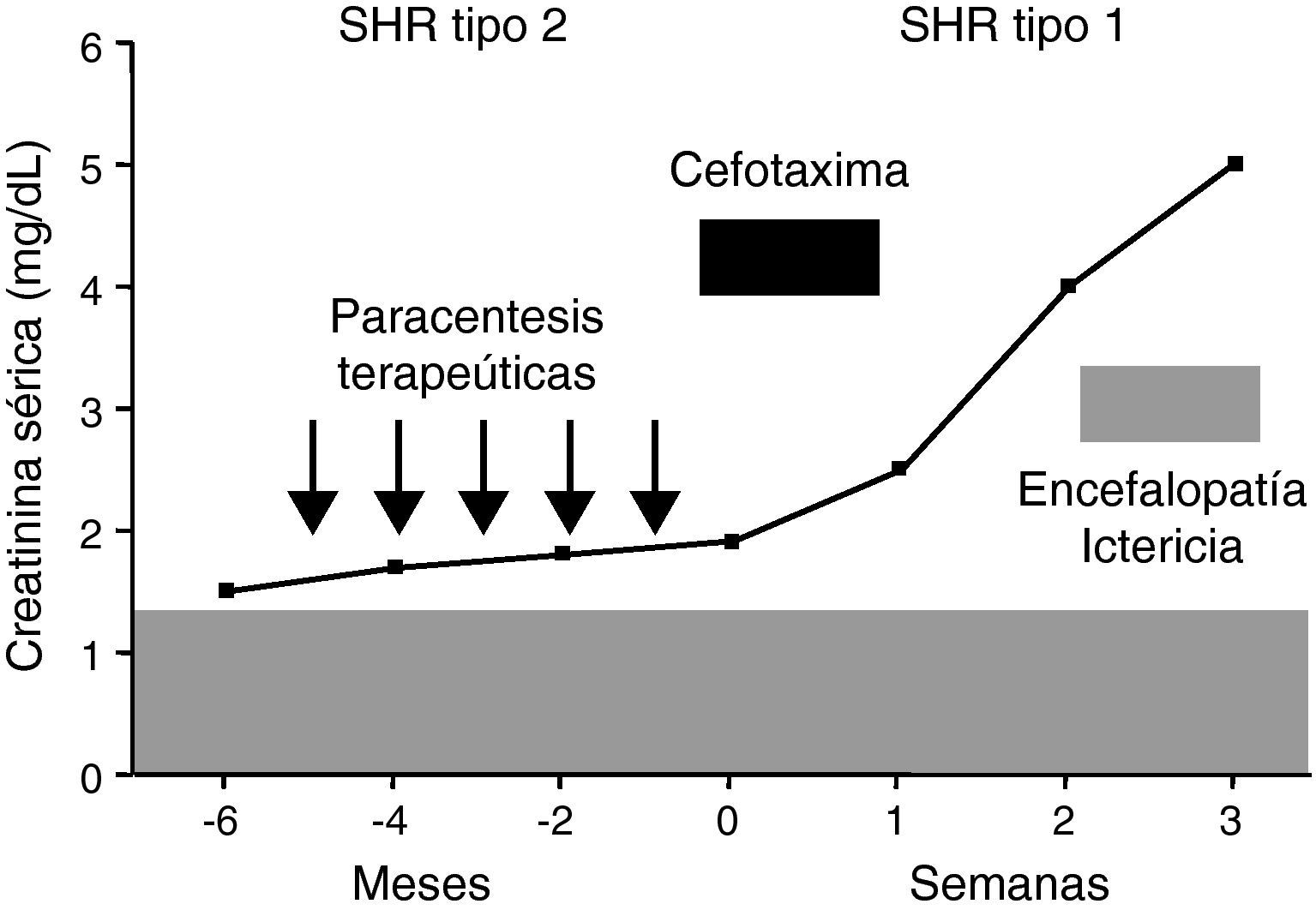
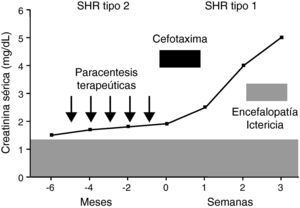
El síndrome hepatorrenal tipo 2 es la manifestación más extrema del deterioro circulatorio que desarrollan espontáneamente los pacientes cirróticos11. El síndrome hepatorrenal tipo 1 constituye probablemente un proceso distinto al tipo 2. Aunque la fisiopatología circulatoria es similar en ambos síndromes, la disminución de resistencias periféricas y el descenso de la función cardiaca, el deterioro circulatorio en el síndrome hepatorrenal tipo 1 es muy rápido, intenso (fig. 2) y se asocia frecuentemente con el fracaso de otros órganos y sistemas como el cerebro, las glándulas suprarrenales, los pulmones y la coagulación. Por otra parte, este síndrome ocurre en estrecha relación con un factor precipitante, frecuentemente infecciones, hecho no tan común en el síndrome hepatorrenal tipo 211.
Curso clínico de un paciente con síndrome hepatorrenal tipo 2 (SHR) y ascitis resistente. El enfermo desarrolla un SHR tipo 1 tras una peritonitis bacteriana espontánea pese a su resolución con cefotaxima. Presentó asimismo un deterioro de la función hepática y encefalopatía, falleciendo 3 semanas después del diagnóstico de la infección.
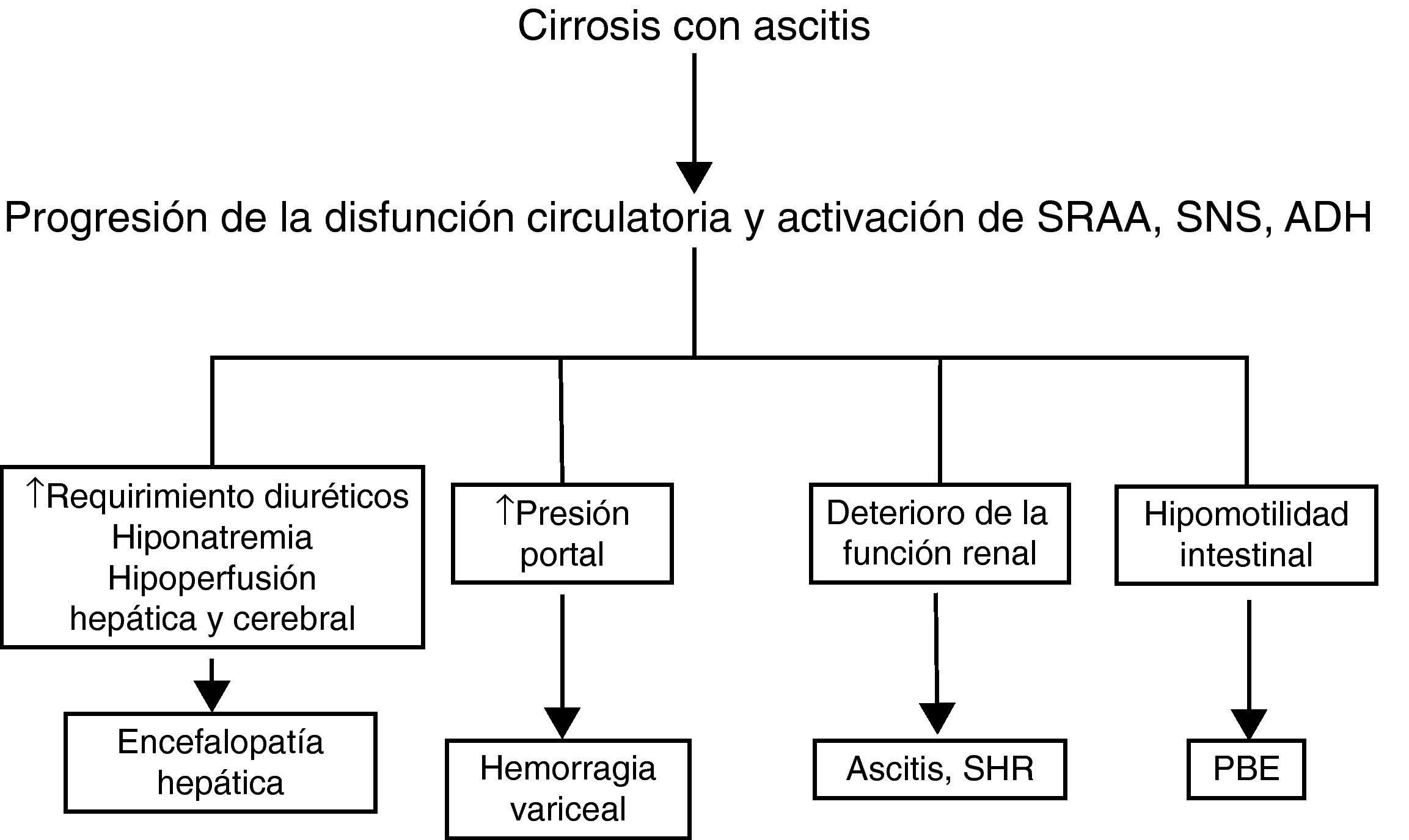
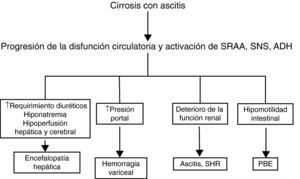
Aunque la disfunción circulatoria de la cirrosis afecta predominantemente al riñón, también altera otros órganos y sistemas (fig. 3). La hiperactividad simpática disminuye la motilidad intestinal, produce sobrecrecimiento bacteriano intestinal y puede favorecer la translocación de bacterias desde la luz intestinal a la circulación sistémica y ser causa de infecciones graves35. La circulación portal intrahepática es sensible a la acción vasoconstrictora de la angiotensina II, noradrenalina y hormona antidiurética. La activación intensa de estos sistemas como consecuencia de la disfunción circulatoria puede contribuir a acentuar la hipertensión portal que presentan los pacientes con cirrosis hepática avanzada y ascitis29,36,37. La hiponatremia secundaria a la hipersecreción de hormona antidiurética puede favorecer el desarrollo de encefalopatía38. El uso de diuréticos para el tratamiento de la ascitis que responde pobremente a estos fármacos (ascitis resistente y/o recidivante) se asocia al desarrollo de encefalopatía hepática en un 25% de los casos39. Hay estudios que demuestran la existencia de una relación estrecha entre el flujo sanguíneo renal y el flujo sanguíneo cerebral, y entre ambos y el grado de activación de los sistemas vasoactivos endógenos40. Los pacientes con síndrome hepatorrenal son aquellos que presentan un flujo sanguíneo cerebral más bajo. El papel de esta hipoperfusión cerebral en la predisposición al desarrollo de encefalopatía hepática que presentan estos pacientes no es bien conocido41,42. Finalmente, estudios recientes en pacientes críticos han encontrado que los enfermos con cirrosis hepática descompensada presentan con una frecuencia del 40-60% una insuficiencia suprarrenal relativa, con valores de cortisol total sérico inapropiadamente bajos con respecto a las demandas periféricas y con una pobre respuesta a la administración de corticotropina43–45. El cortisol es esencial para que se produzca una respuesta vascular adecuada a los sistemas vasoconstrictores endógenos. La insuficiencia suprarrenal relativa, por tanto, podría contribuir a la disfunción circulatoria.
Papel patogénico de la disfunción circulatoria sistémica en las diferentes complicaciones de la cirrosis. ADH: hormona antidiurética; PBE: peritonitis bacteriana espontánea; SHR: síndrome hepatorrenal; SNS: sistema nervioso simpático; SRAA: sistema renina-angiotensina-aldosterona.
Todos estos hechos constituyen la base racional para el uso prolongado de la albúmina en los estudios antes mencionados que se están desarrollando en España e Italia.
Disfunción circulatoria posparacentesisOcurre en aproximadamente un 70% de los pacientes tratados con paracentesis total sin administración de expansores plásmáticos12,13. La incidencia es muy baja cuando el volumen de ascitis extraído es inferior a 5 l, pero aumenta de forma progresiva en relación al volumen de la paracentesis por encima de este límite14. El mecanismo de la disfunción circulatoria es doble. Por una parte, los pacientes desarrollan un descenso de las resistencias vasculares periféricas, lo que indica una vasodilatación arterial. El lugar donde ocurre este proceso es desconocido, aunque es posible que sea el área esplácnica. Este trastorno se acompaña de una activación reactiva de los sistemas vasoconstrictores endógenos con aumento de la actividad de renina plasmática y de la concentración plasmática de noradrenalina. A pesar de esta hiperactividad simpática, no aumenta ni el gasto cardiaco ni la frecuencia del pulso, lo que indica que además de la vasodilatación arteriolar, una inadecuada respuesta cardiaca a la vasodilatación participa en el deterioro circulatorio46.
Disfunción circulatoria postinfecciónLas infecciones bacterianas son una de las causas más importantes de disfunción circulatoria e insuficiencia renal en la cirrosis. Aproximadamente un 30-40% de los pacientes con infecciones graves la desarrollan33,47,48. En muchas ocasiones la insuficiencia renal es reversible, desapareciendo tras la resolución de la infección. En otras, sin embargo, a pesar de curar el proceso infeccioso la insuficiencia renal persiste. En la mayoría de las ocasiones, los pacientes desarrollan una insuficiencia renal rápidamente progresiva (síndrome hepatorrenal tipo 1) con fallo multiorgánico. En algunos casos, sin embargo, la insuficiencia renal se mantiene estable tras la curación de la infección (síndrome hepatorrenal tipo 2)11,30,33. La infección en la que con más frecuencia se desarrolla insuficiencia renal es la peritonitis bacteriana espontánea, seguida de la infección urinaria sintomática (pielonefritis aguda) y las infecciones biliares47,48.
Existen estudios experimentales que demuestran que las infecciones bacterianas en la cirrosis se asocian a una respuesta inflamatoria mucho más potente que en los animales sanos49. Por otra parte, en la peritonitis bacteriana espontánea se ha demostrado que los pacientes que desarrollan insuficiencia renal son aquellos que presentan una mayor respuesta inflamatoria, estimada por la concentración de leucocitos en líquido ascítico y niveles de citocinas en ascitis y sangre50.
Estudios en pacientes con peritonitis bacteriana espontánea han demostrado que el desarrollo de síndrome hepatorrenal tipo 1 ocurre como consecuencia de un mecanismo doble. Por una parte, un descenso rápido e intenso de las resistencias vasculares que determina una activación de los sistemas vasoconstrictores endógenos; por otra parte, un fallo en la función cardiaca con un descenso del gasto. Este último proceso es debido a un deterioro de la función inotropa y cronotropa. Los pacientes no desarrollan taquicardia a pesar de la disfunción circulatoria y del aumento en la activación del sistema nervioso simpático29.
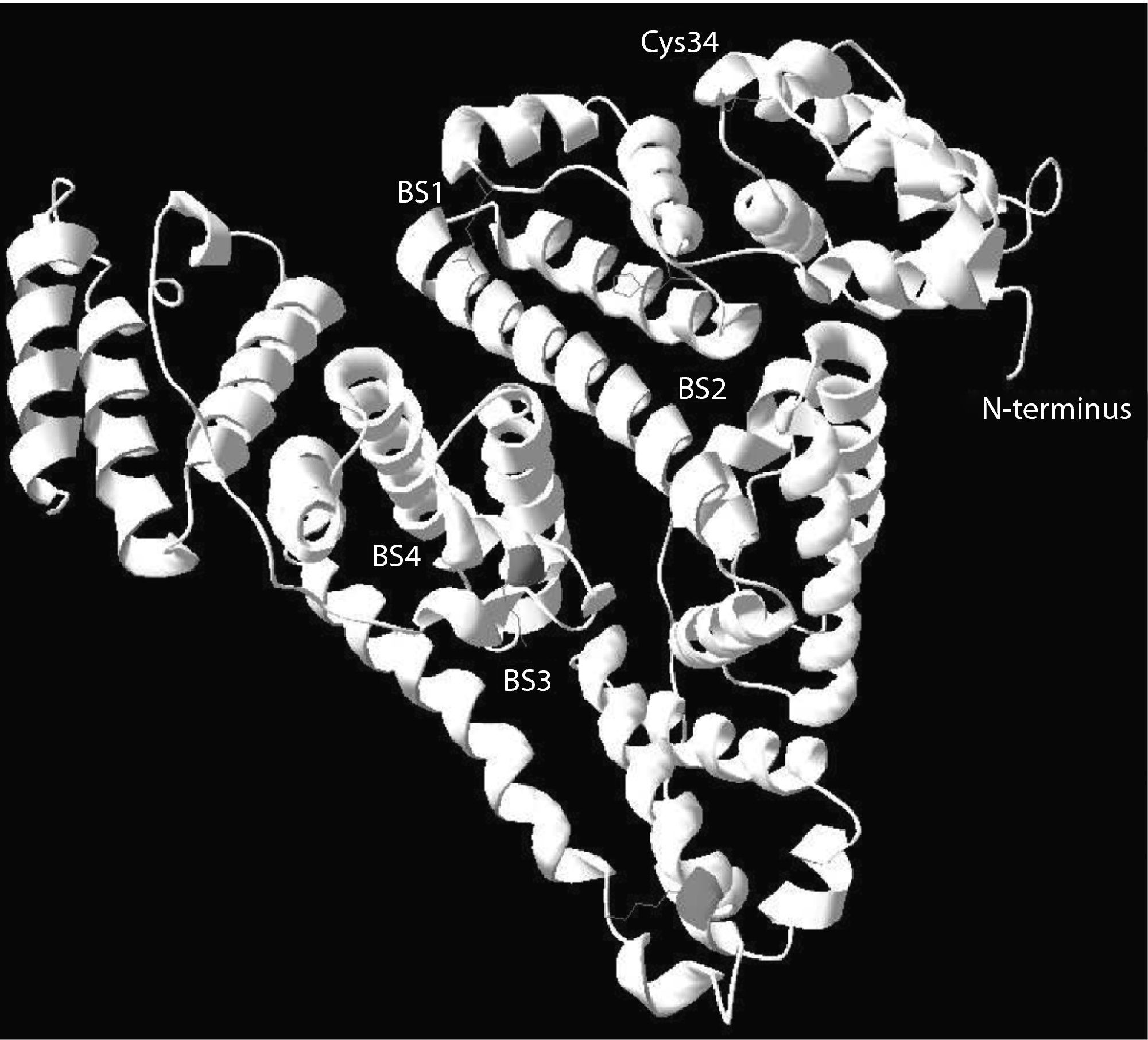
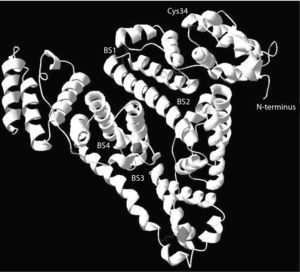
Funciones de la albúmina en la insuficiencia hepáticaTradicionalmente, el protagonismo de la albúmina en enfermedad humana se ha atribuido exclusivamente a sus propiedades oncóticas. El papel de la albúmina en la patogenia de la retención de líquido y en el desarrollo de edema en enfermedades como la cirrosis, el síndrome nefrótico o la enteropatía perdedora de proteínas es un claro ejemplo de este hecho. Sin embargo, la molécula de albúmina posee muchas otras funciones que son esenciales en el funcionamiento de los seres vivos. Dispone de sitios de alta y baja afinidad que fijan ácidos grasos y otras sustancias hidrófobas (fig. 4)3–6,51. Esta función permite que lípidos y otras sustancias hidrófobas (aminoácidos, hormonas) sean vehiculizados desde su lugar de absorción o síntesis a los tejidos periféricos. Gran cantidad de los medicamentos son vehiculizados a los órganos diana también a través de este proceso. Muchas sustancias tóxicas procedentes del catabolismo celular son asimismo transportadas a sus órganos excretores (higado y riñón) mediante su unión a la albúmina. Este fenómeno es especialmente relevante en enfermedades con gran catabolismo celular (cáncer, diabetes, sepsis). En la cis-34, la molécula de albúmina dispone de un dominio con capacidad para fijar radicales libres, lo que le confiere una capacidad antioxidante significativa7. Por su elevada concentración en plasma y tejido intersticial, la albúmina es el antioxidante más importante de tipo extracelular. Finalmente, existen otros dominios con capacidad para fijar metales, especialmente a nivel del N-terminal, los cuales, si no son eliminados, incrementan el estrés oxidativo51.
Estudios de proteómica funcional utilizando técnicas de espectroscopia electrónica por resonancia magnética permiten investigar numerosas funciones de la albúmina, incluyendo la capacidad funcional de sus sitios de fijación y su eficiencia en el transporte de sustancias hidrófobas (absorción, fijación y liberación en órganos diana), y en la destoxificación de productos catabólicos (capacidad de la albúmina de fijar, vehiculizar y liberar sustancias tóxicas producidas por el catabolismo celular). Asimismo, permiten evaluar alteraciones conformacionales de la molécula en los sitios de fijación. La función quelante del N-terminal también puede ser explorada. Utilizando estas técnicas se ha comprobado que la función de la albúmina en la cirrosis hepática se haya profundamente deteriorada51. La capacidad de fijación de ácidos grasos y otras sustancias hidrófobas, y su capacidad de transporte y destoxificación es prácticamente nula (inferior al 20% observado en la albúmina de individuos sanos). El mecanismo que determina esta disminución de la capacidad funcional de la albúmina no se conoce. Es posible que sea secundaria a un proceso funcional, potencialmente reversible. De hecho, la insuficiencia hepática determina una acumulación de gran cantidad de sustancias hidrófobas que saturarían los sitios de fijación. La sepsis, que también altera la función de la albúmina, es un fenómeno frecuente en la cirrosis. Finalmente, tanto las infecciones como la insuficiencia hepática se asocian a un aumento del estrés oxidativo. Todos estos procesos harían que la albúmina se encontrara funcionalmente saturada y sin capacidad para ejercer sus procesos fisiológicos. La diálisis de albúmina (sistema MARS) trata de remover estas sustancias y de hacer que la albúmina endógena sea nuevamente funcional. No obstante, una segunda posibilidad es que determinados ligandos alteren las características moleculares de la albúmina de una forma irreversible. Aunque tradicionalmente se ha señalado que la albúmina dañada es rápidamente eliminada, degradada y sustituida por moléculas nuevas, este hecho probablemente no se produce en la cirrosis, enfermedad en la que la síntesis de albúmina se encuentra profundamente disminuida.
Las consecuencias clínicas de la alteración de la función de la albúmina en la insuficiencia hepática no se conocen, pero podrían ser importantes. La combinación de hipoalbuminemia y de una disminución funcional de la albúmina endógena determina una alteración profunda del transporte, metabolismo y excreción de muchas sustancias endógenas y exógenas que circulan libremente en el organismo pudiendo interaccionar de manera arbitraria en lugar de ser liberadas en los sitios diana apropiados. La farmacocinética y farmacodinámica de muchos medicamentos y, por tanto, su eficacia y efectos adversos se encuentran muy afectados. Finalmente, el estrés oxidativo existente en la insuficiencia hepática y en otros problemas asociados como las infecciones bacterianas no puede ser corregido por la acción de la albúmina. Un aumento del estrés oxidativo puede alterar la microcirculación y la función celular y contribuir al fallo multiorgánico que se observa en muchos pacientes con insuficiencia hepática52.
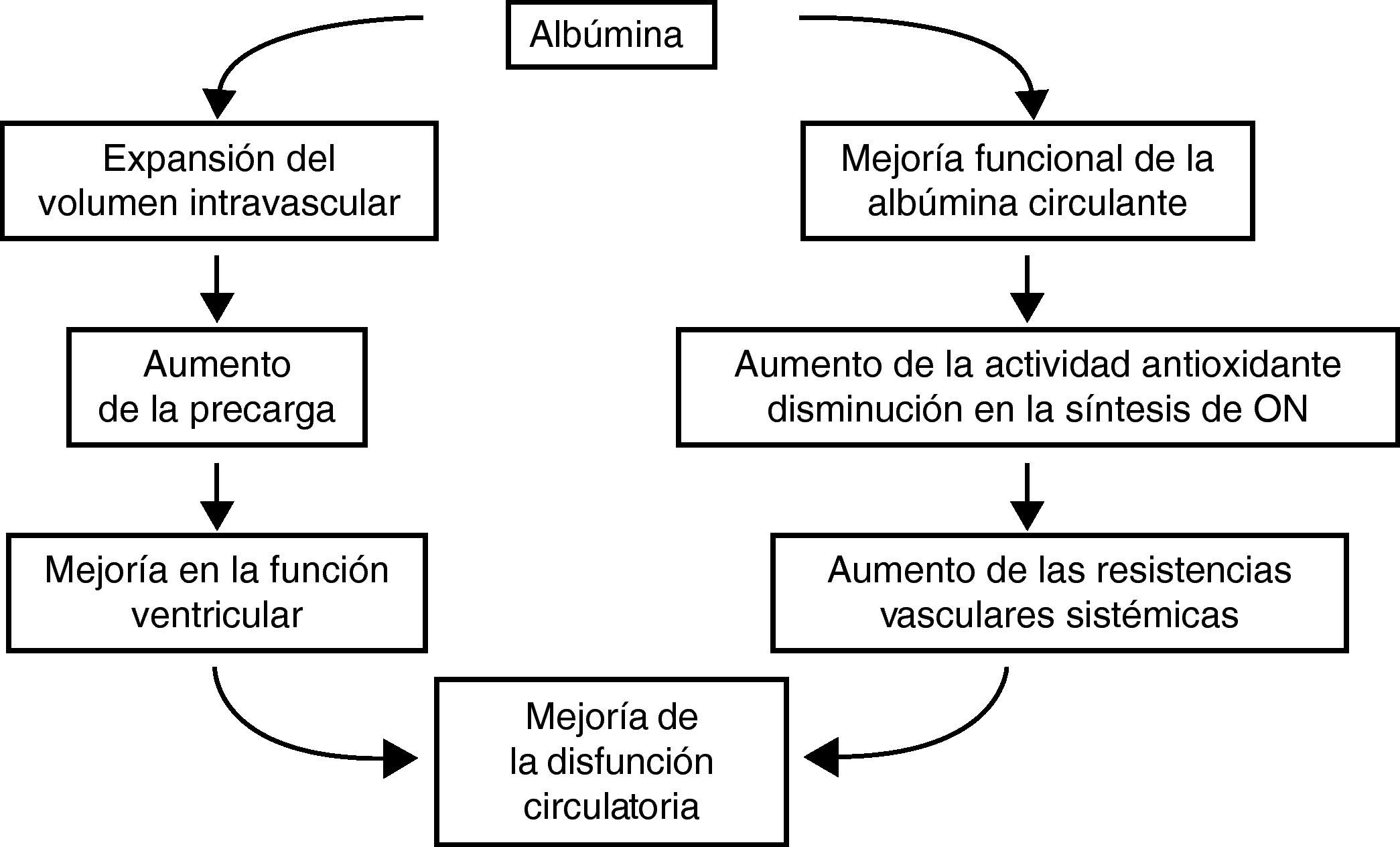
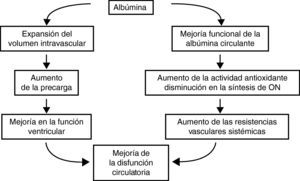
Efectos de la albúmina sobre la disfunción circulatoria de la cirrosisLa administración intravenosa de albúmina en los pacientes con cirrosis hepática y ascitis, además de expandir el volumen plasmático y aumentar la precarga y el gasto cardiaco, aumenta las resistencias vasculares periféricas, lo cual indica que produce vasoconstricción arterial (fig. 5)53,54. Este efecto no se observa con expansores sintéticos. El mecanismo que determina el efecto vasoconstrictor de la albúmina no está bien estudiado. Es posible que tenga lugar en la microcirculación arterial y sea secundario a una disminución en la liberación de óxido nítrico. Los valores plasmáticos del factor Von Willebrand, una marcador de disfunción endotelial cuya síntesis es paralela a la del óxido nítrico, disminuyen en pacientes que reciben albúmina pero no en los que reciben expansores plasmáticos sintéticos54. Una disminución del estrés oxidativo de la microcirculación tras la administración exógena de albúmina funcionalmente activa es otra posibilidad.
La eficacia de la albúmina en la prevención de la disfunción circulatoria posparacentesis en pacientes con una peritonitis bacteriana espontánea o en el tratamiento del síndrome hepatorrenal posiblemente esté en relación con este efecto dual de la albúmina sobre la función cardiocirculatoria. Dicha disfunción circulatoria, espontánea o secundaria, es debida a un descenso del gasto cardiaco y a una acentuación de la vasodilatación arterial. La administración de albúmina humana aumenta el gasto cardiaco y produce vasoconstricción.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.