La prevalencia de las enfermedades inflamatorias intestinales idiopáticas (EII) es tan grande que en algunas poblaciones hasta un 1% de las personas pueden estar afectadas por una enfermedad de Crohn (EC) o una colitis ulcerosa (CU)1,2. En nuestro medio la situación no parece diferente ya que la incidencia de ambas enfermedades se acerca cada vez más a las de los países del norte de Europa, tradicionalmente considerados como área de alta incidencia3,4. Sin embargo, y a pesar de la ingente investigación básica y clínica, ambas entidades son muy a menudo de difícil tratamiento médico. De hecho, la EC es incurable5 y la CU sólo es curable con un tratamiento quirúrgico, no siempre exento de problemas y que, desde luego, debe limitarse a los casos más graves6.
Los glucocorticoides han desempeñado un papel clave en el tratamiento tanto de la CU como de la EC desde principios de los años cincuenta, poco tiempo después de que se iniciara su utilización en las enfermedades humanas a finales de los años cuarenta7. Aunque se asume que ac-
túan en la enfermedad por sus efectos antiinflamatorios e inmunomoduladores, en realidad se han utilizado sin un conocimiento claro de sus mecanismos de acción, que sólo ahora empieza a comprenderse desde un punto de vista molecular8,9. Las pruebas empíricas de su utilidad son, empero, concluyentes. En 1954 y 1955 Truelove y Witss publicaron los resultados de un ensayo aleatorizado y ciego que demostraba de forma clara que la hidrocortisona era muy superior al placebo en el control de la CU especialmente en sus formas graves10. De hecho, la mortalidad de los brotes graves disminuyó bruscamente a partir del momento en el que la hidrocortisona comenzó a ser la base del tratamiento de la enfermedad10. Cuarenta y cuatro años después, los glucocorticoides siguen siendo la base del tratamiento de los brotes graves de CU, y uno de los tratamientos más utilizados en los brotes moderados6. En la EC las pruebas definitivas de la utilidad de los glucocorticoides tardaron más en aparecer publicados y, si bien se utilizaban de forma empírica, no fue hasta finales de los años setenta y principios de los ochenta cuando dos grandes estudios cooperativos, el americano (NCCDS)11 y el europeo (ECCDS)12, demostraron definitivamente la eficacia de estos fármacos, especialmente en las formas graves de la EC. Otros estudios no controlados confirman que la prednisolona, el esteroide probablemente más utilizado, a dosis altas controla los síntomas en la mayoría de los pacientes, aunque su eficacia sobre las lesiones es mucho menos significativa13.
A finales de la década de los noventa los glucocorticoides siguen siendo los fármacos más útiles en el tratamiento de las EII, particularmente en sus formas graves6,13. Sin embargo, su utilidad está condicionada por una serie de limitaciones: a) no son eficaces en todos los pacientes14; b) su eficacia en la fase aguda no se extiende, al menos en la mayoría de los pacientes, cuando el tratamiento se prolonga11,12,14,15; c) aunque los síntomas desaparecen las lesiones permanecen en muchos casos, lo que tal vez provoque la aparición de complicaciones posteriores13, y
d) al ser activos en todo el organismo muchos de sus múltiples efectos son indeseables, y especialmente con las dosis altas difícilmente aceptables16. Además, estos efectos negativos son probablemente infravalorados por los médicos, que ante su evidente eficacia en resolver muchos de los problemas clínicos, a veces muy graves, tendemos a menospreciar las repercusiones que sobre la calidad de vida del paciente tienen los esteroides: el punto de vista del paciente no es siempre igual17. De hecho, cada vez más reconocemos que la calidad de vida normal es un objetivo más importante que la propia remisión clínica de las enfermedades, y los instrumentos para su medición ya forman parte de las evaluaciones objetivas de los ensayos clínicos más avanzados18,19.
Para contrarrestar los potenciales efectos secundarios de los esteroides manteniendo su eficacia se han evaluado distintas opciones20. Así, el más obvio fue utilizar los esteroides en formulación tópica, algo que se ideó poco tiempo después de utilizarlos por vía oral21; sin embargo, la absorción rectal era tan eficiente como la oral por lo que hubo que diseñar esteroides de baja absorción22. Este método sólo es útil en la enfermedad distal, que afecta hasta el ángulo esplénico, límite que alcanzan los enemas en un porcentaje suficiente de casos. Con la finalidad de administrarlos por vía oral se evaluaron diferentes opciones. De los esteroides de acción predominantemente tópica como el tixocortol o la fluticasona, sólo la budesonida ha alcanzado aplicabilidad clínica20,23-25. Por sus características farmacológicas (véase más adelante), y dada la experiencia previa en el asma26, se han diseñado varias formas que permiten utilizar la budesonida en la enfermedad inflamatoria intestinal, puesto que si se administra sin modificar se absorbería en el intestino proximal, y sería degradada a su paso por el hígado sin llegar a las zonas afectadas. Experimentalmente, e imitando la idea de la salazopirina, se ha utilizado un profármaco que al desdoblarse por la acción de las bacterias intestinales sería útil en el colon27. Esta modalidad no se ha investigado en seres humanos, aunque tanto la budesonida como la dexametasona modificados de forma similar han sido eficaces en un modelo de colitis en ratas27-29. Astra Draco, en Suecia, desarrolló una formulación mixta en la que el fár- maco activo se administra en microgránulos de 1 mm formando un polímero con etilcelulosa, rodeado de una resina (Eudragit) con lo que se libera en dependencia del tiempo y del pH, denominándose budesonida CIR (controlled intestinal release). Con esta formulación se consigue una liberación de hasta un 70% del producto en la región ileocecal30. La misma compañía ha formulado el fármaco en enema31, y desarrollado un sistema de liberación predominantemente cólico32. Por su parte, Falk ha desarrollado en Alemania un sistema de liberación controlada sólo dependiente del pH33. Dos de las formulaciones de Astra Draco, el enema y la budesonida CIR, han sido comercializadas recientemente en España.
Esta revisión tiene como objetivo proporcionar un enfoque práctico de la posible utilidad de la budesonida en el tratamiento tanto de la EC como de la CU. Para ello, no sólo revisaremos la bibliografía con un enfoque basado en la evidencia, sino que aportaremos algunas opiniones basadas en nuestra experiencia.
BUDESONIDA: CARACTERÍSTICAS FARMACOLÓGICAS
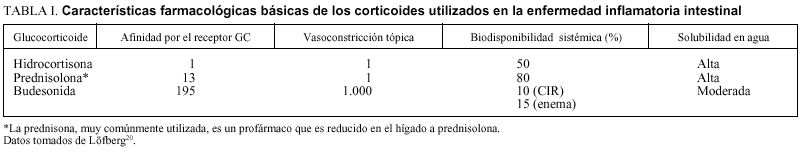
No pretendemos revisar de forma exhaustiva las características farmacológicas de la budesonida, y remitimos al lector interesado a las excelentes revisiones publicadas y fácilmente accesibles20,30,34-36. La budesonida forma parte de los esteroides modificados en el laboratorio, con el fin de obtener fármacos con gran afinidad por el receptor, mayor potencia antiinflamatoria y mejores características de solubilidad35. Efectivamente, como se puede comprobar en la tabla I, es un fármaco con mayor afinidad por el receptor, y mayor potencia antiinflamatoria que la hidrocortisona e incluso que la prednisolona20. Sus características de hidrosolubilidad y liposolubilidad hacen que atraviese las mucosas con facilidad, pero manteniendo durante unas horas una concentración local muy alta en comparación con otros corticoides30,35. Tras su absorción sufre un importante metabolismo de primer paso hepático, de modo que más del 90% de la dosis total que llega a sangre es transformada a dos metabolitos inactivos (< 1% de actividad que la molécula madre) tras su primer paso por el hígado. Esta baja biodisponibilidad hace que sus efectos sistémicos sean mucho menores de lo que corresponde a su afinidad por los receptores y a su po tencia30,35,36.
Todas estas observaciones sugieren que: a) la budesonida CIR podría ser eficaz en el tratamiento de la EC ileocólica; b) a igualdad de eficacia con otros esteroides los efectos sistémicos serían menores, y c) sus efectos sistémicos en los casos de colitis izquierda serían reducidos. Por otra parte, en las EII las alteraciones no afectan exclusivamente a la pared intestinal, y resulta razonable suponer que la budesonida debería ser menos eficaz en controlar la enfermedad extraintestinal o la enfermedad muy grave con una importante repercusión sistémica. Estas hipótesis de trabajo pueden confirmarse o no en los estudios clínicos, que vamos a analizar con detalle puesto que la orientación de esta revisión es fundamentalmente clínica.
BUDESONIDA Y ENFERMEDAD DE CROHN ILEOCÓLICA (TRATAMIENTO AGUDO)
En un primer estudio piloto, abierto y no controlado, en un pequeño número de pacientes se valoró la eficacia y la seguridad de budesonida administrada a dosis de 9 mg (repartidos en tres dosis diarias) para el control de los síntomas de la enfermedad de Crohn (EC) moderada. Se observó que a esa dosis el fármaco parecía presentar eficacia, con pocos efectos negativos, y que la reducción rápida de la dosis se seguía de reaparición de síntomas37. Los resultados de este estudio determinaron que se comenzaran análisis formales de fase III. En un estudio controlado con placebo, utilizando dosis de 1,5 * 2, 4,5 * 2 y 7,5 * 2 mg/día de budesonida, se demostró que las tres dosis eran más eficaces que el placebo (aunque la de 3 mg no alcanzó la significación) siendo la dosis de 9 mg superior incluso a la de 1538. Aunque se observó en todos los grupos algún efecto en la función de regulación de la secreción de esteroides por parte del ACTH, estas alteraciones no se acompañaron de efectos negativos. De este estudio parecía deducirse que 9 mg/día de budesonida son más eficaces que placebo, con escasa toxicidad, y que aumentar la dosis a 15 mg no parecía aumentar la eficacia y sí el riesgo de efectos negativos, al menos tomando a todos los pacientes en su conjunto38. En el estudio canadiense se utilizó como metodología de medida el índice de calidad de vida de Irvine, que confirmó las ventajas de budesonida frente al placebo y la superioridad de la dosis de 9 mg39.
Un estudio simultáneo confirmó que la budesonida (9 mg/día) era algo menos eficaz que la prednisolona (40 mg/día) con un descenso progresivo hasta 5 mg a las 8 semanas. Aunque la prednisolona redujo significativamente más el CDAI tomado como valor numérico (p = 0,001), el porcentaje de pacientes que alcanzó la remisión (CDAI < 150) fue similar en ambos grupos tanto a las 2 semanas (52 frente a 65%, p = 0,22) como a las 8 semanas (52 frente a 65%, p = 0,12). Los efectos negativos, por el contrario, fueron significtivamente menores (p = 0,003) en el grupo tratado con budesonida40. Aunque se podría argumentar que los efectos negativos fueron meramente estéticos, es importante señalar que la glucosa aumentó significativamente (p < 0,001) más en el grupo de la prednisolona, a pesar de la rapidez de la reducción
de la dosis40.
Un estudio posterior realizado por Campieri et al confirma una eficacia similar de la budesonida y la prednisolona en el tratamiento de la EC de localización ileal o íleocecal41. En este estudio se incluyeron tres grupos de pacientes: budesonida 9 mg/día en una única dosis, prednisolona en dosis inicial de 40 mg descendiendo paula tinamente a 5 mg, y budesonida 9 mg repartidos en dos dosis de 4,5 mg/12 h. Los dos primeros grupos fueron indistinguibles en cuanto a eficacia y efectos secundarios. La budesonida en dosis repartidas fue significativamen-
te más eficaz. En un subanálisis no planificado la pred nisolona parecía superior en los casos más graves (CDAI inicial mayor de 300) aunque la budesonida parecía más eficaz en los brotes moderados (150 a 300 de CDAI inicial); de todas formas, hay que señalar estos sub-
análisis se basaban en grupos de pacientes ya muy redu cidos.
Por último, hasta la fecha, se dispone de un estudio comparando budesonida CIR con mesalamina42. Muchos autores, e incluso guías terapéuticas prestigiosas, recomiendan iniciar el tratamiento de un brote agudo leve o moderado de EC con una dosis alta de mesalamina, si bien la evidencia para esta actitud es más bien escasa o controvertida43-45. El fundamento para este razonamiento es doble: es un fármaco con cierta eficacia, y además es muy poco tóxico. Por ello, en casos de brotes leves o moderados antes de indicar esteroides sistémicos con sus potenciales efectos negativos se puede intentar un tratamiento con mesalamina46. En este estudio se comparaba en un análisis doble ciego, aleatorizado, una dosis de 9 mg de budesonida CIR con una dosis de 4 g de Pentasa® (una forma de mesalamina con liberación dependiente de pH no comercializada en España pero de amplio uso en los EE.UU. y otros países), en pacientes con EC ileocólica con un brote leve a moderado. La budesonida resultó mucho más eficaz en todos los parámetros de medida: media de días en el que se alcanza la remisión, porcentaje de remisión a las 8 semanas, índice de calidad de vida, y de forma muy significativa en una menor tasa de retiradas del estudio, las cuales fueron causadas en su mayoría por falta de eficacia. No se encontraron diferencias significativas en la toxicidad de ambos fármacos.
Paralelamente el grupo alemán/austriaco de estudio de budesonida ha ido informando de resultados clínicos con la budesonida modificada Falk, cuya liberación es dependiente de pH. En dos estudios previos no controlados, probablemente uno de ellos ampliación del otro, se comprueba la eficacia de budesonida en el tratamiento de la EC ileal o ileocecal33,48. Un estudio posterior, comparativo frente a la prednisolona, demuestra una eficacia similar entre ambos tratamientos, aunque discretamente inferior para la budesonida pero con menos efectos secundarios49. Muy recientemente, se ha publicado un estudio multicéntrico doble ciego aleatorizado, comparando la budesonida (9 mg/día) con la prednisona (40 mg/día)50. En este ensayo ambos fármacos obtuvieron la misma tasa de remisión a las 8 semanas, en ambos casos relativamente baja. Sin embargo, al analizar cuántos pacientes es taban en remisión y libres de efectos negativos significativos a las 8 semanas de iniciar el tratamiento la bude sonida resultó significativamente mejor que la prednisolona50.
Un metaanálisis de los cuatro ensayos clínicos contro lados de budesonida (9 mg/día) frente a prednisolona (40 mg/día en fase de descenso posterior) en el tratamiento de la EC de localización ileal o ileocecal demuestra que ambos tratamiento tienen una eficacia similar para inducir la remisión clínica de la EC activa (OR [IC del 95%]: 0,84 [0,61-1,18] [NS]). Sin embargo, los valores plasmáticos de cortisol son significativamente menores en el grupo de pacientes tratados con prednisolona (OR: 0,37 [0,23-0,5]; p < 0,001) (Hinojosa y Nos: datos no publicados).
En resumen, los resultados obtenidos de los diferentes estudios publicados sugieren que la budesonida es un fármaco útil en el manejo de la enfermedad de Crohn ileocólica puesto que: a) es más eficaz que el placebo; b) es más eficaz que la mesalamina, y c) es tan eficaz (aunque en algunos estudios presenta una tendencia a una menor potencia) como la prednisolona en el tratamiento de los brotes moderados de EC ileocólica, con una clara tendencia a ser mejor tolerada por el paciente. No obstante, hay que señalar que en los ensayos clínicos realizados, la mayoría de los pacientes tenían un brote moderado, y que las dosis de prednisolona o prednisona se reducían bastante rápidamente.
BUDESONIDA Y ENFERMEDAD DE CROHN ILEOCÓLICA (TRATAMIENTO DE MANTENIMIENTO)
La prednisolona no reveló eficacia en el tratamiento a largo plazo para evitar las recaídas en el estudio NCCDS y sólo en un grupo marginal de pacientes en el ECCDS. Ambos estudios, sin embargo, eran tan ambiciosos que realmente son muy difíciles de analizar e interpretar en cuanto a conclusiones completas se refiere. No debemos olvidar, por ejemplo, que los resultados del NCCDS han determinado durante años una utilización muy limitada de la azatioprina (o la 6-mercaptopurina) en el tratamiento de la EC, dada su aparente no superioridad sobre el placebo. Sin embargo, el defecto estaba en el análisis, puesto que de haber prolongado la observación, o simplemente haber añadido 3 o 4 pacientes al grupo de azatioprina, se habría alcanzado la tan a menudo mal interpretada sig nificación estadística. Sólo los estudios posteriores han
obtenido evidencia incontrovertible sobre la eficacia de la azatioprina (o 6-mercaptopurina) en el manejo de la EC51,52.
En la práctica diaria es muy difícil separar el concepto de mantenimiento de esteroides del de dependencia a los mismos. En cualquier caso un importante subgrupo de pacientes se mantiene asintomático porque sigue tomando corticoides a pesar de sus efectos adversos, evidentes en los tratamientos a largo plazo, y entre los que la acción sobre la densidad mineral ósea son probablemente los más significativos. Por ello, el excelente perfil teórico de toxicidad de la budesonida, que parecen confirmar los resultados más recientes53 sugirió inmediatamente la posibilidad de explorar su utilidad a largo plazo en dosis reducidas. Disponemos actualmente de cuatro estudios en los que se ha analizado este hecho: un estudio multicéntrico canadiense, un estudio multicéntrico alemán, un estudio multicéntrico europeo, y un análisis de coste-efectividad sueco basado en los datos reales del estudio europeo.
En el estudio multicéntrico canadiense los pacientes que habían alcanzado una remisión en un estudio de tratamiento agudo fueron aleatorizados a recibir, durante un año, placebo, budesonida CIR 3 mg, y budesonida CIR 6 mg; los puntos de análisis evaluados fueron la recidiva definida como aumento del CDAI, la toxicidad clínica y la posible alteración del eje hipotálamo-hipofisario54. El análisis riguroso del estudio indica que la budesonida no es eficaz en el tratamiento de mantenimiento, ya que al año de seguimiento los tres grupos tenían la misma tasa de recaídas. Sin embargo, la mediana del día en el que aparece la recaída es significativamente diferente en los tres grupos y la recidiva es más tardía en los pacientes que toman 6 mg, lo que sugiere un efecto dependiente de la dosis. Por otra parte, no se observa toxicidad clínicamente relevante, los efectos sobre el eje suprarrenal existen pero son pequeños, y los primeros datos sobre el efecto sobre el metabolismo óseo a dos años de seguimiento de algunos pacientes que continuaron con el tratamiento confirman que la budesonida no parece alterar ningún parámetro. Este estudio, pues, deja la puerta abierta a la utilización del fármaco al menos en subgrupos de pacientes. El estudio europeo muestra unos resultados casi idénticos al canadiense55. Sin embargo, un estudio similar de un grupo multicéntrico, si bien con una muestra menor, no consiguió demostrar diferencias significativas ni en la tasa de recaídas ni en el tiempo medio hasta las mismas56.
El estudio alemán utilizando una dosis de sólo 3 mg de budesonida modificada Falk no encontró ninguna diferencia significativa con el placebo57.
En una aproximación más directa a la decisión clínica, Noble et al58 trasladaban los datos del estudio europeo a un análisis económico. La conclusión fundamental es que los días libres de recaídas tenían un coste muy razonable (13 dólares) si se utilizaba una dosis de budesonida de
6 mg/día, al menos en el escenario del análisis: Suecia.
Un metaanálisis de los 4 ensayos clínicos controlados frente a placebo confirman que la budesonida (3 mg/día) es similar al placebo en el mantenimiento de la remisión en los pacientes con EC (OR: 0,95 [0,62-1,47]; NS). Sin embargo, la dosis de 6 mg de budesonida tiende a ser superior al placebo en la prolongación de la remisión pero sin diferencias significativas al final del seguimiento de un año (OR: 1,34 [0,74-2,44]; NS) (Hinojosa y Nos: datos no publicados).
En el único estudio que analiza la posible eficacia de la budesonida CIR en la prevención de las recurrencias post-
operatorias, el fármaco no resultó superior al placebo59. Sin embargo, un subanálisis de este estudio sugiere que en los pacientes operados con patrón inflamatorio la budesonida a una dosis de 6 mg previene la recurrencia sintomática, aunque este hallazgo debe ser interpretado con cautela porque no se preveía antes de iniciar el estudio. Una pequeña serie de pacientes en un estudio muy interesante pero muy limitado, parece indicar que la budesonida combinada con azatioprina puede ser útil disminuyendo las recaídas en pacientes con estenosis en tratamien-
to con dilataciones. Por último, recientemente se ha comunicado que la budesonida puede sustituir con éxito a los corticoides sistémicos, en las ocasiones en las que éstos se utilizan como tratamiento de mantenimiento (Cortot et al, AGA, 1999).
En resumen, los datos disponibles no permiten recomendar la budesonida como tratamiento de mantenimiento general. Sin embargo, no sólo es posible que subgrupos de pacientes se beneficien de su uso, sino que los parámetros de seguridad le favorecen claramente cuando se compara con otros esteroides en estos pacientes. Antes de indicar un esteroide a largo plazo recomendamos muy seria mente considerar la utilización de azatioprina o 6-MP52 en el paciente cuando no esté indicada la cirugía60.
BUDESONIDA Y COLITIS ULCEROSA
Se ha intentado modificar la forma de liberación de la budesonida, para conseguir que llegue inalterada al colon, y por tanto obtener la indiscutible eficacia de los corticoides en esta enfermedad con escasísima toxicidad, emulando experimentos animales con otros corticoides modificados. En el único ensayo clínico que conocemos la prueba resultó un éxito, puesto que si bien en las colitis izquierdas parecía ligeramente menos eficaz que la prednisolona, en el conjunto de pacientes fueron fármacos igual de eficaces, con la ventaja de la prácticamente nula toxicidad sistémica de la budesonida32. Sin embargo, han existido problemas posteriores en el desarrollo de esta formulación, y por el momento no se ha ampliado la experiencia clínica, ni disponemos de información contrastada. Existe un pequeño estudio piloto con la forma de budesonida modificada que sugiere que puede ser útil, pero es no controlado, y se ha realizado en sólo 11 pacientes.
Resulta obvio para cualquier conocedor de la colitis ulcerosa plantear la posibilidad de administrar en las colitis distales (las que afectan hasta el ángulo esplénico, alrededor de un 70% de todas las colitis ulcerosas)1-4 la budesonida en enema, dada la eficacia de otros esteroides de
acción local61. Efectivamente, existen estudios que demuestran que el fármaco es activo en enema, con una biodisponibilidad baja (15%) pero algo superior a la de las cápsulas, probablemente porque parte del fármaco es absorbido en la porción distal del recto y vehiculado a la circulación sistémica por los plexos hemorroidales disminuyendo el efecto de primer paso62. Los estudios de dosificación demuestran una relación entre la dosis y la respuesta, y aunque la dosis de 8 mg es la más eficaz, no hay diferencias apreciables con la de 2 mg63, como se ha confirmado recientemente en un estudio multicéntrico americano; por tanto, parece razonable escoger 2 mg por su perfil de eficacia y seguridad. De hecho, con la dosis de 8 mg el cortisol es normal tras 6-8 semanas de tratamiento en el 64% de los pacientes frente al 98% del grupo placebo, mientras que con 2 mg, aunque se obtiene casi la misma remisión clínica, el 87% de los pacientes presentaban un cortisol normal64. Diferentes estudios confirman que la budesonida es muy superior al placebo y al menos tan eficaz como otros esteroides en el control de la colitis izquierda65-68, con un menor efecto esteroide sistémico69. En nuestro país, es el primer enema de esteroides con una formulación aceptable científicamente del que disponemos, puesto que los fármacos disponibles anteriormente tenían dosis manifiestamente insuficientes o carecían del aval de estudios científicos previos adecuados.
En un metaanálisis ejemplar, realizado por el grupo canadiense de Irvine70 se ha comprobado que los enemas de mesalamina son algo más eficaces que los enemas de esteroides. Los datos con budesonida son más limitados, pero parece que la eficacia es comparable a la de los enemas de mesalamina, pero no superior. Asumiendo que los datos de otros estudios son aplicables, el coste-efectividad favorece la utilización de enemas de mesalamina como primera opción. Sin embargo, en muchos pacientes la remisión tarda muchas semanas en alcanzarse con mesalamina71, y algunos no toleran el fármaco. Desde luego, en ellos una opción es la utilización de enemas de budesonida, solos o combinados con los enemas de mesalamina. Nosotros hemos observado pacientes en los que no se consigue la remisión con ninguno de los dos fármacos aislados, y en los que la combinación mejora claramen te la situación clínica. Existe un estudio en la bibliogra fía que proporciona fundamento teórico a este razonamiento72.
BUDESONIDA: IMPRESIONES PERSONALES
Hasta el momento sólo hemos sistematizado la información disponible en la bibliografía para facilitar al lector un análisis crítico y rápido de la misma. Éste suele ser el objetivo de las revisiones tradicionales, que concluyen con un párrafo de perspectivas de futuro que sólo el tiempo confirma o desmiente. Nosotros queremos aportar algo más al lector: nuestra interpretación personal de la situación. Este apartado es muy subjetivo. Además de las discusiones de los trabajos citados, existen en la bibliografía algunos editoriales y revisiones que nos sirven también de base para este apartado73-75.
Siendo muy críticos podríamos decir que la aparición de la budesonida CIR oral en el tratamiento de la EC supone un cambio poco sustancial, puesto que su eficacia es similar a la de los fármacos que disponemos, y su coste es significativamente mayor. La perspectiva del paciente es totalmente diferente, sin embargo17. Los efectos negativos se reducen de forma radical, y éstos pueden tener consecuencias nefastas en la calidad de vida de los pacientes con una enfermedad inflamatoria intestinal, además de graves repercusiones clínicas76-78. Además, hay que tener presente el efecto acumulativo de los esteroides en el organismo, con las implicaciones clínicas que ello supone. En nuestra experiencia inicial con este fármaco, podemos decir que desde el punto de vista del paciente sí representa un cambio importante. Ya hay estudios clínicos diseñados teniendo en cuenta esta perspectiva, analizando no sólo la eficacia, sino la eficacia libre de efectos secundarios, y los resultados favorecen a la budesonida50. Es un paso más para alcanzar un control de la enfermedad que no repercuta negativamente en la calidad de vida del paciente. El paralelismo de la EC y el asma en este aspecto resulta evidente a un observador atento. El problema del coste debe ser sometido a análisis de coste-efectividad que nos sirvan de guía. En el único análisis disponible sobre el coste de la enfermedad, el gasto en fármacos sólo representa una parte relativamente pequeña, y los gastos indirectos, sobre los que probablemente repercute la calidad de vida, son enormes. Son necesarios estudios bien realizados en este sentido58.
Sin embargo, queremos señalar que la disponibilidad de esteroides menos tóxicos puede retrasar indebidamente indicaciones quirúrgicas o la utilización de inmunomoduladores. En nuestra opinión la azatioprina (o la 6-mercaptopurina) todavía se utilizan de forma subóptima, y no sería deseable limitar sus indicaciones porque observemos menos efectos negativos esteroides. En este sentido, la disponibilidad de guías clínicas consensuadas por grupos de trabajo puede facilitar la labor de decisión del clí-
nico6,46,79.
En cuanto a la budesonida en enema, la falta de otras alternativas hace que disponer de ella sea una magnífica noticia para los pacientes con colitis ulcerosa distal, tras la todavía reciente comercialización de los enemas y la espuma de 5-ASA. Parece que en los últimos años la industria farmacéutica y las autoridades sanitarias están mostrando una mayor sensibilidad a las necesidades de un amplio grupo de personas sometidas durante años a la tiranía de las fórmulas magistrales, accesible sólo donde la buena voluntad y conocimientos de los médicos y los farmacéuticos las hacían posibles. Desde luego, no es ajeno a este fenómeno el aumento de la incidencia de la colitis ulcerosa, particularmente en sus formas distales4, lo que significa un mercado potencialmente mayor. En nuestra opinión las asociaciones de pacientes (ACCU) y los grupos de trabajo médicos (GETECCU) deben coordinar sus acciones para informar a las autoridades sanitarias de las necesidades de un colectivo de pacientes, siempre desde la perspectiva de la evidencia científica seria.
Está por definir el efecto que una dosificación flexible de budesonida podrían tener en el manejo de los pacientes con EC inicialmente no respondedores a la dosis de 9 mg. En nuestra experiencia algunos pacientes que no remitieron con 9 mg sí lo hicieron con 15 mg e incluso 18 mg de budesonida. En este sentido, hay que recordar que en el ensayo en que 15 mg no resultaba más efectivo la dosis se daba repartida, y por ejemplo 4,5 * 2 son menos eficaces que 9 * 138,41. Resulta evidente que el peso, el grado de inflamación o la respuesta a esteroides no es igual en todos los casos. De todas formas, habrá que sopesar la supuesta eficacia de dosis más elevadas de budesonida con el evidente riesgo de mayores efectos secundarios.
Por último, queremos señalar que el desarrollo de la budesonida CIR (y también el de la modificada), está permitiendo la realización de estudios metodológicamente muy rigurosos que nos permiten no sólo ampliar en condiciones de ensayo clínico nuestros conocimientos sobre la prednisolona o la mesalamina, sino que nos ofrecerán en el futuro próximo datos interesantísimos sobre el metabolismo óseo en la EC, o la evolución de la enfermedad en niños.
PERSPECTIVAS DE FUTURO
Nuestra experiencia con la budesonida no ha hecho más que empezar. Hay en estos momentos grandes estudios en marcha para demostrar o no su mayor seguridad en cuanto a su efecto sobre el metabolismo óseo en comparación con la prednisolona, su utilidad en niños (los grandes olvidados de los ensayos clínicos, aunque la proporción de pacientes con edad de comienzo temprana es muy significativa), confirmar o no su utilidad a largo plazo, etc. Además, sólo su uso demostrará o no su efectividad, y confirmará o no el perfil de escasos efectos negativos descrito en los ensayos clínicos.
Quizás el punto menos estudiado, y tal vez el de mayor interés, sea el de las terapias combinadas. A punto de disponer de fármacos tan sofisticados con los anticuerpos anti-TNF, y tal vez la interleucina 10, o el receptor soluble del TNF los ensayos clínicos no nos han respondido a preguntas claves en la práctica: ¿remiten más rápido los pacientes al asociar budesonida y mesalamina?, ¿mejoran si combinamos prednisona o budesonida con ciprofloxacina?, ¿recurrirán menos aquellos pacientes multioperados con muchas complicaciones previas usando una combinación de azatioprina y budesonida?73. Éstas son sólo algunas de las preguntas que surgen todos los días en la práctica, y para las que no tenemos contestación basada en las pruebas. Algunos datos experimentales sugieren que una combinación de fármacos puede ser útil en modelos de inflamación experimental80. Valdría la pena, probablemente, diseñar estudios en modelos animales de combinaciones de fármacos ya desarrollados, para servir de sustrato teórico a ensayos clínicos de combinaciones. Estos ensayos son difíciles de diseñar, e implican, además, poner de acuerdo a varias compañías promotoras, pero si los investigadores proporcionamos ideas ya contrastadas en modelos animales, su desarrollo sería más probable.
En conclusión, mientras esperamos terapéuticas más resolutivas81, disponemos de una nueva alternativa que mejora el balance riesgo-beneficio76 en el tratamiento de las formas moderadas de EC ileocólica, y que ayuda al control adecuado de las colitis ulcerosas distales. Nuestro trabajo consiste en utilizarla en los pacientes que pueden obtener más beneficio, y en recoger la experiencia clínica para poder situar la budesonida en el lugar terapéutico que sin duda tiene en el manejo de los pacientes con enfermedad inflamatoria intestinal.
Correspondencia: Dr. F. Gomollón. Condes de Aragón, 18, 2.o B. 50009 Zaragoza. Correo electrónico: fgomollon@ingenia.es o fgomollong@meditex.es